英文名称 :pancreatic en‐docrine tumors
胰腺是人体内同时具有外分泌和内分泌功能的腺体。外分泌功能分泌胰液,具有重要的消化作用。胰腺的内分泌细胞位于胰岛,是散在分布于胰腺实质内的许多小细胞团。胰腺内分泌肿瘤(pancreatic en‐docrine tumors,PETs)为起源于胰腺内分泌细胞的肿瘤,统称胰岛细胞瘤,约占胰腺肿瘤的2%~3%。胰腺内分泌瘤不常见,但也并不罕见。可将胰腺内分泌肿瘤分为功能性(functioning)和非功能性(nonfunctioning)两种,非功能性肿瘤占30%~40%。
关于胰腺内分泌肿瘤的分期(NCCN指南,2010):按TNM分期:T代表原发肿瘤:Tx为原发肿瘤无法测定,T0为无原发肿瘤的证据,Tis为原位癌,T1肿瘤局限于胰腺内,最大直径≤2cm;T2肿瘤局限于胰腺内,最大直径>2cm;T3肿瘤延伸至胰腺外,但没有侵及腹腔干或肠系膜上动脉;T4肿瘤延伸至胰腺外,侵及腹腔干或肠系膜上动脉(不可切除肿瘤);N代表区域淋巴结:Nx区域淋巴结无法评估,N0无区域淋巴结转移,N1有区域淋巴结转移;M代表远处转移:M0无远处转移M1有远处转移。0期为TisN0M0,ⅠA期为T1N0M0,ⅠB为T2N0M0,ⅡA期为T3N0M0,ⅡB期为T1~3,Ⅲ期为T4任何NM0,Ⅳ期为任何T任何NM1。
胰岛内有多种细胞,可分泌多种不同的内分泌激素。已发现的来自不同胰岛细胞的肿瘤有8~9种。胰腺内分泌瘤的种类较多。
(一)功能性胰腺内分泌肿瘤
1.胰岛素瘤(insulinoma)来自B细胞的胰岛细胞瘤,是首先被发现和最多见的胰腺内分泌瘤。胰岛素瘤占功能性胰腺内分泌肿瘤(PETs)的3/4,其发生率为1/100万。约90%胰岛素瘤为良性,实体的,位于胰腺内;多发的,恶性的或胰腺外的胰岛素瘤很少见。胰岛素瘤在整个胰腺的分布是均等的。70%病人的胰岛素瘤小于2cm。多发胰岛素瘤常伴发多发内分泌瘤MENⅠ。约10%的胰岛素瘤为恶性,恶性胰岛素瘤早期发生转移;局部浸润及局限性的远处转移并非是其手术的禁忌证。
2.胃泌素瘤(gastrinoma)90%的胃泌素瘤发现位于十二指肠第一段、第二段、第三段和胰头部,在胃泌素瘤三角区(gastrinoma triangle)(图1)。所谓胃泌素三角区是指上起胆囊管和胆总管交界处,下至十二指肠的第三部,内至胰颈体交界处,这样一个三角形的区域。胰腺胃泌素瘤较少见但是发生转移者较多。
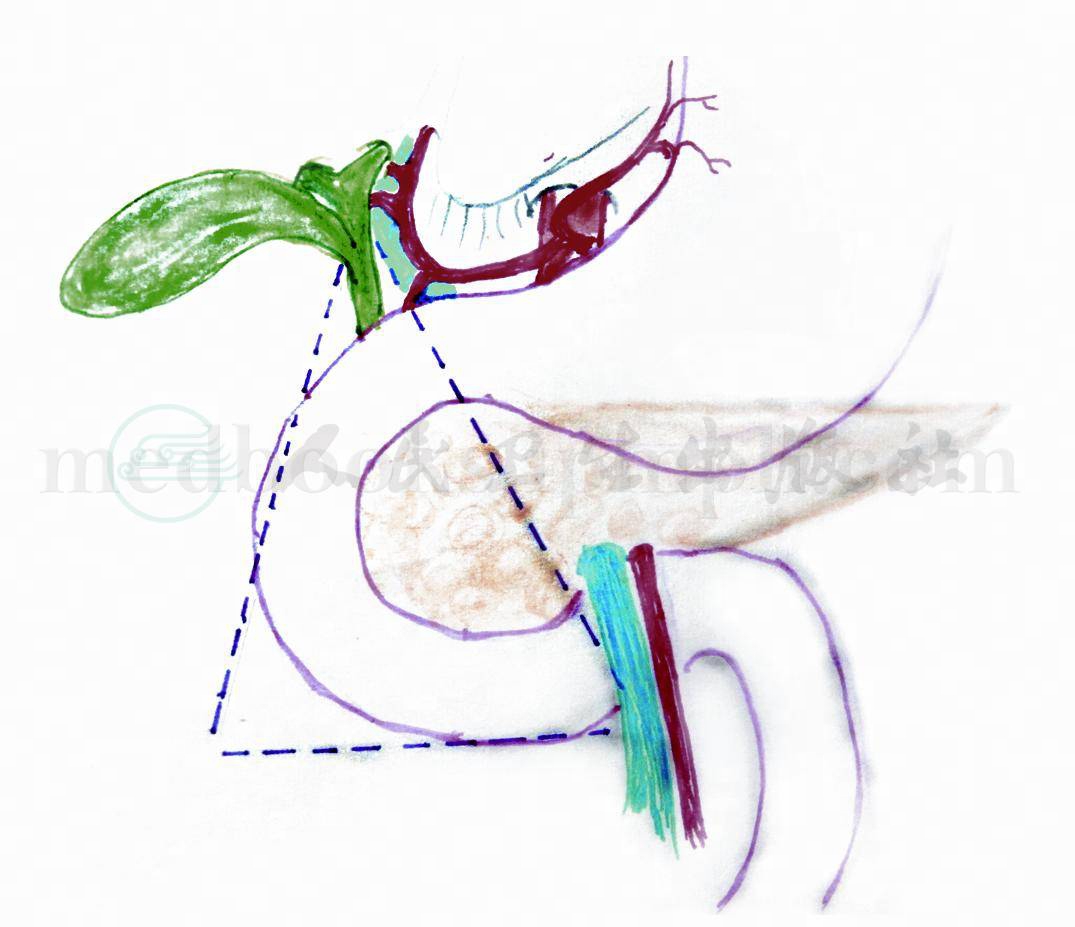
图1 胃泌素三角
3.胰高血糖素瘤(glucagonomas)来自A细胞。大多数的胰高血糖素瘤是实体的,位于胰腺内,尤其在胰体尾部;约80%肿瘤>3cm并且是恶性的。>50%的病人确诊时已发生肝转移。
4.血管活性肠肽瘤(V IPoma)VIPoma来自D1细胞。80%~90%的VIPoma在胰腺,特别在胰尾;通常为实体的,一般>3cm;40%~80%的V IPomas是恶性。
5.生长抑素瘤(somatostatinoma)来自D细胞的生长抑素瘤,半数以上的生长抑素瘤位于胰腺内,其2/3在胰头部。胰腺外的生长抑素瘤最常见的位置为十二指肠。生长抑素瘤通常大于5cm,恶变率高达75%~85%。
6.来自PP细胞的胰多肽瘤。
7.来自NT细胞的神经降压素瘤。
8.来自EC细胞的类癌,等等。
(二)无功能性胰腺内分泌肿瘤
无功能肿瘤中最常见的是胰腺内分泌肿瘤(PETs),发生率高达50%。无功能PETs通常比功能性PETs大。多因为无功能而出现症状较晚。
外科手术为胰腺内分泌肿瘤(PETs)治疗的主要方法。根据肿瘤的多少、大小、存在部位,是否累及主胰管及良恶性采用不同的手术方法。胰岛素瘤属胰腺内分泌肿瘤中最多见的一种,占75%。
(一)胰腺内分泌肿瘤摘除术
又称肿瘤剜除术(enucleation)。
1.胰腺肿瘤摘除术的适应证
(1)适用于大多数胰腺良性肿瘤,包括大多数的内分泌瘤,适用于大部分胰岛素瘤,大小<3cm,肿瘤距主胰管有一定距离。
(2)术前借助影像检查可判断肿瘤的大小、边界是否清楚,肿瘤与相关血管的关系,主胰管是否扩张,肿瘤与主胰管的关系等信息。如肿瘤边界清,血管无受累,主胰管无明显扩张三项主要指标提示肿瘤摘除术的可行性。相反,肿瘤摘除术难以实现。
(3)胰岛素瘤血供较丰富,呈浅暗红色;部分肿瘤含结缔组织较多,比正常胰腺组织硬,但较慢性胰腺炎组织软。胰岛素瘤无包膜,剥离过程中可能切除部分正常胰腺组织。
2.肿瘤摘除术的主要技术和技巧
(1)充分游离肿瘤所在位置的胰腺,使肿瘤能够充分被显露并被术者控制。
(2)术者最好配戴手术放大镜以便清晰准确看清肿瘤周边的细小结构,尤其主胰管的保护。
(3)循肿瘤周边细心剥离,先剪开肿瘤周边的胰腺被膜,准确进入肿瘤与胰腺组织间隙(图6)。
(4)选用较精巧的手术器械剥离也非常重要,根据个人习惯选择。如小直角钳,细的解剖剪刀,必要时还可用小刀片,双极电凝,等等。
(5)小血管用4‐0号丝线结扎,微小血管用电凝止血,活动出血点用6‐0无损伤线缝扎。
(6)保护相邻的血管,如脾静脉、脾动脉、肠系膜上静脉、肠系膜上动脉等。要熟练掌握血管外科技术。
(7)重点保护主胰管,因为,一旦主胰管损伤术后胰瘘是必然的;因此,保护主胰管是非常重要的。首先要时刻警惕,术野要清洁,眼力要好(或配戴放大镜),操作要精细准确。一旦主胰管损伤时多应改行切除术,小裂口也可用7/0或8/0无损伤线修补。
(8)实体肿瘤可用缝线牵引,囊性肿瘤只好用手垫纱布扒。
(9)肿瘤剜除后送冷冻病理检查。如果病理报告为恶性,应扩大切除范围。
(10)用碘伏棉球蘸压创面,检查创面有无渗漏胰液。渗漏胰液处碘伏棉球会被脱色变白。
(11)肿瘤摘除并创面清浩后可喷涂封闭胶减少术后渗出。
(12)局部(创面下方)摆放腹腔引流管,带冲洗管,术后主动缓慢冲流,生理盐水,5gtt/min。术后前一周每天测引流液淀粉酶,观察有无胰瘘及其变化。
(13)一旦术中主胰管受累或损伤应改行肿瘤病段胰腺切除术,根据肿瘤所在部位不同选择不同术式,如胰头切除术,胰中段切除术,胰体尾切除术,等等。
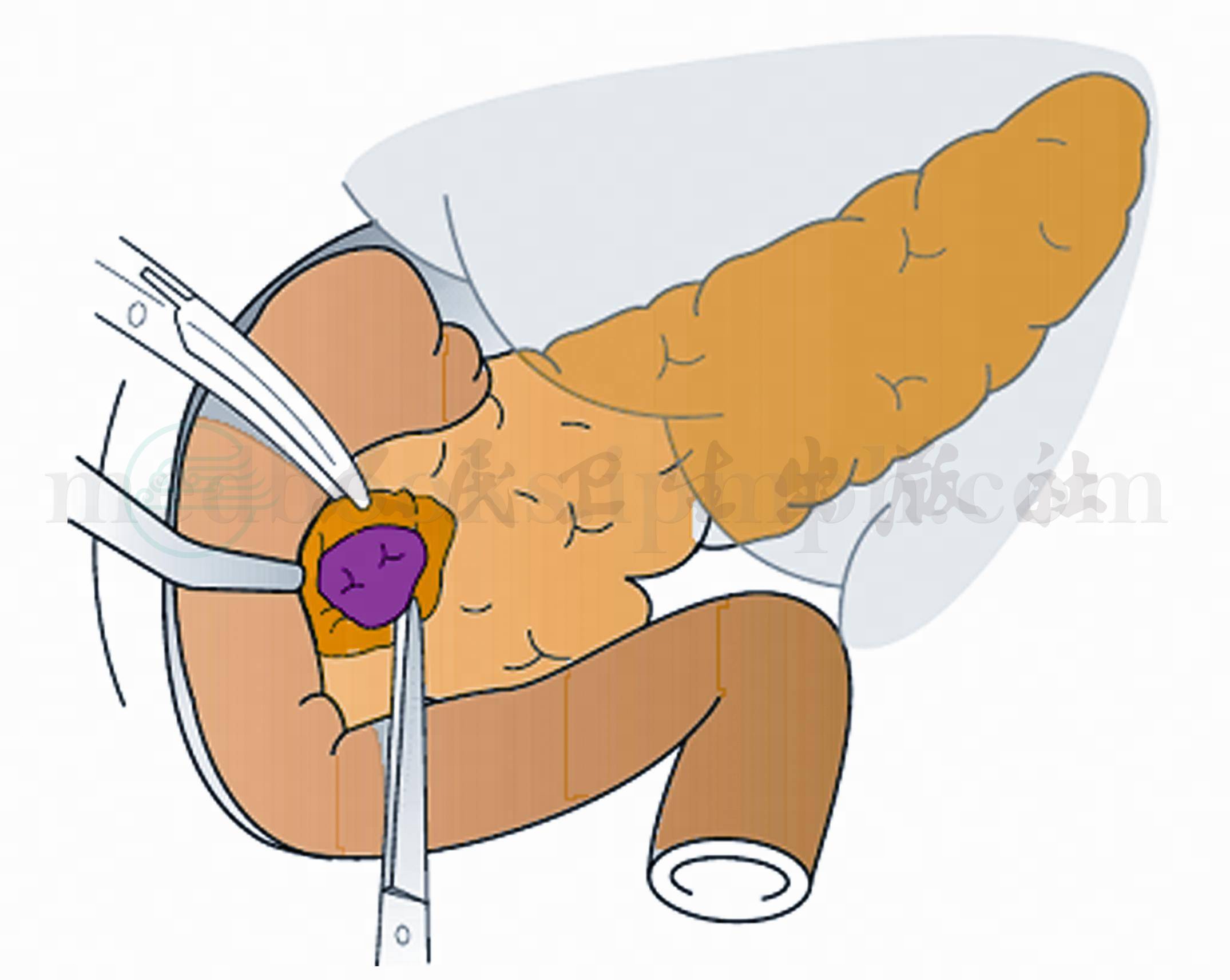
图6 应紧贴瘤体剥离(剜除术)
(二)胰中段切除术
肿瘤位于胰颈体部或者靠近主胰管(Wirsung duct)应施胰中段切除术。因为,单纯肿瘤切除极易损伤主胰管引发术后胰瘘。胰中段切除术的技术要点详见胰中段切除术。
(三)胰体尾切除术
又称为胰远段次全切除术(subtotal distal pancreatectomy)。当肿瘤位于胰体尾部,累及胰管;或者肿瘤剜除术中发现主胰管损伤,或者病理报告为恶性时,应行胰体尾切除术。根据术者技术水平及术中具体情况,可同时切除脾脏或者保留脾脏。需要强调,胰体尾切除后,胰体残端处理过程中,最好能发现主胰管断端,并用6‐0无损伤线缝合;胰腺残端用不吸收线或慢吸收线U字交锁缝合,也可间断缝合,并用生物胶或化学胶封闭处理,以预防术后胰腺残端漏。
(四)胰头十二指肠切除术
适用于肿瘤位于胰头部深层或胰钩突部,肿瘤较大,或多发或恶性胰岛素瘤,施剜除术极易损伤胰腺组织和(或)主胰管,造成术后胰瘘等并发症。或者多发内分泌肿瘤位于十二指肠和胰头,也需行PD或PPPD。技术要点和技巧同胰头十二指肠切除术。
(五)恶性内分泌瘤切除术
同胰腺恶性肿瘤,应尽量切除原发病灶,同时清除相关的肿大淋巴结。如已有肝转移,可用电凝、微波固化、术中射频、注射无水乙醇等方法将肝转移灶破坏掉。具体方法详见相关章节。
(六)保留胰腺的十二指肠全切除术
保留胰腺的十二指肠全切除术(Preserving‐pancreas total duodenectomy,PPTD)适用于多发的并广泛分布于十二指肠的内分泌肿瘤,如多发的胃泌瘤伴MENⅠ。该手术首次由Chung RS(1995)为一例患家族性腺瘤样息肉病病人施此手术,2004年Imamura M为一例多发十二指肠胃泌素瘤并MENⅠ的病人施PPTD,并改进了原手术,发展为一种新技术,即保留了Vater乳头,剥出其黏膜,切开乳头再与空肠小切口吻合重建。
1.适应证
包括:Zollinger‐Ellison Syndrome(ZES)合并MENⅠ、小肠淀粉样变(intestinal amyloidosis)、胃肠道间质瘤(gastrointestinal stromal tumor)、家族性腺瘤性息肉病(familial adenomatous polyposis,FAP),等。
2.手术要点和技巧
(1)自幽门下切除整个十二指肠(图7):保留整个胰腺。要紧贴十二指肠壁切除十二指肠,首先切断胃右动脉,保留胃十二指肠动脉,保护胆总管,胃网膜右动脉;切除全部十二指肠并10cm上段空肠。空肠远断端被缝闭。胰头创面彻底止血。
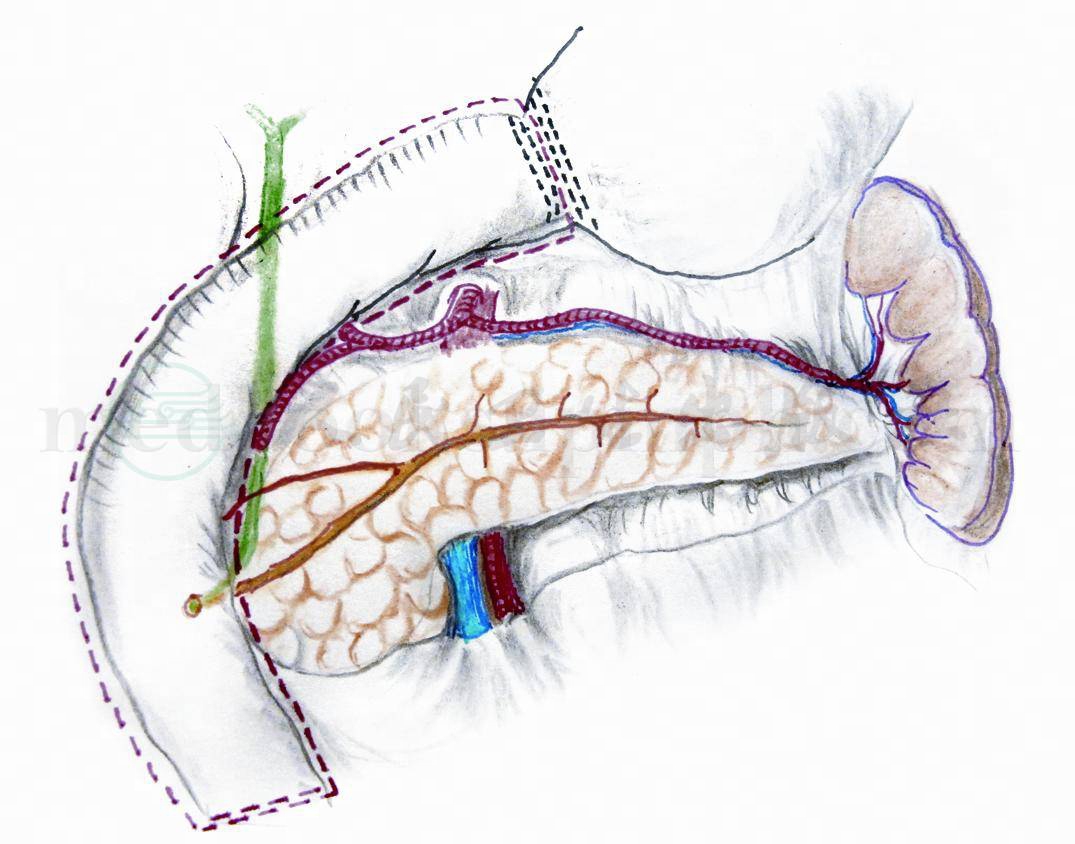
图7 自幽门下切除整个十二指肠
(2)保留大乳头剥去其黏膜:大乳头被保留后,用钳和剪刀剥除其表面的黏膜并用温热盐水压迫止血。再将大乳头切开(1cm)成形。
(3)乳头与空肠黏膜吻合术:提取上段空肠行乳头与空肠黏膜吻合术(图8)。提取上段空肠襻约30cm,经小肠系膜后方提至结肠上区,空肠襻的系膜向下;空肠襻恰围绕胰头。选择乳头对应的空肠做孔,大小恰与大乳头开口相当;少去浆肌层多留黏膜。用6‐0 prolene或5‐0可吸收线间断缝合乳头开口和空肠造口。主胰管内置细支撑管。胆管下端也可置内支撑管。空肠襻与胰头用无损伤线间断缝合使其包绕胰头。Treitz韧带裂孔处后腹膜与空肠襻间断缝合固定。
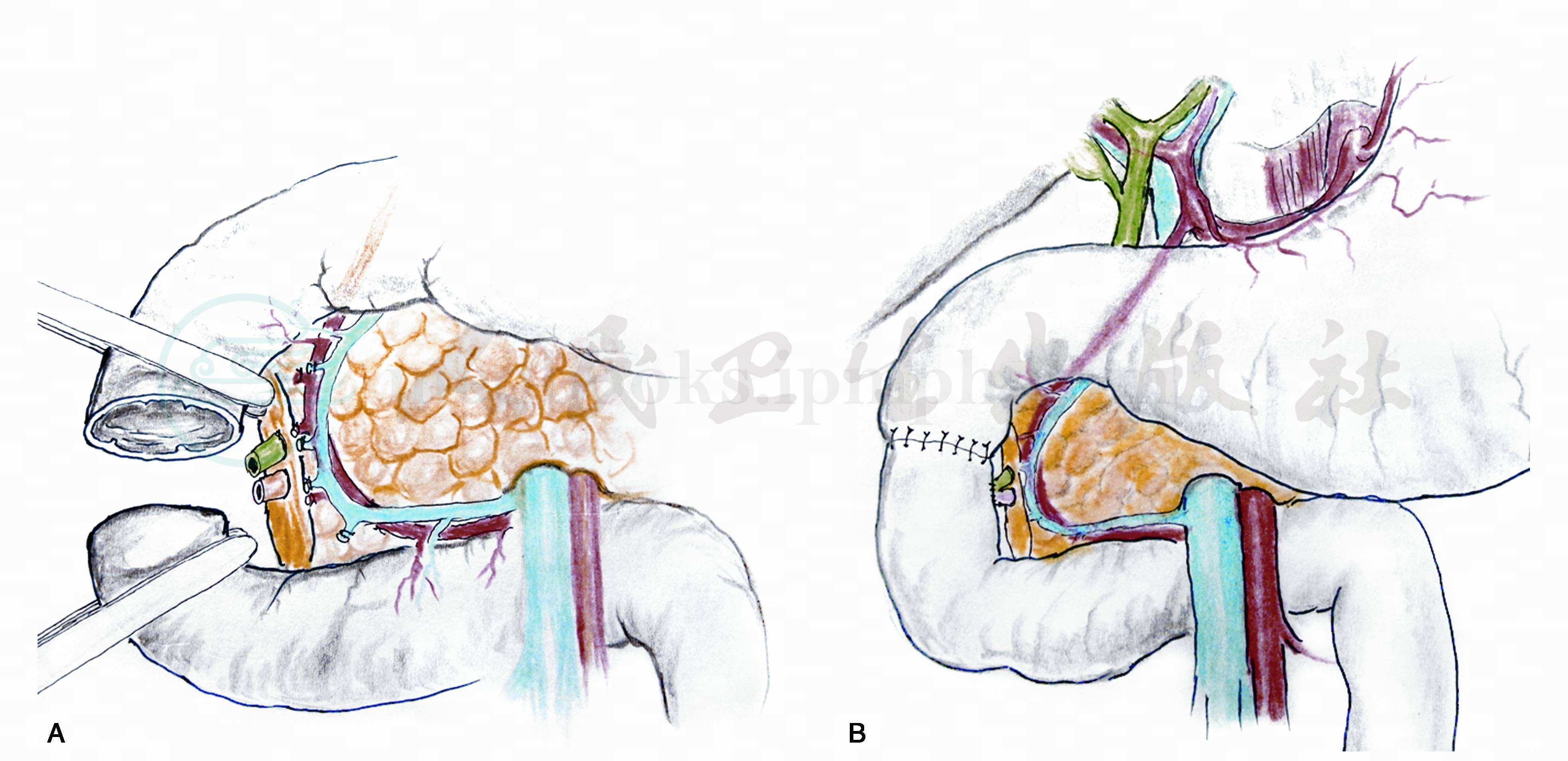
图8 行乳头与空肠黏膜吻合术
(4)切除胆囊。
(5)消化道重建:采用Billroth‐Ⅱ技术,尤如Hoffmeister法,经结肠后行胃与空肠端侧吻合完成消化道重建(图9)。
其中:
1)经结肠中动脉左侧系膜无血管区剪大孔使胃无张力通过。
2)横结肠系膜与胃高吊缝合固定。
3)输入段空肠的长度应合适,距Treitz韧带约8~12cm,保证无张力又不折曲。
4)输入段空肠与胃后壁适当缝合固定,保证同步并防止内疝。
5)腹腔冲洗,胰头后方置腹腔引流管。
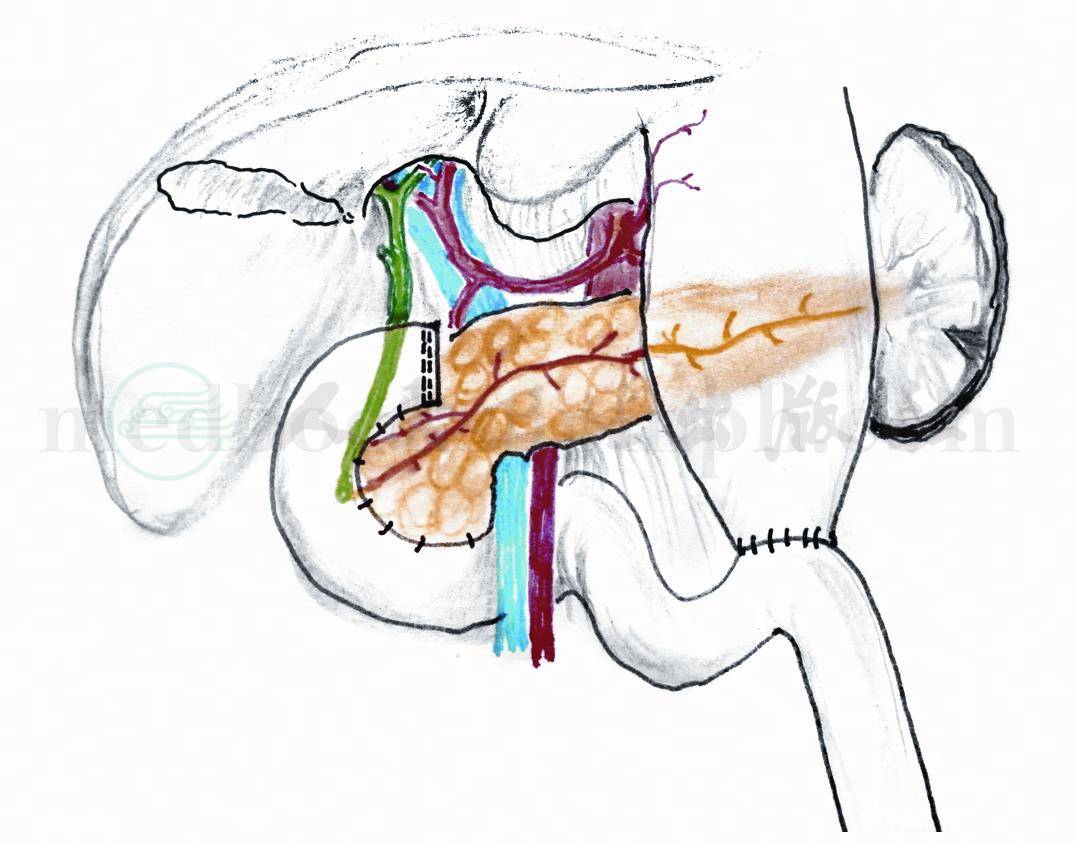
图9 行十二指肠与空肠端侧吻合
(七)十二指肠部分切除术
1.适应证
(1)十二指肠壁的局限性良性病变或者低度恶性病变。
(2)尤其适用于十二指肠水平段的肿瘤,例如,间质瘤,等。肿瘤对胰腺的浸润不重。
(3)肿瘤距十二指肠乳头≥2cm。
2.手术要点和技巧
(1)首先做Kocher切口,游离十二指肠和胰头,要充分游离十二指肠水平段。用手触摸探查肿瘤的存在、大小、与乳头的关系、侵入胰头的深度和范围,等。判断肿瘤切除的可行性。
(2)游离上段空肠10~15cm:在血运分界处切断空肠,近断端缝闭;远段空肠系膜适当裁剪延长,断端待吻合。
(3)切除十二指肠水平段:经肠系膜后方将游离的近端空肠牵拉至结肠上区,紧贴十二指肠壁剥离十二指肠,小血管分支小心结扎;将肿瘤从胰腺内剥离出来,或者用超声刀剥离肿瘤。此过程应注意保护主胰管。
(4)完整切除肿瘤:剥离肿瘤近侧端,安全切缘距肿瘤1cm;横向切断十二指肠,经十二指肠腔内探查十二指肠乳头完整,距十二指肠乳头≥1cm。十二指肠切除标本术中送冷冻病理检查,确定诊断并检查十二指肠断缘有无癌残留。
(5)空肠与十二指肠近断端对端吻合:缝闭Treitz韧带处的裂口。经与十二指肠水平段对应的横结肠系膜无血管区切口提取空肠,空肠系膜向下内方。行十二指肠断端与空肠对端吻合,可先行黏膜对黏膜缝合,再行浆肌层间断缝合(图10)。保证吻合口血运,保证吻合口愈合。
此处不宜用吻合器吻合;也不宜行端侧吻合。
(6)将胃管送过幽门,送过吻合口,术后保证胃肠减压。术后7天后,待病人排气排便后拔出胃管。
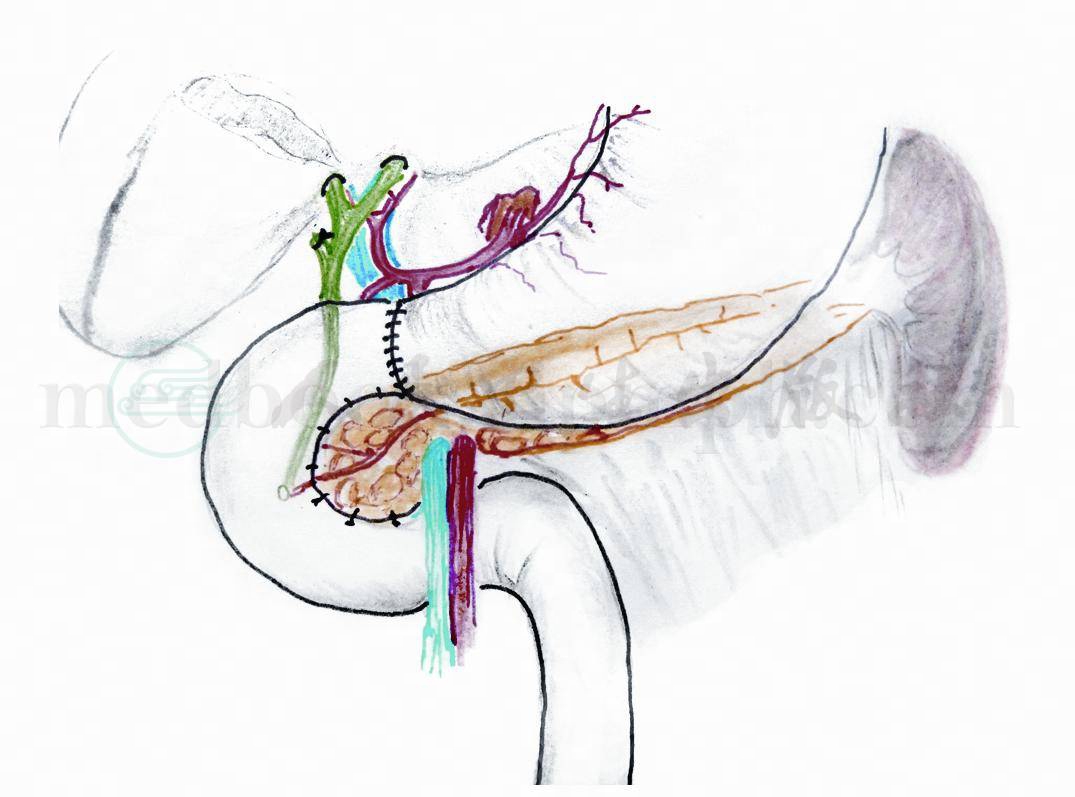
图10 空肠与十二指肠近断端对端吻合
3.术式评价
主要取决于原发病的性质,十二指肠部分切除术的适应证应选择良性肿瘤或者高分化的低度恶性肿瘤,如果肿瘤不复发病人就可以获得长期生存;该手术的可行性和合理性是没问题的,因此,应选择适合的病例施十二指肠部分切除术。













