(一)定义
肿瘤(tumor,neoplasm)是指机体内易感细胞在各种致瘤因子的作用下,引起的遗传物质改变,包括原癌基因突变或扩增,抑癌基因失活或缺失,基因易位或产生融合性基因等,导致细胞内基因表达失常,细胞异常增生而形成的新生物。肿瘤细胞失去正常生长调节功能,具有自主或相对自主生长能力,当致瘤因子停止后仍能继续生长。
(二)肿瘤的性质
根据肿瘤的生长特性和对身体危害程度可将肿瘤分为良性肿瘤、恶性肿瘤以及介于良、恶性肿瘤之间的交界性或中间性肿瘤3种类型。
1.良性肿瘤
是指无浸润和转移能力的肿瘤,ICD-O编码为XXXX/0。肿瘤通常有包膜包绕,或周界清楚,多呈膨胀性生长,生长速度缓慢,瘤细胞分化成熟,对机体危害小,经局部切除后一般不会发生局部复发。少数良性肿瘤或瘤样病变所发生的局部复发多因切除不净或病变的再生所致,对局部不会造成破坏性,经完整切除后仍可获得治愈。极少数在组织学上看似良性的肿瘤可发生远处转移,但并无可靠的组织学指标来预测转移,如发生于皮肤的富于细胞性纤维组织细胞瘤。
2.交界性或中间性肿瘤(borderline or intermediate tumor)
是指组织学形态和生物学行为介于良性和恶性肿瘤之间的肿瘤,ICD-O编码为XXXX/1。在临床实践中,良、恶性难以区分的肿瘤并不少见,这类肿瘤的诊断标准往往不易确定。因此,在作交界性或中间性肿瘤的诊断时,常需附以描述和说明。
交界性肿瘤又分为局部侵袭型(locally aggressive)和偶有转移型(rarely metastasizing)两种亚型。前者是指肿瘤可在局部形成侵袭性和破坏性生长,并易发生局部复发,但不具备发生转移的潜能,临床上常需作局部扩大切除以控制局部复发;后者是指肿瘤除在局部呈侵袭性生长外,还具备转移的能力,多转移至区域淋巴结和肺,但转移率多小于2%,并无可靠的组织学指标可供来预测转移。
3.恶性肿瘤
是指具有浸润和转移能力的肿瘤。肿瘤通常无包膜,周界不清,向周围组织浸润性生长,生长速度快,瘤细胞分化不成熟,有不同程度的异型性,对机体危害大,常可因复发或转移而导致患者死亡。ICD-O编码有两种,XXXX/2代表原位癌或Ⅲ级(高级别)上皮内瘤变,XXXX/3代表恶性肿瘤。
(三)肿瘤的相关术语
1.增生(hyperplasia)
组织中正常细胞的细胞数目异常增多称为增生。增生的细胞形态正常,无异型性。引起增生的刺激因子(物理性、化学性或生物性)一旦去除,组织可以恢复到正常状态。
2.化生(metaplasia)
一种终末分化的细胞转化为另一种分化成熟的细胞称为化生。现已知化生的细胞实际上来自正常细胞中的储备细胞,并非是终末分化的正常细胞。在化生的基础上,化生细胞发生异型增生可进展为恶性肿瘤。
3.分化(differentiation)
从胚胎到发育成熟过程中,原始的幼稚细胞能向各种方向演化为成熟的细胞、组织和器官,这一过程称为分化。肿瘤可以看成是细胞异常分化的结果,不同肿瘤中瘤细胞分化的水平不同。良性肿瘤细胞分化成熟,良性肿瘤在很大程度上相似于其相应的正常组织,如脂肪瘤中的瘤细胞相似于正常的脂肪细胞,有时甚至难以区别,平滑肌瘤中的瘤细胞与正常的平滑肌细胞极为相似。恶性肿瘤根据其瘤细胞分化程度的不同,与其相对应正常组织的相似程度各异,如脂肪瘤样脂肪肉瘤中的瘤细胞相似于正常的脂肪细胞,而多形性脂肪肉瘤中的瘤细胞在形态上与正常的脂肪细胞却相差甚远。一般来讲,恶性肿瘤可分为分化好(well differentiated)、中分化(moderately differentiated)和分化差(poorly differentiated),或分为Ⅰ级、Ⅱ级和Ⅲ级。少数肿瘤分化太差,以至于无法确定分化方向时,称为未分化(undifferentiated)。偶尔,部分恶性程度较低或分化良好的恶性肿瘤在发展过程中出现分化差的区域,提示肿瘤向高度恶性的肿瘤转化或发生去分化(dedifferentiation),如在原发或复发的隆突性皮纤维肉瘤中,有时可见到类似成年型纤维肉瘤的区域,发生于腹膜后的分化良好的脂肪肉瘤可发生去分化。
4.间变(anaplasia)
恶性肿瘤细胞失去分化称为间变,相当于未分化。间变性肿瘤(anaplastic tumor)通常用来指瘤细胞异型性非常显著,如间变性脑膜瘤、大细胞间变性淋巴瘤和间变性横纹肌肉瘤等。
5.癌前病变(precancerous lesion)
是恶性肿瘤发生前的一个特殊阶段,所有恶性肿瘤都有癌前病变,但并非所有的癌前病变都会发展成恶性肿瘤。当致癌因素去除以后,可以恢复到正常状态。如致癌因素持续存在,可演变成恶性肿瘤。癌前病变不同于癌前疾病(precancerous disease),前者不是一个独立疾病,后者是一种独立的疾病,如黏膜白斑、慢性炎症、慢性溃疡、结节性肝硬化、未降睾丸、结肠多发性腺瘤性息肉病、色素痣和着色性干皮病等。
6.非典型性(atypia)
指细胞学上的异常,在炎症、修复性增生和肿瘤性病变中,可出现不同程度的非典型性。
7.异型增生(dysplasia)
一种以细胞学异常和结构异常为特征的癌前病变。细胞学异常主要体现在细胞核上,包括细胞核增大、核形不规则、核仁明显、核质比例增大和核分裂象增多;结构异常包括细胞排列紊乱,极性丧失。
8.上皮内瘤变(intraepithelial neoplasia)
或称上皮内瘤形成,是指上皮性恶性肿瘤浸润前的肿瘤性改变,包括细胞学和结构两个方面的异常。上皮内瘤变与异型增生的含义非常近似,有时可互用,但前者更强调肿瘤形成的过程,后者强调形态学的改变。上皮内瘤变涵盖的范围也比异型增生要广些,通常还包括原位癌。
9.原位癌(carcinoma in situ)
又称上皮内癌(intraepithelial carcinoma)或浸润性前癌,是指细胞学上具有所有恶性特点,但尚未突破上皮基底膜的肿瘤。
10.早期浸润性癌(early invasive carcinoma)
癌细胞突破上皮基底膜或黏膜腺体,但侵犯周围组织局限在一定范围内,成为早期浸润性癌。早期浸润性癌的诊断标准一般以浸润深度为准,但不同器官或部位不完全一致。早期浸润性癌发生转移的危险性小,绝大多数能完全治愈。
(1)早期宫颈癌
指浸润性鳞状细胞癌的浸润深度在距基底膜3mm以内。
(2)早期食管癌
指癌组织累及黏膜下层以上的浅表部位而未侵及肌层,无淋巴结或远处转移。
(3)早期胃癌
指癌组织仅累及黏膜层和(或)黏膜下层,不论癌的大小和有无淋巴结转移。
(4)早期大肠癌
指癌组织穿过黏膜肌层,累及黏膜下层,但尚未侵及浅肌层。仅局限于黏膜层内的黏膜内癌仍包括在高级别上皮内瘤变中,一般无淋巴结转移,但浸润至黏膜下层的早期大肠癌5%~10%可发生局部淋巴结转移。
(5)早期肝癌
单个癌结节或相邻两个癌结节直径之和<3cm。
(6)早期肺癌
经手术和病理证实的Ⅰ期(T1N0M0或T2N0M0)肺癌。
11.浸润性癌(invasive carcinoma)
突破上皮基底膜侵犯间质的上皮性恶性肿瘤。依据浸润的深度分为早期癌、中期癌和进展期(晚期)癌。
(四)良性肿瘤和恶性肿瘤的区别
良性肿瘤和恶性肿瘤的区别主要依据于肿瘤的分化。此外,复发和转移也是重要的依据,但这些区别均具有相对性,如发生于皮肤的富于细胞性纤维组织细胞瘤和发生于唾液腺的多形性腺瘤可转移至肺,依据目前的常规组织学无法预测其转移潜能。有时良性肿瘤与恶性肿瘤的界限并非截然可分,故要判断肿瘤的良、恶性绝非易事,需要长期工作经验的积累。良性肿瘤和恶性肿瘤的一般区别点参见表1。
(五)恶性肿瘤的病理分级和分期
1.恶性肿瘤的病理分级
国际上普遍采用的是3级分级法,有些肿瘤采用4级或2级或不作进一步分级。
Broders(1922)将鳞状细胞癌分成4级,代表由低到高逐步递增的恶性程度。Ⅰ级:未分化间变细胞在25%以下。Ⅱ级:未分化间变细胞在 25%~50%。Ⅲ级:未分化间变细胞在50%~75%。Ⅵ级:未分化间变细胞在75%以上。这种分级法曾被普遍应用于其他肿瘤,但由于4级法较烦琐,现已普遍采用3级法。
以皮肤鳞状细胞癌为例,Ⅰ级:癌细胞排列仍显示皮肤各层细胞的相似形态,可见到基底细胞、棘细胞和角化细胞,并有细胞间桥和角化珠;Ⅱ级:细胞分化较差,各层细胞区别不明显,仍可见到角化不良细胞;Ⅲ级:无棘细胞,无细胞间桥,无角化珠,少数细胞略具鳞状细胞癌的形态。3级法可用Ⅰ、Ⅱ和Ⅲ级表示,也可用高分化、中分化和低分化表示。
表1 良性肿瘤和恶性肿瘤的区别

各种类型的腺癌也可根据其腺管结构和细胞形态分为3级。Ⅰ级的癌细胞相似于正常的腺上皮,异型性小,且有明显的腺管形成;Ⅱ级的癌细胞显示中等程度的异型性,有少量腺管形成;Ⅲ级的癌细胞异型性大,且无腺管形成,呈巢状或条索状生长。
神经胶质瘤(星形细胞瘤、少突胶质瘤、室管膜瘤)分为4级,Ⅰ级为良性,Ⅱ、Ⅲ、Ⅳ级分别为低度、中度和高度恶性。
畸胎瘤也分为4级,0级:全部组织分化成熟;Ⅰ级:有小灶性的胚胎性或未成熟组织;Ⅱ级:中等量胚胎性或未成熟组织,可见到核分裂象;Ⅲ级:大量胚胎性或未成熟组织,核分裂象多。
法国癌症中心联合会(French Fédération Nationale des Centres de Lutte Contre le Cancer,FNCLCC)根据软组织肉瘤的分化、有无肿瘤性坏死及其在肿瘤内所占的比例以及核分裂象的计数将其分为3级,详见表2和表3。
表2 FNCLCC评分及分级标准

表3 软组织肉瘤的FNCLCC分级

2.恶性肿瘤的病理分期
国际抗癌联盟(Union Internationale Contre le Cancer,UICC)建立了一套国际上能普遍接受的分期标准,即TNM(Tumor-Node-Metastasis)分期,其目的是:①帮助临床医师制订治疗计划;②在一定程度上提供预后指标;③协助评价治疗效果;④便于肿瘤学家之间相互交流。美国癌症联合会(American Joint Committee on Cancer,AJCC)与UICC在软组织肿瘤的分期上意见基本一致。
分期系统必须对所有不同部位的肿瘤都适用,且在手术后获得病理报告予以补充。为此,设立了两种分期方法:临床分期(治疗前临床分期),又称TNM分期;病理分期(手术后病理分期),又称pTNM分期。pTNM分期是在治疗前获得的证据再加上手术和病理学检查获得新的证据予以补充和更正而成的分期。pT能更准确地确定原发性肿瘤的范围,浸润深度和局部播散情况;pN能更准确地确定切除的淋巴结有无转移以及淋巴结转移的数目和范围;pM可在显微镜下确定有无远处转移(表4)。
表4 恶性肿瘤的pTNM分期

注:组织病理学分级是术后的病理分级
近年来,恶性肿瘤的总体发病情况在世界各国多呈上升趋势,估计到2015年,全世界肿瘤死亡人数可达900万,发病人数可达1500万,其中三分之二将发生在发展中国家。在我国,恶性肿瘤在不同地区分别列入第一位、第二位死因。肿瘤是一种体细胞遗传病,其发生是一个复杂的多步骤过程,是环境因素和遗传因素相互作用的结果,不同的肿瘤,环境因素和遗传因素所起的作用大小各异。
(一)遗传因素
随着肿瘤遗传学的研究,人们逐渐认识到肿瘤是一种遗传学疾病,其实质为原癌基因的活化和抑癌基因的失活,通过改变控制和调节正常细胞生长发育的协调性,导致细胞的恶性增生。癌变的复杂性体现在它是一个多因素、多基因和多途径的过程,相关基因的改变发生在癌变的每一阶段,它促进了具有生存优势克隆的选择性扩增及其恶性程度的提高。在不同类型的癌,甚至同一种癌的独立起源癌灶间,所发生遗传学改变的基因的种类、数目和顺序都可能是不同的,因而肿瘤的发生存在多种遗传学途径。癌基因是一大类基因族,通常是以原癌基因的形式普遍存在于正常基因组内,其在生物进化过程中高度保守,编码的蛋白质介导细胞生长、信号传递和核转录,调控机体的生长、发育和组织分化。已知的原癌基因有90多种,根据其功能不同可分为:①生长因子类,如编码血小板源性生长因子的c-sis基因;②生长因子受体类,如编码上皮生长因子受体的erbB基因;③主要在生长信号的传递和细胞分裂中发挥作用的蛋白激酶类,如编码酪氨酸蛋白激酶的src、abl、yes、fgr基因等;④使G蛋白结构发生改变,不能与细胞调节因子结合导致恶性转化的,如编码p21蛋白的ras基因;⑤主要参与基因的表达或复制的调控的DNA结合蛋白,如myc基因。原癌基因的活化是一个复杂的过程,有多种诱因可导致原癌基因的活化,如:①病毒的插入或染色体重排;②抑制因子的消除;③碱基序列突变。抑癌基因是人类正常细胞中所具有的一类基因,具有促使细胞的终末分化、维持遗传的稳定性、控制衰老、调节细胞生长、抑制蛋白酶、调节组织相容抗原、调节血管生成等作用。常见的有Rb1、WT1、p53、NF、MCC、DCC、APC和MEN-1。仅在少数遗传性肿瘤和遗传性肿瘤前疾病中起作用,特异性较高,多为实体瘤,如乳腺癌、结肠癌、肝癌、骨肉瘤、视网膜母细胞瘤、肾癌、神经纤维瘤病等。目前,细胞癌基因激活和抑癌基因的失活作用理论已用于解释各种环境因素(病毒、化学、物理等)的共同致癌机制。
(二)病毒因素
1911年Rous报道了白血病鸡的无细胞滤液可于健康鸡中诱发细胞表型相同的白血病,为病毒致癌的实验性研究奠定了基础。但直到1964年Epstein等从Burkitt淋巴瘤患者的淋巴母细胞中分离出疱疹病毒样颗粒,才真正开始了人类肿瘤病毒病因学研究。近年来随着科技迅猛发展,肿瘤病毒病因的研究已深入到分子机制水平。病毒按其所含核酸不同分为两大类:DNA病毒和RNA病毒。DNA病毒一般为水平传播,病毒感染机体进入细胞后可有两种反应。一种为DNA病毒大量复制,同时细胞发生溶解死亡;另一种为DNA病毒整合于细胞内,通过编码转化蛋白,使细胞转化恶变。嗜肝DNA病毒科的乙型肝炎病毒(hepatitis B virus,HBV)感染和肝癌的发病有关;疱疹病毒科的EB病毒(Epstein-Barr virus,EBV)感染和Burkitt淋巴瘤、免疫母细胞性淋巴瘤、鼻咽癌、霍奇金淋巴瘤,平滑肌肉瘤及胃癌的发病有关,人疱疹病毒(human herpesvirus,HHV)-8感染和Kaposi肉瘤(Kaposi’s sarcoma,KS)、Castleman病发病有关;乳头状病毒科的人乳头状病毒(human papillomavirus,HPV)-16,-18,-33,-39感染和肛门生殖器肿瘤、上呼吸道肿瘤的发病有关。
人类只有两类RNA病毒家族(反转录病毒科和黄病毒科)和肿瘤的发生有关,前者包括人T细胞白血病病毒(human T-lymphotropic virus,HTLV)和HIV,后者包括丙型肝炎病毒(hepatitis C virus,HCV)。RNA病毒的复制过程可简略表示为RNA→DNA→RNA→蛋白质,通过前病毒DNA整合到宿主细胞DNA,参与病毒的复制、转录,并传递其遗传信息。外源性RNA病毒以水平传播方式感染宿主相应的细胞,并有病毒的复制和颗粒形成,但不引起宿主细胞的死亡。其中HTLV-1直接介导成人T细胞白血病(adult T-cell leukemia,ATL)的发生,而HIV和HCV对肿瘤的发生只起间接作用。血清学检测证实100%的ATL患者携带HTLV-1,患者的白血病细胞中含有HTLV-1原病毒,而患者体内其他细胞却不含有此原病毒,虽然HTLV-1在ATL发生中的分子病理学机制还不明了,但是HTLV-1基因组所编码的Tax蛋白和p12I蛋白通过和细胞蛋白的相互作用,在转录、细胞-细胞间调节、细胞增殖和凋亡中起重要作用。HIV-1和HIV-2属于反转录病毒科的慢病毒属,感染人体后都可引起获得性免疫缺乏综合征(acquired immune deficiency syndrome,AIDS),但现在绝大多数的AIDS患者是HIV-1感染者。虽然HIV感染所致的免疫缺陷和肿瘤的发生相关,但现无证据支持HIV本身可直接导致肿瘤发生。AIDS患者可伴发非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)、KS、宫颈癌和肛管鳞癌,但这些肿瘤也和某些DNA病毒感染有关,如HHV-8、EBV和HPV。约1%~5%的HCV患者可发展为肝癌,但有明显的地域性,在意大利、西班牙和日本,约50%~70%的肝癌患者和HCV感染有关,而在中国主要和HBV感染相关。现在已可通过注射疫苗预防HCV感染,而对已感染的患者联合应用干扰素-α和利巴韦林可有效减低病毒复制,改善肝细胞的组织改变,其有效率为50%~80%。除了肝细胞,HCV也可感染造血细胞,如淋巴细胞和CD34+前体细胞,感染者为B细胞NHL的高危人群。
(三)化学因素
自从1775年英国医师Pott发现扫烟囱工人的阴囊癌与多年接触煤烟灰和沥青有关,人们逐渐认识到肿瘤的发生和某些化学物质有关,并已被大量的体外实验和动物模型予以证实。化学致癌物通过引起基因的点突变、染色体易位、DNA重排、DNA缺失和DNA甲基化能力缺失,从而激活癌基因,并使抑癌基因失活,它具有明显的器官特异性。在动物和人类中已知有上百种化学致癌物(表5)。通过降低某些致癌物如己烯雌酚的摄入和特异性致癌物,例如氯乙烯、苯和芳香胺的接触,使肿瘤的发病率下降;并可通过给予某些肿瘤干预剂,如维A酸、抗雌激素药、花生四烯酸降低高危人群的肿瘤发病率。
表5 肯定致癌物和可疑致癌物

在这中间吸烟和多种肿瘤的发病有关,如肺癌、喉癌、膀胱癌、食管癌、肾癌、口腔癌、胰腺癌和胃癌,且可能和白血病、宫颈癌、大肠癌、肝癌、前列腺癌、肾上腺癌、胆囊癌及甲状腺癌有关。吸烟者的肿瘤发生率较非吸烟者高3~10倍,在肺癌中甚至可高达20倍,且和吸烟的剂量和烟龄呈正相关,二手烟也可提高非吸烟人群肺癌的发病率。戒烟可降低肿瘤发生的危险性,在戒烟后的2年起患癌的危险度即开始下降,随着戒烟时间的延长其患癌的危险度逐渐下降。雪茄和烟斗可能要较香烟的危险性和成瘾性低,但有研究表明其也可提高肺癌、口腔癌、喉癌、肝癌、胰腺癌和膀胱癌的发病率。
(四)物理因素
物理致癌因素主要包括:电离辐射和紫外线。在自然界如土壤、岩石、植物和建筑材料中,广泛存在电离辐射,最常见的是氡。尽管理论上电离辐射可诱导各种类型的肿瘤,但某些器官、组织和细胞类型对电离辐射较敏感,最常见的为白血病、甲状腺癌、乳腺癌和肺癌,其次为唾液腺肿瘤、食管癌、胃癌、结肠癌、肝癌、卵巢癌、膀胱癌、皮肤癌和中枢神经系统肿瘤。潜伏期的长短和发病几率受多种因素影响,包括受辐射时的年龄、剂量、宿主的易感基因及肿瘤类型,如白血病在受辐射后2年即可发生,4~8年时的发生率最高;而实体瘤的潜伏期可长达5~20年。现在低剂量射线广泛应用于医学诊疗,相关的放射学工作人员及接受放射诊疗的患者的安全性正越来越受到关注,特别是随着肿瘤放疗的发展,长期生存的患者逐渐增多,放疗后的继发肿瘤的报道逐渐增多。一组研究发现宫颈癌患者接受大剂量的放疗后其照射野区的膀胱癌、直肠癌、小肠癌、骨肿瘤的发病率较手术组的高,最早于放疗后2年即可发生第二原发肿瘤;另一组研究发现前列腺癌患者放疗后第10年起其照射野区的软组织肿瘤、膀胱癌和直肠癌的发病率较手术组提高。电离辐射致癌是由于放射线能量直接或间接通过细胞内的水分子产生自由基作用于DNA,导致碱基损伤,DNA链断裂。
紫外线(ultraviolet,UV)根据波长可分为 UVC(240~290nm)、UVB(290~320nm)和 UVA(320~400nm)。太阳产生的UVC在大气层中已被吸收,并没有到达地球,而导致皮肤癌的是太阳光中的UVB和UVA。UVB和DNA相互作用可引起一系列的分子学改变,最常见的是相邻的嘧啶形成二聚体,其中环丁烷二聚体和6-4光产物具有强烈的致癌性和致突变性。UVA很少被大气层吸收,可作用于皮肤,但DNA和蛋白质很少吸收UVA,主要是通过和生色团相互作用后间接导致DNA损伤,但是已证明它有致癌性。因而皮肤癌常见于暴露于日光的部位,如头颈和手臂。
虽然石棉纤维是一化学物质,由于其致癌作用主要是由于它和细胞间的物理作用,而不是化学作用,所以现在将其归入物理致癌物。石棉是纤维结晶后形成的硅酮,可致间皮瘤。有石棉接触史者间皮瘤的发病率可高达2%,且肺癌、咽部肿瘤、喉癌、肾癌、食管癌和膀胱癌的发病率亦有所上升。石棉纤维通过引起双链断裂、突变和染色体损伤导致DNA损伤,同时还可影响有丝分裂和染色体分离,从而形成异倍体;同时石棉还可诱导炎性反应,导致细胞因子的释放,从而促进细胞的生长和克隆的选择。
肿瘤的放射治疗
放射治疗是肿瘤治疗的重要武器之一。据国内外统计,约有60%~70%的肿瘤患者在病程的不同时期因不同的目的需要接受放射治疗。放射治疗在X线被发现后不久约在20世纪20年代就开始应用于肿瘤的临床治疗了。近十多年来随着三维适形,适形调强和图像引导、剂量引导下的放射治疗新技术的出现,放射治疗学的面貌已焕然一新。尽管如此,构成放射治疗学基础的理论即放射生物学放射物理学等基本概念并未改变。
本文将概述放射生物学、放射物理学的基本概念,简单介绍放射治疗学的新进展,以及放射治疗学临床运用的基本原则。
(一)放射生物学概念
1.射线和物质的相互作用
放射线在生物体内能产生次级电子,引起电离。射线通过对DNA的直接作用和间接作用,即产生自由基再攻击生物分子,从而产生生物损伤。
2.细胞死亡
(1)增殖性死亡
又称分裂期细胞死亡,它与细胞周期相关。细胞经射线作用后,并不立即死亡,经过几次细胞分裂后才会最终死亡。
(2)间期死亡
它主要发生于射线照射后几小时内。对放射线较敏感的细胞,如淋巴细胞等多以此类死亡为主。
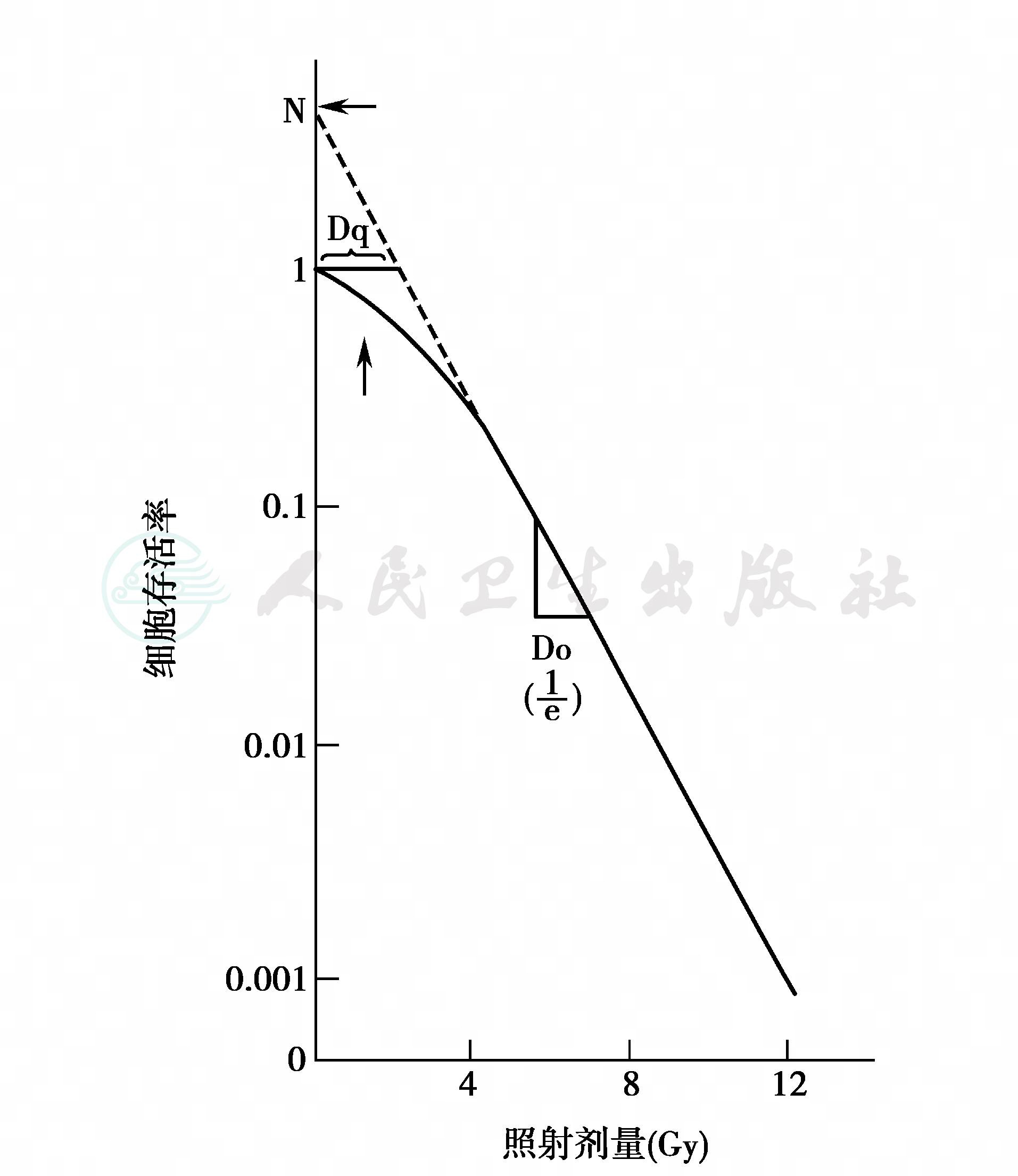
图1 细胞存活曲线
3.细胞存活曲线
细胞经照射后,若被射线击中即可产生损伤或死亡;而未被击中的细胞,或虽被击中损伤但经“修复”后的细胞则可存活下来。显然细胞损伤的大小与所受到的照射剂量有直接的关系。细胞存活曲线就是用来描述照射剂量与相应细胞存活率的相互关系(图1)。该曲线由几部分组成,在高剂量区,曲线呈线性,以Do值为平均致死剂量,即经照射后,可使37%的细胞存活,63%的细胞死亡所需的照射剂量。在低照射剂量区,曲线呈弯曲的形态,称为细胞存活的肩区。肩区的宽度以Dq来表示。
至今为止,最为广泛接受的用来解释肩区部分的生物物理模式是所谓的线性——平方模式,或称L-Q模式。用公式表示为:S=e-(αd+βd2),其中d代表剂量;α和β分别代表单靶和多靶击中引起的细胞死亡,当它们所产生的生物效应相等时,即可以用α/β的比值来表示不同类型组织修复能力的大小。S代表经d剂量照射后存活的细胞百分数。
4.剂量率效应
当剂量率降低时,生物学效应也不断下降,称之为剂量率效应。剂量率效应在近距离照射和调强放疗中具有重要的意义。在全身照射中也借助于剂量率效应以保护正常组织。
5.放射敏感性、放射抵抗性和放射治愈性
放射敏感性用来衡量细胞是否容易产生放射损伤的程度。放射抵抗性含义正好与放射敏感性相反;放射治愈性是指通过放射治疗某一疾病可被控制的几率的大小。须注意,放射敏感性临床上并不能代表放射治愈性,但前者是后者的基础。
6.放射超敏感效应
1993年,Marples和Joiner等根据实验研究,发现当照射剂量<0.1Gy时,存在着细胞生物学效应明显增加的现象,称之为超敏现象。此现象的机制目前尚不清楚,一种解释是由于剂量太低损伤太小尚不足以刺激生物体启动修复机制。超敏现象在调强放疗中或许会有临床意义。
7.LET和相对生物效应
LET即线性能量转换是评价射线质的一个参数。高LET射线几乎没有或较少有亚致死性损伤(SLD)和潜在致死性损伤(PLD)的修复。细胞存活曲线肩区较小或不存在。LET增加则氧增比(OER)下降,这是因为LET高时直接效应增加而间接效应减少。
相对生物效应(relative biology effect,RBE)指要达到同样生物效应时标准射线(250kV X线或γ线)和某种射线剂量的比值。
8.放射效应预测
放射线在一定剂量下,对不同的个体或同一个体不同的细胞类型,如不同的肿瘤细胞所产生的生物效应可以不一样。利用放射生物学理论和方法,通过放射治疗前设法获取与放射效应有关的参数,以预知放射对该个体或细胞所产生放射效应的大小,这种思路和方法就称为放射效应的预测。常用的方法有:①细胞内在放射敏感性的预测。②细胞增殖动力学预测放射效应。③肿瘤细胞内乏氧状态来预测放射效应。
9.分次照射的理论基础
多年来的实践证实,放射治疗必须分次进行而尽可能避免单次剂量照射。单次和分次照射的生物效应是不一样的。放射治疗的设计必须遵循两个重要的放射生物学原则,即每次照射剂量较低及总的治疗时间要短。这样既有利于保护正常组织又能增加肿瘤局部控制率。所以要实行分次照射。其根据如下:
(1)细胞损伤的修复
细胞受到损伤以后,经过一段时间会产生修复,即恢复到未受到照射时相仿的状态。细胞的修复包括两部分即亚致死性损伤修复(SLDR)和潜在性致死性损伤修复(PLDR)。而在分次照射期间主要是SLDR。由于存在SLDR,分次照射会导致生物效应的下降,故为了保持相同的生物效应,必须增加总剂量。细胞的修复过程呈指数性的。目前,我们可以定量地测定细胞的修复速度(T1/2,半修复时间,即完成50%细胞损伤修复所需要的时间)和修复能力(α/β比值)来表示整个修复过程。根据照射后正常组织损伤出现的早或晚,可把正常组织分成两大类:细胞更新速度快的,在照射开始后不久即出现反应的称为早期或急性反应组织,如黏膜、上皮组织等;细胞更新速度慢的,在照射结束后过一段时间才出现反应的称为后期反应组织,如脊髓、肾脏等组织。早期反应组织的T1/2大约为0.5小时;而后期反应组织的T1/2为1.5~2.5小时。后期反应组织的α/β值一般在2~3Gy,而早期反应组织的α/β值一般在10Gy左右。说明增殖慢的组织修复能力较强,而增殖快的组织修复能力较弱。大部分肿瘤组织的修复速度和能力相似于急性反应组织,极小部分与后期反应组织相仿。
(2)细胞的再增殖
细胞增殖不同于细胞的修复,它意味着细胞的分裂及细胞数的增加。正常组织受到照射后,经过一段时间,细胞会产生增殖。临床上表现为治疗疗程增长能缓解急性反应如头颈部黏膜反应等。但后期反应正常组织一般在整个放射治疗疗程之内不会产生细胞的增殖,因而对后期反应组织来讲,主要是细胞的修复,而不是增殖影响辐射生物效应。大部分肿瘤组织照射后也会促使细胞增殖加快,如头颈部肿瘤平均倍增时间由治疗前的45~60天,缩短到3~4天。一般地讲,由于肿瘤组织开始细胞再增殖的潜伏期较长及增殖速度较慢,因而与正常组织相比,肿瘤组织再增殖在影响放射治疗疗效中的作用低于正常组织。
(3)再氧化过程
由于肿瘤生长常快于新生血管的生长,使肿瘤内远离血管的部位成为乏氧区。乏氧细胞对射线的抵抗性高于富氧细胞2.5~3.0倍。在大剂量照射时,由于富氧细胞在照射的很早期即产生死亡,只留下对射线有抵抗性的乏氧细胞,因而从总体看,降低了照射的生物效应。然而,在多次小剂量(如每次2Gy)照射时,每次照射后,由于乏氧细胞具有对射线的抵抗性,难于被杀灭,因而在余下的存活细胞中占据了很大的比例。但由于富氧细胞被杀灭,使原来乏氧细胞较易得到营养和氧的供应而成为富氧细胞。这个过程被称为肿瘤细胞的再氧化。由于在整个治疗过程中,均存在肿瘤细胞再氧化的过程,这样使得乏氧细胞在整个肿瘤中所占比例降到很低的水平,如可低于10%。正常组织内基本不存在乏氧细胞,所以再氧化过程主要产生在肿瘤组织内。
(4)细胞周期的重新分布
细胞周期中每个时相的放射敏感性是不一样的。在常规放射治疗中,每次照射2Gy主要是杀灭位于细胞周期中敏感时相的细胞。在两次照射之间,不敏感的存活细胞群可以进入到对射线敏感的时相,此时,再次照射会有助于更多地杀灭细胞。这个过程对不增殖或增殖较慢的正常细胞影响很小。所以,低剂量分次照射主要影响增殖快的肿瘤,而对后期反应组织的作用不大。
10.分次照射中的时间——剂量因素
(1)每次剂量
每次或每天以1.8~2.0Gy的常规照射剂量是目前常用的治疗计划。由于后期反应组织具有分次照射敏感性,故降低每次照射剂量就会增加后期反应组织辐射耐受性,增殖较快的肿瘤组织基本上与早期反应组织相仿。相反,增大每次照射剂量就会产生严重的后期并发症,这已在临床上得到证实。
(2)照射间隔时间
两次照射的间隔时间取决于靶区内后期反应组织需多长时间才能完成亚致死性损伤的修复,否则,会产生严重的并发症。早期反应组织如小肠上皮细胞一般在射线照射后3~4小时就已完成细胞的修复,其T1/2为30分钟左右。而后期反应组织完成细胞修复的时间比早期反应组织要长得多,如脊髓需要24小时,T1/2为2.4小时左右。不同类型的后期反应组织,其T1/2是不一样的。若以T1/2=1.5小时考虑,如肺组织等,那么,分次照射时必须至少相隔6小时,这样使94%的细胞损伤得到修复,又不会增加太多机器及工作人员的负担。若后期反应组织T1/2较长,如中枢神经系统,由于相隔6小时尚不能使细胞损伤产生完全性修复,因而在设计治疗计划时必须要作剂量纠正。
(3)总的治疗时间
增加总的治疗时间能减轻正常组织急性反应,但却能降低大部分肿瘤的控制率。这一现象已在临床头颈部肿瘤治疗中得到了证实。因此,为了克服肿瘤干细胞的增殖,放疗必须在尽可能短的时间内完成。
11.正常组织的放射耐受性
(1)正常组织放射耐受性
放疗中正常组织的损伤是不可避免的。目前,由于一些先进的技术如三维适形放疗、IMRT、IGRT等在肿瘤治疗的应用,在不影响肿瘤局部控制率的前提下,尽可能地把正常组织损伤降到最低水平,但决不会降到零。如脊髓,由于放射性脊髓损伤是灾难性的,因而脊髓的耐受剂量必须确定在不能产生任何脊髓损伤的范围内。由于正常组织的结构成分不同,功能不同,因此正常组织对射线的耐受剂量会有很大的差异性。
(2)正常组织分类
根据放射反应出现的时间不同,即潜伏期的差异,把正常组织分成两大类:与急性反应有关的组织称为早期反应组织,如皮肤、黏膜等;与后期反应有关的组织称为后期反应组织,如脊髓、肺、心脏等。这样的分类在临床上有很大的意义,两者的主要区别见表6:
表6 早期和后期反应组织的临床和生物学特点

(3)正常组织的容积效应
1)正常组织的结构与放射耐受
根据临床经验可以假设,在正常组织内存在功能性亚单位。在一部分组织和器官中,它们呈“并联排列”,如肺组织等。从整体上讲,肺组织属于对射线很敏感的器官,很低照射剂量就能产生肺功能衰竭。但当照射容积很小时,却可耐受较高照射剂量而不至于产生严重的损伤。另一类器官和组织的功能性亚单位呈“串联排列”,当一个功能性亚单位受到损伤时,即会引起整个器官功能的丧失,如脊髓。在这一类器官中存在一个剂量阈值,照射剂量低于阈值,器官功能不会受到影响,而照射剂量高于阈值,那么器官功能会丧失。大脑是一种特殊的类型,它既不













