英文名称 :ciliary block glaucoma
中文别名 :恶性青光眼
睫状环阻滞性青光眼又名恶性青光眼,首先由Von Graefe(1869)描述。它是一种少见但又非常严重的青光眼,发生于抗青光眼手术后,施手术的闭角型青光眼中约2%~4%发生本症。文献上描述的典型的恶性青光眼病例系抗青光眼手术后数小时、数日以至数月发生本症,且发生在有晶状体眼之原发性闭角型青光眼,然而近10多年来已报告一些恶性青光眼病例系发生于恶性青光眼晶状体摘除之后、以前无青光眼之眼晶状体摘除之后、开角型青光眼手术之后、点缩瞳剂之后。开角型青光眼手术后接受缩瞳剂治疗者、睫状体痉挛及水肿病例、外伤及葡萄膜炎、视网膜脱离巩膜捆扎术后、真菌性眼内炎者以及一些没有施过手术或滴缩瞳剂治疗之眼,也可发生本症。到底上述这些病例是否应该属于典型的恶性青光眼抑或类似典型恶性青光眼,目前尚难以断定,尚需作进一步研究。
一般认为,恶性青光眼只发生于闭角型青光眼,特别是手术时,眼压虽低(用药物控制)但房角闭塞者,术后存在着发生恶性青光眼的可能。但房角闭塞并非引起恶性青光眼的先决条件,因为一些开角青光眼术后和以前未患青光眼的眼睛,同样也会发生恶性青光眼,这个问题值得进一步探讨。然而恶性青光眼常发生于抗青光眼手术之后,手术技术操作是否与它有关?根据文献报告,典型的恶性青光眼可发生于各种青光眼手术之后,如周边虹膜切除术、睫状体分离术、全层巩膜切除术、角巩膜环钻术以及小梁切除术等,并未表明哪一种易患恶性青光眼,而且晶状体摘除术后也有发生恶性青光眼者。因此,手术技术操作与本症发生无明显联系。
对恶性青光眼的发病机制目前尚不明确,下述是几种比较流行的学说(图1、图2、图3)。
1.玻璃体内“水袋”形成学说
这一学说首先由Shaffer(1954)提出,以后由许多学者所接受。假设房水潴留在玻璃体后脱离之后,导致虹膜-晶状体或虹膜-玻璃体隔前移,引起前房普遍变浅,加重生理性瞳孔阻滞,甚至引起房角闭塞,导致眼压升高,借助超声波检查,可以证明玻璃体腔内水袋的存在。导致房水向后转移的机制尚不清楚,最大可能由于睫状体-晶状体阻滞所致。
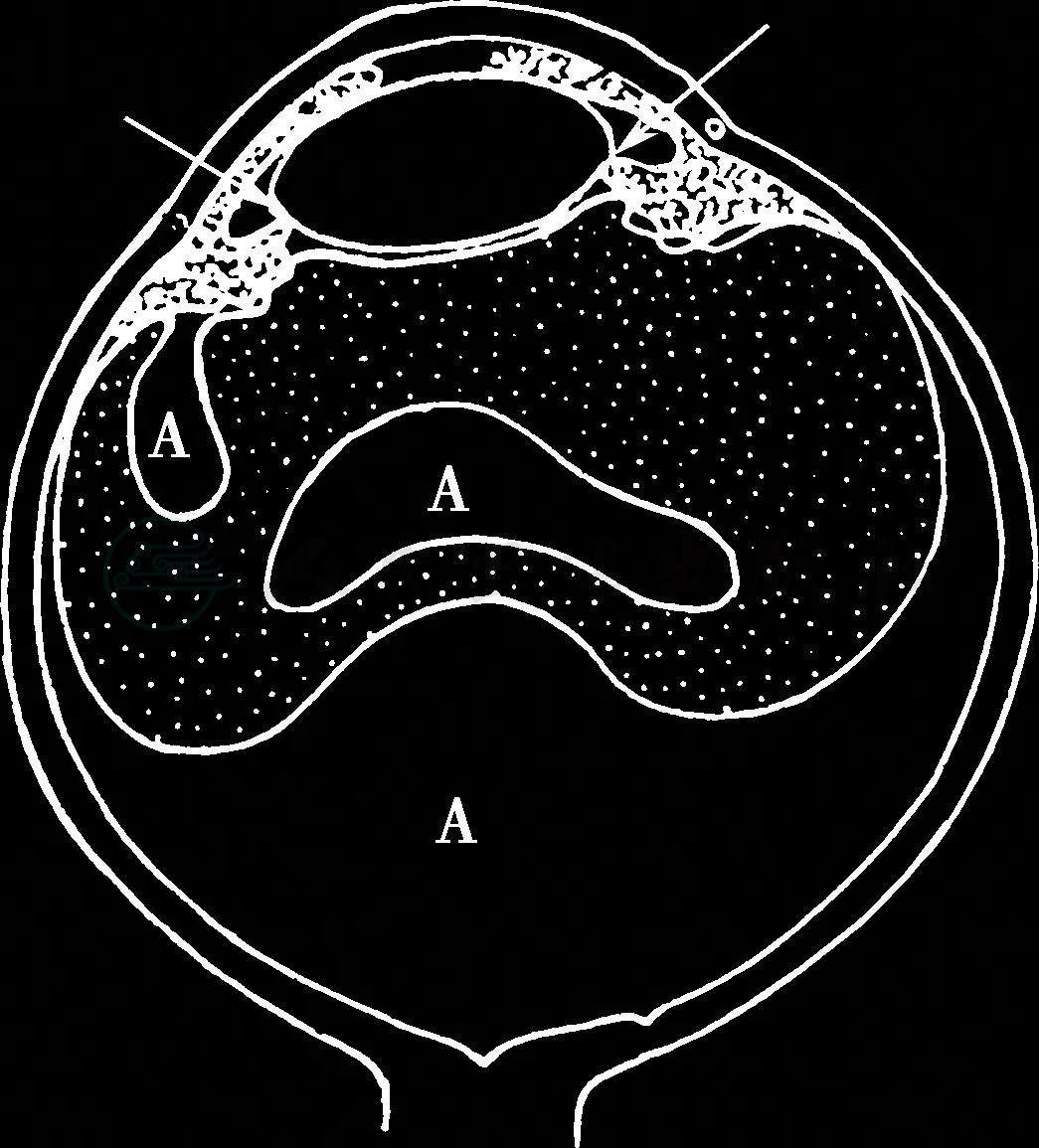
图1 恶性青光眼睫状环晶状体阻滞机制示意图
睫状突与晶状体赤道部同位,导致房水(A)向后倒流潴留在玻璃体内伴晶状体-虹膜向前移位
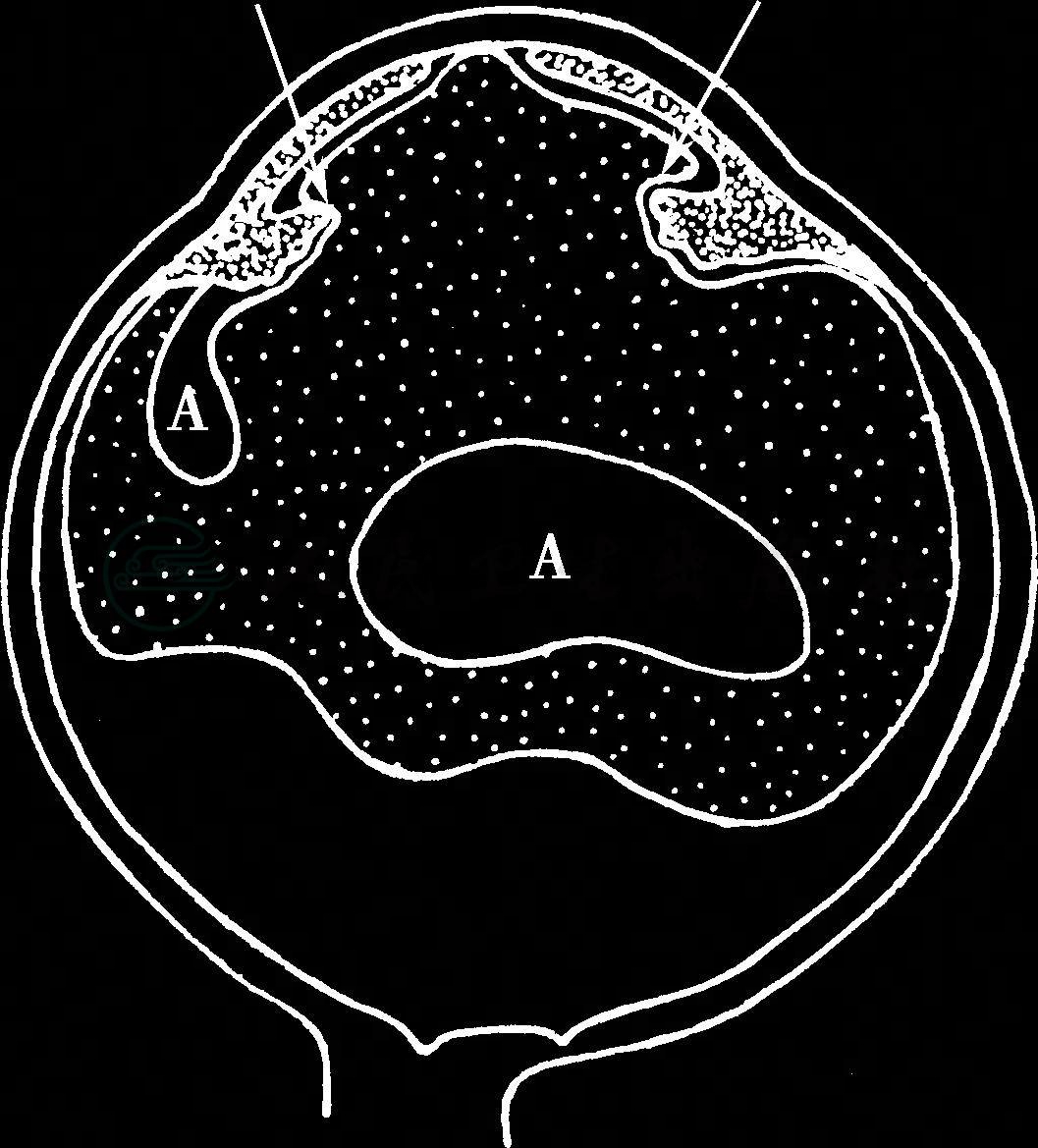
图2 无晶状体眼恶性青光眼睫状环玻璃体阻滞示意图
睫状突与前玻璃体面相贴导致房水向后倒流,引起玻璃体及虹膜向前移位
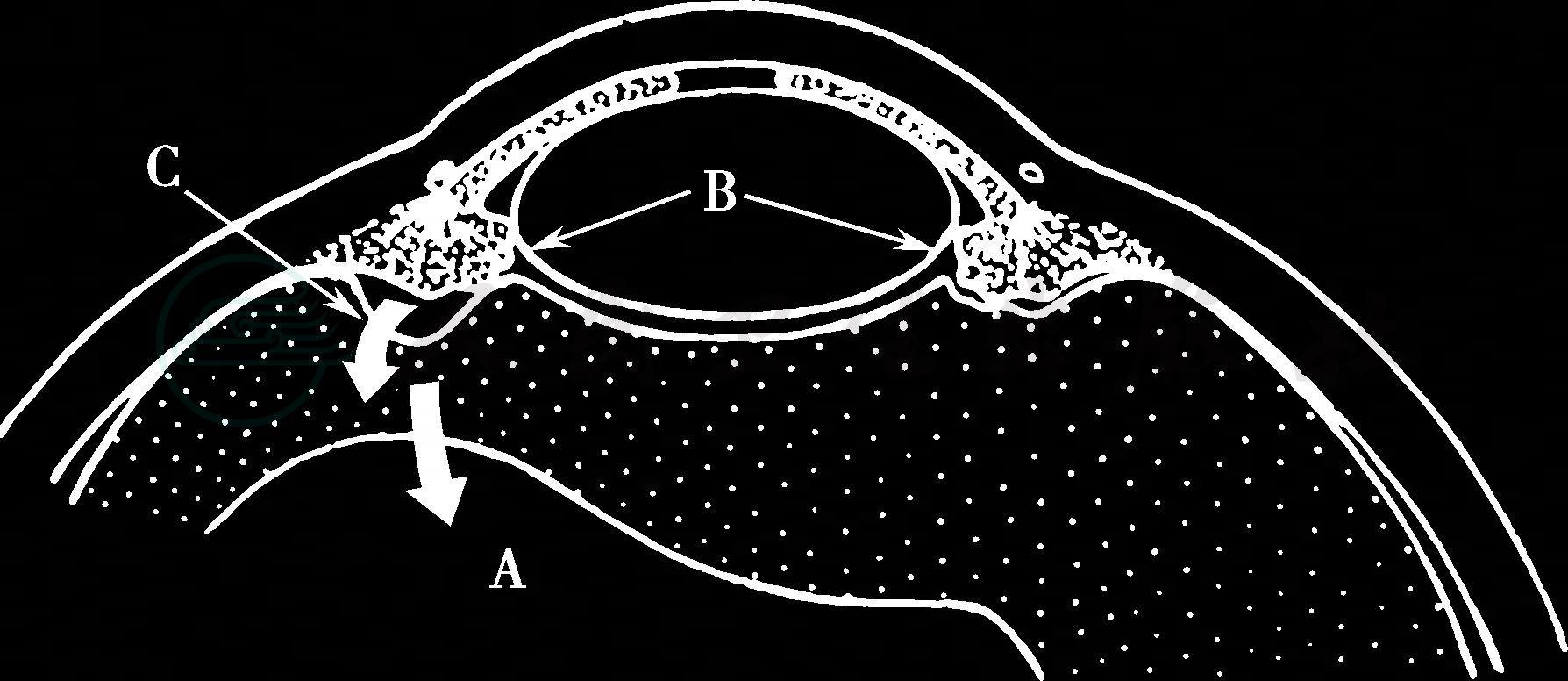
图3 前玻璃体膜可能参与睫状环晶状体阻滞
A.向后倒流 B.近玻璃体基底 C.部分破坏导致房水倒流
2.睫状体-晶状体(或睫状体-玻璃体)阻滞学说
有人已经观察到恶性青光眼患者睫状突的顶端向前转压迫有晶状体眼的晶状体赤道部或无晶状体眼的前玻璃体膜,这就阻塞了房水向前流的通道。故有人主张将恶性青光眼称谓“睫状环阻滞性青光眼”以代替恶性青光眼。房水循环发生机械阻滞的原因,可能与典型的恶性青光眼患者具有小眼球、小角膜、前房浅、晶状体厚以及视轴短等解剖因素有关,再加上滴缩瞳剂、外伤、手术及葡萄膜炎等诱因,可使睫状体水肿或痉挛,促使睫状体与晶状体(或玻璃体)进一步相贴近,从而导致眼压升高。
3.玻璃体及玻璃体前界膜阻滞学说
有人已提出玻璃体前界膜可能参与恶性青光眼的形成,Epstein及其同事(1979)对正常人及小牛眼摘除眼球作灌注试验,支持Grant对恶性青光眼发病机制的假设,他认为恶性青光眼者的玻璃体及玻璃体前界膜通透性降低,影响液体向前引流。由灌注实验表明,当眼压升高时,通过玻璃体的液体流抗力也增加,因此导致经过玻璃体凝胶移动之液体减少。这种抗力增加可能由于玻璃体浓缩及其向前移位,因而前周边玻璃体与睫状体及晶状体赤道部处于同位相贴状态,减少了玻璃体前界膜可通过液体的有效区,进一步加重了玻璃体凝胶内液体向前移动的阻力。由于前后玻璃体的压力差,使浓缩的玻璃体凝胶向前移位,导致前房变浅。
4.晶状体韧带松弛学说
Chandler及Grant(1962)已经提出恶性青光眼者的晶状体-虹膜前移可能由于晶状体韧带松弛或软弱无力以及玻璃体的压力所致,另一些学者也提倡这一学说,而且认为晶状体韧带松弛系由于持续性房角闭塞的结果或者由于手术、缩瞳剂、炎症、外伤或其他不明原因引起的睫状肌痉挛的结果。由于晶状体韧带松弛,晶状体前后径增加,晶状体-虹膜隔前移,导致前房变浅。
恶性青光眼一旦确诊,进一步施行一般抗青光眼手术往往无效,并有招致病情恶化的危险;滴缩瞳剂不能降压,反而导致眼压升高。局部滴散瞳睫状肌麻痹剂、全身用高渗剂及碳酸酐酶抑制剂是治疗本症的基础,局部及全身使用皮质类固醇是对本症有效的辅助治疗方法。
1.药物治疗
(1)散瞳睫状肌麻痹剂
属于这类药物有阿托品、东莨菪碱、后马托品、乙酰环戊苯(Cyclopentolate)及托吡卡胺(Tropicamide)等。用这些药物的溶液滴眼,每天2~4次,可以使睫状肌松弛,睫状环阻滞缓解,晶状体韧带紧张,因而晶状体-虹膜隔向后移位,相对性瞳孔阻滞也可缓解。前房恢复,眼压下降。对于有些晚期病例,药物疗效不满意;也有极少数病例需结膜下注射散瞳合剂才能达到治疗效果。
(2)高渗剂
常用的高渗剂有甘油盐水、甘露醇、尿素、山梨醇等。这些药物可以使玻璃体脱水,减少玻璃体内房水潴留,因而使眼球后段体积减小,这就为晶状体-虹膜隔向后移位提供有利条件。高渗剂与散瞳睫状肌麻痹剂合并使用往往可以收到更满意的治疗效果。
(3)碳酸酐酶抑制剂
常用的有乙酰唑胺及双氯非那胺(双氯磺酰胺),对治疗本症来说,疗效不如高渗剂,也需与散瞳睫状肌麻痹剂合用。若与肾上腺素能β受体阻滞剂(普萘洛尔、噻马洛尔等)合并使用,可能对减少玻璃体内房水潴留有益。
(4)皮质类固醇
一些典型的恶性青光眼常常由于葡萄膜炎、外伤及内眼手术导致睫状体水肿所诱发,应用皮质类固醇治疗有助于减轻炎症、减少渗出、减轻睫状体水肿及防止晶状体或玻璃体同睫状体粘连。因此局部及全身使用皮质类固醇是恶性青光眼有效的辅助治疗方法。
应用上述药物治疗控制眼压后,仍需长期用散瞳睫状肌麻痹剂,每天1~2次滴眼,根据眼压情况,适当结合应用降眼压药。
2.手术治疗
(1)睫状体扁平部抽吸玻璃体积液及前房注射液体或空气:Chandler(1968)首先报告此手术方法用来治疗典型的恶性青光眼,其操作步骤见图7。
1)先在透明角膜缘作一板层斜面切开,为下一步前房注入空气作准备。
2)在颞下方切开球结膜,暴露巩膜,在角膜缘后3~5mm处作表面电烙,以角膜缘后3.5mm为中心作放射状巩膜切开,长约2~3mm。
3)用止血钳在12mm处夹住18号针头,通过已散大之瞳孔,在检眼镜观察下,针头自颞下巩膜切口向视乳头方向刺入12mm深,然后向前后移动针头,划破后玻璃体膜,让液体自动流出,或抽出1~1.5ml液体,眼球即变软。
4)通过预作的角膜缘切口,注射少量平衡盐液于前房,使眼球部分恢复球形。不必使眼球恢复正常压力,否则有引起眼压升高的危险。
5)局部滴阿托品溶液,以后继续用此药物治疗。
(2)晶状体摘除术:当患者用最大限度药量仍不能降压,晶状体明显混浊或一眼已施晶状体摘除时,适于作此手术,需同时切开玻璃体前界膜。多数病例可获得成功的治疗效果。
(3)后巩膜切开及前玻璃体切割术:一些学者细心进行玻璃体切割以除去部分前玻璃体,对治疗本症有一定疗效。但有潜在的严重并发症的可能,应慎重采用此治疗方法。
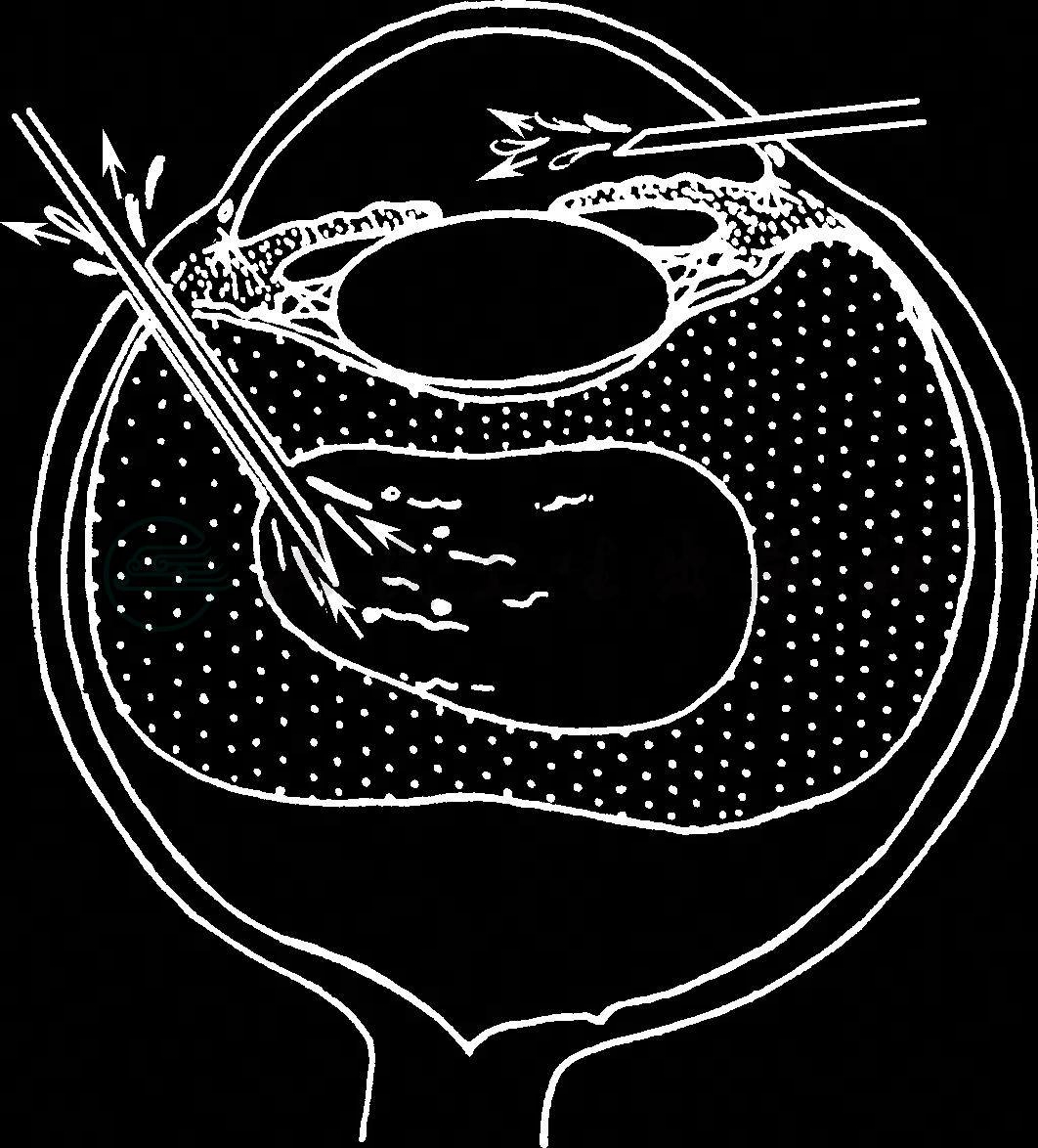
图7 经平坦部作后巩膜切开抽吸玻璃体及前房内注入空气
(4)激光治疗:通过虹膜切除区进行氩激光光凝睫状突,继而用药物治疗,已有报告可缓解恶性青光眼,推想这是由于破坏了睫状环晶状体阻滞所致。一些发生在晶状体囊内摘除术后的恶性青光眼,可能是由于玻璃体前界膜通透力降低所致。有报告用YAG激光在玻璃体前界膜打孔,可取得满意疗效,勿须施前玻璃体切割术。
(5)冷冻治疗:曾有报告睫状体冷冻治疗恶性青光眼,推测其降压机制在于睫状体及玻璃体本身的改变。
3.对侧眼的处理
(1)一眼发生恶性青光眼,另一眼在相似的条件下,有很大可能性也要发生恶性青光眼,此已为许多学者公认。若对侧眼眼压正常,房角开放,可试滴缩瞳剂数天,滴药后如果眼压升高、前房普遍变浅,表示此眼存在着易患恶性青光眼的因素。任何内眼手术均有诱发恶性青光眼发作的危险。
(2)如果对侧眼已处于闭角型青光眼早期,应尽早施周边虹膜切除术或激光虹膜切除术;如果已达发展期或晚期闭角型青光眼,施行抗青光眼手术后,应注意早期控制炎症,适当滴散瞳睫状肌麻痹剂。













