对角膜缘干细胞疾病进行分类和分期的目的,是为了替干细胞缺乏性疾病铺设一条改善诊断和治疗的通道,以便在临床上根据其类别和严重程度,采取针对性措施。角膜健康的维持,必须以本身和相关组织正常的结构和功能为基础:能够分泌足够黏蛋白(mucin)和水性泪液的结膜和使角膜维持透明属性的角膜缘干细胞。因此,关于角膜缘干细胞疾病分类取决于两个要素:干细胞缺乏的程度和结膜的状态。基于上述两要素,Schwartz将角膜缘干细胞功能缺乏性患者分为两期
1.Ⅰ期疾病指干细胞总量丧失<50%,通常由医源性干预引发,包括接触镜相关性角膜病变(contact lens keratopathy)、轻度碱烧伤、翼状胬肉和轻症Stevens-Johnson综合征等,以具有明确的致病原因为特征,有明确的既往病史、角膜缘部位多次手术创伤史、长期佩戴接触镜、严重的眼表感染、局部长期接受抗代谢药物或抗青光眼药物治疗等。
2.Ⅱ期疾病指干细胞总量丧失>50%,主要疾病包括:先天性无虹膜(congenital aniridia)、重度Stevens-Johnson综合征、严重碱烧伤、眼部瘢痕性类天疱疮(ocular cicatricial pemphigoid)、特应性角结膜炎(atopic keratoconjunctivitis)等。
3.正常眼角膜上皮擦伤后的修复过程,无须角膜中央区域的细胞参与,而是先由角膜缘干细胞分裂产生短暂扩增细胞(transient amplifying cells,TAC),后者再分裂增殖为分裂后细胞(PMC)和终末分化细胞(TDC)来完成缺损区域的上皮更新。
4.角膜缘干细胞异常可见于先天性无虹膜、角结膜上皮内上皮细胞癌和接触镜相关性角膜病变等多种情况。引起干细胞减少的主要两大病因是创伤和炎症,前者主要由热烧伤或化学伤和医源性创伤(多次手术性创伤、小梁切除、局部长期用药);造成干细胞减少的急性和慢性炎症有:Stevens-Johnson综合征、瘢痕性类天疱疮、特应性角结膜炎和眼表烧伤等。
1.角膜缘上皮干细胞(LESC,简称SC)的固有特性
1)比角膜中央或旁中央基底上皮细胞具有更高的增殖能力。这些细胞更原始,体积比分化的短暂扩增细胞或终末分化细胞更小。
2)在动态平衡中是一种慢周期细胞,长期保留DNA标记,但一经损伤,就会成为高增殖力细胞。在它们被激活和增殖以前,都会保持这种干细胞特性和安静状态。
3)具有特殊的调节能力:在平稳状态下,SC是长寿命的,并能平衡两个相互冲突的需求——既增加SC的损耗数,又增加损耗SC的分化率。第一种需求是自我更新,而第二种需求是使组织在较低的等级保持对细胞丧失的代偿。
2.SC主宰角膜上皮的动态平衡,是角膜上皮自我更新的生发中心SC及其子细胞在维持上皮动态平衡中的分裂、增殖、分化和迁移过程,可作如下归纳
1)上皮干细胞居于上皮细胞的基底层;
2)在角膜缘呈波浪形,子细胞短暂扩增细胞(TACs)分裂向中央迁移更新上皮。
3)终末分化细胞(TDC),在眨眼过程中随泪液蒸发从眼表脱落,刺激细胞分裂周期,迁移和分化;
4)“角膜上皮维持的X,Y,Z学说”:X(增殖基底细胞)+Y(向心迁移细胞)=Z(表面丧失细胞)。在细胞增殖、分化、迁移和凋亡之间,有一个精确的动态平衡。
5)正常成人的角膜缘和角膜上皮基底层,存在两种有分裂增殖能力但分化程度不同的基底上皮细胞:干细胞(SC)和短暂扩增细胞(TAC)。SC只存在于角膜缘上皮基底层,占该部位基底细胞总数的3%~5%;而TAC则分布在整个角膜上皮基底层。
6)干细胞分裂增殖后的迁移走向。
SC最初产生非对称细胞分裂,产生一个子细胞SC,重新回到干细胞龛(stem cell niche)保持干细胞总数,而另一个子细胞TAC移出干细胞龛继续分裂增殖、分化;TAC的向心性迁移组成角膜上皮基底层,有些细胞离开上皮基底膜,进一步分化为翼状细胞,继续向浅表移行,最终分化成为鳞状细胞随泪液脱落。TAC的半衰期平均数周,但有时个别细胞可长达数月。
3.角膜缘干细胞缺乏导致功能障碍和角膜血管化
诚如上述,角膜缘干细胞是确保眼表上皮正常解剖和生理功能的基础,Huang等对11只兔眼的角膜缘上皮作了环形切除,缺损区很快愈合,未发生上皮糜烂。但观察6个月,36%的术眼发生周边部角膜血管新生。其后,为了验证角膜缘上皮增生能力对上皮愈合功能的影响,Huang将第1次实验兔眼(上皮已愈合)与正常对照的11只兔眼造成角膜中央7.5mm上皮缺损,结果发现,实验组中,伤口延迟愈合和中度角膜血管新生者占45%和64%。而对照组11眼无1例发生上述情况。3周后,将此两组动物作第2次7.5mm的角膜中央上皮清除,结果实验组延迟愈合和上皮糜烂占90%,角膜血管新生占64%,而对照组无1例发生上述情况。此外,还发现实验组角膜有杯状细胞向心性运动,而对照组角膜上皮中未发现杯状细胞。以上实验充分证明角膜缘上皮具有很高的增生能力。此外,角膜缘上皮还有一种在正常环境中对抗结膜侵入角膜区的抑制生长作用。角膜缘干细胞的缺如导致早期的结膜转分化(transdifferentiation)或角膜的结膜上皮化。
由于角膜缘干细胞功能失调(limbal stem cell dysfunction),无法完成角膜上皮正常的更新换代,无法保持角膜表面的光洁和固有的生理功能,角膜缘失去阻挡结膜内生的天然屏障,结膜的转分化作用造成结膜内生和角膜血管化。随着病情的逐步进展,患眼视功能每况愈下,最终因整个角膜表面完全血管化而丧失有用视力。
角膜缘干细胞衰竭的康复,原则上以手术处理为主,辅以适当的药物治疗。由于上皮处于不稳定状况,随时都可能发生角膜上皮缺损、复发性糜烂乃至溃疡;如果深层基质或内皮结构或功能受损需要更换全层角膜组织,在这种情况下,千万别忘记了,结构和功能健全的上皮组织是维持角膜透明属性必不可少的先决条件,如果手术者忽略了这一点,则其后果必然是事倍而功半甚至完全劳而无功。临床医师必须牢记:经久不愈的上皮病变必将导致角膜基质病变,所不同者仅仅是发病时间的早晚问题,如果我们能对角膜缘干细胞缺乏做及时有效的治疗,将可能避免发生角膜基质病变。根据笔者有限的临床经验,可按病变的严重程度采取不同的治疗措施:
1.部分干细胞缺乏(LSCD)
(1)贴敷术
理论上残存两个钟点方位以上的正常角膜缘上皮和周边透明角膜者,通过羊膜贴敷,有可能使LSCD获得修复,作者的经验是LSCD范围<1/2全周者治愈机遇更大。治疗目标和原理,是促使正常LESC受刺激后加速分裂增殖,新增殖的细胞向创面迁移,同时向心性扩展,完成全角膜面的上皮修复。具体手术步骤:角膜缘后1mm球结膜环形切开,先切除结膜化角膜表面纤维血管膜,实施全角膜面羊膜贴敷术,有望在术后3~6周内血管退行萎缩、正常部位的LESC分裂增殖、迁移,促使创面修复。Tseng及其同事曾对15例17眼部分LSCD患者实施羊膜移植,术后随访25.8个月,术后没有人发生上皮糜烂或持久性角膜上皮缺损,大部分患眼视力进步。
羊膜贴敷术对急性眼表烧伤引起的角膜缘干细胞伤亡具有神奇疗效,尤其是那些基底层尚有残存LESC和TAC的患眼,如果不能及时紧急手术处理,烧伤的病理生理过程,会加速这些受伤细胞的死亡;而羊膜贴敷的抗炎作用,将促使濒临灭绝风险的残存LESC和TAC复苏,让这种潜在性LSCD逆转。
(2)自体角膜缘移植
如果羊膜贴敷没能使角膜缘干细胞修复,则表明原有的干细胞和TAC尚不足以代偿性修复损伤部位的上皮,而必须对干细胞缺损的局部作自体角膜缘移植(limbal autograft):从对侧健眼角膜缘取材总面积应小于4个钟点范围,术后供眼发生LSCD的风险很小。取材部位通常首选12点和6点钟部位,各取两个钟点的角膜缘组织,这是因为上下方LESC密度相对为高(植片厚度约150μm/50μm上皮+100μm基质),宽度4mm(2mm周边部透明角膜+1mm角膜缘、1mm表层巩膜及被覆在角膜缘表面的球结膜)。供体眼被取材处创面用羊膜贴敷,能加速创面上皮修复。
(3)异体角膜缘移植(limbal allograft)
供体来源有两种,即亲属活体眼或尸体眼。从亲属活体眼取角膜缘组织,范围也必须小于4个钟点范围,以防止对供体眼造成永久性损害。手术方法与自体角膜缘移植相同。术后可能会出现某种程度的移植排斥,有必要实施全身和局部免疫抑制剂治疗。文献报告23例25眼接受过角膜缘上下方1/3取材者,供眼术后2周上皮修复,视力无下降。手术并发症包括结膜下出血(4眼),角膜中央区保持正常。平均随访41个月。未发现严重并发症。如角膜缘移植材料来自尸体眼,则术后必须常规实施免疫抑制治疗,具体用药方案下文将详细论述。
2.弥漫性角膜缘干细胞缺乏(diffuse limbal stem cell deficiency)
但角膜中央7mm以上范围仍保持透明。是环形角膜缘移植(annular limbal allograft)联合全角膜羊膜贴敷(amniotic membrane patching,AMP)的适应证。
这种病例实际上全周已经LSCD,只不过中央区角膜仍保持透明,只能说明角膜中央基底上皮细胞,即TAC尚存分裂增殖潜能,还能在一段时间内保持角膜中央的上皮更新,如果我们不能抓紧这有限的剩余时间,则数月以后将会导致全角膜面的血管化。在此期间,应不失时机地实施指环形角膜缘移植(图1)联合全角膜羊膜贴敷。既能逆转残存TAC自身的生理功能,维持角膜中央的透明属性,又从源头上消除了干细胞缺乏的隐患,补充角膜缘干细胞的不足。由于供体材料系360°指环状带基底层上皮之薄板层组织,故必须从尸体眼取材。
图1 指环形角膜缘移植示意
3.角膜缘干细胞严重缺乏或衰竭
这些患者表现为全角膜血管化。如果眼睑和结膜状态基本良好,又无明显角结膜干燥,则可先实施全角膜上皮移植(total keratoepithelioplasty),先恢复眼表的结构和功能,然后再根据12个月后的临床结果和疗效,决定下一步增视手术的取舍和选择。国际上普遍采取全角膜上皮移植,作者在上海和平眼科医院角膜组的临床体会是,除实施全角膜上皮移植手术以外,推陈出新,创造了一种重新组合的改良新术式:全角膜蕈状瓣角膜移植术。
(1)全角膜上皮移植(图2)
先沿角膜缘作环形球结膜切开(peritomy)联合全角膜表面纤维血管膜切除,深度约100~150μm,在此基础上对患眼行全角膜上皮移植联合羊膜贴敷术。这里所说的全角膜上皮移植,既包括360°全周角膜缘干细胞,也包括整个角膜上皮基底细胞。植片包括角膜缘开外1mm范围表层巩膜,故整个移植片直径通常达14mm,厚度约150μm(50μm上皮+100μm基质)。术中缝合时从植片环形表层巩膜进针,与受体巩膜表层10-0尼龙线间断缝合16~20针,线结埋藏于巩膜组织。术中无须对受体眼巩膜制作创面,只需直接间断缝合。植片缝合完毕,并在其表面贴敷一层羊膜覆盖全角膜植片。羊膜贴敷技术一如前述。

图2 全角膜上皮移植示意
对于这些患者,如果发现其角膜基质仍基本透明,而晶状体完好,则通过一次手术有望达到增视效果;若角膜深层组织混浊,即便全角膜上皮移植成功恢复上皮更新能力,视力仍然难以提升,增视效果只能寄希望于一年后移植的上皮结构和功能状态稳定时,再作穿透角膜移植(penetrating keratoplasty,PKP)。
(2)全角膜蕈状瓣异体移植术(mushroom pankeratolimbal allograft,m-pKLAL)
1)术式设计
角膜蕈状瓣异体移植术(m-pKLAL)是我们在临床实践中改良的一种新术式。缘于那些角膜深层浑浊的干细胞衰竭患者,虽经全角膜上皮移植获得成功使患眼重获LESC更新角膜上皮的功能,但要恢复视力,还必须再作一次增视性穿透角膜移植。我们在经历了多个这样的成功案例后悟到,即使第二次手术顺利,两次移植手术累加,给患者在移植排斥风险、漫长的残盲痛苦、高昂的治疗费用等多方面的煎熬和负担,都使患者难以承受。鉴此,我们将古老的蕈状瓣穿透移植与全角膜上皮移植术两种术式重组,设计出一种改良的新术式:全角膜蕈状瓣异体移植术。利用14mm直径的大植片,将其周边部分制作成只含板层角膜缘-角膜组织,目的是起到角膜缘干细胞移植作用,而植片正中7~8mm直径为全厚角膜,意在起到增视性穿透移植的功能。植片最周边部分由1mm宽度环形巩膜表层组织构成,中周边为具有一定厚度的板层角膜,只有正中7~8mm是包括后弹力膜与内皮的全层角膜(图3)。供体植片与受体植床周边部板层对应吻合。通常在完成角膜植片缝合以后,水密状态出奇的好,前房立即形成。常规联合羊膜贴敷术覆盖全角膜蕈状瓣,有利于上皮的保护和免疫抑制。
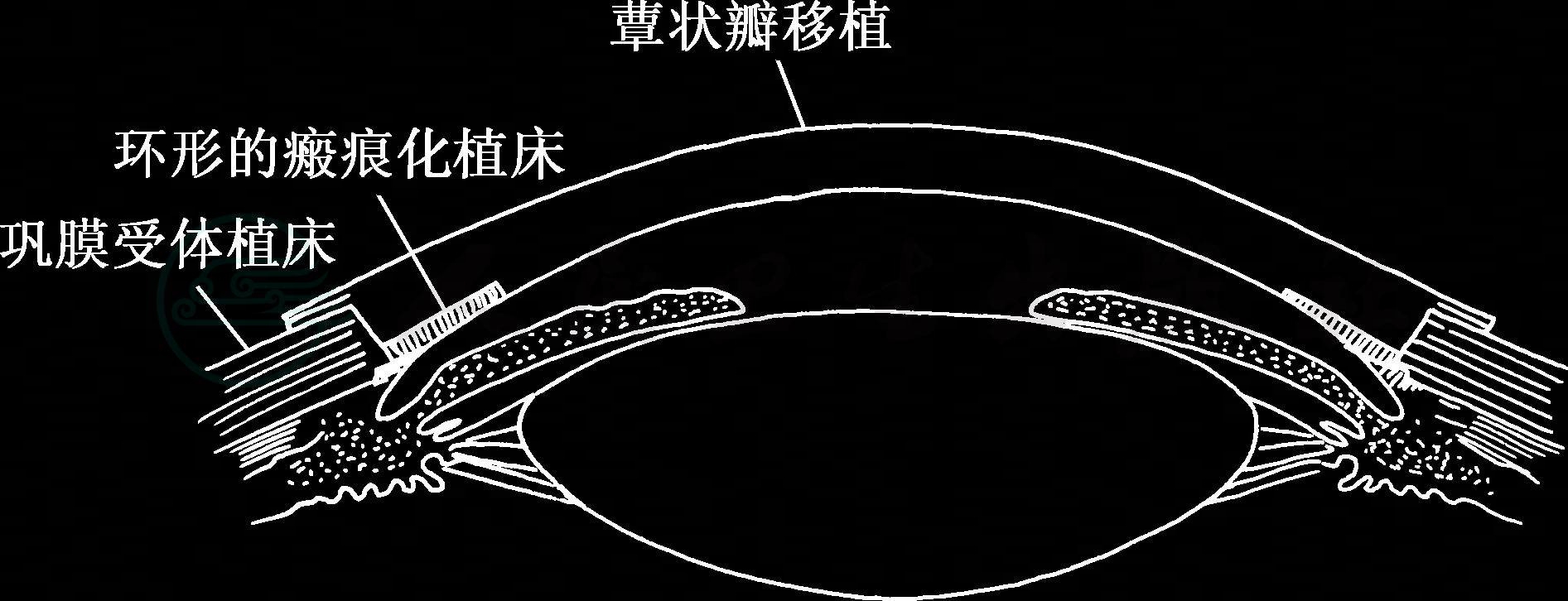
图3 全角膜蕈状瓣异体移植术示意
2)本术式的可取之处
根据作者有限的经验和体会,觉得包含角膜缘组织在内的全角膜蕈状瓣异体移植术只需一次手术,既重建了眼表,恢复了角膜上皮的更新能力,同时又达到了患眼的增视目的;恢复盲眼视力所花费的时间比全角膜上皮移植术缩短一半以上;从理论和临床实践结果均已提示,移植排斥风险因只经历一次移植,植片抗原量远比两次手术减少,故患者发生术后总的排斥风险相对减少;患者花费减轻;蕈状瓣设计术后伤口密闭,前房在术毕立即形成,避免了因植片与虹膜前粘连诱发术后继发青光眼的潜在风险。从作者团队所作20多例两种术式的对比来看,全角膜蕈状瓣异体移植术总体疗效远远高于全角膜上皮移植术。从医患双方考虑,虽手术难度较高,但性价比高于同类手术,在LESC培养物广泛临床应用以前,对本术式前景看好。
培养的角膜缘上皮移植(cultivated limbal epithelial transplantation,CLET)和培养的口腔黏膜上皮移植(cultivated oral mucosal epithelial transplantation,COMET)。培养的上皮移植片通常以羊膜为载体。文献报道该手术过程能够有效地稳定眼表。体外培养扩增移植物的优点是,只需要采取很小一片角膜缘或口腔黏膜,对供体眼或口腔黏膜损害和危险性很小,由于活检标本取自患者本人,术后几无移植排斥风险。此手术方式可用于单眼或双眼角膜缘干细胞缺乏。单眼缺乏案例CLET标本取自对侧健眼,而双眼角膜缘干细胞缺乏患者,CLET标本只能从活体亲属或尸体眼取材。后者术后存在移植排斥风险,术后需要使用免疫抑制剂治疗。口腔黏膜培养物没有角膜缘干细胞,但它们似乎具备角膜缘干细胞相似的根源,在适当的培养条件下,能够产生角膜样上皮细胞。后者最大的可取之处在于,双眼LSCD患者能够从自体口腔黏膜细胞取材。其长远结果有待进一步阐明。
1.羊膜支架培养的角膜上皮移植临床结果
1)Tsai氏的临床结果:100%(6/6)角膜2~4天开始上皮化,1月后角膜透明度改善;83%(5/6)视力由20/112进步到20/45,1例全角膜混浊眼视力由指数/40cm改善至20/200;随访15个月,上皮化眼未再发生新生血管和炎症。
2)Schwab氏的临床结果:培养3~4周,细胞3~5层,直径15~25mm;平均随访13(6~19)个月;14眼(10眼供体来源于自体,4眼来源于亲属);自体6/10成功,视力改善;供体来源于亲属的4眼上皮化,但有并发症。
2.培养颊黏膜上皮移植临床应用
台湾长庚医院借鉴日本Nakamura的方法,用培养的口腔黏膜上皮移植(COMET)治疗严重角膜烧伤:COMET治疗两眼急性碱烧伤和1眼慢性碱烧伤;为2眼慢性热烧伤重建眼表。培养标本取材于自体口腔黏膜,以羊膜为支架。应用免疫共焦显微镜检测培养的上皮薄片上的角蛋白和祖细胞标记。移植术后平均随访29.6±3.6个月。结果发现,培养的口腔黏膜上皮薄片keratin 3、13和祖细胞标记物p63、p75和ABCG2表达阳性。COMET后,所有术眼角膜炎症很轻,除1例患者外,其余术眼角膜表面在术后6.0±3.2天(平均3~10天)完全上皮化。这例上皮未修复的患者出现角膜微穿孔和小片持续性上皮缺损,但最终均无大碍。所有术眼都留有角膜浅层血管。为进一步改善视力,有3例实施了自体结膜-角膜缘移植;另3例做了穿透角膜移植。这些经过后续附加手术的患眼,视力均达到实质改善。他们的结论是,COMET能够促进急性角膜烧伤眼的上皮化,并能减轻炎症;对慢性角膜烧伤案例有助于眼表重建,是严重角膜烧伤可选择的治疗方案。
Nakamura等报告12例15眼平均随访20个月,最长34个月,10眼(67%)完全成功,无任何并发症,视力增加两行;5眼(33%)出现小片上皮缺损,其中3眼自行愈合,2眼(13%)需再次手术。所有术眼均有某些周边部角膜新生血管。
3.目前LSCD培养物移植概况简介
(1)LESC培养物移植的优越性:培养标本取自本人健眼或亲属活检组织,面积仅1~2mm2,对供眼结构功能无严重损害;理论上术后无须使用或适量应用免疫抑制剂;一旦研究完善从实验室走向临床,则LSCD患者将比较容易获得质高而量足的移植材料,无疑是医学界的一大进步。
(2)临床验证概况:欧、美、日和我国台湾均有临床应用报道,但病例数有限,5年以上成功案例很少,其中只有意大利的Pellegrini G教授的研究团队临床案例最多,在1998~2006年间共做了112例患者,绝大多数患眼系化学伤或热烧伤造成的单眼或双眼干细胞缺乏,此前接受过常规角膜移植均告失败。术后平均随访时间(2.91±1.99年,中位数1.93年,最长10年)随访时间最长,处领先水平;是目前比较成熟的临床验证医疗机构。国内多家研究中心还处于实验室探索阶段,尚无临床应用和随访的成功报道。建议眼表学组牵头,成立一个多中心实验室与临床联合研发课题,按国际公认的标准和规格进行实验室和临床验证,尽快赶上国际先进水平。Pellegrini等的成功经验:①用p63标记物鉴定祖细胞百分率,p63阳性细胞数>3%者,长期成功率高达78%,随访最长的案例已达10年;<3%者,成功率仅为11%,失败案例均发生在术后1年以内。②小牛血清联合3T3-J2克隆饲养细胞层。培养过程允许干细胞在安全环境中保持其完善的全克隆状态。他们在培养基中的小牛血清在眼科临床已应用12年,皮肤移植已超过20年均没有发现污染问题。
(3)COMET术中被移植的仅仅是培养的口腔黏膜上皮细胞,尽管标记物p63、p75和ABCG2表达阳性,也只能说明它们只是祖细胞而非干细胞,几乎所有被移植患眼角膜都出现浅层血管,其确切机制及远期效果和应用前景有待深入研究认定。γ-干扰素、肿瘤坏死因子及其他的淋巴因子,其中目前研究比较明确的为IL-2可刺激T和B细胞的活化和增殖,而IFN-γ可诱导供体组织表达Ⅱ类抗原。细胞毒T细胞主要攻击表达Ⅰ类抗原的角膜细胞。
经典的角膜移植术后免疫排斥有上皮型、上皮下型、基质型和内皮型,其中以内皮型排斥反应最多,其产生的破坏性最大。内皮型免疫排斥反应发生率高的原因可能有两个,一是角膜的有核细胞高度集中在角膜内皮层;二是眼内的虹膜和睫状体可能为另一条输送活化T淋巴细胞攻击角膜移植片的途径。













