英文名称 :glomusjugularetumor
中文别名 :颞骨副神经节瘤
颈静脉球瘤(glomusjugularetumor)是一种起源于颈静脉孔区或中耳腔副神经节组织的血管瘤样肿瘤。1941年,Guild在颈静脉球顶和中耳鼓岬发现一种血管性结构,命名为血管球体(glomusbody)。1945年,Rossenwasser首次报道该病,并命名为颈动脉体样瘤(carotidbodyliketumor)。此后该病陆续见诸报道,但命名较混乱,包括鼓室体瘤(tympanicbodytumor)、非嗜铬性副神经节瘤(non-chromaffinparaganglionictumor)、化学感受器瘤(chemodectomas)、血管球细胞瘤(glomerocytoma)等。后来Winship将其命名为颈静脉球瘤,并被广泛接受。目前研究证实,该肿瘤来源于副神经节组织,故Fisch等认为应称之为颞骨副神经节瘤(paragangliomaintemporalbone)。
颈静脉球瘤临床罕见,仅占全身肿瘤发病率的0.012%~0.03%,占头颈部肿瘤的0.6%。在颞骨肿瘤中居第二位,是颈静脉孔区最常见的肿瘤。该病以女性多见,男女比例约为1∶4~1∶6,任何年龄均可发病,其中40~60岁为高发年龄,具有发病年龄越小,肿瘤发展越快、越容易具有多病灶性和血管活性物质分泌性的特点。颈静脉球瘤有多发倾向,发生率约为17%,可位于同侧、对侧或双侧。约有1%~3%的颈静脉球瘤具有分泌儿茶酚胺的功能,类似嗜铬细胞瘤。颈静脉球瘤具有一定的遗传倾向,约占10%~15%,为常染色体显性遗传,且因基因组印迹的存在,父亲患病则子女有50%概率患病,而母亲患病则子女仅携带致病基因而不发病。遗传性颈静脉球瘤多发发生率显著升高,可达25%~78%。
1962年Alford和Guild首次将颈静脉球体瘤分为2型:起源并局限于中耳的称鼓室球体瘤,侵及中耳和颈静脉球两处的称为颈静脉球体瘤。随着医学影像学的发展和颅底手术技术的发展,简单的分型法已不能满足该病诊断与治疗的需要,于是Fisch和Mattox(表1)、Glasscock 和 Jackson(表2)、De La Cruz(表3)先后提出了自己的分型方法。
表1 Fisch分型

表2 Glasscock-Jackson分型

表3 DeLaCruz分型

C型侵蚀方向:
向下沿颈内静脉和第Ⅸ~Ⅻ脑神经延伸,向后进入乙状窦,向上累及颈内动脉管和耳囊,向外侵犯下鼓室和中耳,向内至颈静脉孔和桥脑小脑角。根据累及颈内动脉的情况可进一步分为不同亚型;颅内侵犯情况另作分类;没有根据侧窦或颈部脑神经血管受累情况进行分类(此时已无手术价值)。
D型根据侵入后颅窝的深度分为不同亚型:
De(硬膜外型):肿瘤侵入颅内,但仍在硬膜外;Di(硬膜内型):肿瘤侵入硬膜内。
分析以上分类,可谓各有特色,笔者认为,De La Cruz分类的特点在于与手术径路联系密切、指导性强,不足之处是分类较杂,尤其是牵涉到颅、颈区域的处理,使人不易掌握要领,而迷走神经肿瘤的处理与颈静脉球瘤的处理有所不同,放在此处似有不妥;Glasscock-Jackson分类与Fisch分类大体相似,但详略失当:①对鼓室球瘤的分类过于细致似无必要,因为鼓室球瘤的处理基本同中耳手术;②对颈静脉球瘤的分类则稍显简单,对手术径路的设计等无针对性。Fisch分类则详略得当:对鼓室球瘤一带而过,对颈静脉球瘤则重点突出,根据是否累及颈内动脉、是否侵入颅内进行准确分类,并提出相应手术径路的选择、手术分期的确定以及相关学科的配合等,使术者可以在术前准确评估病变范围、术中选择最佳手术径路、术后科学分析治疗效果。故尽管有学者认为Fisch分类稍显繁杂,但笔者认为这是很有必要的,尤其是牵涉多学科合作时有助于迅速达成共识。
颈静脉球瘤可发生于副神经节所在的任何部位,甚至面神经管内的副神经节。颈静脉球瘤表面光滑,粉灰或紫红色,呈分叶状,外有包膜。其切面呈海绵状,易出血。瘤体间质血管丰富,为扩张的薄壁血窦,甚至呈血管瘤样改变。颈静脉球瘤在光镜下由成串的上皮样细胞(主细胞)和支持细胞构成,外周为纤细的毛细血管网,外层为薄层纤维组织被膜。电镜下可见细胞呈多形性,染色深,核呈网状,染色浅,位于细胞中央,外被核膜,核分裂像少见。主细胞呈片状、条索状分布,直径20~30μm,胞浆嗜伊红,颗粒细小,偶尔胞浆清亮,有空泡形成,线粒体含量极为丰富,类似于内分泌肿瘤细胞。与正常的副神经节组织相比,颈静脉球瘤的血管更丰富,支持细胞和神经末梢极少,这是肿瘤的特征表现(图1)。颈静脉球瘤免疫组化显示:NSE(+),serotonin(+),Chromoganin(+),Leu-enkephalin(+),gastrin(+),substanceP(+),VIP(+),somatostatin(+),bombesin(+),α-MSH(+),S-100protein(+),calcintonin(+)。
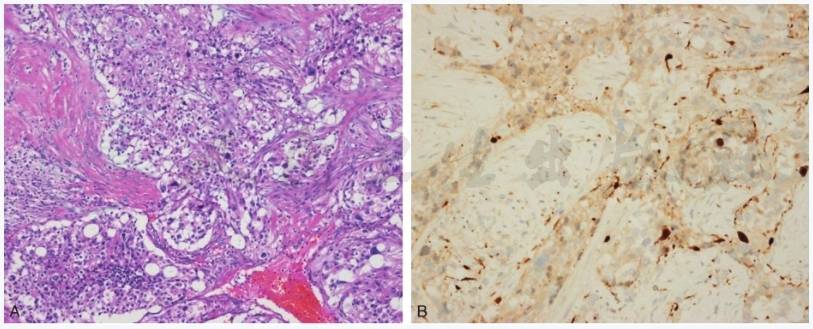
图1 颈静脉孔颈静脉球瘤
A.肿瘤细胞呈假腺泡状排列,细胞大小不一,异型性明显(HE,100×);B.部分肿瘤细胞S100阳性(Ventana 一步法,200×)
听力学检查、前庭功能检查、面神经功能评估均为术前常规,但影像学检查是术前评估中最重要的内容。影像学检查可以精确地显示肿瘤的范围,首先要明确肿瘤是否累及颈静脉孔区,同时需要注意寻找是否存在同时发生的肿瘤。
1.CT
使用薄层(1.5mm)骨窗扫描,可显示肿瘤骨质破坏情况。CT在描述神经血管通道、颅底骨质破坏方面优于MRI。颈静脉球瘤在CT上表现为等密度或略高密度影,无囊变及钙化,增强后可均匀强化。注意观察颈静脉球窝骨质是否受累:如果是颈静脉球瘤延伸至中耳腔,那么骨质会被侵蚀。相反如果是鼓室体瘤,颈静脉球窝周围的骨质应该是完整的。同时要注意内耳及面神经是否受累,注意观察有无半规管漏。肿瘤在纵轴上可能呈喇叭管型。肿瘤可向前累及内听道或包绕颈内动脉岩部。这些发现有助于决定手术入路(图2)。

图2 颈静脉球瘤CT表现
A.颞骨CT水平位显示肿瘤位于右颈静脉球侵及颈内动脉;B.颞骨CT冠状位显示肿瘤位于右颈静脉球侵入颅内
2.MRI
可以很好地显示软组织影,提供有关肿瘤累及范围的间接信息。可清晰显示肿瘤-脑界面的轮廓和病变与硬脑膜内结构的关系,观察神经和血管周围是否存在肿瘤组织,从而将肿瘤组织与脑干、小脑和脑神经相区分。肿瘤在T1相为等信号,T2相为高信号。由于肿瘤组织富含血管造成流空现象,肿瘤影像中可出现散在斑点,即“盐与胡椒”征。肿瘤可明显强化(图3)。

图3 颈静脉球瘤磁共振表现
A.内耳MRI水平位显示肿瘤位于右颈静脉球侵及颈内动脉;B.内耳MRI冠状位显示肿瘤位于右颈静脉球侵入颅内
3.MRA及MRV
MRA可以用来评估颈内动脉的受压情况。MRV有利于评估颅骨硬脑膜窦的侧支循环,因为乙状窦通常会被肿瘤阻断。
4.血管造影(DSA)
可以提供大脑循环及其侧支循环的重要信息,评价肿瘤供血及其与颈内动脉的关系。如果必须牺牲受累的颈内动脉,交叉压迫血管造影、残余血压的测定和临床评价是对发生脑卒中危险性的基本评价标准。DSA通常在手术前1~2天完成。血管造影可以通过发现富含血管的瘤体进一步确定诊断,而且可以寻找滋养血管并栓塞以减少术中出血。颈静脉球瘤滋养血管通常是咽升动脉和枕动脉的茎突乳突支。鼓室体瘤通常不需要术前栓塞,因为它们往往体积较小且易于暴露(图4)。

图4 颈静脉球瘤DSA表现
A. DSA冠状位显示肿瘤血管染色;B. DSA 矢状位显示肿瘤血管染色
此外,耳内镜检查以及实验室检查也能对颈静脉球瘤的诊断提供帮助。颈静脉球瘤患者鼓膜在耳内镜下有两个典型特征:①Brown征:用鼓气耳镜给予正压后肿瘤褪色、搏动停止;②Aquino征:压迫同侧颈内动脉可见肿瘤褪色。对于可疑具有神经内分泌功能的颈静脉球瘤,应收集24小时尿液检查儿茶酚胺含量或检测血儿茶酚胺含量。
颈静脉球瘤的治疗方式取决于肿瘤的大小、范围以及患者的一般情况等。主要的治疗方式包括随访观察、手术切除、放射治疗等。
1.手术治疗
颈静脉球瘤的手术治疗起自20世纪30年代。近年来,随着医学影像技术的发展和显微外科手术技术的提高,颈静脉球体瘤的治疗效果已经有了很大的提高,手术死亡率及术后并发症发生率均显著降低,肿瘤的控制效果总体良好。
(1)术前准备
术前完善的影像学检查(CT、MRI)必不可少,听力学检查、前庭功能检查、面神经功能评估也应作为术前常规。DSA建议在术前1~2天完成,寻找肿瘤滋养血管并行栓塞,可明显降低术中出血量。在对肿瘤具有神经内分泌功能的患者进行手术前,需要请相关科室会诊,在术前及术中应用酚妥拉明来预防术中挤压肿瘤可能出现的威胁生命的高血压。
(2)手术原则
充分暴露肿瘤,在最大限度保护神经功能的前提下,尽量全切肿瘤。
(3)手术路径
根据肿瘤部位、侵犯范围,参照上述临床分型,决定手术路径。常用手术路径有①经外耳道路径:适用于肿瘤局限于中耳腔内(FischA型);②经乳突路径/扩大面神经隐窝路径:适用于肿瘤局限于中耳腔及乳突内(FischB型);③远外侧路径或后乙状窦路径:适用于肿瘤大部位于颅内、颈静脉孔扩大,该径路可从硬脑膜下显露颈静脉孔区,神经外科医师喜欢选择此种径路;④颞下窝A型径路:由Fisch于1978年提出,该径路适合于切除FischC型和D型肿瘤。我们推荐最佳径路——Fisch颞下窝A型径路,它是通过颞骨次全切除和面神经前移来暴露颞骨迷路下和岩尖空间、下颌窝和颞下窝后部,需要联合耳神经外科和头颈外科来完成颅-颞-颈径路。
(4)适应证
颞下窝A型径路适用于切除颈静脉孔区肿瘤,尤其是颞骨副神经节瘤ClassC和ClassD。
(5)禁忌证
①颈内动脉受累。如果颈内动脉受累而大脑侧支循环不良则不宜手术。②对侧迷走神经病变。若肿瘤侧为唯一迷走神经功能正常侧则不宜手术。③肿瘤无法彻底切除。此为相对禁忌证,某些情况姑息性切除可能对患者有益。
(6)手术要点(图5)
①耳后-颈-颞切口;②封闭外耳道;③暴露腮腺内面神经;④暴露颈部大血管和脑神经;⑤颞骨次全切除;⑥永久性面神经前移;⑦结扎乙状窦;⑧填塞咽鼓管;⑨下颌骨前移;⑩暴露颈内动脉;暴露颈静脉孔和迷路下间隙切除肿瘤;腹部脂肪填塞术腔、颞肌瓣加固缝合。


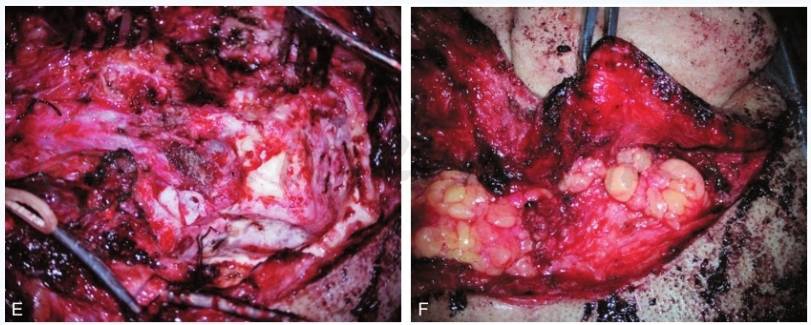
图5 手术切除
A.耳后及颈部切口;B.解剖颈部显露重要血管神经;C.颞骨次全切除术;D.暴露肿瘤及颈内静脉、乙状窦;E.切除肿瘤、保留颈内动脉及后组脑神经;F.脂肪填塞术腔
(7)手术效果
鼓室球瘤:20%采用经外耳道径路,80%采用经乳突路径或扩大面神经隐窝路径。听力保持稳定,术后复发率小于5%。颈静脉球瘤:83%的病例采用颞下窝路径,7%采用乳突-颈部路径,10%病例采用乳突-颈部路径联合面神经部分移位。85%病例达到全切,95%病例面神经改道,20%患者采用声门扩大术。
(8)并发症
①感染:感染和脂肪、肌肉坏死常发生于术前存在感染的术腔,特别是前次手术不成功的情况。②脑脊液漏:蛛网膜下腔一旦开放就可能发生脑脊液漏,利用肌肉-筋膜修复后颅窝硬脑膜和腹部脂肪填塞术腔几乎可以消灭脑脊液漏。如果发生脑脊液漏,可放置腰穿引流。③脑神经麻痹:损伤或切除Ⅸ和Ⅹ脑神经可引起吞咽困难和剧烈咳嗽,而咳嗽往往是导致脑脊液漏的原因。最佳防范措施就是严密缝合切口、加压包扎4~5天。术后气管切开并非常规,此举有可能影响吞咽功能的恢复。若有吞咽困难可放置鼻饲1周。④面瘫:面神经前移可引起轻度麻痹,但完全面瘫罕见,面神经功能恢复率达80%(HouseGradeⅡ)。但是,如果因肿瘤侵蚀而切除神经鞘膜,患者术后可能完全面瘫,面神经功能恢复率只能达到70%(HouseGradeⅢ)。⑤组织缺血坏死:如果术前实施血管栓塞,术后可能出现耳廓及耳后组织缺血坏死。⑥心血管异常:如果同时切除同侧的颈静脉球瘤和颈动脉体瘤,常常发生心动过速。⑦肺栓塞:患者卧床超过3天有发生肺栓塞的风险。
(9)术后护理
①包扎:术后即刻加压包扎,如果蛛网膜下腔开放,至少包扎5天。②引流:放置两条引流管,粗管在上,细管在下。如果蛛网膜下腔开放,在加压包扎之后立刻拔出引流管以免形成脑脊液漏。③拔管:患者清醒后即可拔管,如果估计患者术后可能出现脑神经麻痹,气管插管可延至24~72小时。④输液:输液可持续至患者经口进食,若有脑神经麻痹可输液1周。⑤拆线:如果未开放蛛网膜下腔,术后第8天拆线;如果开放蛛网膜下腔,术后第12天拆线;腹部切口第12天拆线。
2.放射治疗
放疗对颈静脉球瘤的效果存在争议,作用原理、维持时间、恶变倾向等有待继续研究。近年来立体定向放射治疗(伽马刀)逐渐应用于颈静脉球瘤治疗,其对肿瘤的中、短期控制效果得到了初步证实。据Guss和Batra的关于伽马刀治疗颈静脉球瘤的荟萃分析结果,97%病例可以达到肿瘤控制(肿瘤大小在伽马刀治疗后减小或保持不变),95%病例可以达到临床控制(临床症状在伽马刀治疗后缓解或没有变化)。MayoClinic对30例患者进行了长期随访(平均13年),报道肿瘤长期控制率达92%。关于伽马刀治疗颈静脉球瘤的效果,尚待大样本及长期随访结果。目前,伽马刀治疗被推荐用于患者年龄较大或不能耐受手术者、肿瘤切除术后复发、肿瘤与重要血管或神经关系密切不宜手术者。













