英文名称 :acoustic tumor
中文别名 :前庭神经鞘瘤
听神经瘤(acoustic neuromas,AN)神经瘤起源于第八对颅神经前庭支的Sehwann细胞,故又称前庭神经鞘瘤(vetibular schwarmoma,VS),是桥小脑角最常见肿瘤(80%),占颅内肿瘤的8%左右;散发AN通常中年发病,平均发病年龄45~47岁。欧美国家报道听神经瘤年发病率近年有上升趋势。
听神经瘤组织细胞来源于外胚层,由雪旺氏细胞发展而来,绝大多数为神经鞘瘤,是神经鞘膜细胞过度增殖形成的良性肿瘤,大多数单侧发生,双侧发生者多见于Ⅱ型神经纤维瘤病,恶变者甚少。
研究者们对听神经瘤发生的分子机制着重于NF2基因、merlin蛋白、NGFR与VEGF及其受体。研究发现AN是由肿瘤抑制基因NF2基因失活所致。发现散发的AN患者中有50%左右的雪旺氏细胞均有基因突变,现已发现200多个NF2基因突变。在单侧AN中,发生22号染色体杂合子丢失(CHR22LOH)、NF2基因突变的肿瘤生长指数、增殖指数高于无缺失或突变者,NF2蛋白表达水平下降;发生移码突变和反义突变的肿瘤增长指数明显高于剪接位点和无义突变者,并发现22号染色体是散发性AN发生的多发事件区,其丢失与细胞增殖活性有关,其杂合型丢失在前庭雪旺氏细胞比脊髓雪旺氏细胞瘤明显增高(P<0.05)。但Irving认为NF2基因突变与AN的临床生长指数和增殖指数之间没有相关性,NF2基因突变并不是决定体内AN行为的唯一因素。
Merlin改变雪旺细胞的增殖规律被认为可能是听神经瘤发病的主要分子机制之一。用免疫荧光和CLM可以同步呈现听神经瘤组织中各种周期蛋白与merlin在单个瘤细胞中的表达。随细胞周期进程的变化,merlin在细胞核、核周和细胞质间进行穿梭运动,提示merlin与细胞周期蛋白的表达水平之间可能存在相互影响。Merlin蛋白在听神经瘤组织中又不同程度的表达,与肿瘤的生长指数无明显相关性,与患者年龄、性别、肿瘤直径和临床分期无明显相关性。
此外,源于神经嵴细胞的肿瘤包括听神经瘤NGFR有异常高水平表达,被认为是此类肿瘤的标志之一。NGFR在明显生长的听神经瘤中表达增强,且与肿瘤的血管生成密切相关,提示NGFR参与了听神经瘤的发生过程。同时,NGFR、PCNA和MVD可作为反映听神经瘤生物学行为的指标。VEGF和bFGF在听神经瘤肿瘤细胞上表达增加,这两种促血管生成因子的表达与肿瘤的微血管密度(MVD)、生长指数、体积有关。bFGF主要表达于损伤后Schwann细胞上。bFGF在增殖的Schwann细胞上表达增加刺激了细胞的有丝分裂,同时对神经元也起到了分化因子和增殖因子的作用。
最近,也有研究者发现DNA甲基化在AN的发生上有重要作用。Luis等人发现当由于继发抑癌基因失活导致肿瘤发生时,使转录沉默的启动子依赖CpG岛过甲基化也随之发生。他们在对16条染色体的检测中,发现其中有12条存在同程度的甲基化,并且有些DNA甲基化与听神经瘤的临床和影像学表现相关:CASP8的甲基化与患者的年龄和肿瘤大小相关,肿瘤较小、年龄较大的患者CASP8甲基化的频率越高;TP73则与患者听力损失严重程度相关。并且CpG岛不同亚型甲基化与不同的肿瘤类型相关。此外,Marc等人发现促红细胞生成素及其受体的表达在听神经瘤的faz中又一定作用,同时还发现bcl-2、HIF-1及Ki-67标记指数在肿瘤组织中有较高表达。
从肿瘤起源部位分其有前庭神经内耳道段即非神经胶质段和桥小脑隐窝段即神经胶质段。按肿瘤与内听道底关系将其分为4型,Ⅰ型:肿瘤仅充满内听道不向脑桥小脑角扩展;Ⅱ型:肿瘤充满内听道并向桥脑小脑角突出;Ⅲ型:肿瘤主体位于脑桥小脑角,并部分充填内听道;Ⅳ型:肿瘤完全位于脑桥小脑角而不向内听道内扩展。按听神经瘤的大小分为4种类型,即小型:直径<1cm;中型:直径1-2cm;大型:直径2-4cm;巨大型:直径>4cm。事实上,听神经瘤生长速率的差异与许多因素有关:增殖指数、肿瘤病理形态、含铁血黄素沉积、出现黄色瘤样细胞、囊性以及纤维化性。
1. 肿瘤由大量呈梭状病变的schwann细胞组成。其间交替出现由排列紧密、伸长的梭状细胞构成的Antoni A型细胞区和结构疏松含较少细胞成分的Antoni B型细胞区。Antoni A型细胞中有时可见栅栏样的细胞核;囊性听神经瘤中,虽然Antolli A、B型细胞均可见到,但以退变的Antoni B型细胞为主。在Antoni B型细胞区周围有一层由AntoIli A型细胞构成的膜状结构。这些结构疏松的Antoni B型细胞区可以相互融合。而那些异常的血管多出现在Antoni B型细胞区。
2. 肿瘤内血管过度增生,血管呈窦状或毛细血管扩张状。血管壁变薄、失去平滑肌层和内弹力层,管壁玻璃样变,对血压耐受性差,易破裂出血,这些血管不侵犯脑实质,在血管腔内可发现各个阶段的血栓形成,在扩张的血管周围可见血铁黄素沉积。
磁共振影像(MRI)是目前最可靠的诊断方法,听神经瘤的MRI表现一般为T1WI像呈低或等信号,T2WI像呈高或稍高信号;当瘤内有囊变时,T1WI像示有更低信号,T2WI像示有更高信号;当肿瘤内合并有出血,T1WI、T2WI均表现为高信号。肿瘤组织紧贴内耳道孔呈漏斗状,尖端指向内耳道,注射Gd-DTPA后肿瘤呈均匀性、不均匀性或环状强化,瘤体实性部分明显强化。患侧第Ⅶ、Ⅷ神经束较对侧增粗,与肿瘤无明确分界,两者信号变化一致,增强检查后与瘤体相连,且与瘤体强化一致,是听神经瘤特征性MRI表现,是听神经瘤定性诊断的主要依据。约有半数的听神经瘤患侧环池增宽而患侧桥前池多因肿瘤占据而不显示,肿瘤邻近的脑池增宽是脑外肿瘤的定性诊断的重要依据,部分病例瘤周有轻度水肿。
卞留贯等人分析影像学表现与肿瘤组织特征关系发现,小听神经瘤影像学表现为磁共振信号均匀、组织学以Antoni A结构占优;相反大听神经瘤表现为不均匀和囊性变、组织学以混合型结构为主;另外,含铁血黄素沉淀、黄色瘤样细胞以及不均匀听神经瘤的纤维样变主要见于不均匀和囊性的听神经瘤,它们均有统计学意义。R.A. Bhadelia等人发现单侧听神经瘤患者耳蜗FLAIR序列信号较肺肿瘤侧及对照者增高与耳蜗外淋巴蛋白量增加有关。MRI对于听神经瘤的术后复发、手术残留和瘢痕组织也具有一定的鉴别能力,此为临床的二次手术和预后评估提供了重要的影像学依据。
听神经瘤在CT上典型表现可有以下特点:肿瘤绝大多数位于桥小脑角区;多为均匀的等密度或略低密度,也有为均匀的低或高密度,极少数为低、等或高、低、等混合密度;肿瘤生长较大时易发生囊变,增强后病灶明显强化,可为均匀性增强,亦可为不均匀增强,甚至出现单环或多环状强化,囊变部分无强化;肿瘤与岩骨关系密切,病灶与岩骨接触面积小,形成锐角征。多数病例可见内听道呈锥形或漏斗状扩大,甚至出现岩骨骨质破坏改变。CT对骨质破坏和内听道口的扩大的显示优于MRI,但常规扫描易漏诊。而MRI多轴位成像对显示肿瘤大小范围及周围临界组织的解剖关系较CT有明显优势,同时无骨伪影对显示听神经瘤瘤体及病侧听神经增粗很有价值。
对听神经瘤早期诊断,还有很多神经耳科学检查方法,近年来用于AN早期诊断的方法主要有纯音测听,镫骨肌反射,前庭功能检查等。AN患者主要表现为感音性耳聋,伴高频听力下降曲线,也有患者伴低频率听力下降曲线,曲线呈“U”形或平坦型。早期AN患者SRT可正常、升高或有衰减变化。小AN患者的前庭功能,异常率可达70%~90%。ABR用于AN的诊断阳性率约为93%~98%。
听神经瘤的治疗方法有三种:①手术切除,这是公认的首选方法。依手术是否需要保留听力又分为保留听力术式和不保留听力术式;②放射治疗,适用于外科手术禁忌:患耳听力好,健耳听力差或神经纤维瘤病Ⅱ型;③观察,适用于年龄大于70岁或肿瘤限于内听道内。
AN的手术治疗目标已达到:①微创手术的全切率达到97%,复发率<1%,复发者只有大约10%的患者需要进一步治疗;②无严重神经系统后遗症如术后昏迷、偏瘫、球麻痹等;③面神经保留率在小型AN>95%,大型AN>60%;④对肿瘤直径小于20mm有实用听力者争取保存有用听力。
目前对听神经瘤的治疗策略尤其是外科治疗方法的选择上存在较大分歧,伊海金总结了四种听神经瘤的手术方法(表1):
表1 听神经瘤手术方法简单比较
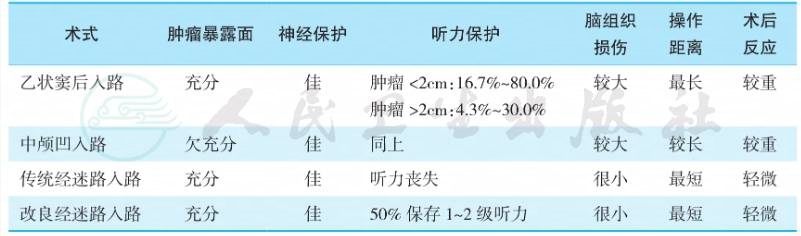
临床上,主要采用乙状窦后入路切除肿瘤。改良经迷路入路可以在保留听力的前提下暴露CPA、IAC、岩斜区域,不仅可以切除听神经瘤,还可处理该区其他病变,如经该入路行前庭神经、耳蜗神经切断,以及面神经迷路段减压的可行性,脑干血管病变处理等。如果联合岩尖切除等其他神经外科入路,可以更好地处理岩斜区病变。但是,目前该方法应用并不广泛,尚处于探索阶段,临床文献也缺乏大宗病例报道与远期疗效观察,有待于进一步开展。Anderson提出对于大听神经瘤,RS入路或RS与TF联合入路分阶段切除肿瘤,面神经功能良好率高。
面神经功能保护是外科手术成功的标志之一,面神经损伤与面神经-肿瘤位置、肿瘤大小有关,与复杂的解剖剖形态结构有关,保护面神经完整,尤其是在大型听神经瘤手术中尤为重要。临床上常在术野中用电刺激定位神经,也可用来判断预后。术中听力监测可监护听神经功能状态,以达到听力保护的目的。
近年来,内镜在耳显微外科以清晰、放大的视野得到好评,可探查内听道内是否有肿瘤残余,克服传统Rs入路不易切除内听道底部残瘤的特点,探查肿瘤与脑干及重要神经血管的关系,提高肿瘤切除的安全性及血管、神经功能保护,利于术后降低脑脊液漏的发生率。
当有严重的出血风险,出现脑干症状,严重的小脑水肿,年龄大且有危险者,应当选择部分切除或分阶段切除。对遗留的肿瘤残体,术后进行影像学随诊。依需要在术后1~6个月,再经原手术径路切除残余肿瘤。
脑脊液漏是听神经瘤术后常见的并发症,其发生率为8%~20%。最常见的原因是内听道后壁磨除后开放了颞骨岩部的气房,其次是开放了颞骨乳突及岩部外侧的气房或鼓室,因此在术中应注意颞骨岩部气房的封闭。听神经瘤术后脑脊液漏大部分可通过保守治疗治愈,少部分需行脑脊液漏修补术。
大型听神经瘤很多术前即存在后组颅神经麻痹,手术可使症状加重或原来没有症状者出现麻痹症状。其发生原因可能为:脑干长期受压移位,供应血管管壁张力增高,减压后暂时失去调节能力,发生脑干缺血或水肿。Bani A等认为术中出现低血压常预示可能发生术后球麻痹。而后组颅神经麻痹本身,除非神经离断或损伤严重,一般恢复良好。
颅内血肿术后血肿发生率较低,形成主要与术中止血不彻底、术后患者清醒时间过早、术后血压升高等原因有关,年龄也是重要因素出血听神经瘤术中出血较多的位置一般在肿瘤前内侧术后应严密观察,及时发现尽快手术,可减低致残率和死亡率。
在血管的保护方面,关键注意肿瘤的固有供血血管与肿瘤毗邻的、紧密相连的“过路”血管的鉴别,对于非供血的“过路”血管予锐性分离与保护;对于供血动脉分支,尽可能锐性分离至最靠近肿瘤壁处予以电凝切断。分离切除肿瘤上极和前部,最后切除内听道肿瘤,切除肿瘤前,需磨开内听道后壁。
放射治疗方法大致分两类:①放射外科:如γ刀、线性加速器等;②放射治疗:即 适形照射法(conformal radiotherapy,CRT),包括立体定位放射治疗、增强调节放射疗法和三维结构放射疗法等。放射治疗的目的是控制肿瘤生长,同时保留神经功能。该方法的观点认为控制肿瘤生长等价于肿瘤治愈。因此,以往放射治疗并不被推荐为听神经瘤的首选治疗方法,但是,随着该治疗方法相关技术的发展,放射治疗,尤其是γ刀被认为对于中、小型听神经瘤可作为首选治疗方法。对于肿瘤体积较大、体质较弱,不能耐受手术的患者来说,立体定向放射分次治疗较放射外科能体现其优越性。国内外学者对听神经瘤患者行γ刀治疗后长期疗效回顾性分析显示,肿瘤控制率达94.16%~98%,听力保留率64%~72.3%,面神经功能保留率95%~100%,并且认为γ刀还存在比手术治疗创伤性小、致残率低的优势,但是该方法的选择需要考虑肿瘤生长的自然病程以及听力保留的可能性。对大型肿瘤,联合应用手术与放射治疗比单纯手术治疗疗效好,可以避免相关并发症的发生。
而观察和等待实为一种因患者身体状态难以承受手术及仅有轻微症状的小肿瘤采取的不得已而为之的方法。有学者报道,观察可以避免出现前庭神经非瘤性的增生,占听神经瘤的3%;延迟治疗的结果是使治疗更困难或听力丧失,尤其是对于发生囊变和肿瘤内出血的听神经瘤患者不适宜等待和观察的治疗策略,应当及时进行手术治疗,以免发生更严重的并发症。
Jason等人利用ErbB抑制剂曲妥单抗和Erlotinib治疗裸鼠听神经瘤模型发现,这两种抑制剂均能有效地抑制肿瘤生长,提示ErbB抑制剂在治疗神经纤维瘤病2型、目前手术及反射治疗均受限制的患者存在应用价值。













