英文名称 :renal vascular hypertension
据记载,早在公元前200年,战国时代秦越人所著《难经》中曾有“按之至骨,举指来疾者,肾也”。公元200—250年间,魏晋时王叔和在《脉经》中也写有“脉火而坚病在肾”。虽然古代肾的概念与现代医学肾有区别,但不难看出古人已认识到高血压与肾之间存在关联。近代,英国医师Bright(1827年)首次提出蛋白尿、脉搏强而硬与肾硬化有关。Traube(1856年)从分析描记的脉搏提出异常脉搏可能为高血压所致。Mohomed(1874年)指出动脉系统的高张力与肾疾病有关。对肾血管病变引起的高血压,有报道 Janeway(1906年)曾缩窄犬的一侧肾动脉后产生高血压持续了105天;Goldbatt(1934年)用特制的夹子钳夹犬的肾动脉主干产生高舒张压,开放肾动脉后高血压消失,从而建立了肾动脉狭窄型高血压的动物模型。之后,Leadbatter和Burkland(1938年)首次临床病例报道一名5岁半男孩患肾动脉狭窄经肾切除后血压恢复正常。但是,采用肾切除的治疗方法因其疗效常会令人失望,而有必要进一步研究肾病变引起的高血压病因。20世纪50年代,Smith(1952年)经皮血管腔内腹主动脉造影观察肾动脉病变;Howad(1954年)发明了通过逆行双侧输尿管插管的分肾功能测定法,从而将本病从形态和功能两个方面由高血压患者中筛选出来,并为开展肾血管成形术提供了影像学的依据。关于肾血管性高血压的基础理论和临床研究从20世纪60年代至今从未间断,赢得相关学科学者的极大关注和兴趣。
文献报道肾血管性高血压的发病率差异较大。一般文献指出肾血管性高血压占所有高血压患者的5%~10%,美国Franklin等(1989年)报道为3%~6%,我国有报道为2%左右。熊汝成等分析复旦大学附属中山医院1950—1975年25年间患高血压的住院患者总人数为3365例,其中肾性高血压患者占19.5%,而肾血管性高血压为1.84%。近年来由于对此病的认识水平提高,诊断技术改进,筛选方法的敏感性和特异性增强,越来越多的高血压患者被证实为肾血管性高血压。美国15个医疗机构“肾动脉性高血压协作研究”报道的2442例高血压患者中,肾动脉性高血压占27.75%。我国北京阜外医院1964—1982年住院的1372例高血压患者中,经肾动脉造影证明有明显肾动脉狭窄者占12.4%。据统计,中山医院近5年(2003年1月至2007年12月底)10种常见的肾疾病共6324例,发现824例并发高血压,占13.03%,其中肾动脉狭窄283例,占肾性高血压的34.34%,比较该院以前25年间(1950—1975年)的分析资料,同样10种常见的肾疾病3145例,发现655例并发高血压,占上述各种肾病总数的20.8%,包括肾动脉狭窄62例,仅占肾性高血压9.47%。由此可见,目前肾血管性高血压在肾性高血压中所占的比例已大大上升,值得引起重视和研究。
此病可以发生于任何年龄,尤应注意小于25岁及大于55岁患严重高血压患者。在欧美国家50岁以上的患者以动脉粥样硬化引起此病最为普遍,男∶女为2∶1,吸烟及高脂血症患者更多见;年轻的患者则以纤维肌性发育异常为多见,女性多于男性。在我国由大动脉炎引起的肾血管性高血压较西方多见,年轻女性多发。
近年来,由于医学影像学技术的发展、新型抗高血压药物的出现和血管外科手术技术的改进,使肾血管性高血压在诊断和治疗方面有很大的进展。
肾动脉本身的病变是肾血管性高血压发生的基本条件。据文献记载,在欧美国家病因以动脉粥样硬化和纤维肌性发育异常为主,而我国则以多发性大动脉炎(aorto-arteritis)为最多见。但是,最近有不完全统计显示在我国肾血管性高血压的病因,动脉粥样硬化已是首位,其次是大动脉炎、纤维肌性发育异常。
1.动脉粥样硬化
多见于50岁以上男性,男性发病率是女性2倍。动脉粥样硬化病变主要发生于动脉内膜,形成粥样斑块,所产生的肾动脉狭窄常在主干开口处及近端2cm以内。由主动脉内粥样斑块延伸至肾动脉内者,75%为双侧性,而粥样斑块位于肾动脉内,围绕主动脉开口处,一般是单侧性,单侧者左侧较右侧为多见。5%的患者病变可累及第2或第3级肾血管。动脉粥样硬化所致的肾动脉狭窄患者,常表现为进行性肾功能减退。
2.纤维肌性发育异常
常见于儿童、青年,女性多于男性。纤维肌性发育异常的发病机制尚不清楚,因白种人发生率比黑人高,且有家族发病的报告,此病被认为有遗传倾向。肾动脉病变主要发生于中1/3和远端1/3,常累及分支,单侧者右侧多见。根据动脉壁发育异常的部位分为内膜纤维增生,纤维肌肉增生、中层纤维增生和外膜下纤维增生。
3.多发性大动脉炎
多见于青年,女性居多。此病因尚未完全清楚,目前认为可能为自身免疫性疾病。临床上可分为三期:①急性活动期;②慢性炎症期;③瘢痕狭窄期。这一炎症变化可发生在胸主动脉使主动脉弓大的分支闭锁,在腹主动脉及其分支使肾动脉开口受累即产生肾血管性高血压。
4.其他原因
(1)先天性肾动脉异常:临床上常在影像学检查中被发现:①肾动脉均匀细小;②迷走肾动脉;③狭窄累及肾动脉或肾动脉分支;④扭曲;⑤肾动脉瘤;⑥肾动脉缺如,但有侧支循环。多见于儿童。
(2)肾动脉急性栓塞:栓子来自心脏、主动脉等处,或并发于手术后,半数以上患者同时伴有其他脏器梗死。临床表现为突发性肾区疼痛,出现高血压并有镜下血尿和蛋白尿。
(3)肾动脉瘤:由于血管壁纤维缺陷,创伤使血管壁夹层分离,或发生结节性多发血管炎而形成囊状动脉瘤、夹层动脉瘤和小动脉瘤,通常无症状,破裂时有出血危险。若瘤体直径大于1.5cm,影响肾血液循环,则有高血压症状。
(4)肾动-静脉瘘:一般为先天性病变,50%病例伴有先天性心脏病,出现高血压者占总数50%,75%以上有血尿,70%~75%病例能听到腹部杂音。此类患者在肾动脉造影时过早见到静脉显影,则可以诊断确立。若因肾穿刺活检时造成,约70%病例在1年半内自行愈合。
(5)外伤血肿、腹主动脉瘤、嗜铬细胞瘤、神经纤维瘤、肾肿瘤等因巨大肿块对肾动脉的压迫而导致肾动脉梗阻,产生肾血管性高血压。
(6)放射线的损害引起肾动脉周围组织纤维化或特发性腹膜后纤维化也可成为肾血管性高血压的病因。
Goldbatt的经典实验奠定了肾血管性高血压研究的理论基础,但尚未完全阐明其发病机制,肾动脉缩窄后使肾血流量减少,肾缺血、缺氧,这仅是促成肾血管性高血压的基本条件,还有其他的条件存在。目前普遍公认的发病机制主要有以下三个方面。
1.肾素-血管紧张素-醛固酮体系(renin-angiotensin-abldosterone system,RAAS)
Tigerstedt和Bergman(1898年)曾发现给兔静脉注射兔肾浸出液后动脉血压升高,认为肾浸出液中含有某种升压物质,将其命名为“肾素”。经过数十年研究,直至Goldbatt完成上述的经典实验,Tigerstedt和Bergmann的发现才被认可。人们的研究又证实肾素存在于肾小球附近的组织中,称为肾小球旁体结构(juxtaglomerular apparatus)。它包括:①近球细胞:分泌肾素;②致密斑:为压力感受器,高钠可以通过致密斑刺激近球细胞促使肾素分泌增多;③Goormashtigh细胞:系神经末梢小体,有控制肾分泌的功能;④Becher细胞群:与葡萄糖、磷酸盐、氨基酸的吸收和合成有关(图1)。
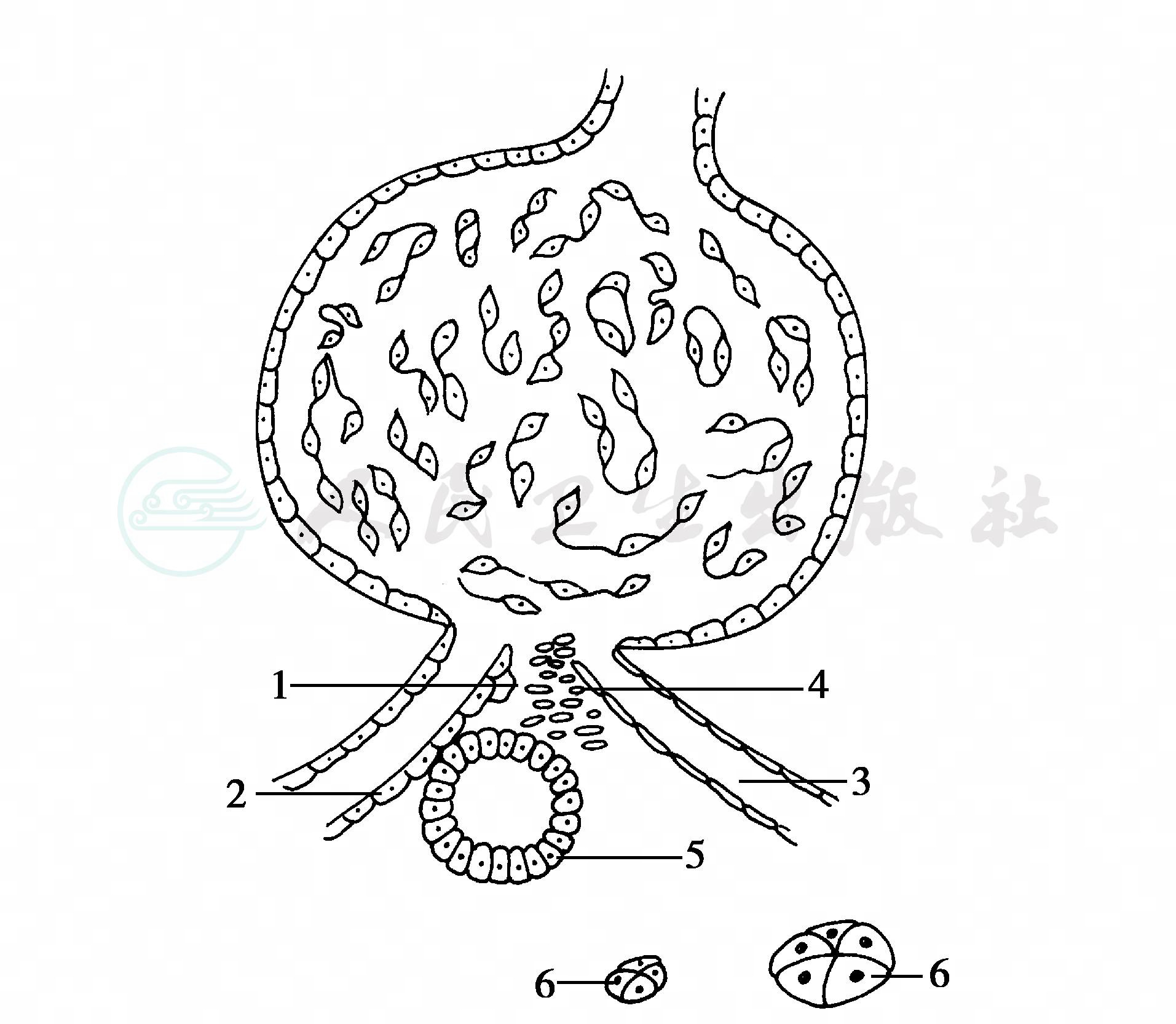
图1 肾小球旁体结构示意图
1.近球细胞 2.入球动脉 3.出球动脉 4.Goormaghtigh细胞 5.致密斑 6.Becher细胞群
进一步研究指出,肾素是一种天门冬氨酰蛋白水解酶,由340个氨基酸组成,分子量为37 200道尔顿,具有不耐热和不可透析的特性。血浆肾素的半衰期为15~20分钟,主要代谢场所位于肝。肾素本身不是加压素,必须与肝内产生的一种α2球蛋白(又称肾素激活素或高压素原)相结合而发生效应,使其分子结构的第10位及第11位两个亮氨酸肽键连接处断裂,释出十肽,成为血管紧张素Ⅰ(angiotensinⅠ,AngⅠ),AngⅠ亦无升压作用。当它流经各脏器血管床时,尤其在肺循环被血管紧张素转化酶(angiotensin converting enzyme,ACE)使其第8位及第9位之间肽键断裂,释出八肽,成为血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)。AngⅡ是一种强有力的血管收缩物质,使血压升高。目前发现人体内AngⅡ通过与其受体(AT1、AT2)的结合发挥生物效应:①作用于全身血管平滑肌使血管收缩,刺激中枢及周围交感神经系统间接引起血管收缩;②刺激肾上腺球状带产生醛固酮,促使远段肾小管钠重吸收,钾排泄;③作用于中枢神经系统使渴觉中枢兴奋,饮水增加,同时也刺激盐欲,使摄盐增加;④促使肾内血管收缩,血流量减少,肾小球滤过率降低,滤过液在肾小管内的流速减慢,延长了肾小管内对水、钠重吸收的时间,引起水、钠潴留,增加细胞外液容量,促进血压增高。此外,由于分子生物学技术的广泛应用,最近的研究发现AngⅡ可以刺激许多生长因子,包括血小板源性生长因子(PDGF)等,有可能完全排除循环RAAS的干扰,了解肾内RAAS的分布、调节及功能,并检测它们的基因表达。AngⅡ再由氨基转肽酶去除第1位氨基酸,释出一种多肽(七肽),称为血管紧张素Ⅲ(angiotensinⅢ,AngⅢ),此物刺激醛固酮的分泌作用比AngⅡ强数倍。在循环中血管紧张素的半衰期仅数分钟,降解后形成小分子的无活性产物氨基酸、二肽、三肽,最终高血压的维持需依赖于肾上腺素和醛固酮。通常过多的醛固酮,由反馈作用抑制肾素的进一步分泌,这就是肾素-血管紧张素-醛固酮体系的调节作用。当肾动脉狭窄时,由于肾缺血刺激球旁细胞产生大量肾素,而醛固酮的反馈作用相对地减弱,不能抑制肾素的过量分泌,故肾素-血管紧张素-醛固酮体系失去平衡是引起高血压的原因之一。
2.激肽释放酶-激肽-前列腺素体系(kallikreinkinin-prostaglandin system,KKPS)
激肽系由肝的激肽原受到肾产生的激肽释放酶作用转变而来。激肽释放酶90%以上分布于肾的皮质,而肾的髓质和乳头分别占4.5%及4.1%,其主要生成部位可能在肾小球旁体。激肽释放酶具有丝氨酸蛋白酶的活性,活性越高,催化激肽原水解,生成激肽越多。另外,肾尚能分泌激肽水解酶,可以破坏所产生的激肽。
前列腺素(PGs)是花生四烯酸(AA)的产物,它在肾通过三大代谢途径即环氧化酶途径、脂氧化酶途径和细胞色素P-450单氧化酶途径来产生活性代谢产物而发挥其生物效应。在肾髓质中分离出来的前列腺素主要有PGE2、PGA2、PGF2a。前列腺素在肾皮质内含量很低,在髓质中以乳头的含量较高。在肾内主要是PGE2和PGF2a,而PGA2的量较少。
激肽和前列腺素具有降低血压的作用,其机制:①促使全身小动脉舒张,外周血管阻力下降;②促使肾内小动脉舒张,增加肾血流量,尤其是肾皮质的血流量,提高肾小球滤过率;③促进水、钠从肾排出,使血容量降低,增加血浆血细胞比容及血浆总蛋白浓度;④前列腺素具有抑制抗利尿激素及拮抗儿茶酚胺的作用。此外,激肽能刺激肾髓质间质细胞分泌前列腺素增多,从而对动脉产生降压作用。
因此,肾激肽与前列腺素的抗高血压作用,一部分是激肽的直接作用,更主要的是通过激肽促进前列腺素的生成而产生。当肾动脉狭窄时,由于肾缺血后激肽释放酶的量减少,使激肽原缺少激肽释放酶的作用,而生成激肽相应减少,刺激分泌前列腺素也相应降低,结果对动脉的降压作用减弱,并使血管容量增多,造成高血压。
3.心钠素体系(atrial natriuretic peptide system,ANPS)
近年来,心钠素在调节血容量和血压中的作用受到关注。1979年De Bell首先发现在心肌细胞内存在着一种强烈的利尿利钠因子。1984年它被证明是由心房合成,贮存和分泌的多肽激素,命名为心钠素(心房促排钠利尿多肽)。现已确认ANP对RAA是一种内源性生理拮抗物质,对控制钠盐和血容量与调整血流和血压具有重要作用。心钠素和肾素的原发处分别为心和肾,但根据信使核糖核酸(mRNA)的检测,它们继发性产生于许多共同场所,包括脑、肾上腺、垂体和生殖系统。研究证明ANPS与RAAS的生物作用是相互抗衡的,ANP对RAA有抑制作用,其作用的方式:①扩张小动脉,降低外周动脉阻力,使动脉压下降;②使肾利尿排钠作用增强;③抑制肾素、醛固酮的释放和分泌;④抑制血管紧张素Ⅱ所致近曲小管对钠的重吸收;⑤降低交感神经系统活动;⑥抑制去甲肾上腺素和加压素对小动脉的收缩作用。由此可见,ANP同时能降低血管紧张素源性高血压和容量性高血压。
4.去肾性高血压(renoprival hypertension)
肾除有抗高血压的物质外,还有调节体液、电解质的功能和排出体内升压物质的作用。去肾性高血压指肾组织没有功能所产生的高血压,也称为肾缺如性高血压或肾切除后高血压。肾组织完全丧失功能如同双肾切除一样,其所发生的高血压与体液和钠盐平稳失调有关。体内的升压物质因去肾后不能排出,积聚后使血压升高。肾动脉狭窄时,由于肾血管损害,肾缺血可发生肾单位硬化,肾功能减退明显,可引起全身及肾内循环的ANPS与RAAS平衡失调,最终导致高血压产生。
1.肾血管病变
肾血管性高血压早期主要是肾血管病变,随后继发肾单位缺血性变化。其病理变化有急性和慢性两种:
(1)急性变化
多发生于恶性高血压型。主要在大叶间动脉和肾内小动脉壁内膜增生,使管腔变狭窄。此种内膜增生在年轻人为细胞增生,老年人为弹性纤维增生;此外,动脉管壁及周围有局限性的坏死区,其中有大量纤维蛋白,称为类纤维素坏死。内膜下增生的结果使微动脉堵塞,以后形成肾小球萎缩,被胶原所替代。
(2)慢性变化
见于长期的持久性高血压。肾的细动脉,特别是入球动脉发生硬化,使肾单位缺血,发生萎缩。随着病情加重,血管狭窄或闭塞,可形成细动脉性肾硬化。病肾明显缩小、变硬,表面凹凸不平,散布着颜色较淡的细小颗粒,并伴有小囊腔,形成细颗粒肾。
由于长期受到高血压因素的危害,早期对侧肾可呈代偿性肥大,功能增强;后期引起坏死性肾小动脉炎和肾硬化、肾萎缩。故患者由于双侧肾功能逐渐减退,最终可以导致慢性肾衰竭。此时即使切除肾动脉梗阻一侧的肾,高血压并不能降至正常,因为对侧肾已发生不可逆性肾血管损害(Floyer肾)。Floyer肾概念的提出具有重要的临床意义,对怀疑有肾动脉狭窄的患者,应及时进行检查,明确诊断,及时适宜治疗,以保护对侧肾不进展成为Floyer肾,防治高血压。
2.肾小球旁体结构的改变
在肾血管性高血压中,近球细胞发生一系列病理变化,即肾动脉狭窄使肾缺血、肾内压降低,引起近球细胞数增加,胞浆内颗粒增加,分泌肾素增多;另外,肾小管内钠离子的变化通过致密斑刺激近球细胞分泌肾素,这些均可导致全身血压升高。肾动脉正常一侧肾小球旁体结构改变则与之相反。这一病理变化,对阐明在单侧肾动脉狭窄中患肾肾素增高和对侧肾肾素降低具有理论意义。
3.肾血管疾病的病理类型
(1)动脉粥样硬化
病变发生于动脉内膜,形成粥样斑块,可沿血管壁蔓延,使管腔狭窄和内膜破坏。内膜被一堆无细胞的粥样物所代替,其中有脂肪、钙盐沉着、吞噬坏死碎屑的组织和血栓等(图2)。肾动脉粥样硬化往往是全身性血管病变的局部表现。
(2)纤维肌肉增生
①内膜纤维增生:内膜显著增厚,有胶原累积,其中有原始成纤维细胞散在,伴发血肿时使动脉狭窄部分变形,有发展倾向。②纤维肌肉增生:病变发生于血管中层,平滑肌与纤维组织同时增生。动脉壁呈同心性增厚,弹力溃破而引起壁间血肿,在血肿周围有大量胶原形成。③中层纤维增生:主要是纤维组织增生,内弹力膜变薄或消失,肌纤维被胶原所代替,中层稀薄,部分呈球囊性扩张,病变一般较为广泛,大多蔓延血管远端2/3或累及分支。④外膜下纤维增生:病变位于血管的外弹力层,中层外膜有胶原沉着。由于肾动脉被大量稠密的胶原所环绕使血管变窄(图3)。
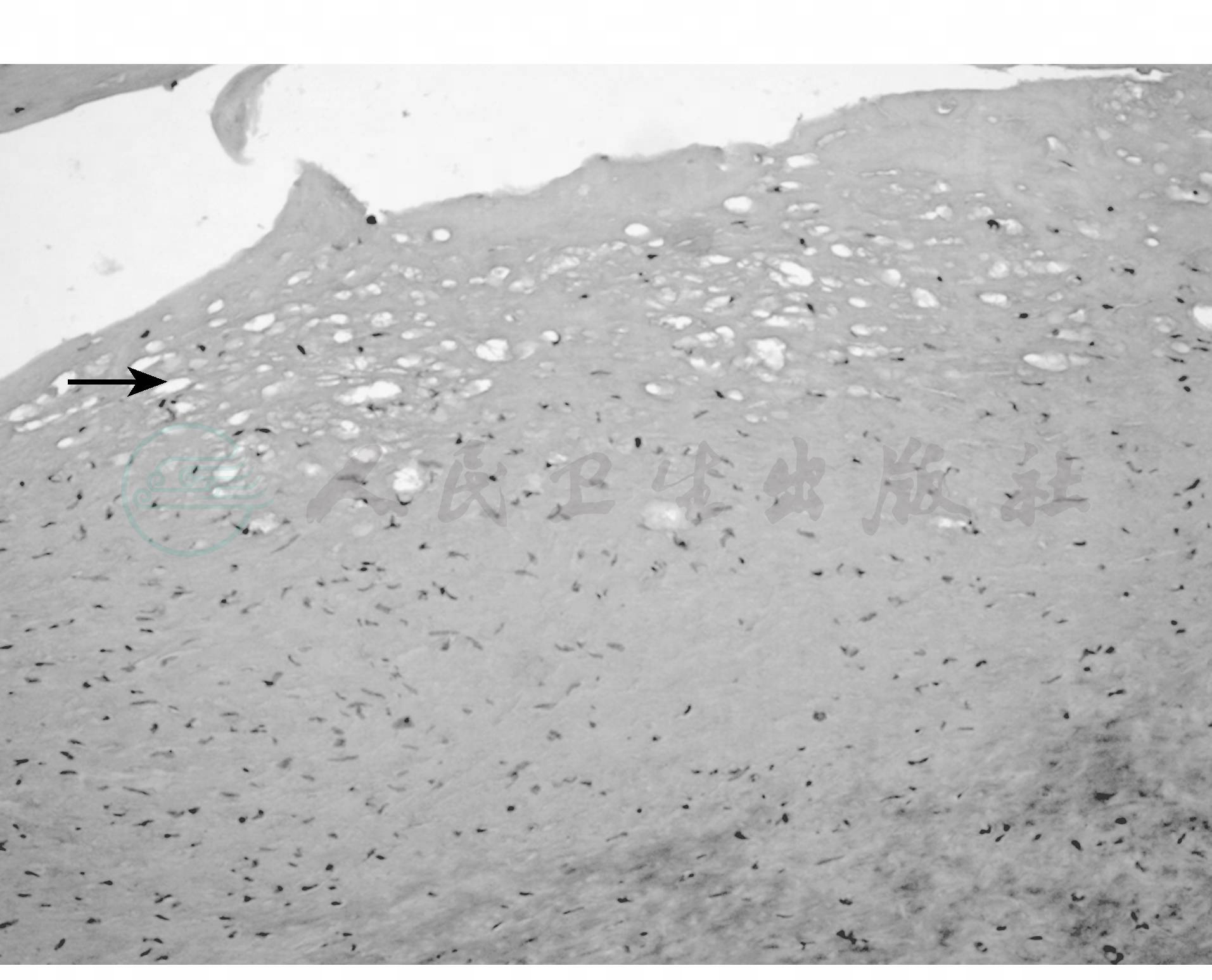
图2 肾动脉粥样硬化
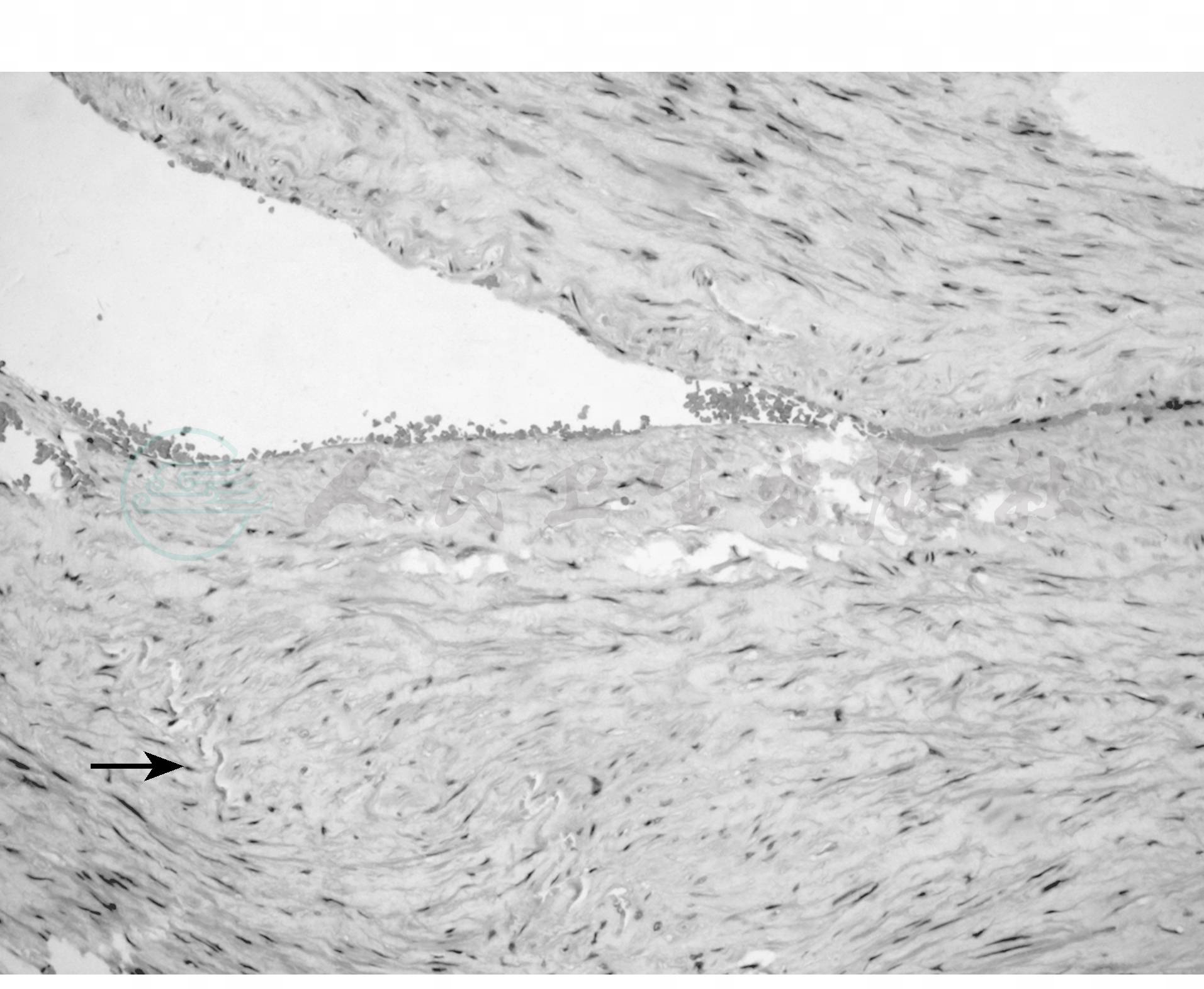
图3 纤维肌肉增生
与正常侧相比,病变侧中膜平滑肌与纤维组织明显增生(×100)
(3)多发性大动脉炎
主要病变在主动脉,以动脉中膜层为主的全层动脉炎(图4)。中层呈弥散性肉芽肿组织增生,伴有淋巴细胞和浆细胞浸润,弹力纤维明显破坏或断裂,被胶原所代替。血管外膜增厚,有细胞浸润与周围组织紧密粘连。内膜纤维增殖,表面肿胀、粗糙和血栓形成致使肾动脉开口狭窄,影响肾血液供应。肾内小动脉一般没有肥大或退行性变化,内膜无增生。
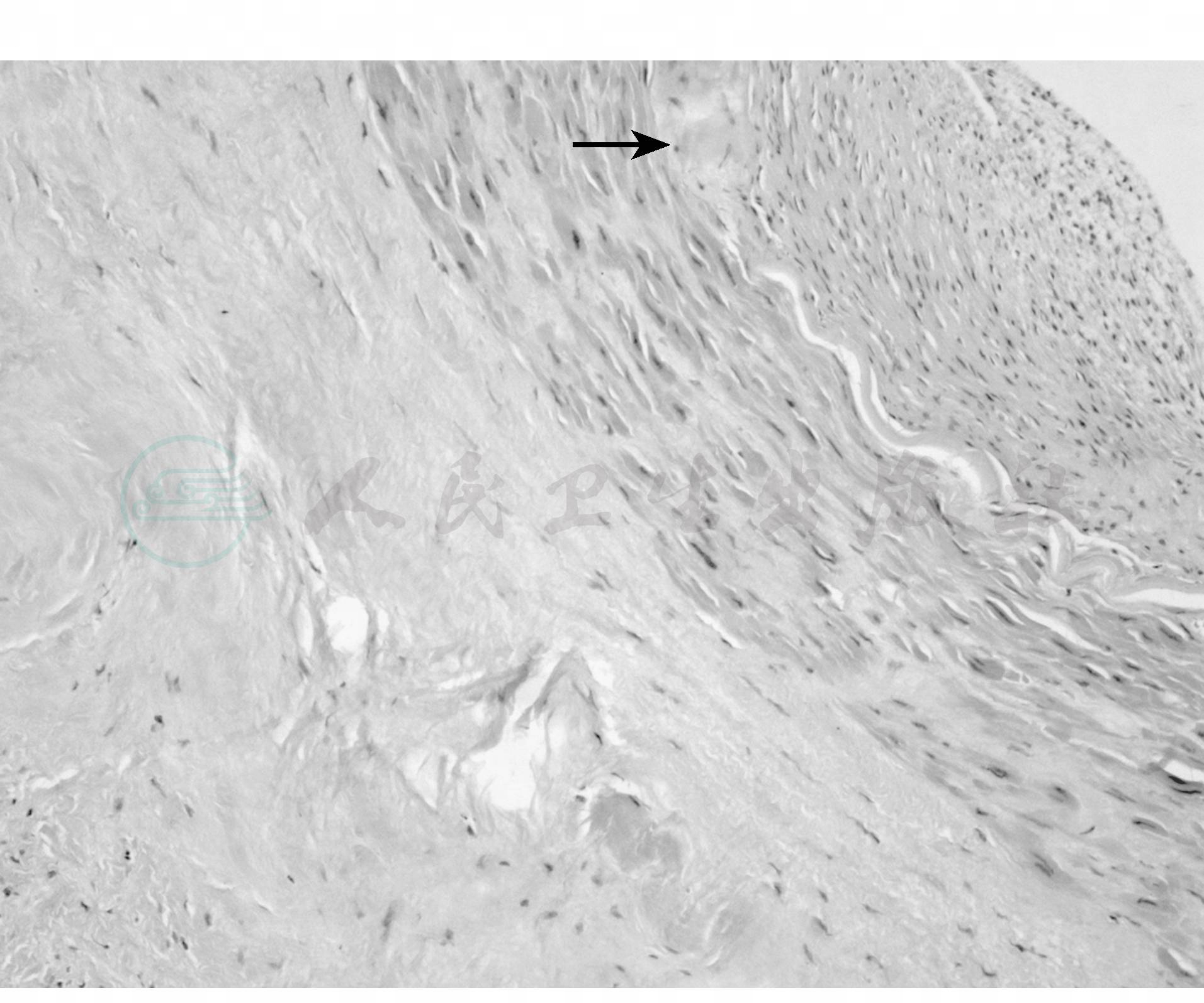
图4 大动脉炎
动脉壁内、外膜纤维性肥厚,中膜弹力纤维破坏、纤维瘢痕形成,并于动脉各层见到灶性慢炎细胞浸润(×100)
1.药物治疗
抗高血压药物用于因手术或PTA前须将血压控制到适当水平,一些不愿或不能接受手术或PTA治疗以及手术或PTA治疗失败的患者。但是,抗高血压药物只可控制患者的高血压,尚不能控制引起肾动脉狭窄的病理改变的进展。
目前药物治疗首选血管紧张素转换酶抑制剂(ACEI)如卡托普利(captopril)或依那普利(enalapril),并可与钙离子拮抗剂或β-受体阻滞剂合用。对不宜用ACEI者,亦可试用β-受体阻滞剂配合利尿剂治疗。简述如下各类药物。
(1)血管紧张素转换酶抑制剂(ACEI)
其作用主要是抑制血管紧张素Ⅱ的形成以降低血压。ACEI大部分从肾排出,且其许多副作用与剂量有关,故在肾功能受损的患者用量应减少。此药物长时期应用可产生某些副作用有皮疹、味觉消失、中性粒细胞减少和蛋白尿。肾功能不良者可使肌酐升高。有资料报道,全世界范围内仅5%的接受ACEI治疗肾血管性高血压患者因进行性肾功能减退而停药,而74%的患者血压受到良好的控制。因此,在所有接受ACEI治疗的患者中,需要密切随访肾大小及功能变化。
(2)钙离子拮抗剂
其降压作用为扩张血管,对双侧肾动脉狭窄者,不像ACEI可致肾功能减退。此药可单独应用或与ACEI合用。
(3)β-受体阻滞剂
此类药物通过阻断β-肾上腺素能受体抑制肾素的释放,以降低血浆肾素水平,故适合于本病患者的治疗。由于β-受体阻滞剂可使肾血管流量及肾小球滤过率稍降低,偶可引起氮质血症。
(4)扩张血管药
可与β-受体阻滞剂、利尿剂合用,对肾功能无不利影响,但对肾血管性高血压患者应慎用。
(5)利尿剂
噻嗪类利尿剂的作用相对小,对低肾素高血压最有效。在肾血管性高血压患者中,用此药偶可使血压上升,且有低钾血症的风险。由于双侧肾动脉狭窄患者有钠潴留,用袢利尿剂如呋塞米,可有辅助降压作用,不宜过多使用,易加重氮质血症。一般不用保钾利尿剂。
2.经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)
Gmntzig等(1978)报道应用PTA扩张肾动脉狭窄获得成功,为肾血管性高血压的治疗开辟了新的途径。适应证:纤维肌性发育异常引起者,首选的治疗措施即PTA。单侧的非钙化、非闭塞性的动脉粥样硬化性肾动脉狭窄、大动脉炎引起的肾动脉狭窄以及肾动脉重建术后的吻合口狭窄、PTA术后复发性狭窄者。此外,对于进行性肾功能减退者,若由于肾动脉病变或缺血性肾病引起,则可以用PTA达到保护肾功能的目的。相对禁忌证:弥漫性主动脉粥样硬化性狭窄累及肾动脉开口者、肾动脉完全闭塞或多个分支病变,特别是血管分叉处病变者。
方法及注意点:经皮穿刺后,用一种头部有圆柱形双腔球囊的小口径动脉导管和J形扩张导管,通过导丝在荧光电视监视下插入狭窄的肾动脉内,每隔10~15秒用生理盐水稀释的造影剂充盈水囊1次(一般需2~3次),借以扩大肾动脉的狭窄处。粥样斑块被扩张的气囊压碎或挤到血管壁中,血管壁的平滑肌和弹力纤维被拉伸到超过其弹力回缩极限,而后一层新的内膜重新覆盖被压进血管壁的碎片。神经肌肉发育不良性的狭窄者,需要拉伸动脉中层的纤维且常有撕裂伴外膜膨胀,使血管外径增加。术后再狭窄与拉伸的程度是否足以压碎粥样斑块、动脉外膜是否过分拉伸到超过其回缩限度有关。操作时应注意所用球囊加压扩张后的直径不能太小,约与肾动脉造影显示的直径相当。加压后保持足够的压力和时间。术前服用钙离子通道阻断剂以预防肾血管痉挛。术中用肝素抗凝,术后用阿司匹林80mg/d,共6个月,防止血栓形成。
PTA的优点:不需要全身麻醉,手术并发症较低,可与肾动脉造影同时进行,即诊断与治疗一次完成,住院时间短甚至不需要住院。但是,实施PTA应有放射科医师、内科及外科医师在场以处理高血压变化和潜在的外科并发症。
Rainsay和Waller(1990)综述1981—1987年10组共691例肾血管性高血压患者PTA治疗情况,其中464例为动脉粥样硬化所致肾动脉狭窄,193例为纤维肌性发育异常,余为移植后狭窄等。随访11~26个月,资料完整者670例,技术成功率平均为88%,失败率12%。据血压评价,治愈率平均为24%,改善率43%,失败率33%。纤维肌性发育异常患者治愈率为5%,比动脉粥样硬化患者治愈率高。缪廷杰等报道,在1986年复旦大学附属中山医院应用PTA治疗多发性大动脉炎伴发肾动脉狭窄时,同时扩张肾动脉和腹主动脉,分别扩张4mm和9mm,从而改善了腹主动脉和肾动脉的血供,使血压下降。目前PTA已在国内广泛应用,成为肾血管性高血压的首选方法(图7)。
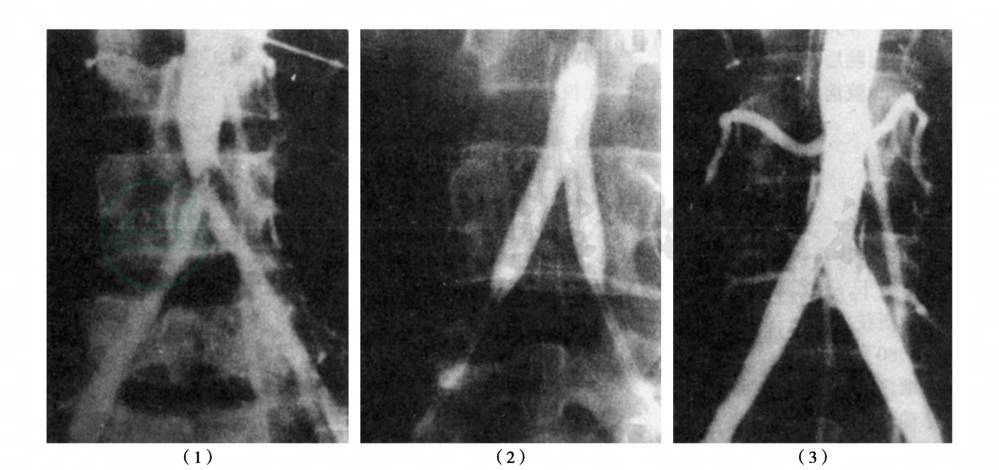
图7 腹主动脉造影及PTA术后造影
(1)主动脉造影显示腹主动脉远端近分叉部位严重狭窄;(2)双球囊导管并列于狭窄段进行同时扩张;(3)PTAA术后造影显示原狭窄段管腔明显增宽
PTA的并发症:与PTA直接相关的并发症有穿刺部位出血、动脉内膜剥离形成急性栓塞、肾梗死、急性末梢缺血、臀部坏死、下肢坏死、动脉穿破以及球囊破裂等。与PTA非直接相关的并发症有造影剂过敏、因血压下降所致脑或心肌缺血、暂时的或不可逆的肾损害等。Roberts报告600例PTA的并发症为4.5%,发生栓塞为1%。Mabler和Triller等报道,在80例肾动脉病患者105次PTA治疗中其并发症发生率为11%,其中严重者为4%,死亡率约1%。Kremar Hovinga和de Jong(1986)等报道PTA扩张成功后再狭窄的发生情况,随访4~45个月,经血管造影证实,33例中12例发生再狭窄,其中动脉粥样硬化患者(24例)发生再狭窄有10例(占42%);纤维肌性发育异常患者9例中有2例(占22%)。由于发生再狭窄后再行PTA多不成功,所以宁可进行手术治疗。
近年来肾动脉支架应用是血管成形术的最重要的进展。在动脉粥样硬化斑块所致肾动脉狭窄患者,经常发生PTA术后肾动脉再狭窄,放置肾动脉支架是防止血管扩张后再狭窄的重要措施。目前最常用的支架是气囊扩张型的支架,即支架位于气囊导管顶端,随气囊膨胀而扩张,并有自我膨胀的装置,通过自身固有的弹性膨胀到预定的直径。放置支架的适应证:肾动脉开口处狭窄、PTA术后再狭窄或其他常规肾动脉成形术疗效不佳的患者。有资料统计,肾动脉支架放置的技术成功率为90%;高血压治愈或改善达47%,较单独应用血管成形术高,但与血管重建手术相比较仍较低。
3.经皮导管肾动脉栓塞术
通过导管选择性或超选择性对肾动脉或肾内分支动脉进行栓塞,将栓塞物如不锈钢弹簧钢圈、吸收性明胶海绵、无水乙醇、硅橡胶等置入肾动脉管腔狭窄部位,使之完全闭塞,阻断血供,达到类似肾切除的目的。这种方法适用于肾内型动脉瘤、肾内动-静脉瘘、单侧肾动脉或肾内动脉分支狭窄。但是,术后可发生发热、恶心、暂时性血压升高,经对症处理后症状逐渐消失。
4.手术治疗
肾血管性高血压主要是有解剖学上肾动脉发生病变,在以上方法疗效不佳或失败时,往往需行手术治疗。手术治疗有患肾切除术和肾血管重建手术两大类。
(1)肾切除
这是最早出现的外科治疗肾血管性高血压的方法。采用此方法时,必须注意患者对侧肾动脉有无病变或是否会逐渐发展。若肾萎缩,其长径<9cm、肾动脉主干闭塞或梗死、严重的肾小动脉硬化、不可能纠正的肾血管病(肾内动脉病或动静脉畸形)可考虑肾切除。当有节段性肾梗死或节段性肾发育不全可作部分肾切除。但是,肾血管性高血压可为双侧病变且呈进行性,故目前除少数病例外,患肾切除已很少采用。
(2)肾动脉重建术
20世纪50年代以来,各种肾动脉重建手术相继出现,手术目的是恢复足够的肾动脉血流量,纠正肾缺血,达到改善肾功能和降低血压。这类手术包括肾动脉血栓内膜剥除术、血管旁路移植术、脾-肾动脉吻合术、肾动脉狭窄切除和血管移植术。现将几种主要的肾动脉重建术简述如下:
1)动脉血栓内膜剥除术(thromboendarterectomy)
由Freeman(1952)首先采用适用于肾动脉开口处或其近端1/3的动脉粥样硬化斑块或内膜增生病变。
2)旁路手术(又称搭桥手术,by-pass operation)
De Weese首先开展自体大隐静脉肾动脉旁路手术。由于静脉特有的弹性,利用自体静脉行肾血管成形术,不易形成吻合口狭窄。也可应用人造血管进行血管重建,但是人造血管不能应用于小血管的重建并且容易导致吻合口的中层增生,且较自体血管有更高的感染率。内皮细胞化的人造血管,即将静脉内皮细胞种植于人造血管腔,不易血栓形成,并提高抗感染能力。血管旁路手术通常适用于肾动脉狭窄伴有狭窄后扩张的病例(图8)。
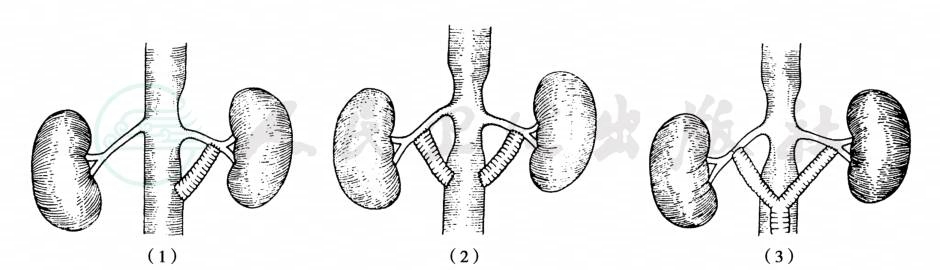
图8 腹主动脉-肾动脉旁路手术示意图
(1)单侧旁路手术;(2)双侧旁路手术;(3)“Y”形双侧旁路手术
3)脾-肾动脉吻合术
由Libertino和Novick首先采用,最常用的术式为脾-肾动脉吻合术。适用于左肾动脉狭窄性纤维肌肉增生病变,要求脾动脉有足够的管径大小,而右肾动脉狭窄可采用肝-肾动脉吻合术。这两种术式均需要腹腔动脉是完好的。
4)肾动脉狭窄段切除术
适用于肾动脉局限性纤维肌肉增生,狭窄的长度在1~2cm以内。
5)病变切除及移植物置换术
适用于肾动脉狭窄长度超过2cm的病变。
6)肾动脉再植术
适用于肾动脉开口异常或肾动脉开口水平的腹主动脉内有斑块硬化病变切断肾动脉后将远端再植于附近正常的腹主动脉。
7)自体肾移植(auto-renotransplantation)
1974年开始我国采用自体肾移植治疗肾动脉狭窄(图9),此手术的优点:①髂内动脉血压较肾动脉压为高,移植后该肾有充分的血供;②大动脉炎患者髂内动脉较少引起狭窄;③不用血管代用品或缺血性离体血管,不易引起异物反应和栓塞;④手术野较表浅,操作容易;⑤可以保留患肾,尤其适用于双侧肾动脉狭窄病例。方法及疗效:在肾蒂近端切断肾动脉和肾静脉,保留较长的正常血管。将肾置于4℃生理盐水中冷却,用4℃肾灌注液注入肾动脉,直至肾表面呈苍白、肾静脉流出液完全澄清后冷却。通常将此肾移植于同侧髂窝。1988年全国291例肾自体移植术总结治愈者225例,好转43例,无变化11例,死亡12例。另外,据两组资料分析,212例自体肾移植近期效果分别为82%及95.2%,远期效果为79.8%。
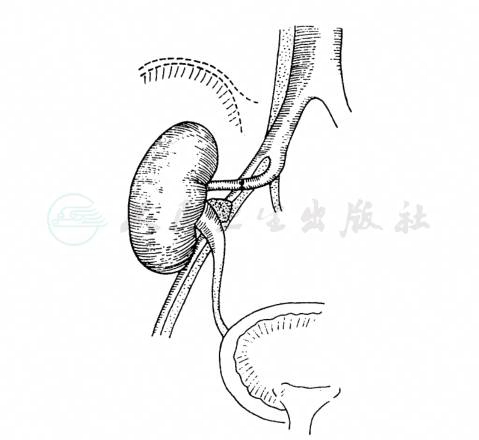
图9 自体肾移植术示意图
右肾移植于右髂窝部,右肾动脉与右髂内动脉端端吻合,右肾静脉与右髂外静脉端侧吻合,输尿管移植于膀胱
8)体外肾血管显微修复术
应用于累及多段血管或同时伴有动脉瘤样病变的患者,尤其是有某些细小或分支的肾动脉狭窄,由此使不能作血管重建术需行肾切除的患肾可能被挽救。方法:①肾的保护:患肾切除前,先在静脉内注射5%葡萄糖溶液500ml,加呋塞米1g或加20%甘露醇100ml,可使该肾在充分利尿状况下切除,有利于保护患肾。肾离体后立即用0.5%利多卡因20ml和肝素2500单位加于100ml生理盐水,注入肾动脉。离体肾置于4~6℃冷却的林格液内,随之进行肾动脉灌洗至肾表面呈苍白,肾静脉流出液澄清为止;②显微镜血管修复,一般需要切断输尿管。肾取出体外置于工作台冷却液盘内,操作时始终保持低温。应用显微外科设备及器械仔细地解剖肾门和病变血管的切除或修复,包括:分支肾动脉合并缝合,动脉瘤切除,离体血管嫁接,多支肾动脉吻合和病变肾组织局部切除等;③自体肾移植:患肾修补完成后,移植于同侧髂窝内,输尿管再植于膀胱壁内。优点:①在低温灌注下不受缺血时间的限制完成手术;②在无血状态下进行,解剖清楚,操作方便;③可最大限度保留肾和肾组织;④术中减少出血。













