英文名称 :double outlet0 of right ventricle
右心室双出口是一个病理生理混乱和解剖结构异常排列非常繁杂的系列,形态学表现从VSD合并主动脉骑跨到大动脉错位合并VSD。这些极端差异的组成导致了多年以来在其定义、分型以及外科修复时机上存在大量相互矛盾的争议。86%DORV心房心室连接一致,11%房室连接不一致,其他包括心房与单心室连接、房室瓣闭锁或心房异构。文献统计在1000个新生儿中,DORV的发病率约0.09%,在先天性心脏病中DORV占1%~1.5%。
1972年Lev等提出DORV经典的定义是①主动脉和肺动脉都起始于形态右心室;②两个大动脉瓣之间有多少不等的圆锥结构,半月瓣和房室瓣纤维连续中断,被肌性圆锥结构分隔开来;③VSD为左心室的唯一出口。DORV的定义中是否应该包括主动脉瓣-二尖瓣纤维连续缺如尚存在争论。Lev的定义把合并主动脉瓣/肺动脉瓣-二尖瓣纤维连续的病例排除出DORV,并且提供了一个将合并主动脉瓣下VSD及PS的TOF与DORV明确的分界点,但这个概念却与病理学数据不符合。在从合并主动脉瓣下VSD和PS的TOF向DORV过渡过程中,正常的主动脉瓣-二尖瓣间纤维连续逐渐缩小范围直至完全消失,但是从肺动脉主干在室间隔上没有任何骑跨的Taussig-Bing到肺动脉主干轻度骑跨在左心室、肺动脉主干从双心室相等发出、肺动脉主干大部分由左心室发出、直至TGAVSD过程中,肺动脉瓣-二尖瓣纤维连续逐渐发育。另一个相关争议就是DORV的诊断是否必须存在双侧圆锥。Baron、Hallerman等人应用主动脉瓣和二尖瓣叶分离这一标准从影像学上区分DORV和TOF。Howell等人分析认为只有37.5%存在完整的双侧肌性圆锥;从而得出结论:这一标准对于形态学描述非常实用,但并非是DORV分型的绝对必须标准。
目前比较一致的观点是将DORV定义为心室大动脉连接的一种类型,其两条大动脉完全或绝大部分起自右心室。这一定义比较广泛,让每个医师自己决定是否大血管“绝大部分”起自右心室。这一定义中,DORV可以是单心室或双心室,合并各种类型的房室连接和心房排列方式。在真正的DORV解剖矫治手术中,必须要预留一个通道将VSD与体循环半月瓣相连接,从而产生一个宽大不阻塞的左室流出道,这一点非常明确。这是DORV本质的形态学特点,使之与其他可能混淆的畸形相区别。
DORV最早的分型方法是Neufeld等基于以下三个原则建立①VSD和室上嵴的关系;②VSD相对于大动脉的位置关系;③是否存在肺动脉狭窄。1972年Lev等根据VSD和大血管间解剖关系描述DORV,从而建立了当前被广泛应用的分类基础:DORV合并主动脉瓣下VSD、DORV合并肺动脉瓣下VSD(Taussig-Bing)、DORV合并双动脉瓣下VSD、DORV合并远离双动脉VSD。尽管这种分型对生理学特性和外科手术选择非常实用,它仍然存在很多重要的缺陷。正如Lecompte、Kirklin等学者指出VSD-大动脉关系类型和外科手术选择之间并不存在绝对的相关关系。对于这一复杂的心室大动脉连接畸形,其分类和命名法远没有一个提供术前解剖标准的实用性定义重要,因为它对决定最佳手术方案非常有帮助。目前比较一致和实用的分类是STS先天性心脏病命名及数据库委员会数次讨论之后建立的数据库,可以对目前各种外科手术的结果进行可靠的、有意义的分析研究。该分类在所需要的DORV的相关形态学描述可以分为几个标题:VSD、右室流出道、大动脉关系、冠脉解剖、圆锥解剖、左室流出道、三尖瓣环—肺动脉瓣环距离、及其他合并畸形。最简单的数据库,把DORV分为以下五型:VSD型(主动脉下或双动脉下VSD,不合并RVOTO)、TOF型(主动脉下或双动脉下VSD,合并RVOTO)、TGA型(肺动脉下VSD,Taussig-Bing)、室缺远离型(remote VSD,合并或不合并RVOTO)和室间隔完整型。这一命名法采用简单数据库设置,是因为它简洁的表述了VSD的相关解剖,并将DORV按照可能的外科矫治方法加以归类。VSD的相关解剖(主动脉下、肺动脉下、双动脉下、无关远离)将在二级命名里和是否合并RVOTO一起描述。该数据库将冠状动脉解剖将与5种可能的两条大动脉相对排列关系一起描述。大动脉关系详见下文。冠脉解剖依据数据库委员会所采用在TGA相关冠脉解剖系统来描述。是否存在圆锥、术前是否合并左室流出道梗阻、三尖瓣环-肺动脉瓣间距离以及是否存在其他相关心脏畸形等数据将作为附加的重要形态学变量在更全面的数据库中记录。
1.VSD的特点
构成形态学左室流出道一部分的VSD通常是非限制性的(直径等于或大于主动脉管径)。此外约10%的VSD是限制性的,在非常罕见的情况下可不存在两心室间的交通。室间隔完整的DORV通常合并二尖瓣和左心室发育不良,并且小的房间隔缺损成为唯一的左向右分流通道。约13%的患者VSD是多发的。DORV的VSD的实际解剖位置比较固定,多数是心室圆锥部位于“间隔小梁缘”或隔束的前支和后支的环抱中。当位于流入道间隔、小梁部肌间隔或膜旁向下方延伸占据流入道间隔时,VSD不是在心室圆锥部。这些罕见病例中,VSD是典型的与大动脉无关型,很难用心内隧道来修补,并且可以并发于任何大血管相对关系。
DORV的VSD通常用“主动脉瓣下”、“肺动脉瓣下”、“肺动脉瓣下”、“双动脉下”和“远离大动脉”这些名词来描述。这些VSD和半月瓣的关系对外科手术有特殊的意义,VSD和半月瓣的这种重要关系更依赖于高度变化的大血管之间相对关系,以及圆锥漏斗隔的方向和大小。在DORV中,“主动脉瓣下”、“肺动脉瓣下”和“双动脉瓣下”意味着VSD是“近主动脉瓣”、“近肺动脉瓣”和“近二大动脉”(图1)。这些VSD在室间隔位置的差别以及与半月瓣的关系对彻底理解DORV这一畸形非常重要。
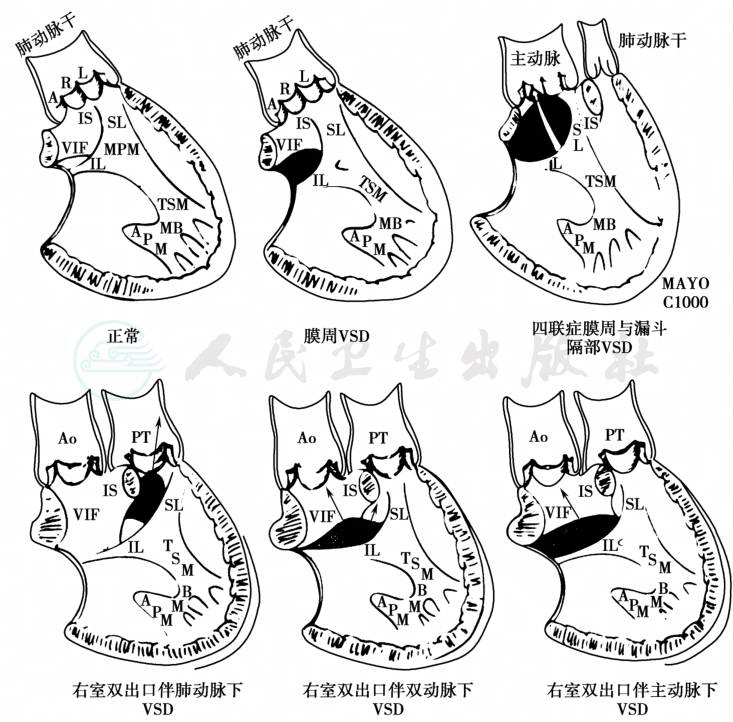
图1 DORV不同VSD位置示意图
主动脉瓣下VSD在占DORV手术接近50%。VSD均位于主动脉瓣下方,并且根据主动脉瓣下圆锥的存在和长度而与主动脉瓣间隔不同的距离。主动脉瓣下圆锥缺如,主动脉瓣左冠瓣或者二尖瓣前瓣将构成VSD实际的后上缘。约77%的DORV合并主动脉瓣下VSD患儿存在双动脉下圆锥,23%只存在肺动脉瓣下圆锥。双动脉下VSD约占DORV手术患儿10%。VSD位于室间隔上方TSM的区域内,紧邻主动脉瓣和肺动脉瓣下方(近双动脉)。由于漏斗部间隔发育不良或缺如,肺动脉瓣和主动脉瓣一般很邻近。这种典型大室缺的上缘由半月瓣构成。TSM及其前后支区域构成它的前、下和后缘。可能双侧圆锥都发育不良,同时漏斗部间隔发育不良或缺如,或者在两组半月瓣下方仅存在一个圆锥。绝大多数合并肺动脉瓣下VSD的DORV没有肺动脉狭窄,属于Taussig-Bing型。在接受外科手术的DORV患者中有30%左右是肺动脉瓣下VSD,一般为非限制性。VSD位于肺动脉瓣下室间隔的前上方,并为TSM分支包绕。漏斗隔(圆锥)从室间隔向右室前壁延伸,将VSD和肺动脉瓣下区域与主动脉瓣下区域隔开,使VSD与肺动脉相关。在Taussig-Bing畸形中,漏斗隔的异常肥厚以及部分分支可能导致主动脉瓣下不同程度的梗阻。双/单圆锥,主动脉瓣下圆锥在Taussig-Bing畸形中各占50%。DORV外科手术患儿中远离型VSD约占10%~20%。这种VSD距离主动脉瓣和肺动脉瓣都很远,不位于TSM的分支之间,位于流入道间隔但不向膜周延伸或者在小梁部间隔。多数这种远离型VSD发生在DORV合并完全房室间隔缺损中。
2.大动脉关系
DORV畸形中两条大动脉的相对关系有两种基本类型:螺旋型和平行型。大多数患儿大动脉位置相对正常,即主动脉干位于肺动脉主干的后方偏右侧,并且从心底部发出时两条大动脉呈螺旋状相互盘绕。此类患儿VSD常位于主动脉瓣下。另一种情况是,主动脉和肺动脉相互平行(没有螺旋盘绕)。此时主动脉可以任意程度围绕肺动脉主程度前后移位:主动脉可以并排位于肺动脉右侧;或者肺动脉右前方;或者肺动脉正前方;最后甚至在肺动脉左前方(左侧异位)。当大动脉是并列平行走向时,VSD多数位于肺动脉瓣下。主动脉左侧异位是最不常见的大动脉走行,VSD一般位于主动脉瓣下。肺动脉狭窄通常并发在主动脉左侧异位患者,同时右冠状动脉经常横跨肺动脉瓣下流出道。尽管VSD和半月瓣间关系通常可以根据大血管间关系来推测,但事实上VSD的相关解剖与大血管间关系无关。
3.右室流出道梗阻(RVOTO)
所有在TOF中出现的RVOTO类型都可以在DORV中出现。RVOTO最常见于主动脉瓣下或双动脉瓣下VSD;在Taussig-Bing和远离型VSD中不常见。尽管RVOTO最常位于漏斗部,但也可以是单纯瓣膜性狭窄,合并或不合并肺动脉瓣环和主肺动脉发育不良。DORV可以合并肺动脉闭锁。
4.主动脉瓣下狭窄
主动脉瓣下狭窄并不常见,但其是DORV的重要特征,有非常重要的临床意义。主动脉瓣下狭窄多数存在于肺动脉瓣下VSD;Sondhermer统计病例中占Taussig-Bing畸形的35%。Taussig-Bing合并主动脉弓缩窄病例中,伴有主动脉瓣下狭窄多由于左室流出道发育不良引起。主动脉瓣下狭窄也可以由房室瓣结构造成,或是附属组织冗长脱垂,或者肌束异常肥厚增生,也可伴有主动脉瓣狭窄或闭锁
5.传导系统
房室连接一致的DORV,其房室结一般位于房室间隔的肌肉部分。无论VSD是主动脉瓣下、双动脉下、还是肺动脉瓣下,His束均穿过中心纤维体的右侧三角,邻近三尖瓣沿VSD后下缘走行。如果在VSD和三尖瓣之间有肌束,此时传导束不再沿着缺损的后下游离缘走行,肌束可起到保护传导束的作用。
6.冠状动脉解剖
从头侧向下方看,绝大多数DORV冠脉开口是按顺时针方向旋转。因此,左冠发出处更靠后方,同时右冠起源更靠前。主动脉位于肺动脉右侧靠前时,冠脉特点类似于d-TGA:右冠起自右后瓣窦(瓣窦2),而左冠起自左前瓣窦(瓣窦1)。在Wilcox的统计中,冠脉分支类型多数是正常的,但有25%是LAD从RCA上发出,并在肺动脉瓣前下方横跨右室流出道;5%为主动脉左侧异位,其RCA均横跨右室流出道进入右侧房室沟。
7.合并心脏畸形
DORV几乎可以合并房室瓣的任何畸形,如房室瓣狭窄甚至闭锁、骑跨、完全性房室通道缺损,严重时可以使实施解剖矫治手术变得非常困难。主动脉弓缩窄及其他左室流出道梗阻多见于Taussig-Bing畸形。其他合并畸形包括:动脉导管未闭、心室发育不良、无顶冠窦综合征、体静脉回流异常、完全内脏反位、右位心(dextrocardia)、房间隔缺损等。
DORV的外科治疗目的是进行完全解剖修复。手术将左室连到主动脉,右室连接到肺动脉,关闭室间隔缺损。手术时机取决于患者症状的显著程度和心脏合并畸形,外科手术方案取决于心脏解剖条件。通常应尽早完成根治手术。
决定手术方法的解剖因素包括:肺动脉瓣和三尖瓣之间的距离(图2)。如采用心内隧道法则需建立室间隔缺损至主动脉的心内隧道,隧道位于三尖瓣和肺动脉瓣之间。如距离足够则隧道具有充分的宽度保证血流通畅,反之则隧道口径不足致使隧道狭窄或远期出现狭窄,故不宜采用此手术方法,应考虑采用Rastelli手术。圆锥隔是影响手术的另一重要解剖因素。如果圆锥隔过度肥厚则需予以切除,以使心内隧道获得足够的空间。如圆锥隔过长伴有肺动脉与室间隔缺损之间距离过小则提示不宜采用心内隧道法。另外过长的圆锥隔通常伴有主动脉瓣下狭窄或主动脉弓发育不良。如果伴有肺动脉瓣下狭窄,在采用心内隧道法时需充分解除狭窄,甚至需要采用心外管道重建右心室和肺动脉连接。
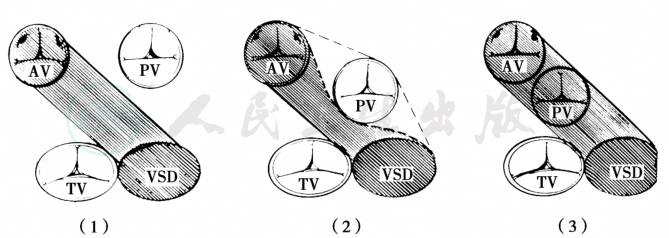
图2 肺动脉瓣与三尖瓣间的距离
(1)肺动脉瓣与三尖瓣之间有足够距离,因此自室间隔缺损至主动脉的心内隧道不全梗阻;(2)肺动脉瓣与三尖瓣之间的距离小于主动脉内径,因此心内隧道法将造成主动脉瓣下狭窄(3)当肺动脉瓣与三尖瓣距离极小时,需行Rastelli手术
1.手术指征
目前认为右室双出口诊断明确即有手术指征,关键是手术时机的选择,以及根据不同的病理形态包括室间隔缺损的位置和有无肺动脉瓣狭窄等选用相应的技术方法。不伴有肺动脉瓣狭窄的病例需应用药物治疗控制心力衰竭和肺动脉高压并尽早施行手术。如果药物治疗不能有效控制心力衰竭则需提前手术,包括姑息性的肺动脉环束术或根治手术,目前认为患者有适应证即应在婴儿早期行根治手术。伴有肺动脉狭窄的病例较少发生心力衰竭和肺动脉高压,目前由于技术水平的提高以及新的血管材料的应用,手术年龄适当提前至6月~1岁。如室间隔缺损属限制型也应早期手术,否则可造成左室进行性肥厚。对于心室发育不良、任一房室瓣的严重畸形、不可逆的肺血管病变均是DORV解剖根治手术的禁忌证,而非常远离二大动脉的VSD以前认为是双心室修补的禁忌,随着DRT(Double-Root Translocation)技术的成熟,该类DORV双心室修补也成为可能。
2.手术方式选择
右室双出口手术治疗目的是将左心室血流导入主动脉而将右心室血流导入肺动脉。根据不同的病理类型可采用不同的方法。最常用的是心内隧道法,适用于室间隔缺损位于主动脉瓣下或双动脉瓣下的病例,如伴有肺动脉狭窄则需切除肥厚肌束,右室流出道补片或跨瓣补片,有时需应用带瓣外管道。室间隔缺损远离两大动脉者传统手术需置心内管道,连接室间隔缺损和主动脉,右心室切口与肺动脉之间置带瓣外管道,或者进行单心室Fontan类手术,目前根据各个中心技术水平不同多选择DRT手术。对室间隔缺损位于肺动脉瓣下且不伴有肺动脉瓣狭窄者,修补室间隔缺损时将左室血流导入肺动脉形成功能上的完全性大动脉错位,然后施行Switch手术。Nikaidoh手术适用于伴有肺动脉狭窄的病例的另一种手术。另外在合并有升主动脉病变、房室瓣异常和心室发育不良的病例,Damus-Kaye-Stansel,左心室至主动脉带瓣外管道及Fontan或改良Fontan手术等均可选用。
3.手术技术
(1)DORV,VSD型(主动脉瓣下或双动脉下VSD,不合并PS):
用连接左室和主动脉的心内隧道手术修复(图3)。右室流出道纵切口,注意保护冠状血管,探查心内解剖结构,包括室间隔缺损的位置及有无肺动脉狭窄。室间隔缺损位于主动脉或双动脉瓣下,可采用Dacron人造血管,将其修剪成梭状,补片长轴实际长度取决于主动脉右位程度,应为主动脉周长的2/3。补片的宽度应覆盖从VSD下缘到主动脉瓣环上界的距离。在实施心内隧道修复时,如果VSD是限制性的(直径小于主动脉瓣),则需要向前上方切开或者在这一区域内楔形切除部分室间隔以扩大VSD使其口径不小于主动脉直径,这一区域远离传导系统,也不易损伤二尖瓣组织。对于梗阻的右心室肌束予以切除。偶尔需要切除部分漏斗隔来构建从VSD到主动脉的垂直通道。有时心内隧道可能引起RVOTO,需流出道补片扩大。
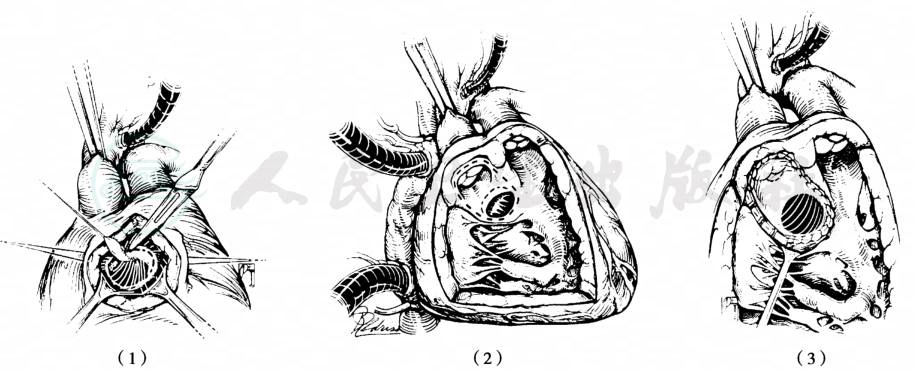
图3 DORV合并主动脉瓣下VSD或双动脉瓣下VSD、无肺动脉狭窄的心内隧道修补
(1)限制型VSD切除室间隔扩大VSD,切除范围用虚线标示;(2)扩大VSD;(3)建立内隧道连接VSD和主动脉
心内隧道法矫治无PS的DORV合并主动脉下/双动脉下VSD术后并发症很少。完全性传导组织不常见,并且至少87%以上的患者心功能为Ⅰ级(NY分级)。需要再次手术的并发症包括:主动脉下梗阻(无论是否与管道相关)、肺动脉下流出道梗阻、残余漏。以往认为低年龄是手术的独立危险因素,目前认为已经消除,但是大年龄仍然是一个显著的风险因素,可能是随年龄增长的肺血管病变引起。
(2)DORV,TOF型(主动脉下/双动脉下VSD合并PS):
对于存在肺动脉狭窄的病例,除了闭合VSD时需要内隧道技术而不是直接补片之外,其修复技术和TOF中描述的类似。对于冠状动脉解剖正常的患儿,建议6~12月龄内手术。如果肺动脉分支严重发育不良或根治手术时需要用心外管道,建议采用体-肺动脉分流手术。对于合并异常冠脉在肺动脉瓣环下方横跨右室流出道单纯行心内疏通不能解除右室流出道梗阻,以及长时间体-肺分流导致的显著肺血管疾病的大龄患儿,需要放置心外带瓣管道。单纯肺动脉瓣狭窄而瓣环及分支正常的患者,可以实施肺动脉瓣交界切开或肺动脉瓣切除术。
为避免使用外导管,有学者采用充分游离肺动脉及其分支,然后将其拉下与右心室切口做吻合。通常后壁直接吻合而前壁应用自体心包补片,此即REV手术(图4)。REV手术同样适用于不能进行心室内隧道手术的心室动脉连接不一致的患者。REV手术会产生肺动脉反流,所以仅适用于术前肺动脉狭窄且肺动脉压力低的患儿。为缩短肺动脉至右心室的距离,有采用横断主动脉将肺动脉前置于主动脉之前与右心室吻合,然后吻合主动脉,此即所谓的Lecompt操作。当主肺动脉侧-侧位或主动脉稍微在肺动脉前方时,即没有必要进行REV手术。REV操作的开始步骤和大动脉调转的操作一样;然后纵向右室切口;构建心内隧道将VSD导入主动脉;肺动脉移位至右室流出道,并且缝闭肺动脉开口;在主肺动脉前壁做纵切口;肺动脉后缘缝合于右室流出道切口上缘;用宽大的自体心包片闭合右室流出道的下部切口和肺动脉前壁。有学者使用带单瓣的自体心包补片可以减轻术后肺动脉反流,而使用Contegra裁减后作为补片更可以取得良好效果。对于冠状动脉异常的患儿会妨碍右室切口,是REV手术的禁忌证。相对Rastelli手术,其远期无需更换外管道,因此对于此类患儿REV手术是首选治疗方案。虽然早期手术效果令人鼓舞,但是对于REV手术尚缺乏长期随访资料。
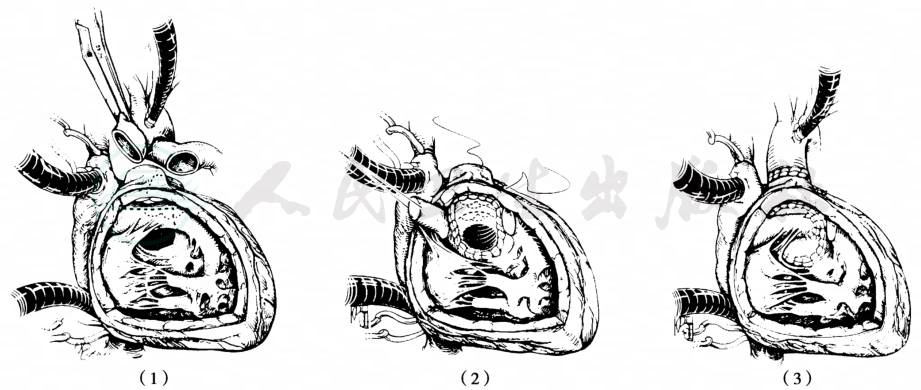
图4 REV手术治疗Taussig-Bing畸形
(1)三尖瓣腱索装置在VSD上方附着于漏斗隔;(2)将漏斗隔向前翻起,而非切除;(3)VSD关闭后将包含有三尖瓣腱索附着的漏斗隔缝合到内隧道补片的右室面上
对这种复杂亚型可实施的修复手术的包括:①补片内隧道将VSD导入肺动脉,同时进行Mustard/Senning心房水平调转手术;②补片内隧道将VSD导入肺动脉,主动脉-肺动脉连接(Damus-Kaye-Stansel手术),同时在右室和远端肺动脉间放置带瓣心外管道;③直接将VSD导入主动脉;④补片内隧道将VSD导入肺动脉,同时行大动脉水平调转(Switch手术);⑤补片内隧道将VSD导入主动脉同时肺动脉移位(REV手术)。目前心房调转手术后远期严重心律失常、肺静脉回流梗阻、体循环心室功能下降等原因和DKS手术需要使用心外管道,且内隧道同时大动脉调转术式的广泛接受应用,前二者目前已经很少采用。
合并肺动脉下VSD的DORV手术修复中最吸引人的选择就是不需要大动脉调转或者心外管道的完全心内隧道修复。这种类型的修复手术已经有多种技术实现:Abe提出的后位、管样隧道方法修复;Doty提出的前位、管样隧道方法;Patrick和McGoon提出的前位、螺旋管道修复;Kawashima提出的后位、直管道技术。
Abe和Doty技术都需要应用部分性或完全性心内隧道将VSD导向主动脉。但是这些技术由于管道无法生长,易发生主动脉瓣下狭窄,已经不再被推荐用在Taussig-Bing的任何亚型中。Patrick-McGoon法和Kwashima手术都为应用心室内隧道法修复合并肺动脉下VSD的DORV的技术,目前仍然有一定的适用范围。
Patrick-McGoon技术用于大动脉倾斜关系或前后位的患儿,建立一个长而复杂几何形状的心内隧道。这个隧道走行在肺动脉左前方,将VSD与主动脉直接相连。由于隧道围绕肺动脉的左侧走行,构建这个隧道不依赖于三尖瓣于肺动脉瓣间的距离。这一技术通常需要扩大VSD,即使VSD本身是非限制性的。Patrick-McGoon技术现在已经被大动脉调转手术所取代,但在这部分亚型的患者中还是一种可以选择的技术。
(3)Kawashima手术(图5):
当大动脉位置接近侧-侧位时,且主动脉在肺动脉右侧时,采用走行在肺动脉后方、三尖瓣和肺动脉瓣之间的管道将主动脉和左心室相连接。必须切除漏斗隔以使心内隧道无不梗阻。当VSD是限制性时,需要扩大。由于这个隧道走行在肺动脉瓣和三尖瓣环之间,这两个结构之间必须间隔足够大的距离才可能构造隧道。三尖瓣环和肺动脉瓣环间最小距离应等于或大于主动脉瓣环直径。如三尖瓣环和肺动脉瓣环间距离不足或大动脉关系倾斜位或前后位时应选择动脉调转术。有时由于右室流出道被心内隧道构建时占用,右室流出道直径必须用流出道补片加宽。
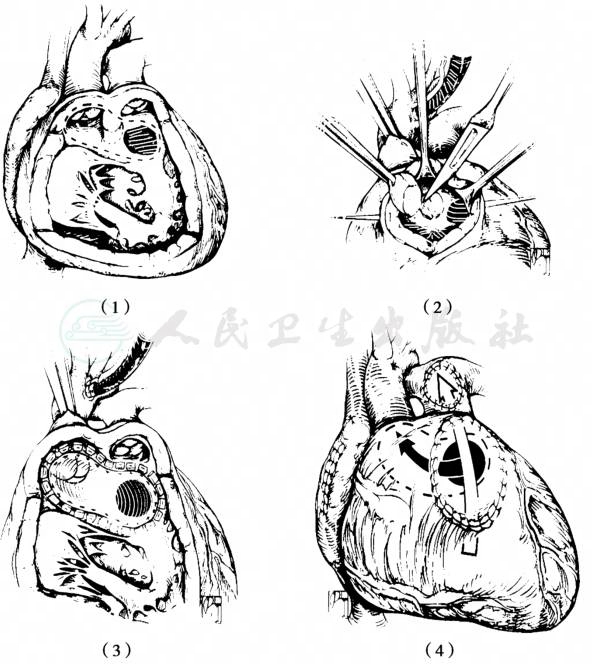
图5 Kawashima手术治疗Taussig-Bing畸形
(1)内圈虚线为需要切除的漏斗隔部分;(2)切除整个漏斗隔以免造成肺动脉下内隧道梗阻;(3)三尖瓣和肺动脉瓣间建立内隧道连接VSD和主动脉;(4)必要时补片扩大右室流出道,以免内隧道造成右室流出道狭窄
(4)大动脉调转同时心内隧道闭合VSD:
最常应用于合并肺动脉下VSD的DORV的手术方案是大动脉调转同时心内隧道闭合VSD(图6、图7)。这一技术已经被成功的应用于任何大动脉排列关系的Taussig-Bing畸形。手术采用胸骨正中切口,高位主动脉插管,建立转流后阻断PDA,降温至18℃,分离主肺动脉,同时标注冠状动脉移植位置。阻断主动脉后推荐经三尖瓣修补VSD,也可纵行切开右室流出道进行修补。用涤纶补片沿VSD边缘连续缝合上缘,引导左心室血在补片下进入肺动脉使成为完全性大动脉错位,部分病例由于严重肺高压肺动脉瓣环明显增大,可通过肺动脉瓣暴露VSD并修补,从而避免切开右心室。
大动脉的横断取决于是否进行Lecompte操作。预计使用Lecompte操作则在主动脉瓣交界上方横断主动脉,在肺动脉中部横断肺动脉。如不实施则在尽可能远处很多主动脉,而在肺动脉瓣交界上方横断肺动脉。横断时切勿损伤肺动脉瓣,因为完成大动脉转位后肺动脉瓣成为新的主动脉瓣。探查左右冠状动脉开口,并沿瓣窦边缘剪下主动脉壁,成为带蒂的冠状动脉。在肺动脉根部的相应位置剪开肺动脉壁,将左右冠状动脉在无扭曲和张力的状态下植入。如实施Lecompte操作,将肺动脉和升主动脉做换位,使新的肺动脉在主动脉前、然后将升主动脉与新主动脉吻合、心包补片修补冠状动脉取下后的缺损再与远端肺动脉吻合,形成新的肺动脉。
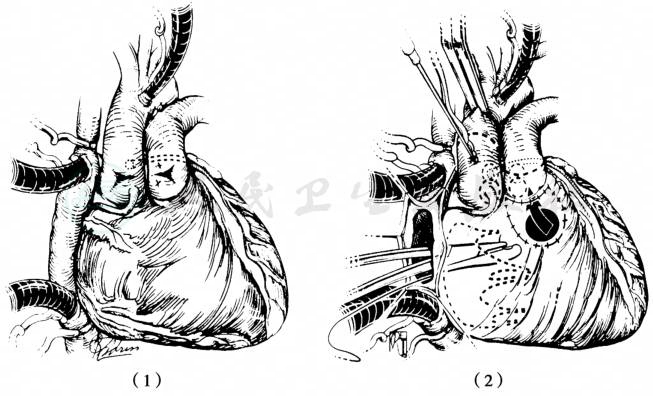
图6 大动脉调转+内隧道术治疗Taussig-Bing畸形
(1)建立转流后心脏畸形外观,肺动脉上用缝线标记出冠状动脉移植位置;(2)修补VSD,将血液导入肺动脉。大动脉横断位置用虚线标明(不进行Lecompte操作)
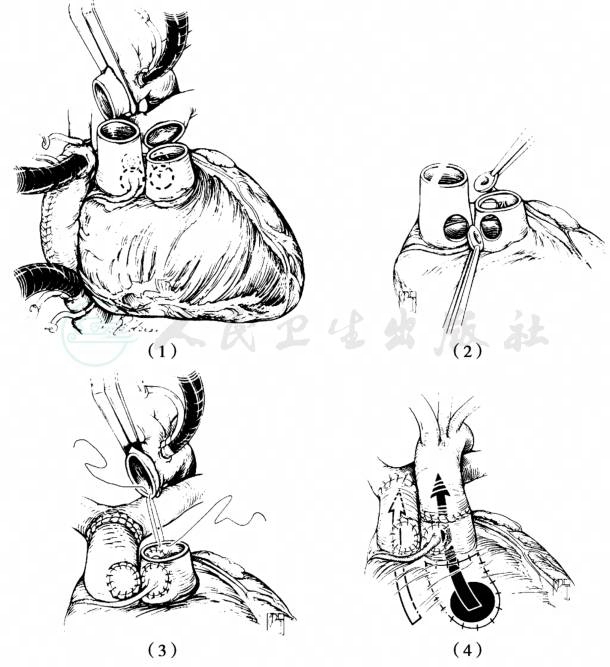
图7 大动脉调转+内隧道术治疗Taussig-Bing畸形
(1)不进行Lecompte操作时大动脉横断位置;(2)纽扣状切下包含冠状动脉开口的主动脉壁,在肺动脉标记的移植点切除肺动脉壁;(3)将冠状动脉移植到新主动脉上,避免有张力、扭曲。新肺动脉壁用自体心包补片修补;(4)新主动脉和自体升主动脉吻合,重建左室-主动脉一致性连接;新肺动脉与自体肺动脉吻合,重建右室-肺动脉一致性连接
如果大血管位置是侧-侧位,交叉换位后缝合分叉处的肺动脉部分,并向右肺动脉延长切口,再与换位前的主动脉根部吻合。也有学者建议不实施Lecompte操作,将剪下的肺动脉远端部分在升主动脉后拖到升主动脉的右侧,然后再与换位前的主动脉根部吻合,依旧保持其大血管侧-侧关系。如主动脉足够远而肺动脉切的足够近则可轻松完成吻合,这样可避免交叉换位导致的肺动脉牵拉狭窄。
大动脉调转术适用于任何大动脉位置关系的病例,冠状动脉移植术在各个大动脉位置均完全可行。对于新生儿和小婴儿,是一种理想的一期手术方案。但是比较Taussig-Bing患儿行Kawashima术还是ASO手术各有利弊。Kawashima手术可用于大动脉侧-侧位,特别是冠状动脉解剖畸形或肺动脉瓣不能代替主动脉功能时,心内隧道方法修补可保留原来的主动脉瓣,避免冠状动脉移植。但术后远期易出现左室至主动脉瓣的心内隧道狭窄及左室流出道梗阻。ASO手术适合大动脉前后位,其冠状动脉适合移植的患儿。如原来已做肺动脉环缩术,术后的肺动脉瓣代替主动脉瓣可能出现主动脉关闭不全,推荐进行心内隧道手术。由于DORV的解剖类型复杂,大动脉转换术要求操作要求相当精确,手术时间长,因此术前必须做好准确的判断,准备好各种手术方法应用的器械。根据术中心内解剖条件决定手术方案,才能不断提高手术的成功率。
Nikaidoh手术是将主动脉换位、同时重建双心室流出道的技术,主要应用于由于肺动脉狭窄(重建后的左室流出道)而不能行大动脉调转手术的DORV或TGA/VSD患者。这个手术的灵感起源于主动脉-心室成型术及TGA-IVS患者中进行的Switch手术。
Nikaidoh手术主要手术方法是将主动脉及其瓣膜从其右室起源处游离下来,如同Ross手术中切取肺动脉及其瓣膜。同时按Switch手术中同样的方法游离冠状动脉;在瓣环水平横断肺动脉,将肺动脉瓣、圆锥隔切除,这样就切除了室间隔缺损的上缘;纵向切开肺动脉根部通过室间隔直至VSD腔内,以打开肺动脉下区域;切除瓣下狭窄部位。主动脉根部向后移位并双层缝合在完全打开的自体肺动脉瓣环上;将冠状动脉移植至新的主动脉根部;然后修补室间隔缺损,补片上缘缝合在主动脉根部。最后将肺动脉连接至右心室切口,前壁以自体心包片作扩大成形。
理论上Nikaidoh手术可用于合并肺动脉下VSD、大动脉前后位合并肺动脉狭窄的DORV患儿。与Rastelli手术比较,Nikaidoh手术后心脏的解剖形态更接近正常,且心内补片占据右心室空间比Rastelli手术的内隧道更少,比较适合小婴儿和右心室腔较小的患儿。另外Nikaidoh手术还比较适合室间隔缺损为限制性或向流入道延伸、房室瓣骑跨或冠状血管分支密集影响右心室表面切口的病例。如果选择Lecompte技术可以不需要采用Homograft,减少了远期外管道梗阻和更换。但是由于其手术复杂,相对REV手术并无明显优势,并不强烈推荐此类患儿进行该术式。
(5)DORV,远离/无关型VSD(DORV,remote/noncommitted VSD):
这些患者通常合并流入道即房室通道型VSD。部分患者可以通过心内隧道矫治,部分需要向前上方扩大VSD。如果心内隧道导致右室流出道梗阻,则需要跨瓣环补片或应用带瓣心外管道。如果将肺动脉隔于补片的左室面,则需要应用REV手术重建右室-大动脉连接或用带瓣心外管道。如果解剖条件要求将VSD隔入肺动脉,而又没有肺动脉狭窄时,应该实施大动脉调转手术。随着外科技术进步,目前更多的临床中心选择DRT手术。DRT手术在保留左心室流出道完整性的同时,将主动脉根部移植到正常位置,并将肺动脉根部重建后与主动脉根部调换位置,恢复左、右心室流出道的正常解剖结构和位置关系。利用保留一侧冠状动脉主动脉根部的半旋转技术,在简化术式的同时,减少了手术创伤,取得更好的治疗效果。基本的过程是在主动脉根部心外膜下游离左、右冠状动脉主干,在主动脉瓣下0.5cm处将主动脉根部从右心室流出道离断,并切下一侧冠状动脉开口(通常是右侧冠状动脉)。经右心室流出道切口用补片修补VSD。沿靠前方的瓣交界处切开肺动脉瓣环,并将整个主肺动脉根部从左心室流出道离断,注意避免损伤二尖瓣瓣环。切除肺动脉瓣下残余纤维狭窄,疏通左心室流出道。以离断的冠状动脉开口部(通常是左侧冠状动脉)为支点,将主动脉根部向后旋转约60°至左心室流出道开口,注意避免冠状动脉的扭曲。完成主动脉根部与左心室流出道吻合;切下的冠状动脉开口纽扣状片缝合移植至相应的主动脉根部。选用同种异体肺动脉单瓣补片或牛颈静脉单瓣补片加宽并重建已经游离下和主肺动脉根部。充分疏通右心室流出道,通过右心室流出道出口切除右心室流出道肥大的壁束。行Lecompte操作将肺动脉调至主动脉前,吻合主肺动脉根部与右心室流出道开口(图8)。
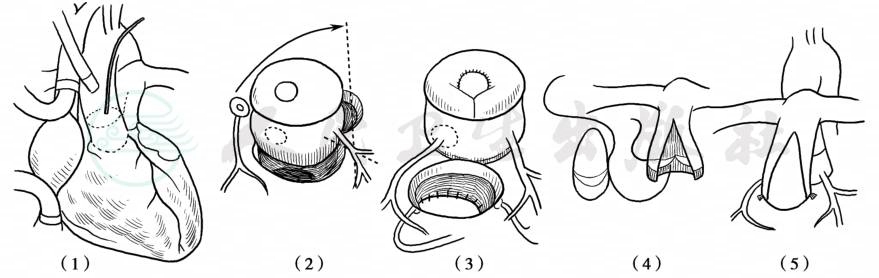
图8 DRT技术治疗远离二大动脉VSD型DORV
(1)沿虚线切下主动脉及肺动脉根部;(2)以离断的冠状动脉开口部为支点,将主动脉根部向后旋转至左室流出道开口;(3)间断缝合完成主动脉根部与左室流出道吻合,将切下的冠状动脉开口纽扣状片再植至主动脉根部;2针U形缝合环缩右心室流出道开口,使其与新肺动脉根部相匹配;(4)(5)用同种异体肺动脉单瓣补片或牛颈静脉单瓣补片重建主肺动脉根部,并与重建后右室流出道开口吻合
(6)房室连接不一致DORV:
双心室修补手术是治疗房室连接不一致DORV的理想选择。采用VSD修补和形态学左室—肺动脉心外管道连接术,这种手术方法也达到了双心室修补的目的,有良好的近期治疗效果,手术方法比较容易。主要缺点是容易发生Ⅲ度房室传导阻滞、心室功能错位。纠正型大血管错位的资料显示,解剖右心室不能长期承担体循环工作,因此10年生存率仅50%~80%,大约58%的患儿术后远期出现三尖瓣反流。从许多解剖特征提示左心室与二尖瓣较右心室与三尖瓣更能承受长期的高压泵作用。由于主动脉下圆锥较长、主动脉瓣位置较高、肺动脉开口与VSD接近甚至骑跨在VSD之上,血流动力学类似纠正型大血管错位。如果患儿年龄小于6月且无肺动脉狭窄,可采用Double Switch手术,即Senning/Mustard术联合ASO手术。如果患儿伴有肺动脉狭窄,小婴儿时可以选择体肺分流等姑息手术改善缺氧情况,3岁后采用Senning/Mustard联合和Rastelli手术。
房室连接不一致DORV还可以合并有多种复杂畸形,包括共同房室瓣、三尖瓣骑跨或附属组织嵌入到VSD和主动脉之间的区域、两个心室发育不平衡、上下心室等,如果双心室修补无法完成,应该选择单个心室的修补方案包括双向腔肺分流术和改良Fontan手术等。
4.术后并发症
(1)左室流出道梗阻:
DORV心室内隧道手术取得成功必须保证左室流出道的通畅。手术后左室流出道梗阻可发生在不同部位,如主动脉瓣下圆锥肌肉肥厚、限制性VSD小于主动脉直径未予扩大、远离两大动脉型VSD裁剪的内隧道补片太小或心内隧道扭曲等。如果术中食管超声检测左室到主动脉压力阶差>2.7kPa(20mmHg),提示有左室流出道梗阻存在,如果压力阶差大于50mmHg,必须重新手术解除梗阻。
(2)右室流出道梗阻:
由于漏斗部肌肉肥厚或心室内隧道占用右室腔内空间,引起右室流出道变窄。手术时应根据局部情况用补片扩大右室流出道。如有肺动脉瓣、瓣环狭窄则需做跨瓣环补片。如果超声检测右室到肺动脉压力阶差大于30mmHg,提示有右室流出道梗阻存在。
(3)完全性房室传导阻滞:
DORV房室连接不一致者,形态学左室(功能右室)切口修补VSD时由于传导束走向的变异和VSD边缘室隔厚度变薄,即使在传导束危险区将垫片放在形态学右室侧也容易发生Ⅲ度房室传导阻滞,需安装起搏器。另外如果VSD向膜部延伸,缺损后下缘有时需要超越缝合,否则可能损伤传导束。
(4)VSD残余分流:
多见原因是在补片缝合时心肌撕裂造成术后残余心内分流,如果肺循环流量与体循环血流量比大于1.5,需再手术修补。
Shen等研究报道,DORV手术后存在18%的远期猝死率。应用Cox风险模型分析证明手术年龄大、围术期或术后室性心律失常、Ⅲ度房室传导阻滞是远期猝死的显著风险因素。但是目前国内外的DORV外科研究并没有报道如此高的远期猝死率。













