按解剖部位对开放性眼球外伤进行分类,可依眼球壁全层裂开的部位分为角膜裂伤、角巩膜裂伤和巩膜裂伤。由于临床表现、处理和预后上的相似性,角巩膜裂伤通常也归入巩膜裂伤(图1)。20世纪70年代以来,由于眼科显微手术的开展和抗生素的应用,角膜裂伤的预后已有很大改善,在多数病例,角膜伤口经初期修复,伤口对合良好,前房迅速恢复,较少有严重并发症发生,即使晶状体累及,也可行白内障手术,最终恢复有用视力。但是,巩膜裂伤的预后仍无明显改善,这主要是由于创伤愈合过程中引起的并发症可造成视网膜脱离等严重并发症。
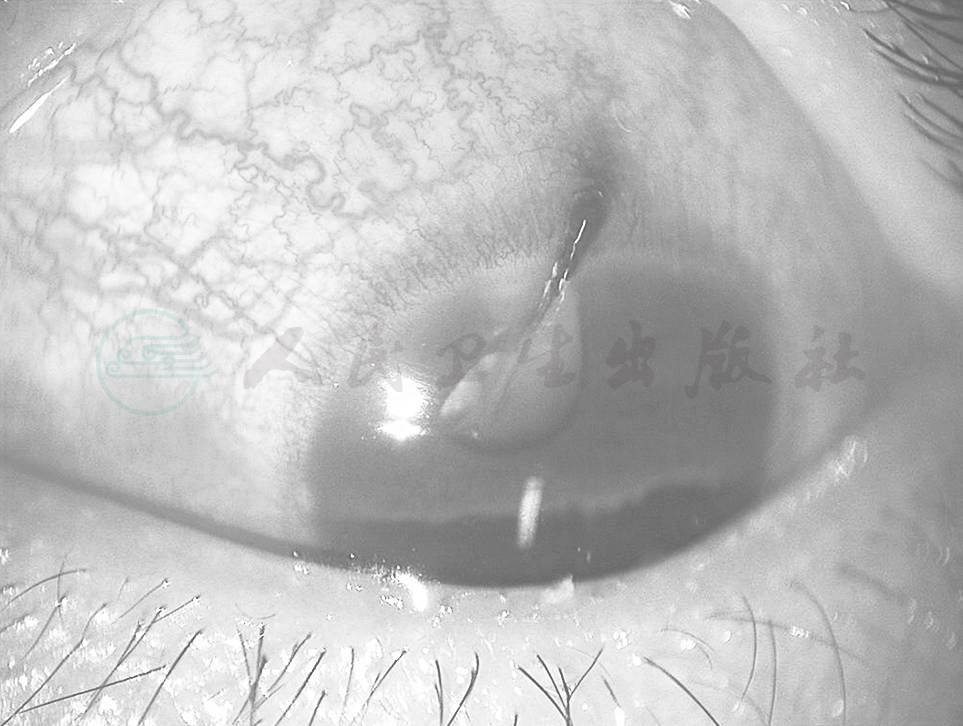
图1 角巩膜缘的开放性外伤,伴有虹膜在伤口的嵌顿
1.病因
大多数锐器刺穿巩膜引起巩膜裂伤,多位于前部巩膜,常常累及相邻的睫状体和玻璃体。晶状体也可能损伤。后部巩膜裂伤可能由高速飞行的金属片引起,或作为大的巩膜裂伤的一部分,或是眼球贯通伤的出口部位。这类裂伤总是伴有脉络膜、视网膜和玻璃体的损伤。
严重的钝挫伤可造成巩膜破裂。常见的破裂部位在角巩膜缘,也可在直肌下,或为在赤道部巩膜的间接性巩膜破裂,而且多伴有较广泛的脉络膜视网膜损伤及眼内出血。
医源性的巩膜裂伤可能发生在视网膜脱离手术中;球后注射或结膜下注射也偶有发生。硬而紧的巩膜环扎带可能穿破巩膜进入眼内。
2.巩膜裂伤的愈合
巩膜伤口的愈合与角膜不同。巩膜表面无上皮覆盖。巩膜伤口主要由巩膜表层的成纤维细胞、偶尔也有葡萄膜基质的成纤维细胞或血管组织修复。根据动物实验观察,在伤后1天内,巩膜表层有轻度的炎症,巩膜的断端不能自行愈合。笔者曾用边长为2mm的三棱针造成巩膜裂伤,在巩膜全层刺伤即刻,伤口张开,有玻璃体嵌顿。伤后3~4天,巩膜表层的纤维细胞活化,变成典型的成纤维细胞,从外面长入巩膜缺口中;伤口部位脉络膜断端也明显增厚,基质中可见成纤维细胞。伤后7天,伤口的空缺已完全被增生的纤维组织充填,在组织学切片上可见这些成纤维细胞、胶原纤维及小血管与巩膜表层相延续,而巩膜实质层的断端无明显变化。伤后2周,修复巩膜缺口的纤维组织中,细胞成分减少,胶原成分增加,但瘢痕组织的厚度较邻近巩膜明显变薄。在伤口内侧表面的视网膜断端,组织变性萎缩,细胞核数量明显减少;伤口瘢痕的内表面无视网膜组织覆盖(图2)。在不合并玻璃体积血或葡萄膜、视网膜嵌顿于伤口的情况下,无论在兔眼巩膜穿通后不经缝合的赤道部小伤口(2mm大小),或在猴眼赤道部造成8mm长的、经过严密缝合的裂伤,巩膜、脉络膜和视网膜伤口的愈合过程都与上述观察一致,没有明显的向眼内的纤维组织增生。
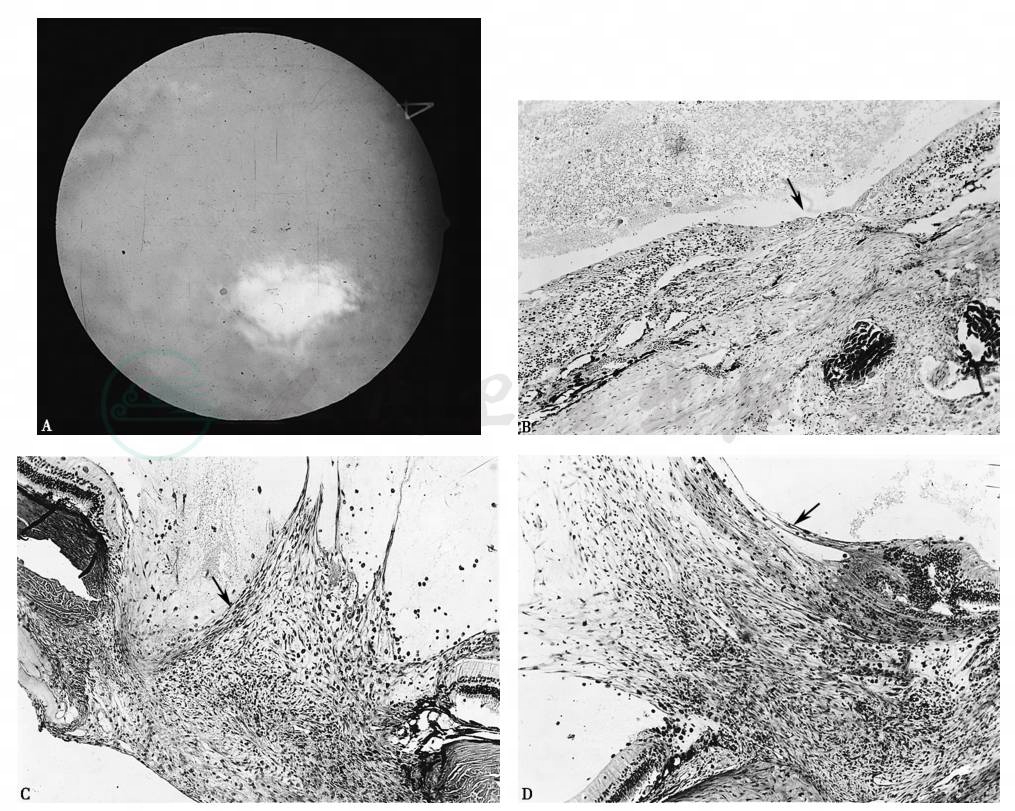

图2 兔巩膜穿通伤的愈合及并发症
用边长2mm的三棱针刺穿兔巩膜,造成巩膜穿通伤。在不伴有明显出血的情况下,伤口在致伤后2~4周愈合,没有向玻璃体内的增生(A,B)。但致伤时向玻璃体注射自体血液0.2ml,则引起明显的玻璃体内纤维组织增生(C,D和E)。A.致伤后2周的眼底照相,穿通伤内口闭合、平复。B.致伤后4周巩膜穿通伤口基本愈合(箭号),视网膜附着。致伤后伴有血液注入的眼,1周(C)与2周(D)时,显示活跃的成纤维细胞向伤内的增生(箭号),4周时形成粗大的增生条索(箭号),周围视网膜皱褶(E)。B~E,H.E染色,× 200
在巩膜裂伤合并玻璃体积血、眼内炎症或组织嵌顿等情况下,巩膜伤口的愈合不同于以上描述的结局。大量的临床病例观察及动物实验,后者包括睫状体平部切口加玻璃体内注入自体血液、巩膜贯通伤、赤道部穿通伤加玻璃体积血、巩膜穿通伤加玻璃体内分别注入白细胞、红细胞及血清成分等,都证实巩膜伤的愈合过程过度活跃,从巩膜表层增生的成纤维细胞在伤后4~7天时,即沿着变性凝聚的玻璃体胶原束、血块或嵌顿的组织向眼内生长,此时伤口及玻璃体腔含有大量的巨噬细胞(见图2)。在伤后7~14天,过度增生的纤维血管组织附着于视网膜上,病理检查见视乳头前及睫状上皮细胞也参与增生组织中,由于增生中含有肌成纤维细胞(myofibroblast),即具有平滑肌特征、含有5~7nm肌动蛋白(actin)微丝的成纤维细胞的收缩,造成牵拉性视网膜脱离,在睫状体平面形成的睫状膜的收缩,可使睫状体分离,并使整个视网膜皱缩于晶状体后或睫状膜部位,最终眼球萎缩(图3)。这一病变即称为外伤性增生性玻璃体视网膜病变(外伤性PVR)。
外伤性PVR实质上是创伤后炎症和修复过程在眼球后段的一种特殊表现。从病理学的一般规律看,这一病理过程与全身其他部位的创伤如发生在皮肤上的创伤有着共同的过程,即炎症期、增生期、重塑期。但是,由于眼球后段的特殊性和巩膜裂伤的特点,外伤性PVR与一般创伤的愈合相比,与特发性PVR(即孔源性视网膜脱离后发生的增生性玻璃体视网膜病变)相比,还有如下的特点:
(1)巨噬细胞是刺激眼内细胞增生的主要细胞之一。尤其在合并玻璃体积血时,玻璃体内有大量巨噬细胞浸润。巨噬细胞能分泌多种生物活性因子,包括生长因子、白介素-1、纤维结合蛋白以及各种溶酶体酶。笔者将活化的巨噬细胞注入兔眼玻璃体内,诱发了牵拉性视网膜脱离(图4)。持久的眼内慢性炎症及因血眼屏障损害向眼内的血浆渗出增加,总是与创伤愈合的过度反应和眼内细胞增生相联系。因此,玻璃体积血、眼内持久的炎症是发生外伤性PVR的刺激因素。
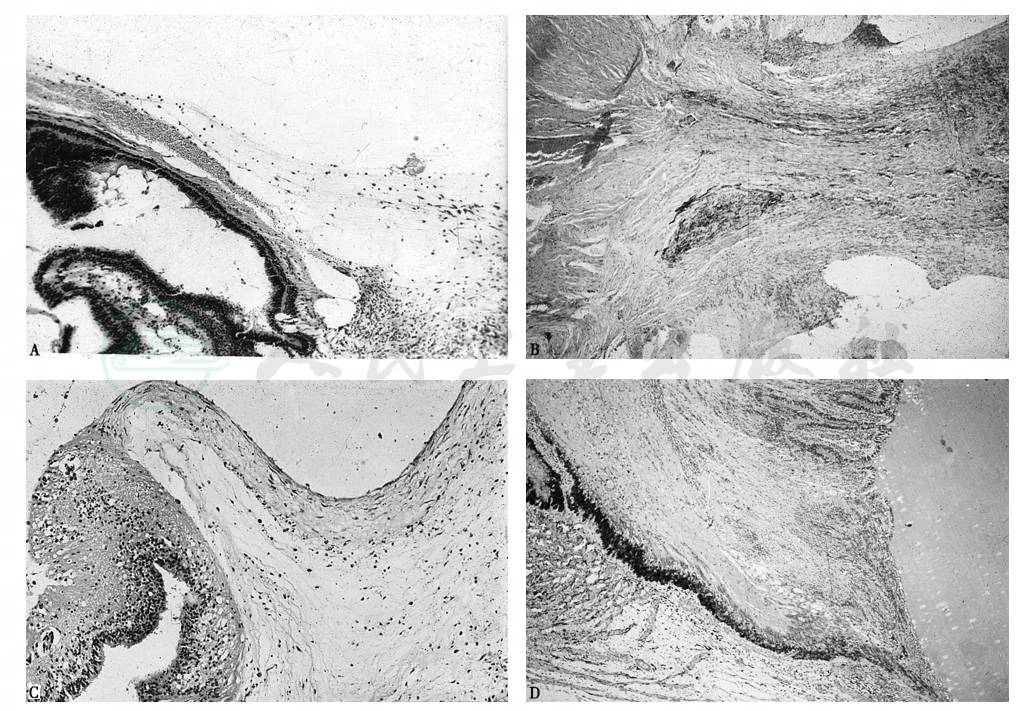
图3 眼球巩膜裂伤后的组织病理学照相
这4张照片代表4例来自20世纪70年代(玻璃体手术前时代)外伤后的眼球摘除。A.睫状体平坦部的巩膜裂伤3周后,伤口内侧的细胞增生引起牵拉性视网膜脱离 B.后部巩膜裂伤4周,长入玻璃体的粗大条索,引起眼球萎缩。注意这张照片与图11-41的E类似 C.伤后4周,来自巩膜伤口的增生条索粘连在视网膜表面,形成牵拉性脱离 D.巩膜外伤后4周的牵拉性视网膜脱离,视网膜皱缩于睫状体附近,睫状体平坦部的单层无色素睫状上皮变为多层 A~D.H.E.染色,× 200
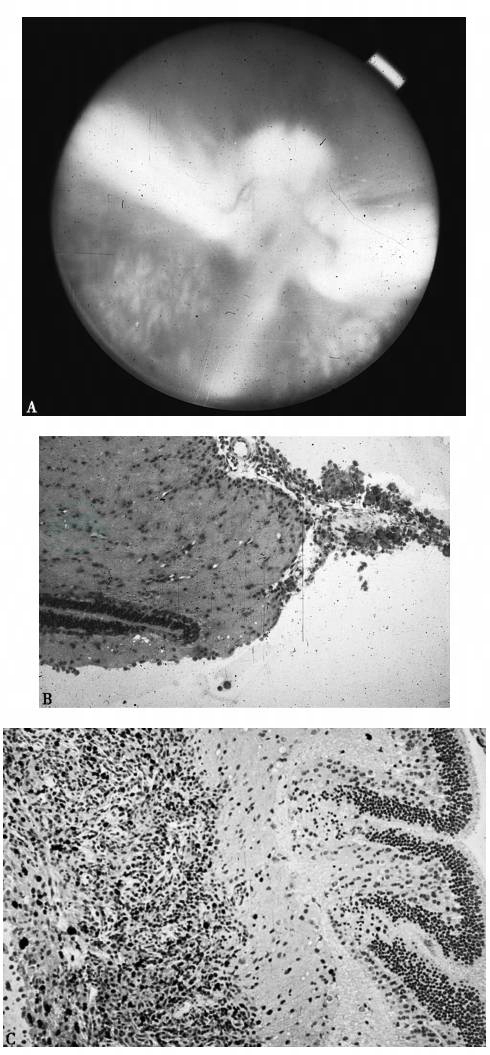
图4 活化巨噬细胞注入兔玻璃体内诱发牵拉性视网膜脱离
A.兔的活化巨噬细胞注入玻璃体内4周的眼底照相,可见视盘前的灰白色条索及牵拉隆起的髓线(兔视盘两侧水平的翼状有髓神经纤维,其上的血管是兔唯一的视网膜血管系统)B.造模后2周的视盘及其前方的组织切片,显示细胞增生和视网膜皱褶 C.经3H-胸腺嘧啶标记的组织病理学切片,显示大量增生的细胞(黑色核)和视网膜皱褶 B和C.H.E.染色,× 200
(2)眼内增生的细胞主要是成纤维细胞,而不是视网膜色素上皮细胞。成纤维细胞主要来源于伤口,也可来源于视网膜的血管复合体。此外,神经胶质细胞(Müller细胞)、睫状上皮也参与增生组织。除伤口部位的视网膜破口之外,视网膜色素上皮细胞缺少机会游走和增生。在增生的组织中可含有小血管。引起增生组织收缩的主要力量来自肌成纤维细胞。
牵拉性视网膜脱离的发生时间多在伤后2~4周。横贯玻璃体腔的增生性条索或膜较为多见,在伤口附近也有视网膜周围膜形成。在有较多玻璃体积血的情况下,视网膜脱离发生时,玻璃体仍处于高度混浊的状态,难以用检眼镜直接观察到。因此,超声波检查具有重要的诊断价值。另外,角巩膜裂伤常引起睫状膜形成,继而造成前部增生性玻璃体视网膜病变,使玻璃体手术处理这类伤眼的手术时机非常短暂,难度也很大。因此,在符合手术适应证的伤眼,手术宜在伤后1~2周内尽早施行。
及时修复伤口、恢复眼球结构的完整性以及防治外伤后的并发症,是巩膜裂伤临床处理的基本原则。需要进行眼球的外重建(缝合伤口等)和必要时的内重建(即保持眼内介质透明、视网膜附着和维持眼压,实现结构和功能的尽可能的恢复)。
1.伤口初期修复
应尽早手术处理穿通伤口。实验证实,巩膜伤口不易自行闭合,大于2mm的不规则伤口即有组织的嵌顿,也应手术清理、缝合。手术前,用生理盐水和稀释的抗生素溶液冲洗结膜囊。剪开球结膜,充分暴露伤口;伤口过大或位置靠后时,牵拉眼球不可过度,以避免更多的眼内容物脱出,此时,也可先清理、缝合前部的伤口部分,然后再向后探查,应看到并缝合伤口的止端。对脱出和嵌顿在伤口的眼内组织如葡萄膜、视网膜,用稀释的抗生素液充分冲洗,尽可能地游离并送回眼球内,但对脱出的晶状体物质、玻璃体应予剪除。缝合后若眼压过低,可注入平衡盐液或适量的黏弹剂。
初期修复伤口的主要目的是恢复眼球的完整性,在多数情况下不能完全解决眼球内的结构紊乱或介质混浊问题。这些问题可在初期修复后进行详细的检查,包括超声波和视觉电生理检查、X线或CT检查等,然后决定进一步治疗或手术方案。在初期手术时,有以下几个问题值得提出讨论,其中有些问题仍有争议。近年来,由于玻璃体手术技术不断完善,有人提出初期手术即进行伤口修复和玻璃体手术,显然这可能只适合一部分病例。
(1)是否同时作白内障摘除
外伤性白内障多见于角巩膜裂伤。对非晶状体破裂性白内障,可在初期修复后再作处理。对晶状体破裂性白内障,如果没有嵌顿在伤口内,也可不在初期修复时摘出。因为开放性外伤的伤口不是清洁的,要清除眼内的晶状体物质,势必要在低眼压、组织关系不清晰等情况下,器械多次进入眼内,这对于伤眼尽快恢复完整性、预防或控制感染是不利的。同时,从伤口吸出晶状体物质还难以避免晶状体囊膜等在伤口的嵌顿(尤其在没有显微手术的条件下),这些物质的遗留可作为从伤口向眼内长入的成纤维细胞的支架,是加剧眼内增生和伤口愈合不良(尤其是角膜伤口)的因素(图5)。如果破裂的晶状体物质嵌顿于伤口中,可以根据情况从伤口游离和吸出晶状体物质,缝合伤口时应确认伤口内无嵌顿。初期修复后,如晶状体蛋白进入前房,为避免继发性青光眼和晶状体过敏性眼内炎,可重新作角膜缘切口行白内障摘除术。没有晶状体物质逸出的外伤性白内障,可根据视力需要在晚些时间安排手术。
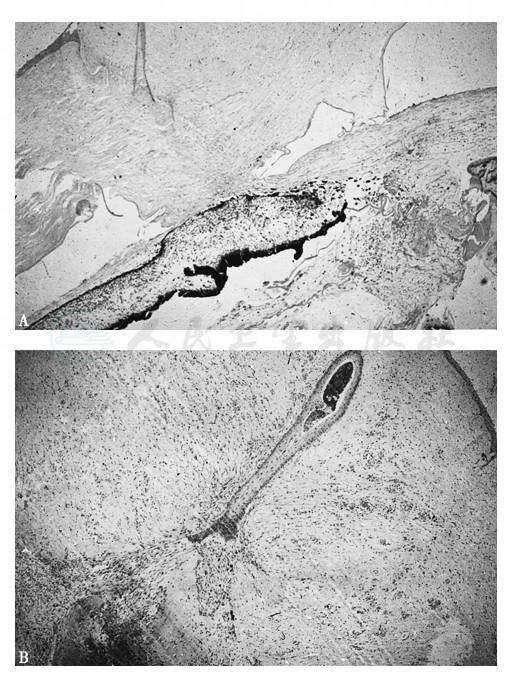
图5 角膜伤口嵌顿引起愈合不良的组织病理学照相
2例角膜穿通伤后2个月时各因眼球萎缩而摘除眼球。注意A图中角膜内伤道愈合不良,纤维瘢痕长入前房并与虹膜粘连,晶状体物质残留。B图显示角膜基质内上皮囊肿形成,前房消失,充满瘢痕组织。H.E.染色,× 100
由于白内障手术技术的日臻成熟,在伤口缝合的初期手术中进行白内障手术也是可行的。但要避免上述的不利因素。首先,需要仔细用抗生素清洗结膜囊和伤口;应另作前房穿刺或辅助切口,注入黏弹剂形成前房,分离伤口内嵌顿的晶状体物质、虹膜组织或凝血块;从手术切口、而不是伤口吸出晶状体物质。
至于是否初期植入人工晶状体,则需要考虑更多的条件,如无感染可能,无视网膜的明显损伤,角巩膜伤口较小不至于引起较大的角膜瘢痕与散光等,植入后估计有一定的视力恢复等。否则,在处理外伤并发症时会遇到较大困难,甚至需要取出人工晶状体。
(2)是否同时作眼内异物摘出术
术前若能确定或疑为磁性异物时,可在影像学定位后,采用眼球外进路或通过伤口用电磁铁吸出异物。由于眼内异物是感染性眼内炎的主要原因之一,及时摘出异物是有利的。若为含铜的异物,可以在初期修复后尽早安排手术,以内进路(玻璃体手术)取出。过小的铜异物,如雷管爆炸时形成的1mm左右的碎片,实验证实不致引起明显的眼内损害,尤其被包裹时,可以不予摘出。铅异物可在伤后2~3周取出,动物实验已证实,在此期间内没有出现明显的视网膜毒性。玻璃等性质稳定的异物可根据大小、部位不一定强求作摘出术。由于外伤的情况千变万化,具体的处理都应根据实际情况决定,没有绝对不变的模式。
(3)是否向玻璃体内注药预防感染
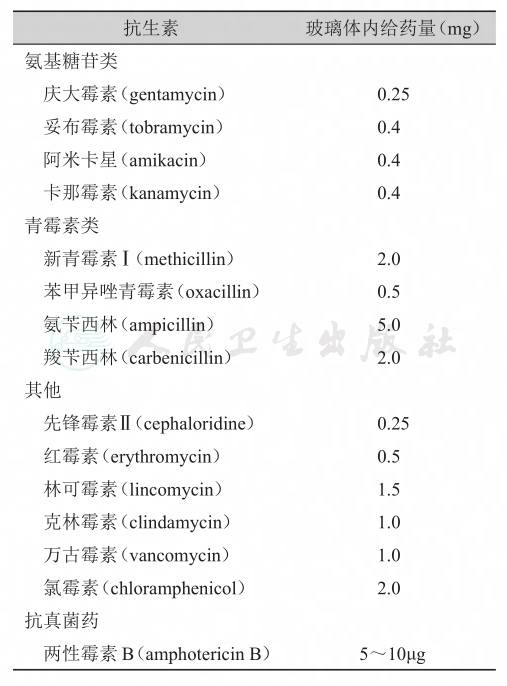
这主要根据感染可能性大小的推测,伤后就诊的早晚而定。研究表明,静脉或球旁注射等方式给药都不能使玻璃体腔的药物浓度达到有效灭菌浓度,因此直接向玻璃体内注射药物是抗感染最有效的给药方法。通常对合并眼内异物、就诊及初期清创缝合手术较晚、伤口污染较重、葡萄膜脱出、玻璃体积血等病例,可以在初期手术中作预防性玻璃体注药,可给予万古霉素1mg、头孢他啶(ceftazidime)1mg、特殊情况下(如缺药)或庆大霉素200~400μg(剂量过大时有视网膜毒性)、地塞米松0.5~1mg。仅注射1次。各种抗生素的选择可参见表1。
(4)是否作巩膜外垫压术预防视网膜脱离
位于睫状体平坦部或锯齿缘以后的巩膜裂伤,尤其在伤口较大及合并玻璃体积血时,有较大的视网膜破口存在,发生玻璃体内纤维增生的可能性也较大,因此,采用电凝并顶压巩膜以封闭外伤性视网膜裂孔、缓解对视网膜的牵拉可以是一种选择的方法,但其效果没有循证医学的证据。可在缝合前部巩膜伤口后,对伤口周围作一排电凝,然后安置巩膜缝线,外垫压的硅胶材料可环形放置;然后用预置的巩膜缝线捆扎。较小的巩膜伤口,在缝合后可仅作电凝。据近年的经验,累及视网膜裂伤的开放性外伤,视网膜瘢痕通常会引起收缩和视网膜脱离,因此玻璃体手术和硅油填充几乎是必需的,预防性外垫压实际上很少采用。
表1 文献中记载的玻璃体内抗生素注射种类及其剂量
初期缝合手术时还应注意以下几点:①巩膜伤口应良好对合:缝针应进入巩膜2/3深度,不能过深(穿透巩膜进入眼内)或过浅(对合不好或缝线撕脱),可用5-0~7-0缝线,进出针部位距伤口边缘1.5mm,伤口中无组织或血块嵌顿。②角巩膜裂伤应首先对合角膜缘部:在切开、分离球结膜和球筋膜囊后,先在角膜缘作1针缝合,然后依次缝合角膜伤口和巩膜伤口。③应充分暴露全部巩膜伤口:巩膜裂口可能向后延伸很长,应逐步暴露缝合。如果是贯通伤,一般先处理前部入口,再作360°球结膜切开,暴露赤道部或其后的出口。对接近后极部的较小伤口,由于暴露时难免挤压眼球,可能致使更多的眼内容物脱出,也可在初期手术时暂不处理。这类伤口可在1~2周愈合,在此期间可根据超声波等检查结果考虑是否再行玻璃体切除术,以防止玻璃体内纤维组织增生造成牵拉性视网膜脱离。④巩膜缺损的处理:可大致按照角膜移植术的方法用异体巩膜作巩膜修补术。
2.初期修复手术后的处理
(1)外伤性葡萄膜炎:用阿托品散瞳,服用合成的前列腺素抑制剂、非激素类抗炎药。糖皮质激素类药物如口服泼尼松,40mg/d;短时地塞米松静脉注射。
(2)外伤性感染性眼内炎:不同的给药方式效果有不同。用抗生素眼液频繁点眼(1~2小时1次),可使结膜囊无菌,防止眼球外的感染源进入眼内;全身静脉或肌内注射大剂量抗生素,主要是防止眼内感染向全身扩散,由于血眼屏障的关系,这种给药方式尚不能提供玻璃体内有效的药物浓度。对玻璃体内感染最有效的给药方式是玻璃体内注射药物,一般仅注药1次。对一些脓肿形成的严重病例,可以考虑玻璃体切除术,在灌注液中可加入抗生素液。
(3)外伤性增生性玻璃体视网膜病变:巩膜裂伤合并大量玻璃体积血、眼内炎症、眼内异物或贯通伤,是发生这一病变的高危险眼,可在伤后1~2周行玻璃体切除术。
(4)眼内重建的玻璃体手术。













