2018年美国脑肿瘤注册登记中心(Central Brain Tumor Registry of the United States,CBTRUS)公布数据,脑干肿瘤在原发性中枢神经系统肿瘤所占比为1.5%。脑干肿瘤好发于儿童及青少年。随着年龄增长,其在原发性中枢神经系统肿瘤中所占比呈现逐渐下降,其中0~14岁儿童为13.3%,15~19岁少年为5.3%,19~39岁人群中则降至2.5%。脑干内部结构精密而复杂,所掌管的功能涉及意识、呼吸、心跳、血压等基本的生命活动。随着显微神经外科技术、显微神经解剖、神经电生理监测技术以及多模态神经导航技术发展,脑干肿瘤外科治疗安全性取得显著提高。
(一)脑干胶质瘤
1.流行病学
根据2018年CBTRUS的统计数字,胶质瘤在脑干原发性肿瘤中所占的比例约为75%。脑干胶质瘤好发于儿童,占儿童脑肿瘤的15%~20%,其中80%为弥散内生型脑桥胶质瘤(diffuse intrinsic pontine gliomas,DIPG)。儿童DIPGs发病高峰年龄为6~7岁,中位生存期仅9~12个月,2年生存率<10%,5年生存率<1%,是儿童因脑肿瘤死亡的主要原因之一,因此是神经外科领域中最复杂、最难治的疾病之一,也是脑干胶质瘤的研究热点。脑干胶质瘤在成人脑肿瘤中所占的比例为2%~4%,其中约45%~55%为DIPG。成人DIPG中位发病年龄为30~40岁,病史较长、病情进展缓慢,中位生存期约6~7年。
2.诊断
脑干胶质瘤的诊断主要依靠临床表现和MRI影像检查。脑干胶质瘤典型的临床表现为三主征,即:脑神经功能障碍、共济失调和长束征。除此之外绝大多数儿童DIPG患者存在其他非典型表现,主要包括:夜间多梦、呓语,伴有梦中哭或笑,睡眠中肢体“肌阵挛”样抽搐,少数患者甚至出现梦游,夜间盗汗,脾气性格改变(主要表现为需求无法得到即刻满足时对父母的攻击行为),以及大小便困难。这些非典型症状出现时间往往早于三主征,但是由于隐匿且不典型往往得不到家长重视。延髓低级别胶质瘤患者可以表现为舌肌萎缩、声音嘶哑、斜颈、生长发育迟缓甚至停滞、因消化吸收功能弱导致的营养状态差、打鼾、夜间呼吸睡眠暂停以及微误吸导致的反复肺炎。上述症状往往比较隐匿而且进展缓慢,容易被家长所忽视,部分患者会长期就诊于消化科或呼吸科。以眼球运动障碍作为孤立症状起病的患者,往往首诊于眼科,对这部分患者应该建议进行神经科的相关检查,以免延误诊断和治疗时机。
MRI对于脑干胶质瘤具有较高的诊断价值。其特殊序列如磁共振波谱成像(MRS)、灌注加权成像(PWI)、弥散加权成像(DWI)、弥散张量成像(DTI)可以在一定程度上反映肿瘤的病理性质。MRS可以鉴别肿瘤性和非肿瘤性病变,以及预测肿瘤性病变的病理级别;PWI可以反映肿瘤内部的血流灌注情况;DWI可以鉴别肿瘤与脓肿、胶质瘤与淋巴瘤等;DTI成像经过重建可以反映肿瘤与皮质脊髓束、内侧丘系等重要纤维束的关系,有助于判断内生型脑干胶质瘤是否适于手术以及选择最佳的手术入路和脑干的安全进入区。
3.影像分型
MRI影像分型是指导脑干胶质瘤外科治疗的重要依据。2017年《脑干胶质瘤综合诊疗中国专家共识》中结合蛋氨酸成像和DTI等提出两种脑干胶质瘤分型方案。第一种方案将脑干胶质瘤分为三种类型,即:
Ⅰ型:外生型脑干胶质瘤,肿瘤向外生长,主体位于脑干外部(图1A)。
Ⅱ型:内生型脑干胶质瘤,可分为Ⅱ a型,即局灶内生型(图1B)和Ⅱ b型即弥散内生型。对Ⅱ b型脑干胶质瘤建议行11C-MET PET检查,综合MRI增强扫描的特点和MET摄取情况,可将Ⅱ b型肿瘤分为伴有局灶性强化或高代谢的Ⅱ b1型(图1 C~E)和无局灶性强化或高代谢的Ⅱ b2型(图1 F~H)。
Ⅲ型:为特殊类型的脑干胶质瘤,Ⅲ a型为顶盖胶质瘤(图 I);Ⅲ b型为导水管胶质瘤,其发生率较低,以梗阻性脑积水为首发症状,病理类型以低级别胶质瘤为主(图1 J);Ⅲ c型为NF1相关的脑干胶质瘤,可分布在脑干内任何部位,可表现出各种生长方式和影像学特点。
第二种方案根据DTI成像中皮质脊髓束(corticospinal tract,CST)和肿瘤的位置关系将BSG分为3型,即:
A型:为推挤型,CST受到肿瘤推挤发生移位,患者四肢肌力为Ⅳ~Ⅴ级(图2)。
B型:为推挤+破坏型,CST同时受到肿瘤的推挤和破坏,患者受累肢体肌力为Ⅱ~Ⅲ级(图3)。
C型:为穿过型,CST从肿瘤内部穿过,患者受累肢体肌力为Ⅲ~Ⅴ级(图4)。
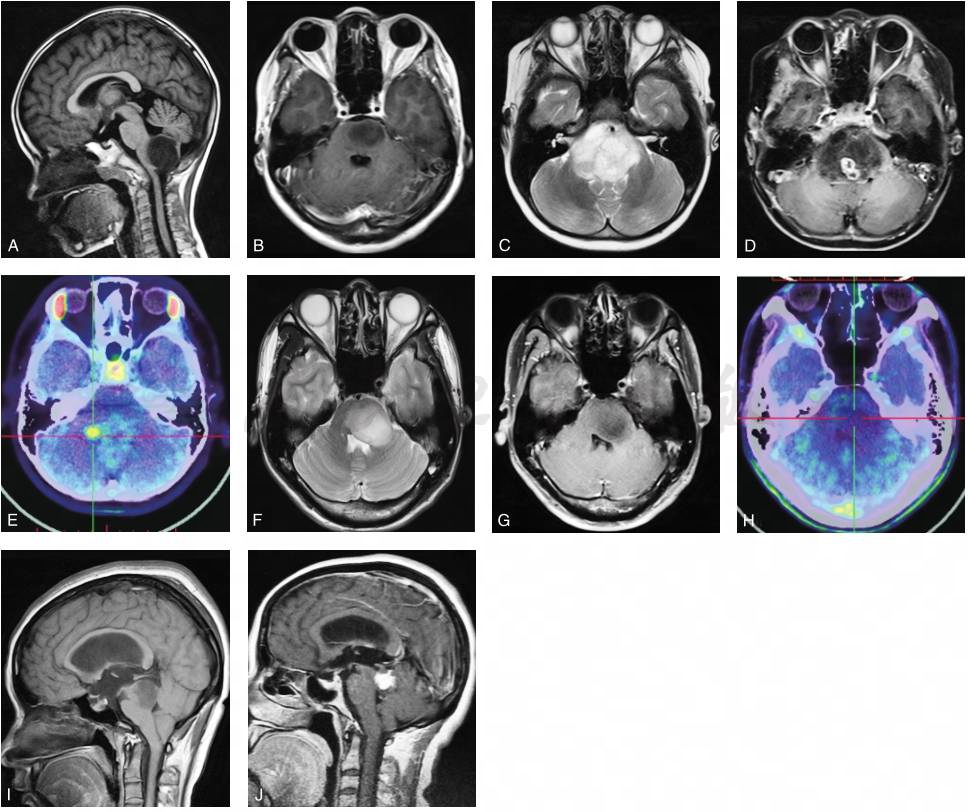
图1 基于MRI的脑干胶质瘤分型
A.外生型;B.局灶内生型;C~E.弥散内生型脑干胶质瘤伴有局灶强化和高代谢;F~H.弥散内生型脑干胶质瘤无局灶强化和高代谢;E、H为11C-MET PET-CT显像;I.顶盖胶质瘤;J.导水管胶质瘤
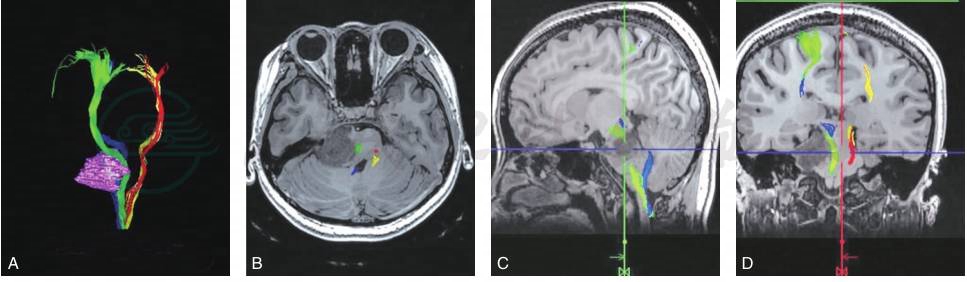
图2 DTI分型A型:肿瘤单纯推挤皮质脊髓束(推挤型)
A.纤维束和肿瘤的三维重建结果,绿色所标注为右侧的皮质脊髓束,肿瘤将皮质脊髓束推向左侧,患者的左侧肢体肌力Ⅴ-级;B~D.分别为磁共振T1WI轴位、矢状位和冠状位与纤维束的融合图像,绿色为右侧的皮质脊髓束,红色为左侧的皮质脊髓束
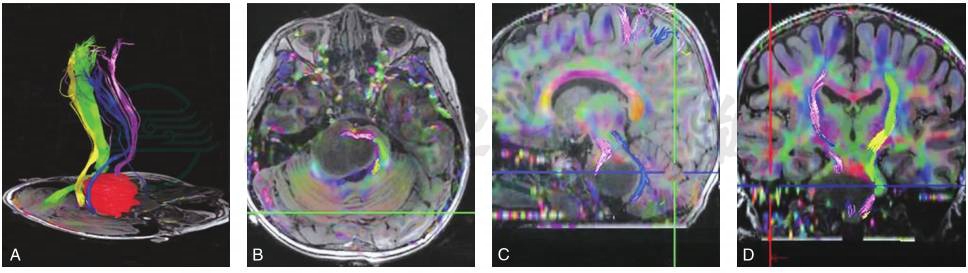
图3 DTI分型B型:肿瘤推挤并破坏CST(推挤+破坏型)
A.纤维束和肿瘤的三维重建结果,粉红色所标注为右侧的CST,可见CST明显受到肿瘤明显推挤发生移位,同时患者左侧肢体肌力Ⅲ级;B~D.分别为磁共振T1WI轴位、矢状位和冠状位与纤维束的融合图20-像,粉红色为右侧的CST
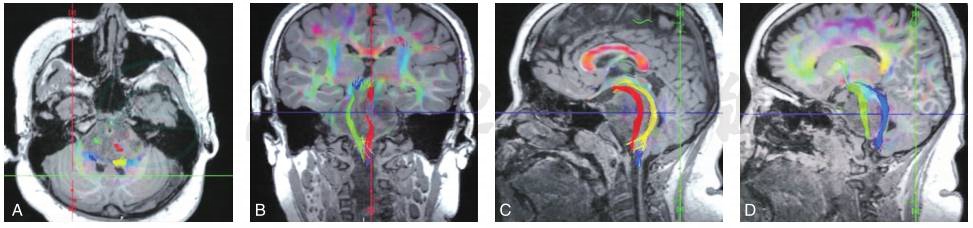
图4 DTI分型C型,CST穿过肿瘤(穿过型)
A、B.分别为磁共振T1WI轴位和冠状位,显示双侧CST均从肿瘤内部穿过;C、D.磁共振T1WI矢状位,分别显示在肿瘤内部穿行的左侧和右侧的CST(红色和绿色分别表示左侧和右侧CST)
需要注意的是,DTI成像所显示的纤维束是在数学模型基础上后期重建获得,纤维束形态和数量受图像采集和重建参数的影响较大。建议DTI作为制定手术入路的辅助性参考依据,术中应用可与电生理监测相结合。
4.治疗
脑干胶质瘤(brainstem glioma,BSG)的治疗以综合治疗为主,包括手术、放射治疗、化疗。放射治疗是DIPGs的标准治疗方案,但只能短暂的改善症状,无法延长其总生存期。化疗对部分复发或术后残余的毛细胞型星形细胞瘤有效,但各种化疗方案均未能显著改善DIPGs的预后。手术可显著改善外生型及局灶型低级别肿瘤的预后。脑干胶质瘤综合治疗决策流程见图5。

图5 脑干胶质瘤的综合诊疗流程
(1)手术治疗:脑干胶质瘤手术有挑战性。除术者显微外科手术技艺外,术前手术适应证的选择、术中切除程度的判断是决定手术效果的重要因素。手术原则是在保护功能的前提下最大程度地切除肿瘤,以延长患者生存期;部分有脑积水或颅高压症状不适宜肿瘤切除的患者可选择减压术、分流术缓解症状。除以下所列的适应证外,最终是否采取手术治疗需结合病情的轻重、进展速度、患者的一般情况及意愿进行综合考虑。
手术适应证:外生型BSG;局灶内生型BSG;伴有局灶性强化或11C-MET PET-CT显示伴有局灶高代谢的弥散内生型BSG;不伴有局灶性强化或11C-MET PET-CT成像显示不伴有局灶高代谢的DIPGs可选择开放活检或立体定向活检术;观察期间表现出恶变倾向的胶质瘤(体积变大、MRI增强扫描出现强化、侵及周围结构)。
手术禁忌证:弥散型BSG累及整个脑干(中脑、脑桥、延髓);伴有软脑膜播散或种植的BSG;Karnofsky功能状态评分(KPS)<50分,脑干功能严重衰竭的患者;合并多脏器功能异常,无法耐受手术者。
(2)放射治疗能够缓解临床症状,特别是3岁以上的儿童。放射治疗后,症状缓解时间不一,多数在照射后1~2个月内症状有所缓解,但亦有临床症状加重者。
放射治疗适应证:DIPGs;高级别BSG;低级别BSG,包括外生型(Ⅰ型)和局灶内生型(Ⅱ)型,肿瘤全切除术后应密切观察,出现肿瘤进展可行放射治疗;部分切除或活检者视分子病理结果,选择放射治疗和/或化疗,或定期观察,肿瘤进展时治疗。顶盖型(Ⅲ盖型)、导水管型(Ⅲ导型)和NF1相关(Ⅲc型)BSG,可以首选观察,肿瘤进展时选择手术切除或立体定向活检术,明确组织病理及分子病理类型,指导后续治疗。
放射治疗相对禁忌证:年龄<3岁者;一般情况差或脑干功能严重衰竭无法耐受放射治疗者;存在严重脑积水未处理者;伤口未愈合或局部存在感染者。建议尽可能明确病理诊断后选择放射治疗,避免误诊误治。
(3)化疗:尚未有前瞻性的临床试验结果显示化疗可以改善BSG的预后。建议对BSG患者在获取组织病理及分子病理的基础上,选择性应用化疗药物。
5.分子病理分型及研究进展
2016过渡版WHO中枢神经系统肿瘤病理分类中提出了“伴有H3 K27M突变的弥散型中线胶质瘤”,该类肿瘤主要见于儿童患者,病理以高级别胶质瘤为主。综合BSG的发病年龄、预后特点及目前分子遗传学方面的研究结果,可以将BSG分为4种分子亚型。
(1)H3F3A K27M(编码组蛋白H3.3)突变型
H3F3A K27M为目前BSG中所发现的最高频突变,该类型BSG对放射治疗不敏感,易转移复发,预后较差,中位生存期9~12个月,2年生存率为11.6%。
(2)HIST1H3B/C K27M(编码组蛋白H3.1)突变型
常见于年龄<5岁的DIPGs患者,相比于H3F3A K27M突变型预后较好,常伴有ACVR1突变。DIPG中的长期存活者(生存期超过24个月者)多为该型。该类型在中国人群中比例相对较少。
(3)IDH1突变型
仅见于成人,主要为非DIPGs,中位诊断年龄为30~40岁,预后较好,中位生存期141.2个月,2年生存率75%。
(4)其他类型
少部分患者并无IDH1/2、H3.3/3.1突变,为双阴型,该型患者预后较好,2年生存率92.9%,现有文献报道中尚未观测到其中位生存期。该类患者建议检测BRAF V600E、BRAFKIAA1549融合突变、NF1,K-ras突变、NTRK2融合突变以确定是否为毛细胞型星形细胞瘤。
研究发现,利用脑脊液中游离肿瘤DNA(ctDNA)可以开展脑干胶质瘤的液体活检。脑脊液ctDNA深度测序检测脑干胶质瘤基因突变的敏感性达到97.3%。根据脑脊液ctDNA突变谱所建立的分子病理分型与直接通过肿瘤组织测序建立的分子分型具有极高的一致性,可以用于指导临床实践。
H3 K27M、ACVR1、PPM1D等关键基因突变在脑干胶质瘤的发现,一方面证明了脑干胶质瘤与相同组织病理类型的大脑半球胶质瘤具有完全不同的分子病理特点,从而解释了过去近50年幕上胶质瘤放化疗方案对脑干胶质瘤(尤其是DIPG)无效的原因。另一方面,上述基因突变也为探索脑干胶质瘤的新型治疗方案提供了靶点;目前针对H3 K27M突变的免疫治疗方案、表观遗传学治疗方案(如组蛋白去乙酰化酶抑制剂、组蛋白去甲基化酶抑制剂等)、ACVR1小分子抑制剂和PPM1D小分子抑制剂已经在细胞及动物模型水平展示出显著治疗效果,随着研究的继续深入,这些新疗法有望在将来改善脑干胶质瘤患者的预后。
(二)脑干海绵状血管畸形
海绵状血管畸形(cavernous malformation,CM)通常认为是在出生时(先天性)即出现低血流量血管畸形,可发生于全身多个器官。脑干海绵状血管畸形约占颅内海绵状血管畸形的9%~35%,好发部位依次为脑桥、中脑、脑桥延髓交界。由于脑干内存在重要的神经传导束和众多神经核团,CM出血后多引起严重的神经功能障碍,给患者带来灾难性后果。虽然手术治疗的主要目的在于减少再出血的风险,另外可部分改善已形成的神经功能障碍,但手术的轻微副损伤也会造成永久性神经功能障碍,因此,学术界对BSCM是否应行手术治疗,以及手术时机等存在争议。
手术适应证:①病变靠近脑干表面或为“外生型”;②病变再出血并引起进行性加重的神经功能障碍;③出血范围已超出病灶;④病灶内部出血伴显著占位效应。临床经验证实亚急性期手术最佳,因为急性期脑干水肿明显,副损伤重,术后易发再出血。
(三)延髓血管母细胞瘤
血管网织细胞瘤来源于中胚层血管内皮细胞的胚胎细胞残余组织,为富含血管的良性肿瘤。中枢神经系统的血管网织细胞瘤主要位于幕下,其次位于脑干及脊髓,对于脑干的血管网织细胞瘤,79%发生于延髓。延髓背侧血管网织细胞瘤的手术治疗具有相当的挑战性。血管网织细胞瘤的发病年龄一般为30~40岁之间,男女比例为2∶1。延髓背侧血管网织细胞瘤的首发症状仍以头痛、头晕、肢体麻木、无力为主要表现。有一部分患者在病情加重后出现呛咳、吞咽困难等后组脑神经障碍。
头部MRI的T2加权像有助于鉴别血管网织细胞瘤与其他肿瘤。全脑血管造影(DSA)不但能为确诊血管网织细胞瘤提供重要的依据,而且能够详细描述肿瘤血供的具体细节,包括肿瘤血管和肿瘤染色的具体范围、供血动脉来源和引流静脉途径,为制订手术计划提供详细的依据。延髓背侧血网的血供主要来源于大脑后动脉、小脑上动脉及小脑前下及后下动脉,还有报道血供来源于脉络膜后动脉以及咽升动脉,血供有时有一支或两支以上的主要动脉血管。头部MRI可以将延髓背侧血管网织细胞瘤分为三型,即实质型、小结节大囊型以及大结节小囊型。不同的分型对采用不同手术方式有帮助。实质型血管网织细胞瘤与囊实型血管网织细胞瘤的手术治疗往往具有不同的难度。大结节小囊型及小结节大囊型血管网织细胞瘤的手术均较实质型相对容易,对于囊实型肿瘤手术中不要试图先切除囊变再切除结节,可同时切除。对于瘤结节很小、较难寻找的病例,为防止瘤结节残留导致复发可采用超声辅助先行寻找结节逐渐切除。延髓背侧血管网织细胞瘤多为以实性为主伴有半月形小囊,肿瘤位于室管膜下,一般与延髓有明显界限,即在肿瘤与延髓之间有一明显的胶质增生带,手术要严格按照膜外操作技术在胶质增生带进行,要注意保护肿瘤被膜及瘤周组织,手术中常见肿瘤呈紫红色,表面有血管怒张,于肿瘤表面看到的大血管多为静脉引流血管,不可先行处理,动脉血管多位于腹侧需先行处理。操作过程中如果误入瘤内可引起致命的严重后果。随着荧光显微镜的问世,对于术中供血动脉与引流静脉的分辨起到较好的帮助,术者可以更直观地分辨这些血管。对于体积大于3cm×3cm×3cm的巨大实质型血管网织细胞瘤,主张采取对供血动脉先行栓塞,待一周后再予显微手术切除。由于肿瘤大多由一支以上血管供血,很难彻底栓塞,栓塞的目的是使高流量供血动脉大部分栓塞,手术切除可以减少出血,缩短手术时间,增加全切机会。
(四)其他肿瘤
脑干其他肿瘤包括脑干内神经鞘瘤、表皮样囊肿、生殖细胞瘤等,由于这些肿瘤比较少见,鉴别起来非常困难,往往通过术后病理证实。
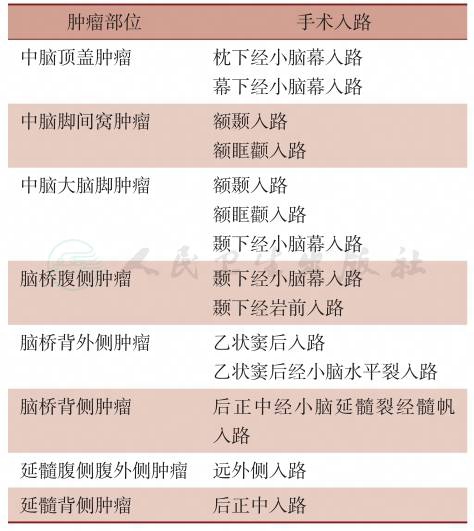
手术入路的选择对于脑干肿瘤手术至关重要,在门诊仍能见到脑干肿瘤术后严重并发症的病例,有些并发症通过入路改进可以避免,因此脑干肿瘤一定要选择个性化的手术入路。不同部位脑干胶质瘤常用的手术入路见表1。除手术入路外,脑干安全进入区的选择同样重要,因此开展脑干胶质瘤手术需要熟练掌握脑干的显微解剖。
表1 不同部位脑干胶质瘤采用的手术入路
神经电生理监测是开展脑干肿瘤手术所必需的监测,在没有电生理监测的护航下进行脑干肿瘤手术后果难以想象。术中电生理监测项目包括:
1.脑神经监测
应根据肿瘤的位置监测术中可能损伤的脑神经,脑神经监护的意义在于:定位神经走行;提示术中操作对神经的刺激和损害。通常的脑神经监测内容包括动眼神经(上睑提肌或下斜肌)、三叉神经(咬肌)、面神经(眼轮匝肌肉、口轮匝肌、颏肌)、迷走神经(环甲肌)、副神经(斜方肌)、舌下神经(舌肌)、舌咽神经(茎突咽肌)。脑神经监测方式包括自发肌电和电刺激诱发肌电。监测过程中应注意避免肌松剂对结果的干扰。
2.脑干BAEP
是反应听神经和脑干功能状态的指标之一,即使手术同侧的耳蜗神经术前已受损害或在术中受到损伤,仍可根据对侧脑干BAEP的变化了解脑干的功能状态。术中听觉脑干通路的损伤与脑干BAEP变化关系密切。BAEP的Ⅲ、Ⅴ峰潜伏期和Ⅰ~Ⅲ、Ⅲ~Ⅴ、Ⅰ~Ⅴ峰间潜伏期均是术中监护的关键性参数。同侧的反应潜伏期突然延长0.5~1.5ms应积极寻找原因。
3.脑干SEP
脑干病变损伤累及内侧丘系者均可表现出相应的SEP改变,主要表现为N13~N20峰间潜伏期延长、N20波幅和潜伏期改变。对于脑干及毗邻部位手术,SEP要求监测双侧上肢SEP和外周监护电位。SEP一般以诱发电位波幅下降50%或潜伏期延长10%为报警标准。
4.脑干MEP
能够反映CST的功能状况。建议有条件的单位综合应用经颅MEP技术和皮质下刺激定位技术。皮质下白质的刺激可用双极刺激器或单极刺激,皮质下刺激的关键是定位运动传导束的距离。术中需明确CST的位置,需结合DTI导航(指示纤维束的宏观位置),经颅MEP(确保整个运动通路的完整性)和皮质下电刺激(确定CST的精确位置)。对于脑干背侧、第四脑室底附近的手术,建议用神经核团定位技术,目的是确定面神经和展神经核及其神经的位置,避免其损伤。
脑干肿瘤中以脑干胶质瘤为研究的核心和热点。临床研究方围绕提高手术安全性和精度的各种辅助技术不断发展,使得最大程度的安全切除脑干胶质瘤从理论性的指导原则变成了切实可行的实践。













