英文名称 :bradyarrhythmias
缓慢性心律失常(bradyarrhythmias)的诊断日益常见。其中最常见的病理情况是房室传导阻滞,心室率为40~50次/min。完全性心脏传导阻滞(congenital complete heart block,CHB)所致的缓慢性心律失常占所有胎儿心律失常的9%。53%以上的完全性心脏阻滞与先天性心脏病有关,预后差,存活率低于15%。但是,CHB合并结构性先天性心脏病的发生率仅为0.4%~0.9%。50%以上的心脏解剖正常的胎儿CHB通常与母体患有结缔组织病,抗体如anti-Ro(SSA)、anti-La(SSB)经胎盘转运有关。一度房室传导阻滞为P-R间期延长,在产前难以发现。二度房室阻滞表现为P-R间期进行性延长导致脱漏搏动,或P-R间期固定,房室传导比例为2∶1、3∶1或4∶1等。Ⅲ度房室传导阻滞是房室节律的完全分离,无心房搏动传导到心室。一度及二度传导阻滞一般不影响血流动力学,三度传导阻滞由于太慢的心室率可使心排血量下降而出现充血性心力衰竭。
房室传导阻滞可能是传导系统发育不良、与房室结之间无连接或房室结解剖位置异常。在胎儿及新生儿完全性房室传导阻滞中,约50%的患儿存在心脏解剖结构的异常,包括单心室、心脏肿瘤和心肌病等。还有证据表明,有些胎儿房室传导阻滞是由于母体存在某种抗核抗体,通过胎盘进入胎儿引起其传导系统炎症,继而发生传导阻滞。抗可溶性核抗原抗体(ENA):抗-Ro和抗-La抗体,被证明存在于受累的胎儿及其母亲血中。心脏结构正常的胎儿其CHB均与抗-Ro和抗-La抗体存在有关。病理生理学包括母体自身抗体抗-Ro经胎盘转运,与胎儿心脏传导系统结合导致炎症和纤维化。胎儿和新生儿身体中心脏的抗Ro抗体浓度最高。在受累婴儿的心脏组织中证实有IgG沉着。体外实验证明,抗Ro抗体选择性地与新生儿心肌组织而非成人心肌组织结合抑制复极化。
CHB胎儿的母亲几乎都存在抗Ro和抗La抗体,但仅1%~2%的抗体阳性孕妇的胎儿发生CHB,且通常发生在孕20~24周。由于大多数抗体阳性孕妇怀有正常的胎儿,因此提示CHB发生必须有一个次要因素。有人推测病毒感染可能影响抗原表达启动免疫损害。Ro与La核蛋白可能与病毒基因组形成复合物变成免疫原。有趣的是,在CHB胎儿的母亲体内发现,CMV的IgG抗体滴度增高。CHB不一定由母体抗Ro和抗La抗体引起,而可能由QT延长综合征或病毒感染所导致。
大多数CHB胎儿能较好地耐受心室率慢,并能维持到足月。但是,15%~25%的CHB胎儿发生非免疫性水肿,而胎死宫内或出生后不久死亡。非免疫性水肿是预后不良的特征,存活率仅为15%。与之相似,当CHB合并有心脏结构异常,存活率仅14%。房室瓣关闭不全同样也是胎儿心脏失代偿和非免疫性水肿的预兆。心室率慢致心室进行性扩张,导致房室瓣变形引起房室瓣关闭不全。在CHB胎羊模型,缓慢的心室率导致心室进行性的舒张期扩张使房室瓣变形,导致反流。通过心脏起搏增加心室率能立刻扭转房室瓣关闭不全。因房室瓣关闭不全导致静脉高血压和被动性肝脏充血,继而出现非免疫性水肿,导致心包积液、胸腔积液、腹水和全身水肿。
除了对母体自身抗体沉积的炎症反应导致胎儿传导系统进行性破坏外,CHB胎儿还可能出现广泛的心肌炎,抗体沉积遍布心脏,炎症反应导致进行性心肌失代偿。心内膜下弹性纤维组织增生标志着终末期心肌损害,表现为乳头肌或房室心内膜下心肌的回声改变。
胎儿期CHB并不常见,发生率大约1∶(20 000~25 000)活产。但是,许多CHB胎儿死亡,其实际发生率可能更高。
1.产前评估、监护和随访
既往无结缔组织病的孕妇如怀有CHB胎儿应进行风湿病相关问诊及检查。应详细超声检查胎儿解剖,包括脐动脉舒张期血流多普勒波形研究。应行超声心电图除外心脏结构异常,并证实房室分离、确定房室节律。此外,需注意评估心室收缩力、有无提示心内膜下纤维弹性组织增生的心肌回声增强、房室瓣关闭不全和心搏出量,作为随访评估的基线。
在妊娠晚期心室率可能进行性减慢,对心室率低于65次/min的胎儿应增加监护的频率。心率< 60次/ min时应每周2次行超声检查有无房室瓣关闭不全或非免疫性水肿的早期表现。同样地,应行连续的超声心电图检查以发现收缩力、心搏出量、心肌回声方面的细微变化和房室瓣关闭不全。脐动脉舒张期血流是随访胎盘循环阻力的有用指标。心胸比例可用于提示肺发育不良。因缺乏心率变异性,NST没有临床价值。
2.母体药物治疗
药物治疗分为减轻对胎儿心脏的免疫损害和增加心室率。一旦发现有完全性心脏传导阻滞,则现有的所有治疗方法都不能将其逆转,包括糖皮质激素、血浆置换、静脉注射免疫球蛋白(intravenous immune globulin,IVIG)及羟氯喹。二度心脏传导阻滞可能能够逆转,但即使给予治疗也可能进展为完全性心脏传导阻滞。一度心脏传导阻滞的临床意义尚不清楚。
(1)糖皮质激素治疗:
应用糖皮质激素能提高存活率,母体应用地塞米松组与未应用地塞米松组的存活率分别为90%和46%。二度传导阻滞进行糖皮质激素治疗的目标有两方面,一方面是减轻炎症,另一方面是防止发生不可逆的完全性心脏传导阻滞。因此,对于二度心脏传导阻滞胎儿的母亲,产前一旦检测到阻滞,建议在没有糖皮质激素禁忌证的情况下立即使用,每天口服地塞米松4mg或倍他米松3mg,并每周进行一次超声心动图的胎儿监测。一旦确诊完全性心脏传导阻滞,基本难以逆转,5%~20%的胎儿会在宫内死亡。二度传导阻滞可以在不治疗的情况下恢复为正常窦性心律,但并非所有患者都对治疗有应答。终止治疗的时间可以到足月。有前瞻性双盲研究6~16岁产前暴露于母体抗Ro抗体、胎心率缓慢和/或延长地塞米松治疗的免疫介导的先天性房室心脏传导阻滞(CAVB)的儿童,研究这些儿童学龄期认知和学习成绩的影响,发现智力得分、语言理解、感知推理、工作记忆和处理速度方面没有统计学差异。
(2)β-受体激动剂增加心室率:
在没有心脏结构异常的情况下,心室率> 55次/min,胎儿通常能很好地耐受这种心律失常。当胎儿心率低于55次/min时β受体激动剂可能增加心率和增强心肌功能增加每搏输出量。特布他林、利托君和异丙肾上腺素都用来尝试加速胎儿心率。这些药物没有比较性研究评估效果,且通常母体难以耐受达到有效增加胎儿心率的药物剂量。所有病例在开始β受体激动剂治疗前都应评估QT间期,防止QT延长综合征。应用心磁描记术有助于诊断QT延长综合征。
推荐对于心室率低于55次/ min或有心室功能异常证据的胎儿通过母体应用地塞米松(4~8mg/d)和β受体激动剂(利托君30~60mg/d或硫酸沙丁胺醇10mg/d)治疗。
(3)静脉注射免疫球蛋白治疗胎儿CHB。静脉应用免疫球蛋白与母体循环中的抗Ro抗体结合,增加抗体清除率,防止经胎盘转运。它同时降调抗-Ro抗体产物。但支持该干预的资料有限,目前认为不能改变新生儿结局。
3.血浆置换
血浆置换也被推荐用于发生心包积液、心脏增大、传导紊乱时减少心肌损害。但是,一旦胎儿CHB确定已无法通过血浆置换逆转。Bunyan等建议在孕20周前、抗体经胎盘转运增多之前进行血浆置换。在激素治疗之外,需每周3次血浆置换。血浆置换是基于这样的概念:血浆置换虽然不能逆转对胎儿传导系统的损害,但可消除母体抗Ro抗体和减少胎盘转运。但免疫治疗未被证明可有效预防或逆转胎儿CHB的后果。
4.胎儿宫内治疗
胎儿CHB缺乏有效的药物治疗、早产儿预后差,而为放置临时起搏器行剖宫产早产分娩其围产儿死亡率接近80%。因此一些学者尝试在宫内放置心脏起搏器。虽然在动物实验和个别患者成功开展该技术,但宫内干预仍处于试验阶段。
5.终止妊娠
胎儿CHB终止妊娠的指征包括:胎儿总体状况不佳,胎儿生长受限有终止妊娠指征,心脏功能恶化的明显征象如继之发生非免疫性水肿。CHB胎儿分娩方式尚存在争议。如胎儿因心功能不全而需终止妊娠,阴道分娩的应激可能加重血流动力学改变。此外,在CHB胎儿发现胎儿心率好转是非常困难的。一些学者报道产程中连续胎心监护和头皮血采样,宫内情况良好的CHB胎儿经阴道分娩。
当CHB胎儿达到30周,发生血流动力学异常、非免疫性水肿、心室率低于55次/min,房室瓣关闭不全或收缩力差时,推荐剖宫产终止妊娠。如CHB胎儿宫内情况良好,产时监护充分,可考虑阴道分娩。分娩需在配备有小儿心脏病专家和具备有能力放置经静脉或心内膜外起搏器的外科医生的中心进行。
6.新生儿治疗
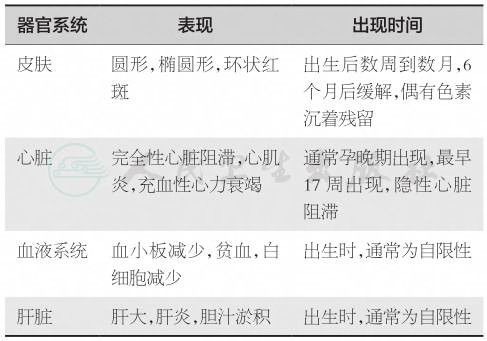
在宫内或新生儿期未诊断为结构性缺陷的情况下,所有先天性完全性心脏传导阻滞病例中,80%~95%的病例是新生儿红斑狼疮(neonatal lupus,NL)导致的。NL是一种自身免疫性疾病,自身抗体从母体被动转移至胎儿,导致胎儿和新生儿狼疮。主要表现是心脏和皮肤方面的表现。NL最严重的并发症是完全性心脏传导阻滞。诊断标准是母亲存在抗Ro/SSA抗体、抗La/ SSB抗体或可能存在抗RNP抗体,并且胎儿或新生儿出现心脏传导阻滞,或新生儿出现典型的皮疹、肝脏或血液系统表现,无法用其他原因解释。大多数NLE表现为皮肤和心脏疾病(表1)。
在产房静脉通路建立之后立即静脉滴注异丙肾上腺素。可应用糖皮质激素预防心肌损害进展。有新生儿专家采用换血来清除循环中的母体抗体,但无证据支持。心脏起搏器是确切的治疗措施。如果婴儿不稳定或是因为心脏失代偿而分娩的,需经静脉或经胸腔放置临时起搏器。早产儿无法经静脉或经胸腔放置临时起搏器,而需行左前胸切口放置临时起搏器,直到婴儿长大到可以放置永久性起搏器。如胎儿有水肿,因心脏失代偿而分娩,或心室率< 55次/ min,需立即放置心脏起搏器。如心脏阻滞持久、心脏失代偿,药物如异丙肾上腺素治疗很难阻止进一步恶化。
产前诊断为完全性CHB的治疗方案:
表1 新生儿狼疮的临床表现
(1)诊断为孤立的房室传导阻滞:
心率> 55次/min、心室功能正常,给予地塞米松4~8mg/d;心率> 55次/ min、心室功能异常,给予地塞米松4~8mg/d及β受体激动剂。
(2)孕期随访:
每周2次产科检查,每周2次胎儿超声心电图。
(3)分娩:
无不良情况的,在37周剖宫产或阴道分娩;进行性水肿的,剖宫产后立即安装心脏起搏器。
(4)新生儿重症监护处理:
心排血量低:异丙肾上腺素,起搏器;新生儿狼疮:口服泼尼松;心内膜纤维弹性组织增生:静脉滴注免疫球蛋白。
无已知的发生胎儿CHB的遗传因素。有NL患儿的妇女再显风险率最高。再次妊娠出现同样的NLE的表现。有自身免疫性疾病和抗Ro抗体的妇女是第二类高危人群。在无抗Ro抗体的SLE孕妇,NLE的发生率仅为0. 6%。有抗Ro抗体占NLE患者的50%,在胎儿或新生儿出现症状之前很难鉴别。胎儿的兄姐有心脏性NL病史,羟氯喹预防性治疗一天1次,400mg孕期6~10周时开始使用可以降低胎儿发展为心脏性NL的风险。不推荐使用糖皮质激素进行预防治疗,即使既往分娩过NL新生儿,药物暴露的风险超过不确定的潜在收益。













