英文名称 :Peutz-Jeghers syndrome
1895年Connor首次报道了一对孪生子有黏膜黑色斑沉着。后期对这对孪生子的随访中发现1例于20岁时死于肠套叠,另外1例于52岁时死于乳腺癌。1896年Hutchinson详细了描述口唇色素沉着的表现。1919年Weber报道1例口腔黏膜色素沉着的病例,并进行了疾病鉴别诊断的分析,发现口腔黏膜色素沉着是一类进行性进展的疾病,与艾迪生(Addison)病无关,与种族有关,但在该篇文章中并未能明确归类或提出可能疾病。
1921年Peutz报道了7例以口唇黏膜色素沉着、小肠息肉为特点的荷兰家系患者,这也是较早地较完整地“一窥”波伊茨-耶格综合征的文献。1949年Jeghers等人在Peutz、Touraine、Couder等人发表的10例报道基础上,进行了随访、回顾分析,总结了该类疾病具有遗传性、皮肤黏膜色素沉着、肠道息肉的特点,还提到了黏膜色素沉着的病理表现:表皮色素颗粒沉着。文章提出,应该用一个“综合征”来命名这一类包括两个特点的疾病:①口腔黏膜、唇、颊部、面部和指(趾)黏膜黑斑沉着,其中口唇黏膜黑斑沉着是主要特征;②小肠多发息肉或乳头状瘤,胃、结肠、直肠可能受累,其中小肠息肉是主要特征。
1954年以Peutz和Jeghers为名,首次提出以波伊茨-耶格综合征(Peutz-Jeghers syndrome,PJS)(OMIM #175200)命名这一类疾病。而1957年Horrilleno和同事首次报道了消化道息肉是错构瘤的病理特点,这个病理的描述也标志着PJS与其他胃肠道息肉综合征是不同的疾病。1998年发现PJS特异性突变基因——丝氨酸-苏氨酸激酶11(serine threonine kinase 11,STK11),这为PJS发病机制和基因诊断的探究都奠定了基础。
该疾病于2018年5月被我国国家卫生健康委员会等五部门联合制定的《第一批罕见病目录》收录。目前PJS即黑斑息肉综合征公认的定义,是一种罕见的以口唇黏膜、四肢末端皮肤色素沉着和全胃肠道多发息肉为特征的遗传性疾病,最常见的遗传方式为常染色体显性遗传,伴随以胃肠道癌症为主的癌症易感倾向。
该病是常染色体显性遗传病,50%的患者伴有家族史,无家族史患者可能由基因新生突变所致。分子遗传学研究显示PJS发病主要由STK11基因突变引起,包括杂合性缺失、移码突变或无意义突变等。高达94%患者可检测到STK11基因突变,该基因定位于染色体19p13.3,编码丝氨酸-苏氨酸激酶11/肝激酶B1(STK11/LKB1)。研究显示,该基因的突变与本病的癌症易感倾向有关。其他相关致病基因主要包括19q13.4区域可能基因、α干扰素诱导跨膜蛋白(interferon induced transmembrane protein 1,IFITM1)基因及Brahma相关基因(Brahma-related gene 1,Brg1)等,但相关研究较少,且不同基因突变之间的关联也尚不明确。
(一)实验室检查
本病无特异性实验室检查指标。部分患者因为消化道出血可发生缺铁性贫血。如果合并癌变,可伴有肿瘤标志物升高。
(二)基因检测
多数患者可发现STK11失活突变,其他相关致病基因主要包括19q13.4区域可能基因、IFITM1基因及Brg1基因等。
(三)内镜检查
PJS患者好发胃肠道息肉,小肠最为常见,胃、结肠次之。故对此类患者在基线筛查和随访时均需定期进行内镜检查,如胃镜、结肠镜、胶囊内镜或小肠镜检查。以往小肠是消化道内镜检查的盲区,但近来随着小肠镜的开展,息肉检出率较前改善。此外,胶囊内镜对息肉检出率也较高,但因PJS患者息肉多发,有胶囊内镜滞留风险,需要谨慎评估检查风险。
(四)影像学检查
影像学也可以帮助消化道息肉的检出,主要包括全消化道钡剂造影、小肠CT成像、磁共振小肠造影等。由于小肠内镜检查存在一定的技术要求和风险,故小肠无创影像技术对小肠息肉的诊断有较大意义,且具有无创性、患者耐受较好的优点。研究比较胶囊内镜与磁共振小肠造影对PJS中胃肠道息肉检出效能,显示磁共振小肠造影有更高的阳性预测值。
(五)病理检查
黏膜、皮肤色素斑为真皮基底内黑素细胞数量增加,黑素沉着。胃肠道息肉病理多表现为错构瘤型,少数表现为腺瘤、炎性息肉等,或同时存在多种息肉类型。
PJS的诊断主要依据家族史、皮肤黏膜色素沉着和内镜/影像学发现息肉证据。其公认的诊断标准是2007年欧洲共识,符合以下任意一条标准即可诊断:①两处或以上经组织学检查证实的Peutz-Jeghers息肉;②发现某一个体有任意数量的Peutz-Jeghers息肉,且其近亲中有PJS家族史;③发现某一个体有特征性皮肤黏膜色素沉着,且其近亲中有PJS家族史;④有特征性皮肤黏膜色素沉着的个体出现任意数量的Peutz-Jeghers息肉。对于符合上述临床诊断标准的个体,应进行基因检测确定是否出现STK11基因突变。对于没有基因突变的家族,也不能排除PJS的诊断。
PJS尚无有效的根治方法,其主要治疗目标为缓解症状、提高生活质量、避免严重并发症。主要治疗手段包括胃肠道息肉处理和随访,癌症筛查和处理等,其皮肤黏膜色素沉着一般不予处理。PJS癌变风险较高,且胃肠道息肉导致肠套叠、肠梗阻、消化道出血等并发症,从而影响生命质量和增加病死率,故需要定期监测、规律随诊、及时对症处理。
(一)胃肠道息肉处理
胃肠道息肉是本病诊治的重点和难点,尤其是小肠息肉容易引起肠套叠、肠梗阻、消化道出血等严重并发症。其主要治疗方式包括内镜治疗和手术治疗,以往曾认为手术治疗是本病的主要治疗方式,但围手术期并发症及短肠综合征的风险限制了该技术的应用,故内镜治疗技术的革新对本病息肉处理较为重要。
1.内镜治疗
对于直径小于0.5cm息肉可随诊观察,每隔1~2年随访。直径0.5cm以上、符合内镜切除指征者,可考虑胃镜、结肠镜和/或小肠镜下切除治疗。气囊辅助小肠镜技术是目前PJS小肠息肉的主要治疗手段,对于小肠息肉的治疗安全性、有效性较好。但需注意内镜治疗切除息肉相关并发症,如出血、穿孔等,对于每次内镜下切除的数目、范围和适应证需要谨慎评估。
2.手术治疗
对于不能进行内镜治疗的较大息肉者、并发肠套叠和肠梗阻等以及结肠和直肠内息肉较大且密集丛生无法逐个摘除者,也可考虑行外科手术治疗。手术方式包括肠段切开息肉摘除术,对于息肉数量较多的肠段可行部分肠段切除术,也可行术中内镜下息肉切除术。但因为手术治疗存在创伤和术后并发症的风险,如短肠综合征等,限制了其应用。
(二)癌症处理
PJS患者为癌症高危人群,包括胃肠道肿瘤、生殖系统肿瘤等。合并癌症者,建议按照相应癌症诊疗指南综合治疗。
1.癌症筛查
PJS患者患癌风险较高,故对于其定期随访和筛查有利于干预治疗及发现潜在的恶变。在小肠息肉的筛查中,小肠CT成像(CTE)、小肠MR成像(MRE)、胶囊内镜和小肠造影都有一定的准确性,其中胶囊内镜可行性、安全性、敏感性高,且可以观察整个小肠,可以早期诊断,尽量避免出现肠梗阻等并发症后再发现疾病。筛查时间各部位不一(表1),建议筛查范围包括消化道、胰腺、甲状腺、子宫、卵巢、睾丸、乳腺等。建议对无临床症状的PJS儿童于8岁左右开始第一次消化道息肉筛查,对于存在息肉者,此后可考虑每年行内镜检查,并预防性切除直径大于0.5cm息肉,以期减少相关并发症的发生。对于有间断腹痛、便血等息肉相关临床症状的PJS患者,建议立即进行诊治。
2.癌症处理
建议按照相应癌症诊疗指南综合治疗。
表1 PJS患者癌症筛查表
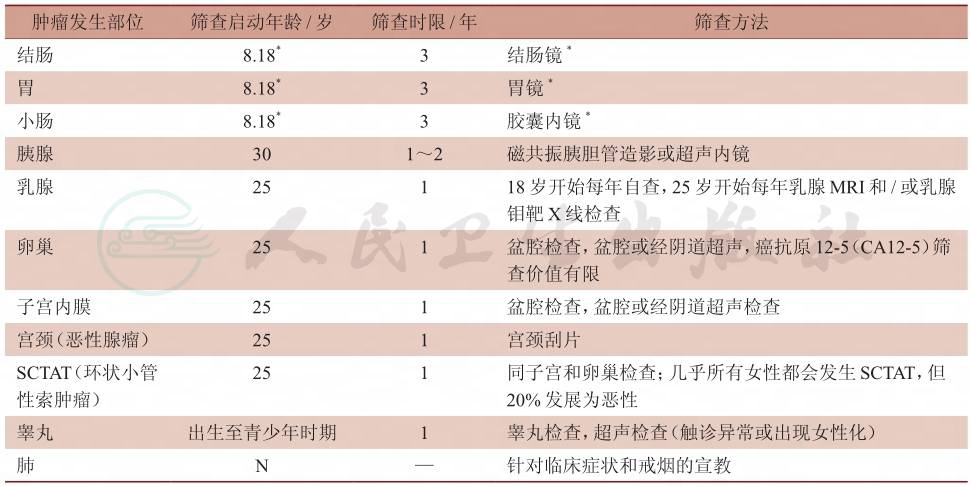
*筛查启动年龄是8岁,如果筛查发现息肉,则每3年重复检查;如果筛查无息肉,则18岁时重复检查,之后每3年检查1次;建议根据临床症状可考虑提早筛查间隔;N:无共识意见
PJS的药物治疗手段逐渐崭露头角,环氧合酶-2和mTOR信号通路均被认为参与PJS的发生,可能成为潜在治疗靶点。有小规模临床研究和动物模型报道了选择性环氧合酶-2抑制剂和mTOR抑制剂对PJS的治疗效果,但仍需大规模临床研究证实。此外,作为常染色体显性遗传疾病,基因治疗也被认为对本病有效,但目前尚无临床应用研究报道。这些都将是未来研发的重点。













