英文名称 :mitochondrial disease
线粒体病(mitochondrial disease)是一组由于遗传缺陷引起线粒体三磷酸腺苷(ATP)合成障碍而导致的复杂的异质性疾病,它主要累及能量代谢系统,发病率大约1∶5000。线粒体病的临床表型复杂多变,发病年龄大小不一,直到今天,它的诊断仍然十分困难。线粒体功能蛋白由线粒体基因组(mtDNA)和核基因组(nDNA)双重编码,涉及基因1000多条。目前线粒体病尚无特效治疗方法,本章对线粒体病的发生、临床、诊断、治疗和预防做一简要的介绍,有助于我们更好地理解线粒体病。
线粒体病患者的主要临床特点是氧化磷酸化功能缺陷和由此引发的一系列复杂多样的临床表现。线粒体病是一种“年轻”的疾病,从发现至今仅仅50年的时间,然而人们对它的认识却是突飞猛进的。
随着研究的深入,医生也面临着巨大的挑战。其一就是线粒体病患者复杂多变的临床表型。线粒体病既可以同时累及多个组织器官表现为各种综合征,如线粒体脑肌病伴高乳酸血症和卒中样发作(mitochondrial encephalomyopathy with lactic acidosis and stroke-like episode,MELAS)(OMIM #540000)、肌阵挛癫痫伴破碎红纤维综合征(myoclonic epilepsy with ragged red fibre,MERRF)(OMIM #545000)、Leigh综合征(Leigh syndrome,LS)(OMIM #256000)等。也可仅以累及单一器官为主,表现类似某些常见病,如糖尿病、心肌病或脑卒中等。其二是线粒体病的发病年龄不一,新生儿期、儿童期和成年期都可以发病。
线粒体病的临床表现可以发生在人体除了红细胞外的各个器官,但是由于线粒体主要为人体提供能量ATP,因此症状最常出现于能量需求较大的器官,例如脑、骨骼肌和心脏。由于多个基因与线粒体病有关,而每个基因又会引起不同的临床症状,因此在线粒体病中基因型与表型的关系非常薄弱。例如在儿童最常见线粒体病Leigh综合征,目前发现80多个基因上不同的变异可引起该病。因此与之相关的线粒体病的诊断标准并不统一,多根据患者的临床表型结合实验室检查和影像学资料并排除其他疾病之后综合判定。
一、线粒体病的分类
线粒体病有多种分类方法,目前最常用的分类方法有两种,一是根据疾病的临床表现分类;二是根据引起线粒体病的变异基因的不同分类。
(一)根据疾病的临床表现分类
线粒体病根据其临床表现可以分为三大类。
1.线粒体肌病(mitochondrial myopathy)
病变以侵犯骨骼肌为主。临床特征为骨骼肌极度不能耐受疲劳,轻度活动即感疲乏,常伴肌肉酸痛及压痛,肌萎缩少见。
2.线粒体脑病(mitochondrial encephalopathy)
病变以侵犯中枢神经系统为主。主要包括Leber视神经萎缩(Leber optic atrophy)(OMIM#535000)、Leigh综合征、线粒体DNA耗竭综合征4A型(Alpers型)[mitochondrial DNA depletion sydrome 4A(Alpers type),MTDPS4A(OMIM#203700)]等综合征。
3.线粒体脑肌病(mitochondrial encephalomyopathy)
病变除侵犯骨骼肌外,尚侵犯中枢神经系统。主要包括MELAS、MERRF和卡恩斯-塞尔综合征(Kearns-Sayre syndrome,KSS)(OMIM #530000)等综合征。
(二)根据引起线粒体病的变异基因的不同分类
根据引起线粒体病突变基因的不同可以分为三大类。
1.mtDNA突变引起的线粒体病
包括mtDNA上的点突变和缺失。
2.nuclear DNA突变引起的线粒体病
由于呼吸链是由mtDNA和nuclear DNA共同编码的,因此mtDNA和nuclear DNA突变均可致病,大约70%~75%的原发性线粒体病是核基因突变所引起。这些核基因包括参与组成五个复合酶体的结构基因,复合酶体组装过程中的辅助蛋白质、转运这些蛋白质跨越线粒体内外膜的转运蛋白以及和氧化磷酸化偶合相关的蛋白质等。
3.核基因组与mtDNA间信息交流缺陷而造成的线粒体病
两个基因组之间的信息交流对于线粒体的数目和mtDNA的复制和修复有直接的调控作用,可以影响mtDNA的拷贝数,从而引起相应的临床症状。
二、特殊的线粒体综合征
1.MELAS
MELAS是一种累及多器官系统的疾病,临床表现复杂多样,反复发作。平均发病年龄10岁,一般在2岁到40岁之间,大多数患者早期发育正常。后来出现发作性头痛、呕吐,偏瘫、偏盲、偏身感觉障碍等脑卒中样发作,多伴有身材矮小、智力减退、神经性耳聋。血乳酸增高,脑脊液多正常。头颅CT或MRI显示分布在顶叶、颞叶及枕叶的多发性脑梗死,但是病灶与脑部血供分布不一致,另外还可伴有基底节钙化、脑萎缩、脑室扩大等;MRS可见病灶区典型的乳酸盐峰,N-乙酰天门冬氨酸盐/肌酸值正常或略降低,肌活检可见破碎红纤维(RRF)。现已报道了31个MELAS综合征相关的mtDNA突变,超过80%的MELAS患者携带有mtDNA m.3243A>G突变。该突变位于线粒体编码的tRNA亮氨酸1(mitochondrially encoded tRNA leucine 1,MTTL1)基因,影响tRNALeu的立体构象,从而干扰tRNALeu的氨酰化、加工、转录后修饰以及蛋白质的合成。其他致病突变还包括MTTL1基因m.3271T>C,线粒体编码的tRNA缬氨酸(mitochondrially encoded tRNA valine,MTTV)基因m.1642G>A突变,线粒体编码的细胞色素C氧化酶Ⅲ(mitochondrially encoded cytochrome coxidase Ⅲ,MTCO3)基因m.9957T>C和线粒体编码的NADH脱氢酶5(mitochondrially encoded NADH dehydrogenase 5,MTND5)基因上m.12779A>G、m.13045A>C、m.13513G>A和m.13514A>G等。
2.MERRF
MERRF是一种进行性神经退行性疾病,中枢神经系统出现选择性的神经细胞变性、胶质细胞增生和神经传导通路脱髓鞘。多见于儿童,几乎所有患者的首发症状为肌阵挛。肌阵挛、癫痫和肌肉活检有RRF为本病的三大特征。此外常见症状还包括肌病,中枢神经系统症状,大脑共济失调,视神经萎缩,听力下降。非神经系统症状可出现心动过速和脂肪瘤。血乳酸可增高,脑脊液多正常。MRI主要表现为大脑和小脑萎缩。MERRF已报道的突变有8个位点,包括m.611G>A、m.3255G>A、m.8296A>G、m.8344A>G、m.8356T>C、m.8361G>A、m.8363G>A和m.12147G>A,其中最常见的致病突变为MTTK基因上的m.8344A > G。高突变比例的m.8344A>G可使线粒体内的蛋白质合成下降,赖氨酸含量高的蛋白质尤为明显,线粒体耗氧量和呼吸链的功能均下降。有时可能出现MERRF与MELAS表型并存,形成了MERRF和MELAS重叠综合征。
3.Leigh综合征
Leigh综合征是一种进行性神经退行性疾病,病变的主要特征为脑干,间脑或基底节区出现局部双侧对称性海绵样损害。Leigh综合征的平均发病年龄为1.5岁,可分为婴儿型和迟发型,大部分患者为婴儿型,表现为精神运动发育迟缓、肌张力低下、共济失调、不自主运动、呼吸节律异常及惊厥、喂养困难等。病情进展快,多在发病几年内死亡。脑脊液和血乳酸高,脑脊液更明显。肌肉活检正常。MRI检查表现为对称性的纹状体以及脑干出现长T1和T2信号的病灶。15%~20%的Leigh综合征是由mtDNA突变引起的,常见的突变点有m.8993T>C/G、m.10158C>T和m.10191T>C;80%左右的Leigh综合征是由核基因突变所致,最常见的基因是SURF1。
4.Leber视神经萎缩
Leber视神经萎缩是最常见mtDNA突变导致的线粒体病,发病率大约为11.82/100 000。突变为器官特异性疾病,主要侵袭视网膜胶质层细胞,临床上呈急性或亚急性起病,患者年龄范围为5~80岁,青中年多发,其中80%~90%为男性。临床表现为双眼同时或先后相继受累,病变主要累及视盘黄斑束纤维。初期常表现为视盘炎、眼底呈以缺血为主的视神经变性导致视神经退行性变、急性或亚急性中心视力下降等,常伴有色觉障碍并伴发周围神经的退化、心脏传导阻滞和多发性硬化等症状。95%的患者是由mtDNA上的m.11778G>A、m.3460G>A和m.14484T>C引起的,这三个突变分别位于MTND4、MTND1和MTND6基因上。其中m.11778G>A最常见,占56%;其次是m.3460G>A,占31%;最后是m.14484T>C,占6.3%。除了上述三个主要突变,还有次要突变位点和单倍体型,它们影响主要突变的表达,从而影响疾病的表型。例如m.14484T>C突变位点出现于线粒体J单倍体型时,Leber视神经萎缩的发病率提高了8倍;mtDNA次级突变m.4216T>C和m.13708G>A等突变也会使m.11778G>A和m.14484T>C突变患者的Leber视神经萎缩的发病风险增加。
5.慢性进行性眼外肌麻痹(chronic progressive external ophthalmoplegia,CPEO)和卡恩斯-塞尔综合征(Kearns-Sayre syndrome,KSS)
CPEO是成人中常见的线粒体疾病之一。其特点为进展性眼肌麻痹导致上睑下垂和眼运动障碍。上睑下垂常为首发症状,可以单侧出现继而累及双侧。任何年龄均可发病,多在20岁以前。可伴有四肢近端肌无力。虽然在某些患者中检测到了mtDNA的点突变(m.3243A>G,m.12316G>A),但是最常见的还是大片段缺失突变。
KSS是一种散发性的线粒体病,也主要在20岁以前发病,当患者具有眼外肌瘫痪、视网膜色素变性和心脏传导阻滞时,称为完全型KSS;当患者仅有眼外肌瘫痪或伴有其他一项时,称为不全型KSS。患者也常常表现为其他神经系统症状,如大脑共济失调、认知受损和耳聋,非神经系统症状包括心肌病、完全传导阻滞、身材矮小、内分泌系统疾病和吞咽困难。实验室检查可发现乳酸血症;头CT显示基底节钙化(5%),MRI检查表现为脑萎缩和双侧皮质下白质广泛的长T2信号,脑干、苍白球、丘脑和小脑高信号损害;肌肉病理检查发现RRF(98%);眼底检查可见椒盐状改变但视野正常。也有学者将20岁前发病、伴视网膜色素变性的CPEO称为KSS,认为KSS是CPEO较为严重的一型。还有学者认为KSS至少具有下列三个特征的一个:①心脏传导阻滞;②脑脊液蛋白超过100mg/dl;③小脑共济失调。
大部分KSS和CPEO与mtDNA的单一大片段缺失(2~8kb)有关,占80%。常见缺失从8482到13 459,共4977bp,在缺失的两端还有13bp的同向重复。其次有些患者在10 204~13 761或10 208~13 765出现3558bp缺失。缺失常常出现在重或轻链复制的启动子、12S或16S rRNA基因、重链复制的开始部位。部分与点突变有关。目前已报道的点突变超过十余种,常见的突变包括m.3254C>T、m.4274T>C、m.5703G>A和m.12315G>A。
6.Pearson综合征(Pearson marrow-pancreas syndrome)(OMIM #557000)
这是一种罕见的婴儿期疾病,以铁粒幼细胞贫血和胰腺外分泌失常为特点,患儿常早期死亡。存活下来的患儿血液系统症状有所改善,但开始表现为KSS症状。这些患儿的所有组织中往往携带有mtDNA大片段缺失且突变率较高。
7.视网膜色素变性共济失调性周围神经病(neuropathy,ataxia,and retinitis pigmentosa,NARP)(OMIM #551500)
发病年龄从青少年期到成年早期,临床特点为感觉性周围神经病、视网膜色素变性和小脑共济失调,这三大临床表现有时不全部出现,其他症状还包括发育落后、痴呆、惊厥、近端肢体无力。血乳酸水平正常;肌活检一般无RRF。该综合征已在多个家系中报道且与线粒体编码的ATP合成酶6(mitochondrially encoded ATP synthase 6,MTATP6)基因的m.8993T>G突变相关。患者的遗传异质性决定了临床症状的严重性:女性携带者或症状较轻的女患者突变率<70%;突变率为70%~90%时,表现为NARP;突变率> 90%时,表现为Leigh综合征。因此,常可见到NARP和Leigh综合征在同一家系中并存。
一、线粒体的结构
线粒体是双重膜细胞器,分为外膜、内膜、膜间隙和基质腔。外膜是一层平滑而连续的膜,它是线粒体的边界膜;内膜向线粒体内室弯曲突出形成嵴,含有呼吸链酶复合体和ATP合成酶复合体等蛋白质。基质是充满内室的液态物质,内含数百种酶,包括丙酮酸与脂肪酸氧化的酶、三羧酸循环全部的酶等。
不同种类组织中的线粒体数量主要由该组织对能量依赖程度决定。由于神经元、心肌细胞和骨骼肌细胞对于能量变化最为敏感、依赖程度最大,因此它们中的线粒体数量最多。线粒体拥有自己的遗传物质,即线粒体DNA(mtDNA),每个细胞通常具有一百至数百个线粒体,而每个线粒体内又含有2~10个拷贝的mtDNA,因此每个细胞可具有数千个mtDNA。
人类的mtDNA是闭环双链DNA,长度大约16 569bp,mtDNA非常紧凑,没有内含子。在mtDNA中包含13个蛋白编码基因、22个tRNA基因和2个rRNA基因(16S rRNA和12S rRNA)。13种蛋白质组成呼吸链与ATP酶复合体,具体编码复合体Ⅰ的7个亚单位:ND1、ND2、ND3、ND4、ND4L、ND5和ND6;复合体Ⅲ的1个亚单位:CYB;复合体Ⅳ的3个亚单位:COⅠ、COⅡ和COⅢ;复合体Ⅴ的2个亚单位:ATP酶6和ATP酶8(图1)。虽然线粒体拥有自己的蛋白质合成系统,但是mtDNA自身复制、修复、转录和翻译需要的酶仍然完全依赖于核基因。
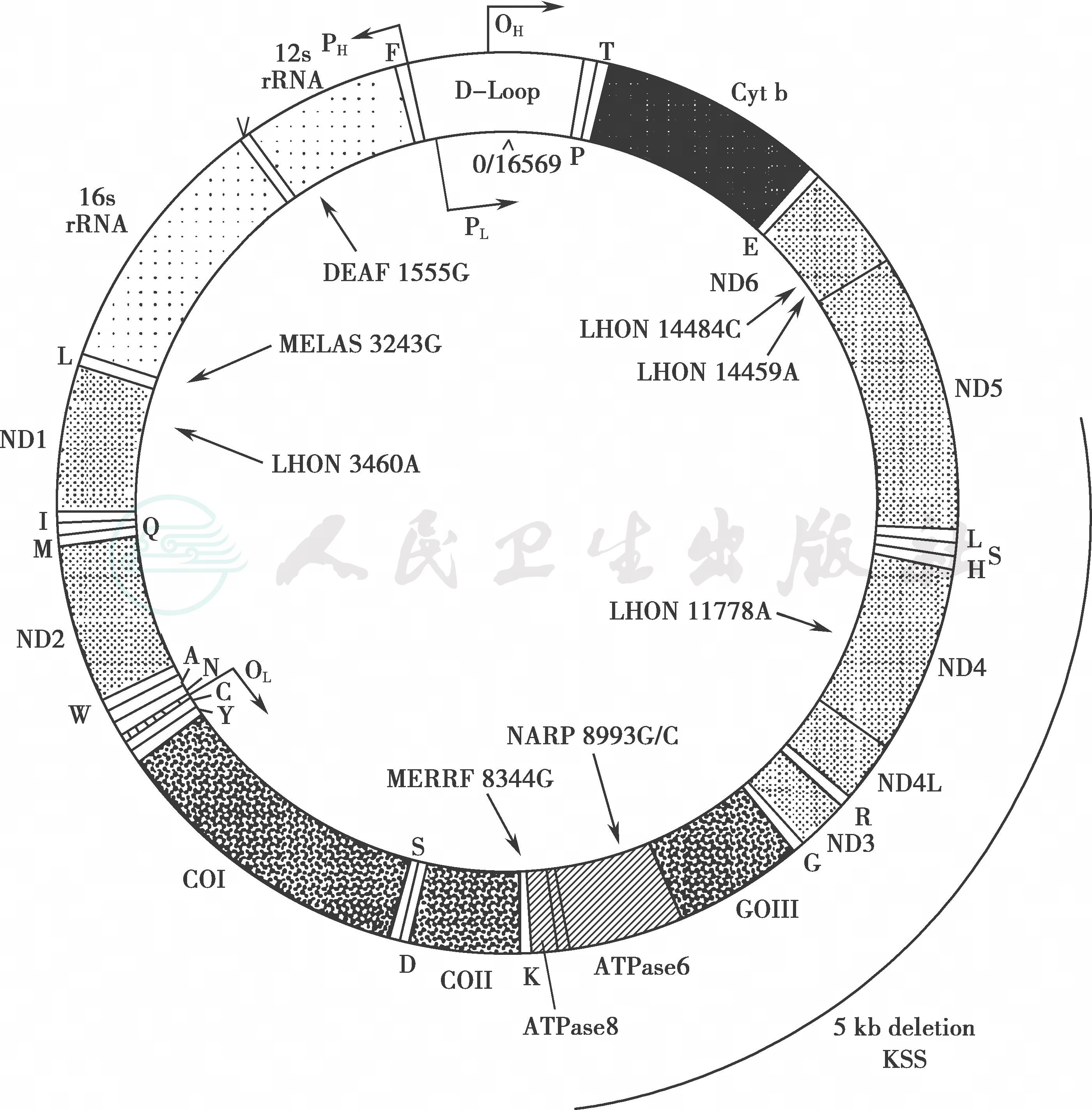
图1 人类线粒体DNA的结构示意图
图片源自https://www.mitomap.org/MITOMAP
线粒体的功能是由双重遗传系统控制的,即线粒体基因组和核基因组。核基因变异是线粒体病最常见的病因,自1995年第一个核基因SDHA变异被发现以来,目前认为有1 000多条基因与线粒体病相关,但是其中只有150多条基因编码线粒体呼吸链酶复合物而直接影响氧化磷酸化和ATP的产生。而其他的基因则与线粒体的功能间接相关,包括与线粒体呼吸链酶复合物装配相关的基因、保持线粒体DNA稳态和表达的基因及线粒体动力学相关的基因。这些核基因编码的线粒体相关蛋白由细胞质中的核糖体翻译后通过内膜转运酶/外膜转运酶(TIM/TOM)系统转运至线粒体。
二、线粒体DNA的传递
mtDNA是通过母系遗传方式遗传的。到目前为止,有1例报道证实父亲将位于mtDNA复合物Ⅰ基因上的一个2bp的缺失传递给了下一代,但在散发的线粒体肌病患者中未发现父系的线粒体。也有研究认为,当父亲还存在其他的变异可使父系线粒体复制时,这些父系mtDNA就能够保留在合子中,最终在成熟个体中存活下来,这种mtDNA遗传方式称父系渗漏(paternal leakage),但是这是极为少见的。因此,即使父系遗传存在,在遗传咨询中,mtDNA的母系遗传还是被普遍接受的。
三、线粒体DNA的同质性和异质性
每个细胞中可能有上千个mtDNA分子,在大多数情况下,它们的序列都是一致的,我们称为mtDNA同质性(mtDNA homoplasmy)。但是当细胞发生mtDNA变异时,细胞中野生型mtDNA和变异型mtDNA以某种比例共存称为mtDNA异质性(mtDNA heteroplasmy)。mtDNA异质性这个概念对于理解变异mtDNA和线粒体病患者临床表现多样性的关系非常重要。
线粒体在细胞有丝分裂过程中以随机分配的方式进入子代细胞,母体变异的mtDNA随机分配进入子细胞后,变异的mtDNA在子细胞的线粒体中所占的百分比会发生改变。卵母细胞中有150 000个mtDNA,在卵子细胞形成时仅有少量的mtDNA(大约100个),这种mtDNA锐减的过程称为遗传瓶颈。它是造成不同组织、不同细胞变异mtDNA所占比例不同的主要原因。
四、线粒体的功能
线粒体参与多个细胞的生物学过程,其中最主要的是通过氧化磷酸化产生细胞需要的能量ATP。这个过程需要5个酶复合物,这些酶复合物又是由多个亚单位组成的。其中复合物Ⅰ、Ⅲ、Ⅳ和Ⅴ是由核基因和线粒体基因共同编码的,而复合物Ⅱ是由核基因编码的。
五、线粒体DNA的变异
mtDNA上的变异非常多,mtDNA的变异率一般为nuclear DNA的10倍。其原因主要是:①mtDNA所处的环境,线粒体产生能量的同时也产生大量的高超氧化物,使mtDNA更易受到损伤。②虽然mtDNA存在修复机制,但是非常有限。由于缺乏类似nDNA具有的多种DNA损伤修复机制,mtDNA发生损伤后难以修复。③mtDNA缺乏像nDNA与组蛋白的结合而形成的保护,也使得mtDNA易被损伤。
mtDNA上的这些变异一部分是多态位点,另一部分是致病的变异。线粒体DNA的致病变异种类繁多,包括mtDNA缺失和点突变。缺失可以发生在mtDNA环的任何部位,缺失大小从一个碱基到几千个碱基。最常见的缺失是大于5kb的缺失,跨越细胞色素b基因和编码细胞色素氧化酶Ⅱ亚基的基因,包括tRNA基因和编码蛋白的基因。缺失在人群中的发生率大约为1.2/100 000。缺失是以异质性的形式存在的,不同组织中缺失的mtDNA分子比例不一致,而且会随着时间变化而变化。
1988年Wallace首次报道线粒体DNA突变可以引起线粒体病,目前已经发现了300多种与线粒体病相关的mtDNA的点突变。根据突变的性质可以分为同义突变、错义突变和无义突变等。根据突变所在的基因和功能可以分为蛋白质编码基因的突变和影响线粒体中蛋白质合成的突变,前者是在线粒体13个蛋白质编码基因中的突变,突变大多为错义突变和无义突变;后者是发生在tRNA基因和rRNA基因上,改变其序列的突变,它们并不直接影响蛋白中氨基酸的构成,但是会影响线粒体内蛋白质的合成效率、降解速率以及蛋白质的修饰和加工,从而使线粒体呼吸链中的酶复合物功能受损,引起临床症状。
六、线粒体DNA突变的致病机制
mtDNA突变引起的临床症状十分复杂,同一家系中携带同一突变的患者临床症状也不相同,有的致死,有的却没有任何的临床症状,目前机制尚未完全清楚,据研究主要与下列因素相关。
1.突变异质性
即突变的mtDNA和正常的mtDNA共存于细胞。衡量mtDNA突变异质性程度的重要指标之一是突变比例,突变比例指发生突变的mtDNA占全体mtDNA的百分比。突变比例往往决定mtDNA疾病发生及其临床表型。
2.突变阈值效应
突变型与野生型mtDNA的比例以及该种组织对线粒体ATP供应的依赖程度决定了其是否发病;突变mtDNA需要达到一定比例,才足以引起组织器官功能改变,即阈值效应。当异质性mtDNA的突变负荷较低时,突变型mtDNA的作用可能被掩盖,由野生型mtDNA发挥补偿作用。
3.遗传背景的影响
遗传背景的影响一直受到关注,核基因的修饰以及mtDNA单倍体型和mtDNA复合突变的作用使同样的突变在不同个体中的发病与否、病情的轻重有所差别。遗传背景在疾病的发生过程中所起的作用,既有促进疾病的发生作用,也有抑制疾病的发生作用。
4.环境因素的影响
包括药物、营养条件、感染等都会对临床表型产生影响。
尽管已进行了数年的临床试验,目前为止仍无特异性的治疗手段,临床上一般采用药物或支持性疗法来缓解症状和减缓疾病的进展。但是随着基因诊断技术的发展,越来越多的线粒体病突变被发现,针对突变,精准治疗可以得到实现,近来已取得一些进展。另外,基因诊断还提高了诊断速度,使线粒体病患者获得早期治疗的机会,提高了治疗效果。目前的治疗包括对症治疗、药物治疗和基因治疗。
(一)对症治疗
由于线粒体病目前尚缺乏有效的治疗,所以对症治疗对患者更重要。感染或精神刺激均可以导致能量消耗的增加而诱发疾病,所以应当防止感染的发生;有一些药物可以导致线粒体或能量代谢的异常,应当防止应用,例如丙戊酸钠的肝脏副作用明显,线粒体病患者慎用。癫痫的控制、血糖的控制、酸中毒的治疗、心脏损害的处理、胃肠症状的处理、肺部感染的控制等对于患者均可能是挽救生命的治疗。还有一些改善生活质量的治疗,如眼外肌麻痹患者的整形手术,听力丧失患者的助听器配置或耳蜗植入术等。
(二)药物治疗
大多数的药物还在研发和实验中,根据其作用机制主要分为维生素和辅助因子、抗氧化剂、补充还原当量以恢复氧化还原平衡、稳定线粒体膜和刺激线粒体生物合成等,目前临床应用较多的是维生素、辅助因子和抗氧化剂。由于线粒体疾病最根本的缺陷在于ATP产生不足,所以改善能量代谢的维生素、辅助因子、ATP和抗氧化剂都有助于症状的缓解。目前比较推荐的就是“鸡尾酒疗法”,包括大剂量ATP、辅酶Q10、肉碱、B族维生素、维生素C、维生素E以及肌酸。另外,辅酶Q10的类似物还原型辅酶Q10(ubiquinol)和艾地苯醌(idebenone)也被用于临床,其中艾地苯醌已经在美国批准用于治疗Leber视神经萎缩。
有几种特殊的线粒体病对于特异性药物的反应非常好,包括辅酶Q10合成障碍、核黄素(维生素B2)转运和代谢障碍、硫胺素(维生素B1)和生酮饮食反应型丙酮酸脱氢酶复合物缺陷和由于编码硫胺素转运蛋白的SLC19A3[溶质载体家族(solute carrier family,SLC)]基因突变引起的生物素-硫胺素反应性基底节病。
(三)基因治疗
基因治疗还处于探索阶段,根据线粒体的病因分为针对线粒体DNA和核DNA两部分。线粒体基因组的高拷贝数、线粒体突变的异质性以及独立的密码子,都使线粒体病的基因治疗非常困难。针对mtDNA突变的基因治疗大致存在3种途径。①异位表达野生型mtDNA:将野生型mtDNA的功能基因导入细胞核内,核内表达的产物进入线粒体替代缺陷的功能;例如重组腺相关病毒ND4(rAAV2-ND4)治疗Leber视神经萎缩,重组载体包括一段用于核基因编码线粒体蛋白的序列和线粒体目标序列,这种方法在动物模型和人临床试验中都获得很好的效果,目前已进入Ⅲ期临床试验。②降低mtDNA突变率:通过各种方法使线粒体内突变mtDNA降解或停止复制,同时促使野生型mtDNA拷贝数上调。③直接纠正mtDNA的突变:将野生型DNA转染入线粒体内,弥补或纠正突变型mtDNA的缺陷。由于RNA很难转运至线粒体,因此目前认可的成簇规律间隔短回文重复序列编辑系统(CRISPR-Cas9)并不适用于线粒体DNA的基因治疗。
针对核DNA的基因治疗也在研发当中,主要原则是利用载体向细胞转入正常的基因,表达相应的蛋白,目前尚在动物实验阶段。对于NDUFS4基因缺陷导致的Leigh综合征,基因敲除小鼠的治疗取得了很好的效果,但是线粒体涉及的基因太多,对于每个基因的精准治疗是非常困难的。
线粒体病的发病率远比我们想象的高,流行病学研究显示,线粒体病在人群中最小发病风险为1/5000,是造成儿童神经代谢病和遗传性神经系统疾病的主要原因。线粒体病为进展性病程,目前仍不可治愈,因此预防非常重要。
一、线粒体病的遗传咨询
由于线粒体病的遗传病理机制复杂,几乎包括了所有的遗传类型。如果没有通过分子诊断找到突变,仅能给出初步的遗传咨询,不能进行产前诊断。如果分子诊断检测发现突变基因和突变位点,就能够给出相应的针对性的遗传咨询。相对来说,对于检测到nuclear DNA突变的线粒体病患者的遗传咨询较为简单,与其他单基因病的遗传咨询和诊断没有区别。例如常染色体隐性遗传,患儿父母为携带者,再育患儿风险为25%,可再孕后实施产前诊断。而对于mtDNA突变引起的线粒体病呈母系遗传,突变女性的后代有发病风险。但是由于线粒体基因突变的异质性、突变传递的可变性以及临床表现的多样性,其遗传咨询和产前诊断十分困难,下面我们主要针对线粒体基因突变引起的线粒体病进行介绍。
mtDNA突变类型不同,传递风险也不同,例如线粒体缺失突变通常是自发的,而点突变通常是由母亲传递的。家庭成员分析对于突变传递的遗传咨询非常重要:如果先证者母亲不携带突变,而且先证者的同胞也不携带突变,则母亲再育胎儿受累的概率较小。笔者所在课题组收集16个携带m.3243A>G突变且已生育2个子女的家系进行研究,发现当母亲血液中未发现m.3243A>G突变、尿液中m.3243A>G突变比例小于10%时,再育胎儿受累概率小。
当线粒体突变为异质性突变,即正常线粒体和异常线粒体共存于同一个患者,携带线粒体异质性突变的母亲如果传递给后代较多比例的异常线粒体,那么后代的临床表型较重,反之则较轻。而携带线粒体同质性突变的母亲100%会将突变传递给后代,但是其他因素(例如环境因素、核基因的修饰作用等)会影响疾病的严重程度。
二、线粒体病妇女的生育指导
近几年产前诊断技术和植入前诊断技术发展迅速,为线粒体突变妇女的生育指导提供了有力的方法。目前对于携带线粒体突变孕妇的生育指导主要有以下几个方面。
(一)卵子捐赠
接受来自无关女性的健康卵子无疑会避免突变的传递,虽然与父亲的精子受精,但是胎儿的一半基因来自捐赠的女性,大部分妇女都不能接受。
(二)绒毛穿刺和羊水穿刺
当明确是mtDNA基因突变时,临床常用绒毛膜细胞或羊水细胞行产前诊断。对于异质性突变,由于在生殖细胞发育过程中的“瓶颈效应”,不同子代携带的突变线粒体数量差别非常大,同一个体的不同组织中的突变线粒体分布也不同。虽然线粒体突变比例与临床症状有一定的关系,但是在其他修饰因素的作用下,突变比例并不能完全反映携带该突变者是否患病,因此对于孕妇的产前诊断非常困难。但是绒毛穿刺和羊水穿刺会对胎儿情况提供一些参考,如果检测突变比例非常高(>40%),那么胎儿患病概率非常高;反之如果检测突变比例非常低(<10%),那么胎儿患病概率非常低。但是,如果检测突变比例在中间范围,则非常难判定胎儿的情况。
(三)植入前遗传学诊断
植入前遗传学诊断(PGD)是指在胚胎8细胞阶段进行单个细胞mtDNA突变遗传分析,评估突变率的大小。但是植入前遗传学诊断应用于线粒体疾病是有局限性的,因为所有卵细胞都可能带有突变的mtDNA,最理想的结果是选中含mtDNA突变率最低的胚胎植入子宫。大约每个卵裂球含有10~100 000个拷贝的线粒体DNA,虽然每个卵裂球中的线粒体DNA拷贝数不同,但是线粒体DNA的高拷贝数对于PGD是非常合适的。一些研究发现,对于异质性突变,在小鼠和人类的早期胚胎中的分布是同质性的,PGD已经成功应用于一个携带线粒体8993突变的家系。但极体和任一卵裂球中的突变比例是否均代表胚胎突变比例,PGD技术是否可以应用于其他线粒体突变的家庭,还需进一步的验证。
(四)细胞质移植
绒毛穿刺、羊水穿刺和PGD对于携带线粒体异质性突变妇女生育有一定的指导,但是对于携带同质性突变的妇女则没有帮助。细胞质移植是将携带正常线粒体的细胞质转移至卵细胞,起到稀释异常突变线粒体的作用。通过稀释作用,原本同质性突变的卵母细胞变成异质性突变的卵细胞,那么受精后的后代可能含有较低比例的突变。但是目前发现该技术的应用价值不高,由于移植效率低,对于卵细胞的突变比例改变不大,而且细胞质移植可能改变了某种表观遗传的修饰,16个接受细胞质移植的孕妇有2个发现了染色体异常。
(五)细胞核移植
细胞核移植将携带mtDNA突变的卵母细胞的细胞核移植到去除细胞核的捐赠卵细胞内,从而保留了来自双亲的细胞核遗传物质,而突变的线粒体基因被去除。最近的研究认为卵细胞的细胞核移植时,低于2%的供体mtDNA被带入受体细胞,证明了这种方法对mtDNA突变引起的线粒体病预防有良好的应用前景。目前有母系纺锤体移植(maternal spindle transfer)和原核移植(pronuclear transfer),二者的区别是前者是卵细胞移植,后者是受精卵移植。但是该方法还有伦理学上的限制,而且对于胎儿远期的健康问题还没有研究。但是这种方法对mtDNA突变引起的线粒体病预防有良好的应用前景。
目前大部分神经系统遗传病尚缺乏有效的治疗方法,疗效多不满意。因此,通过避免近亲结婚、推行遗传咨询、携带者基因检测及产前诊断和选择性流产等措施防止患儿出生及预防遗传病的发生是最根本的措施。













