产后子宫感染(postpartum uterine infection)过去曾被称为产后子宫内膜炎、产后子宫肌炎及产后子宫旁组织炎。感染常累及子宫蜕膜子宫肌层及子宫旁组织。故被称为子宫炎伴盆腔蜂窝织炎(metritis with pelvic cellulitis)。分娩方式是子宫感染发生的一个最有意义的相关因素。在法国感染相关的死亡率剖宫产比阴道分娩高出将近25倍。从因为切口并发症及子宫内膜炎再次入院治疗的比率来看,计划性剖宫产比计划性阴道分娩要高很多。
阴道分娩:Parkland医院在1987年对5000例阴道分娩的产妇进行为期6个月的随诊,需要进行治疗的产后子宫炎发生率为1. 3%,但有高危因素(包括破膜时间延长、产程延长、胎儿内监护及多次阴道检查)阴道分娩产妇产后子宫炎发生率达6%。如果有绒毛膜羊膜炎,产妇阴道分娩后子宫炎发生率为13%,徒手剥离胎盘后产褥期子宫炎的发生率上升3倍。
剖宫产的抗生素预防性应用:在全世界的范围内几乎都在进行剖宫产的单剂量围手术期抗生素的预防应用。美国妇产科学会(2003)推荐产后感染高风险患者应用抗生素预防感染。在过去的30年中这种单次剂量抗生素预防感染有效地降低了产后感染的发生率及严重程度。剖宫产术后感染的高风险因素包括:产程延长、胎膜早破、多次宫颈检查及胎儿内监护。有上述所有高危因素但没有进行围手术期预防感染的妇女大约有90%会发生严重的盆腔感染。
与产后子宫感染发病有关的高危因素包括:剖宫产、破膜时间延长(>24小时)、产程时间(>12小时)、贫血、肥胖、营养不良(包括低蛋白血症)、临近预产期性交、宫内感染、胎儿内监测(>8小时)、低社会经济状况、急诊手术、全身麻醉、产后出血、阴道指诊检查次数、合并阴道炎、细菌性阴道病、子宫颈炎和不良妊娠结局(包括死胎、早产、新生儿病率和低体重儿)。其他与感染风险增加相关的因素还包括下述情况的剖宫产:多胎妊娠、母亲年龄过小、肥胖症、过长的产程诱导时间、羊水胎粪污染。其中阴道助产手术、剖宫产、破膜时间延长和产程延长是引起产后子宫感染最重要的原因,在三者同时存在时,产后子宫感染的发生率可达85%,最近注意到早产时应用多疗程糖皮质激素与产后子宫感染有关。Jacobsson等证实在孕早期有细菌性阴道炎的妇女产褥感染的风险提高3倍。
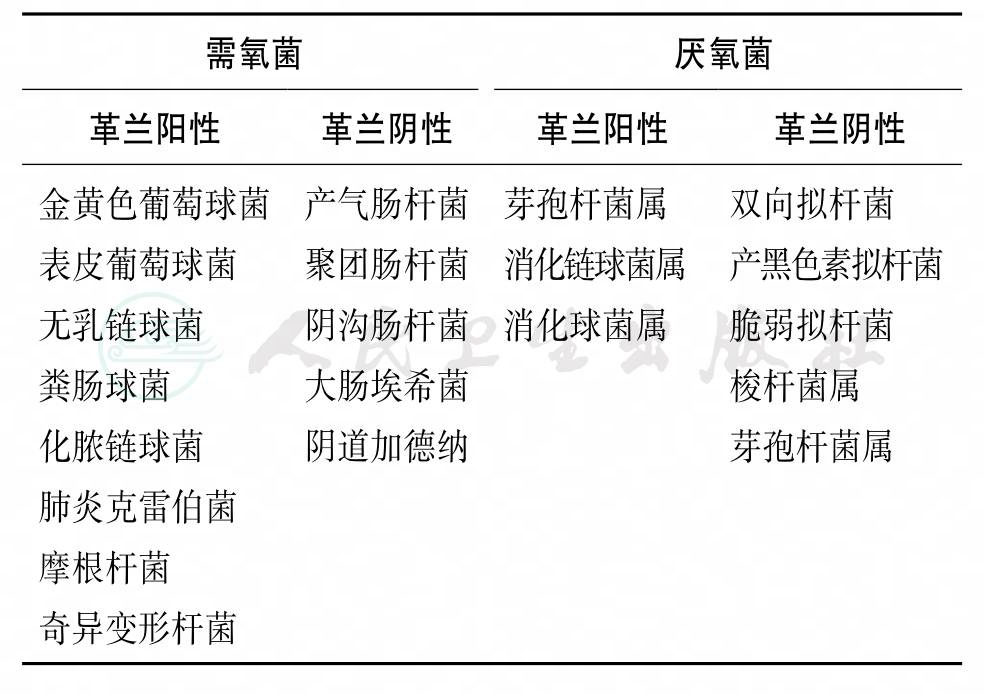
尽管孕产妇阴道和子宫颈内存在细菌,但在破膜前子宫腔内常保持无菌,破膜后下生殖道的细菌可上行进入子宫腔内。Gilstrap和Cunningham对破膜6小时及以上的产妇在剖宫产时进行羊水细菌培养,培养出需氧菌和厌氧菌者占63%,仅培养出厌氧菌者占30%,仅培养出需氧菌者占7%。厌氧菌者革兰阳性球菌(包括消化链球菌和消化球菌)占45%;类杆菌占9%;芽孢梭形杆菌属占3%。需氧菌以革兰阳性球菌为主,包括:肠球菌占14%,B族链球菌占8%,大肠埃希菌占9%。
在产后子宫感染产妇子宫腔内分离出的常见细菌包括:B族链球菌、粪肠球菌、大肠埃希菌及拟杆菌属细菌;其次出现的细菌包括枸橼酸杆菌属、不动杆菌属及假单胞菌属细菌。外源性病原体包括淋病奈瑟菌、A族链球菌及沙眼衣原体。产后子宫感染常由包括需氧菌和厌氧菌的多种细菌感染引起。另外,常见于下生殖道的人型支原体、解脲脲原体及阴道加德纳菌也可能与产后子宫感染有关。Udagawa综述30例分娩前后A族链球菌感染,17例在临产前产时或产后12小时内出现感染表现,其孕产妇和新生儿死亡率分别为88%和60%。13例在产后病情加重者产妇死亡率为55%,没有围产儿死亡。通常来说感染是多种微生物的,互相有增效协同作用。其他促进毒性作用的因素包括血肿形成及组织失活。
自产后子宫感染患者宫腔分离出的常见细菌见表2-8-1。
表2-8-1 引起产后子宫感染的微生物
阴道分娩后的产褥感染包括胎盘部位、蜕膜、邻近的子宫肌层、宫颈阴道的裂伤。剖宫产后子宫炎的发生机制如图2-8-1所示。手术后子宫感染发生主要与细菌污染、手术创伤、异物(缝线)及合适的厌氧环境等有关。由于病原体由胎盘剥离面侵入,扩散到子宫内膜层,引起急性子宫内膜炎,炎症可累及邻近的浅表肌层,感染扩散时可侵及深部肌层乃至浆膜层,因此子宫内膜炎多半有子宫肌炎。

图2-8-1 剖宫产后子宫炎的发生机制
1.血液检查
产妇血白细胞总数于产褥早期仍较高,可达20 000/ mm3,周围血白细胞总数增高及分类核左移常常预示感染。但在严重产褥感染时,由于骨髓抑制,血白细胞总数及中性粒白细胞可不增高。白细胞增多可能15 000至30 000/μL,但应注意剖宫产本身可以增加白细胞数量。
2.尿液分析
由于泌尿道感染的临床表现常和轻型子宫内膜炎者相似,应对所有产后子宫内膜炎患者进行尿液分析,在正确采集尿液标本情况下,如果发现脓尿或菌尿,则应同时针对泌尿道感染进行治疗,并送尿液进行培养。
3.微生物学检查
消毒会阴后暴露子宫颈,从子宫颈采集标本进行需氧菌和厌氧菌培养沙眼衣原体人型支原体和解脲脲原体的检测。尽管常常可从子宫颈甚至子宫腔培养出细菌或其他病原体,但这些微生物并不一定是引起产后子宫腔感染的病原体,故应谨慎解释所得到的微生物学检查结果。
4.其他检查
B超检查有助于确定是否存在:①子宫腔胎盘胎膜残留;②子宫旁包块;③子宫直肠窝积液血肿或积脓;④腹部切口积液;⑤检查可能存在的子宫感染并发症如宫旁蜂窝织炎、伤口感染、盆腔脓肿及感染性盆腔静脉炎等。
1.一般治疗
产妇取半卧位,有利于恶露排出及将炎症局限于盆腔内。重症病例可少量多次输血,注意补充热量及水分,饮水不足可经静脉补液,注意纠正水电解质紊乱及低蛋白血症,高热时应采取物理降温。
2.抗生素治疗
治疗产后子宫感染宜选择广谱抗生素,同时要考虑药物对哺乳的影响。对阴道产后轻度子宫感染可选择口服抗生素,对中重度子宫感染,特别是剖宫产后子宫感染应选择静脉滴注或肌内注射抗生素。大约90%的女性在应用一种药物治疗后在48~72小时内会明显好转。在这一时间后的持续性高热常提示有难治性盆腔感染(宫旁蜂窝织炎、腹部切口或盆腔脓肿、感染性血肿、感染性盆腔血栓性静脉炎等)。胃肠外应用抗生素治疗停止后不需要进一步口服抗生素治疗。
抗生素选择原则:最好根据细菌培养结果和药敏试验选择抗生素,然而治疗往往需在得到细菌培养前开始,因此必须根据经验选择抗生素。在1979年Dizerga等研究发现克林霉素+庆大霉素对95%的患者有效果,这一用法目前仍被认为是对大多数情况下的标准治疗。尽管应用这一药物组合,肠球菌感染可能持续存在,所以在最初时或如果48~72小时没有效果时对克林霉素-庆大霉素的组合还加上氨苄西林。庆大霉素一日一次的剂量用法与每8小时一次的剂量用法效果相似。由于庆大霉素有肾毒性和耳毒性的潜在风险,当患者肾小球滤过功能下降时,一些学者推荐应用克林霉素和二代头孢治疗,也有学者推荐应用克林霉素和氨曲南单酰胺菌素复合物与氨基糖苷类取得相似的效果。β-内酰胺抗生素的范围包括对许多厌氧病原体有效。包括头孢类比如头孢西丁、头孢替坦、头孢噻肟;广谱青霉素比如哌拉西林、替卡西林、美洛西林。除了过敏反应外,β-内酰胺抗生素在遗传学上是安全的,在主要的毒性作用方面是安全的。β-内酰胺酶抑制剂克拉维酸、舒巴坦和他唑巴坦已经被加入到氨苄西林、阿莫西林、替卡西林、哌拉西林已扩展它们的有效范围。甲硝唑对厌氧菌有更好的治疗效果。氨苄西林和氨基糖苷类以及甲硝唑的组合在严重的盆腔感染时对大多数的微生物都覆盖有效。亚胺培南是碳青霉烯类有着广谱的覆盖范围,对子宫炎相关的绝大多数微生物覆盖有效。西司他丁可以抑制亚胺培南在肾脏的代谢,二者组合对绝大多数的子宫炎有效,但宜作为保留抗生素,限用于盆腔脓肿及其他抗生素治疗无效的严重感染。表2-8-2为美国妇产科学会推荐的剖宫产术后盆腔感染抗生素的用药方法。
表2-8-2 剖宫产术后盆腔感染的抗生素用药

3.盆腔蜂窝织炎
在大多数的宫旁蜂窝织炎的妇女,广谱抗生素持续治疗会有明显的临床改善。典型病例5~7天发热好转,但有些病例时间会更长些。硬结的吸收大约需要数日~数周。当怀疑子宫切口坏死考虑手术探查。在一些少见的情况下,进行子宫的清创术和切口的再次缝合效果满意。但大多情况下,需要进行子宫切除和手术清创,并且术中难度较大,可以出现明显的失血。在明显的炎症过程中,宫颈和子宫下段也包括在内,可扩展至盆壁,围绕一次或双侧的输尿管。
4.腹膜炎的治疗
如果感染是来源于未受损的子宫而扩展至腹膜,通常来说单纯的抗生素治疗即足够了。但是如果腹膜炎是来自于子宫切口的坏死或肠管的损伤,一定要进行手术治疗。
5.腹腔、盆腔脓肿的治疗
经抗生素治疗无效的病应考虑腹腔盆腔脓肿的可能,需做仔细的妇科检查和B超检查明确诊断。常见的脓肿包括:膈下脓肿、肠区间脓肿及子宫直肠窝脓肿。以子宫直肠窝脓肿多见。根据脓肿位置及时经穹隆或经腹壁切开引流。广泛腹腔、盆腔脓肿经腹引流时可取腹正中切口,用热盐水自横膈至盆腔完全冲洗,游离回肠-盲肠联合至十二指肠-空肠曲等肠管,术毕另切一小口留置2~3根双腔引流管,分别至膈下、腹腔及子宫直肠窝内。术中发现子宫严重感染者需切除子宫,为保证盆腹腔引流,应开放阴道断端。图2-8-2为经阴道穹隆切开引流术示意图。少数情况下,宫旁的蜂窝织炎发生化脓,形成波动性的阔韧带脓肿,可以进行CT引导的细针穿刺引流。
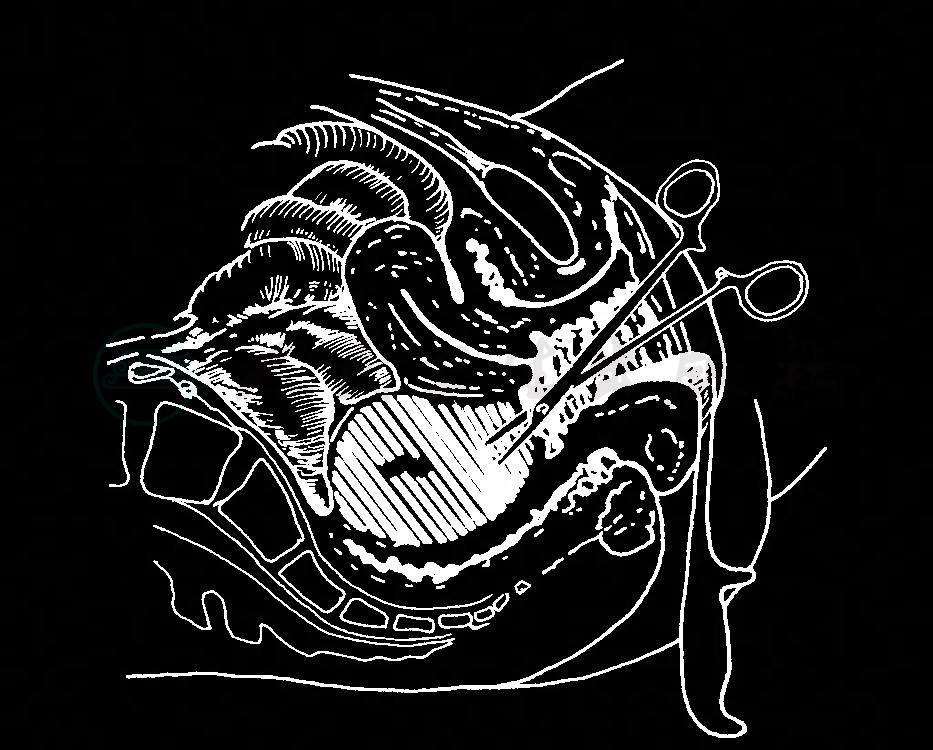
图2-8-2 盆腔脓肿经阴道切开引流术













