中文别名 :宫缩乏力
子宫收缩乏力(简称宫缩乏力)多发生于初产妇,尤其是高龄初产者,常见的原因有:
1.导致宫缩乏力的有关因素
(1)精神因素:
因产妇怕痛或对分娩及胎儿预后有顾虑,尤其是35岁以上初产妇,由于过重的心理负担和精神紧张或情绪不佳等,干扰了中枢神经系统的正常功能,而影响子宫收缩。
(2)体质因素:
单纯性肥胖、营养不良、贫血或合并有急慢性疾病,均能导致宫缩乏力。
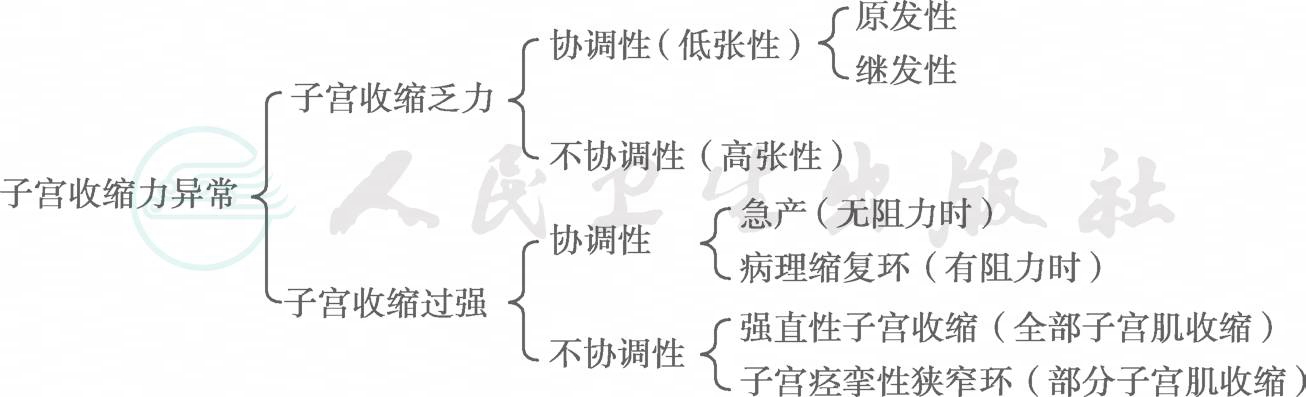
图2-6-43 子宫收缩力异常的分类
(3)内分泌、电解质紊乱:
临产后,产妇体内雌激素、缩宫素、前列腺素、乙酰胆碱及儿茶酚胺类物质分泌不足,孕激素水平下降速度缓慢,子宫对乙酰胆碱的敏感性降低等,均可引起内分泌失调性宫缩乏力;妊娠30周以下早产,缩宫素受体尚未完全建立,子宫平滑肌对缩宫素不敏感。
(4)药物影响:
妊娠晚期或临产后应用大剂量解痉剂、镇静剂、镇痛剂及麻醉剂,如硫酸镁、吗啡、哌替啶、氯丙嗪、巴比妥等,使子宫收缩受抑制而乏力,或使用子宫收缩剂的剂量不适当,亦可引起子宫收缩不协调。
(5)基因调控:
大约10%~20%的宫缩乏力与对缩宫素反应不良有关,单卵双胎的姐妹表现出一致性,而母亲或姐妹有产力异常病史者发生率明显升高,提示初产妇自然临产产力异常可能与基因调控有关。
2.子宫本身因素
子宫壁过度膨胀,如多胎、双胎、巨大儿、羊水过多等,使子宫肌纤维过度拉长伸展失去正常收缩能力;子宫肌纤维变性,如多次妊娠及分娩、刮宫或曾有过急慢性子宫感染史者结缔组织增生,子宫肌细胞炎症,影响子宫收缩能力;子宫结构异常,如发育不良、子宫畸形如双角子宫、纵隔子宫、子宫肌纤维发育不良等;子宫肌瘤,尤其是壁间肌瘤或子宫下段肌瘤和嵌顿在盆腔内的浆膜下肌瘤,均可使胎先露下降受阻,导致宫缩乏力。
3.产道和胎儿因素
骨盆大小和形态的异常,导致产道狭窄;胎儿过大或胎位异常,形成头盆不称,阻碍胎先露下降;悬垂腹子宫轴异常,子宫过度前倾,妨碍胎头衔接。临产后经过一段时间的试产,因不能克服胎先露下降的阻力或胎先露不能紧贴压迫子宫下段及宫颈部,而不能很好地刺激局部感受器,反射性地引起有效宫缩,致使正常子宫收缩逐渐减弱,此即所谓的继发性宫缩乏力。
4.其他因素
产妇临产一段时间后往往不能进食,甚至呕吐,体力消耗甚大,使产妇处于疲惫状态,常可发生酸中毒,或于第一产程后期过早地使用腹压向下屏气,耗费体力使子宫正常收缩减弱。产妇尿潴留亦是影响子宫收缩不能忽略的重要因素之一,膀胱充盈会阻碍胎先露的下降。
最小的有效宫缩定义为每10分钟有3次平均大于25mmHg以上的子宫收缩。然而,有效地子宫收缩涵盖着较为宽泛的范围,每次宫缩的幅度可能会发生变化,从25mmHg至75mmHg,在每10分钟内可能持续2~4.5分钟,宫缩强度达到95~395MVU(蒙氏单位,Montevideo units,指是经宫腔内导管或外部压力感受器测量出宫腔压力,将子宫收缩时宫腔压力峰值(mmHg)乘以10分钟内宫缩次数计算而得出)。在一项缩宫素引产的回顾性报告中91%可以达到至少200~224MVU,40%达到300MVU以上。
1.宫缩与宫颈扩张
在雌激素和前列腺素的影响下,整个孕期肌细胞都有自发活动,但在分娩发动前,任何个别的肌细胞或肌细胞群发起的收缩都不能蔓延至整个子宫肌层。在肌细胞间形成间隙连接,间隙连接为电活动在肌细胞间传导提供优先通道,子宫肌层产生协调反应。随着协调性不断增加,收缩力逐渐增强,以至宫内压力增加,孕妇或观察者均可感知到Braxton Hicks收缩,这种子宫收缩通常不会引起产妇疼痛。
临产后有效的子宫收缩在分娩过程中起到重要作用,可以使胎儿屈曲、旋转,适应并通过复杂的产道娩出。第一产程中,子宫容积变化很小。宫颈扩张要求子宫壁具有张力,所以实际上子宫肌层的收缩是等容性的(即肌纤维拉紧时没有变短)。同时因肌纤维没有明显变短,不会导致横穿子宫肌层的血管持续受压,从而避免了随着子宫收缩胎盘灌注的间断性减少。
传统理论认为,作用力(子宫肌层收缩,尤其在宫底部)和阻力(宫颈和下段)之间的平衡决定了产程进展。宫缩起始于宫底部,具有顺应性的宫颈减弱了子宫肌层产生的张力。这样具有顺应性的宫颈不仅可以迅速扩张,而且在较少的子宫收缩力下就可以扩张。反之亦然。与初产妇相比,经产妇子宫收缩力较弱,而宫颈扩张速度较快,这正是由于阻力低的缘故。然而超声研究发现足月妊娠的子宫肌壁厚度是均一性的,并不存在“底部优势”。子宫肌细胞的电生理研究进一步阐释,子宫收缩是高度协调的三维传播的子宫电活动,其中下段放松早于宫底部的模式更有利于产程进展。
2.子宫收缩力评估
(1)触诊子宫收缩
因为子宫收缩的强度与可触知的收缩持续时间有关(当宫压>15mmHg时,多数子宫收缩才能被触诊感知到),并且整体收缩力依赖于收缩频率,所以对于多数临床用途,包括催产素催产,触诊所感知的收缩持续时间和频率能够提供足够的、半定量的子宫收缩力评估。鉴于此原因,手摸宫缩仍然是临床检测子宫收缩力的标准手段。
手摸宫缩至少持续40秒,10分钟内3~4次的宫缩频率最为适宜。如果已出现进行性宫颈扩张,则不需要对子宫收缩力规定一个下限。只有当产程延长时,才需要考虑宫缩是否足够。
由于蜕膜释放前列腺素、孕妇神经垂体分泌催产素。随着产程进展,宫缩逐渐加强,第一产程末期的自发宫缩可能超过引产或催产的安全范围。胎儿的安危在分娩期处于微妙的平衡之中。宫缩越强,产程进展越好,而对胎盘灌注影响越大。分娩早期,在对胎儿有累积不良作用之前,高强度宫缩的压力和产程的迅速进展常有自限性。另一方面,产程进展不好也会导致超过胎儿承受能力的宫缩累积效应。处于危险中的胎儿承受能力也较低,加强宫缩会对其造成更大、更迅速的影响。在引产的最初4个小时内,每10分钟内超过6次宫缩,为宫缩过频。宫缩之间的间歇短甚至无间歇,与胎心减速具有明显的相关性。
(2)分娩力计(tocodynamometer,Toco)
电子胎儿监护在监护胎心变化的同时,使用分娩力计来评估子宫收缩力。压力传感器放置在宫底部位的腹壁上,通过描记的曲线下面积来评估子宫收缩力,简单无创,能够测量宫缩的频率和持续时间。但是这种方法评估子宫收缩力的敏感性和特异性均不高,无法评估子宫收缩的强度,腹壁厚度的限制及其与子宫的相对位置限制了宫缩力计的准确性。尤其不适用于肥胖者。
(3)宫内压力导管(intrauterine pressure catheter,IUPC)
子宫收缩力可通过测量宫内压力(intrauterine pressure,IUP)来量化,IUP与肌壁张力直接成比例,而与子宫大小间接成比例。评估子宫收缩力有4个参数:幅度、持续时间、频率和基础压力或张力。前三者与子宫收缩本身有关,末者与子宫本身的弹性回缩力和肌肉张力有关。
子宫基础张力的测量对流体静力压力很敏感。流体静力压力与子宫上部液平面的传感器相对位置有关,这种关系受体位影响,因此在流体静力压力上正确测量基础张力需要知道传感器的相对位置。目前传感器通常置于宫内导管尖端,并不知道其确切位置。如果记录开始,压力调零,就可以估算基础张力的变化,而不是其绝对值。实际上除了胎盘剥离或者使用催产素这些异常增加子宫基础张力的情况外,多数研究发现基础张力水平对宫颈扩张并没有显著作用,可以忽略。
宫内压力导管(intrauterine pressure catheter,IUPC)是监测子宫收缩的金标准,它比宫缩力计能更准确地评估的宫缩频率和强度。在有些情况下,精准地监测子宫收缩力也具有法医学意义,如瘢痕子宫进行引产或催产,或者多产、经产妇使用催产素,或子宫过度刺激时胎儿面临危险(例如有胎儿生长受限证据时)。
然而IUPC,需要在破膜之后才能插入导管,因此它的使用是有限的。此外,这种侵入性方法有胎盘和胎儿损伤、感染和子宫穿孔的风险。美国妇产科学会和加拿大妇产科医师协会建议在有选择的情况下使用IUPC,如产妇肥胖或对催产素反应不良。认为用IUPC监测可能更好地调整催产素剂量而改善母儿结局,从而防止子宫过度收缩和胎儿缺氧,能够更好地解释胎心率异常模式与子宫收缩的关系。由于临床支持的数据有限,这个假说主要是根据专家意见。内外监测的随机临床试验没有显示手术产率或新生儿不良结局有差异。
(4)子宫肌电图(electrohysterography,EHG)
肌细胞的电活动可以通过子宫肌电图(uterine electromyography, EMG)进行无创性监测。电子子宫肌动描计仪(electrical uterine myography,EUM)是一种由以色列Migdal Ha'emek开发的新技术软件和设备。设备用9个表面EMG电极和多通道放大器,对子宫的电活动进行测量。9个电极呈正方形放置于孕妇脐周,形成3行3列。电极的位置决定于非侵入性位置传感器。收缩的能量以微瓦(μW)为单位。9个电极对子宫不同部位的肌电信号进行精确的测量,信号输入计算机系统,进一步进行数据库和功能界面的处理,对子宫收缩力进行量化评价。
EUM不仅能够无创性评估子宫收缩的开始、高峰时间、持续时间和频率,也可以评估其强度。此外,因为是无创监测而不需要破膜,也可以作为疑诊早产宫缩的诊断工具。在监测过程中可以下床活动。在测定子宫收缩和预测早产方面,EUM与分娩力计传感器有着很好的一致性。与分娩力计比较,产妇的体质指数对监测值略有影响,但不具统计学意义。
目前,子宫肌电图是最有临床应用前景的子宫收缩力评价方法。
最小的有效宫缩定义为每10分钟有3次平均>25mmHg以上的子宫收缩。然而,有效的子宫收缩涵盖着较为宽泛的范围,每次宫缩的幅度可能会发生变化,从25mmHg至75mmHg,在每10分钟内可能持续2~4.5分钟,宫缩强度达到95~395MVU[蒙氏单位,Montevideo units,是指经宫腔内导管或外部压力感受器测量出宫腔压力,将子宫收缩时宫腔压力峰值(mmHg)乘以10分钟内宫缩次数计算而得出]。在一项缩宫素引产的回顾性报告中91%可以达到至少200~224MVU,40%达到300MVU以上。在宫缩乏力中,虽然子宫基础张力在正常范围内(<10mmHg),但峰值升高不超过25mmHg(正常压力约为60mmHg或8kPa)。
1.宫缩与宫颈扩张
在雌激素和前列腺素的影响下,整个孕期肌细胞都有自发活动,但在分娩发动前,任何个别的肌细胞或肌细胞群发起的收缩都不能蔓延至整个子宫肌层。在肌细胞间形成间隙连接,间隙连接为电活动在肌细胞间传导提供优先通道,子宫肌层产生协调反应。随着协调性不断增加,收缩力逐渐增强,以致宫内压力增加,孕妇或观察者均可感知到Braxton Hicks收缩,这种子宫收缩通常不会引起产妇疼痛。
分娩发动后,具有节律性、极性和对称性的有效子宫收缩在分娩过程中起到重要作用,可以使胎儿屈曲、旋转,适应并通过复杂的产道娩出。宫口未扩张时,子宫容积变化很小。宫颈管消退要求子宫壁具有张力,此时子宫肌层的收缩是等容性的(即肌纤维拉紧时没有变短)。同时因肌纤维没有明显变短,不会导致横穿子宫肌层的血管持续受压,从而避免了随着子宫收缩胎盘灌注的间断性减少。随着产程进展,子宫体肌纤维的缩复作用使宫腔容积逐渐缩小,迫使胎先露部下降,宫颈管消失及宫口开大。
传统理论认为,作用力(子宫肌层收缩,尤其在宫底部)和阻力(宫颈和下段)之间的平衡决定了产程进展。宫缩起始于宫底部,具有顺应性的宫颈减弱了子宫肌层产生的张力。这样具有顺应性的宫颈不仅可以迅速扩张,而且在较少的子宫收缩力下就可以扩张。与初产妇相比,经产妇子宫收缩力较弱,而宫颈扩张速度较快,这正是由于阻力低的缘故。子宫肌细胞的电生理研究进一步阐释,子宫收缩是高度协调的三维传播的子宫电活动,其中下段放松早于宫底部的模式更有利于产程进展。
2.子宫收缩力评估
(1)触诊子宫收缩:
因为子宫收缩的强度与可触知的收缩持续时间有关(当宫压>15mmHg时,多数子宫收缩才能被触诊感知到),并且整体收缩力依赖于收缩频率,所以临床大多数情况下,触诊所感知的收缩持续时间和频率能够提供足够的、半定量的子宫收缩力评估。鉴于此原因,触诊宫缩仍然是临床检测子宫收缩力的方法之一。
触诊宫缩达到“至少持续40秒,10分钟内有3~4次的宫缩频率”最为适宜。如果已出现进行性宫颈扩张,则不需要对子宫收缩力规定一个下限。只有当产程延长时,才需要考虑宫缩是否足够。宫缩过频是指宫缩频率>5次/ 10min,持续至少20分钟。宫缩之间的间歇短甚至无间歇,与胎心减速具有明显的相关性。
(2)宫缩监测仪(tocodynamometer):
电子胎儿监护在监护胎心变化的同时,使用压力探头来评估子宫收缩情况。压力传感器放置在宫底部位的腹壁上,通过描记的曲线下面积来评估子宫收缩力,简单无创,能够测量宫缩的频率和持续时间。腹壁厚度、探头放置的位置可能会影响压力传感器接收宫缩的信息,使其不能非常准确评估子宫收缩的强度,特别是肥胖者,但目前该方法仍是临床评估宫缩的最客观和最常用的方法。
(3)宫内压力导管(intrauterine pressure catheter, IUPC):
子宫收缩力可通过测量宫内压力(intrauterine pressure,IUP)来量化,IUP与肌壁张力直接成比例,而与子宫大小间接成比例。评估子宫收缩力有4个参数:幅度、持续时间、频率和基础压力或张力。前三者与子宫收缩本身有关,末者与子宫本身的弹性回缩力和肌张力有关。
宫内压力导管是监测子宫收缩力的金标准,它比宫缩监测仪能更准确地评估宫缩频率和强度。宫内压力导管,需要在破膜之后才能置入宫腔,故而限制了其临床的使用。此外,这种侵入性方法有胎盘和胎儿损伤、感染和子宫穿孔的风险。美国妇产科医师协会和加拿大妇产科医师协会(Society of Obstetricians and Gynaecologists of Canada,SOGC)建议在有选择的情况下使用IUPC,如产妇肥胖或对缩宫素反应不良,认为用IUPC监测可能更好地调整缩宫素剂量而改善母儿结局,从而防止子宫收缩过频和胎儿缺氧,能够更好地解释胎心率异常与子宫收缩的关系,但由于临床支持的数据有限,这个建议主要是根据专家意见。
宫缩内外监测的随机临床试验显示手术产率或新生儿不良结局无差异,故IUP在临床的应用并不普及。一项系统综述纳入了3项高质量的RCT,比较了产程中应用宫内压力导管与体外监测对妊娠结局的影响,其中一项研究(n=150)仅限于被诊断为难产的自然分娩者,另外两项研究同时包括催引产者。结果显示,宫内压力导管增加了阴道手术分娩的比例(OR 1.25,95%置信区间为1.02~1.53),剖宫产率也较高(OR 1.25,95%置信区间为0.91~1.21),但与外监护相比无显著性差异;使用宫内压力导管(296.84分钟)与外监护(297.19分钟)的催引产平均产程没有显著差异(P= 0.99);相关感染的指标也没有差异(RR 0.69,95%置信区间为0.44~1.08)。
(4)子宫肌电图(uterine electromyography, EMG):
子宫平滑肌细胞的电活动可以通过子宫肌电图进行无创性监测。电子子宫肌动描计仪(electrical uterine myography,EUM)是一种由以色列Migdal Haemek开发的新技术软件和设备。设备用9个表面EMG电极和多通道放大器,对子宫的电活动进行测量。9个电极呈正方形放置于孕妇脐周,形成3行3列。收缩的能量以微瓦(μW)为单位。9个电极对子宫不同部位的肌电信号进行精确的测量,信号输入计算机系统,进一步行数据库和功能界面的处理,对子宫收缩力进行量化评价。
EUM不仅能够无创性地评估子宫收缩的开始、高峰时间、持续时间和频率,也可以评估其强度。此外,因为是无创监测而不需要破膜,也可以作为疑诊早产宫缩的评估工具。在监测过程中可以下床活动。在测定子宫收缩和预测早产方面,EUM与宫缩外监护仪有很好的一致性。但目前,子宫肌电图的临床应用并未获得相关指南的推荐。
产力异常是构成难产的三要素之一,可以是产力本身,也可以是由产道和胎儿因素所致的异常,因此,在处理产力异常时应明确病因,全面了解母儿状况,有针对性地进行处理。
1.协调性宫缩乏力
一旦出现协调性宫缩乏力,不论是原发性还是继发性,首先应寻找原因,检查有无头盆不称及胎位异常,阴道检查了解宫颈扩张和胎先露下降情况。发现有头盆不称,估计不能经阴道分娩者,应及时行剖宫产术;若判断无头盆不称和胎位异常,评估能经阴道分娩者,应采取加强宫缩的措施。
(1)第一产程:
1)一般处理:
消除精神紧张,鼓励进食,注意营养和水分的补充。建立静脉通道,以备给药或输液。如果产妇长时间不能进食或不喝水,应考虑静脉输液,产妇因长时间宫缩痛而出现疲劳者,可用镇痛药物如哌替啶100mg肌内注射或实施分娩镇痛。不推荐灌肠,排尿困难者,可先行诱导法,无效时导尿并留置尿管,有助于促进宫缩和先露下降。破膜12小时以上者给予抗生素预防感染。在产程管理中助产人员应该充分考虑个体因素的不同,如孕妇年龄、心理因素、有无分娩镇痛、孕妇体力和饮食状况及胎儿因素等,针对不同情况给予个性化的照护。
2)加强子宫收缩:
经上述处理,子宫收缩力仍弱,确诊为协调性宫缩乏力者,产程无明显进展,应采取措施加强宫缩。Bishop评分法可用于判断宫颈成熟度,评估引产措施的效果,见表1。
表1 Bishop宫颈成熟度评分法
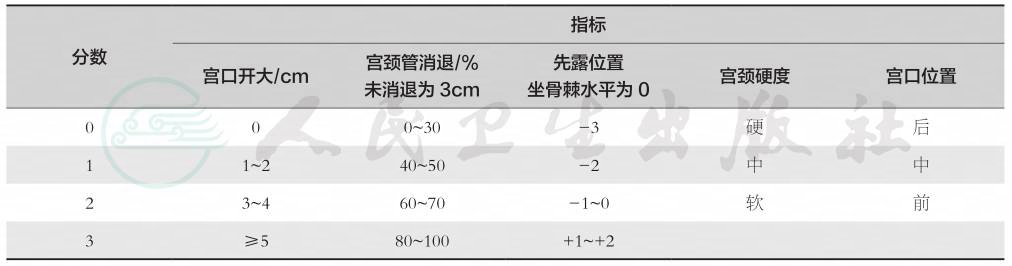
该评分法满分为13分。若产妇得分≤3分,人工破膜引产均失败,应该用其他方法促宫颈成熟;4~6分的引产成功率约为50%;7~9分的成功率约为80%,>9分均成功。
A.人工破膜:宫缩乏力、潜伏期出现延长趋势、胎心监护异常等,评估无头盆不称、胎头已衔接,首先可考虑行人工破膜。破膜后前列腺素和缩宫素释放增加,胎头直接紧贴子宫下段及宫颈内口,引起反射性子宫收缩,加速产程进展,同时通过破膜可以观察羊水的性状。人工破膜应在宫缩间歇期进行。破膜时必须检查有无脐带先露,破膜后术者手指停留在阴道内,经过1~2次宫缩待胎头下降后,再将手指取出。对于羊水过多的患者,破膜后若短时间内大量羊水流出还应警惕胎盘早剥的发生。人工破膜可以缩短产程,减少缩宫素应用,但可能会增加绒毛膜羊膜炎风险。2013年的一篇Cochrane综述纳入了15篇随机研究,包含5 583例单胎、头位、孕周36周以上且自然临产的孕妇,比较人工破膜和期待治疗对产程的影响,结果发现,单纯的人工破膜不会缩短第一产程和第二产程,但减少了后续缩宫素的使用,并不增加感染机会,而剖宫产风险有增加趋势。鉴于此,考虑到人工破膜存在一定的风险,如脐带脱垂或受压、胎儿损伤等,不建议产程中常规行人工破膜。无头盆不称、胎头已衔接而出现了产程延缓或停滞、胎心监护异常时,则推荐人工破膜了解羊水性状,促进产程进展,评估胎儿情况。但是新产程管理下,人工破膜的时机及利弊还缺乏大型的随机对照研究的循证数据支持,需要更多的临床研究。
B.缩宫素静脉滴注:适用于协调性宫缩乏力、胎心监护正常、头盆相称者。应用缩宫素的目的是加强子宫肌的收缩力和频率,帮助宫颈扩张和胎儿下降,促进产程的进展。应用过程中要避免因宫缩过度频密诱发的胎儿窘迫。使用缩宫素催产前应评估骨盆、宫颈和胎位及母儿状况。
缩宫素是治疗宫缩乏力的关键性药物,通常在妊娠20周后子宫肌层才开始对外源性缩宫素有反应,并随着孕周的增长而加强,直到34周后趋于稳定。缩宫素受体敏感性增加的另一个高峰是在分娩期,这主要是由于子宫肌细胞表面缩宫素受体结合位点的募集和基于细胞内钙离子升高的受体激活。在自然分娩期间,血液中内源性缩宫素的浓度保持稳定,但受体激活对缩宫素反应性增强。外源性缩宫素的血浆半衰期很短,只有3~6分钟,大约需要40分钟才能达到稳定的血浆浓度,临床上可以每30分钟调整一次缩宫素浓度。产程中缩宫素的使用要规范,有条件者建议应用输液泵连续静脉内给药,可以对药物剂量进行连续、精确的控制。
缩宫素诱导的子宫肌层缩宫素受体脱敏已在动物及人体外实验得到证实,分娩期长时间连续使用缩宫素可能会导致缩宫素受体脱敏,从而减弱子宫肌层对缩宫素的进一步反应,增加产后出血的风险,与持续暴露于缩宫素相比,缩宫素间歇性作用子宫肌层对后续缩宫素的反应更灵敏,这很可能是由于缩宫素间歇性作用导致受体脱敏减少或促进了受体再敏化。
缩宫素是加强宫缩最常用的药物,但是不合理的应用会增加不良围产儿结局,2007年被美国药物安全处方中心(Institute for Safe Medication Practices,ISMP)认为是一种具有不良反应高风险的药物,需要特殊保障措施,以减少应用不当造成的风险。
缩宫素静脉滴注的用药方法:先用5%葡萄糖500ml行静脉滴注,按每分钟8滴调好滴速,然后再向输液瓶中加入2.5U缩宫素,将其摇匀后继续滴入并根据宫缩进行调速。切忌先将缩宫素溶于葡萄糖中直接穿刺静脉滴注,因此法初调时不易掌握滴速,可能在短时间内有过多缩宫素进入体内,容易产生宫缩过频。最好用静脉输液泵输注以保证输注剂量的准确性。
不同国家和不同医疗机构颁布的缩宫素应用方法存在很大差异,例如ACOG(2009)推荐有低剂量(low-dose)和高剂量(high-dose)两种不同滴注方案。但每个方案都建议采用静脉输液泵输注。低剂量方案是指初始剂量为0.5~2mU/ min,每次调整为1~2mU/ min,间隔15~40分钟。此方案减少了宫缩过频及胎心异常的发生。高剂量方案是指初始剂量为6mU/ min,每次调整为3~6mU/min,间隔5~40分钟,此方案产程较短,较少出现绒毛膜羊膜炎和因难产而导致的剖宫产,但是增加了宫缩过频及胎心异常的发生。ACOG(2009)和SOGC(2015)认为,两种方案都适用于临床。
因缩宫素个体敏感度差异极大,静脉滴注缩宫素应从小剂量开始循序增量,中华医学会妇产科学分会产科学组也推荐低剂量缩宫素方案,即2.5U缩宫素加入5%葡萄糖500ml中,从小剂量2.5mU/ min开始,每次调整剂量2.5mU/min,调整间隔为30分钟。具体用法是2.5U缩宫素溶于5%葡萄糖500ml中即0.5%缩宫素浓度(5mU/ml),以每毫升15滴计算相当每滴液体中含缩宫素0.33mU。从每分钟8滴即约2.5mU/min开始,根据宫缩、胎心情况调整滴速,一般每隔30分钟调节1次,直至出现有效宫缩。有效宫缩的判定为10分钟内出现3次宫缩,每次宫缩持续30~60秒,子宫收缩压力达50~60mmHg,伴有宫口扩张。在调整滴速时,每次递增6滴约2mU,最大滴速不得超过30滴/min即10mU/min。如达到最大滴速,仍不出现有效宫缩时可增加缩宫素浓度。增加浓度的方法是以5%葡萄糖中尚余毫升数计算,一般100ml葡萄糖中再加0.5U缩宫素变成1%缩宫素浓度,先将滴速减半,再根据宫缩情况进行调整,增加浓度后,如增至每分钟20mU仍无有效宫缩,原则上不再增加滴数和浓度,一般以此为剂量上限。中华医学会妇产科学分会产科学组明确指出缩宫素引产的最大浓度10U/L,最大剂量为20mU/ min。
缩宫素静脉滴注过程中,应有专人观察宫缩、听胎心率,或电子胎心监护仪连续监护;测量血压。若出现宫缩持续1分钟以上或胎心率有变化,应立即停止静脉滴注。外源性缩宫素在母体血中的半衰期为1~6分钟,故停药后能迅速好转,必要时加用宫缩抑制剂。由于缩宫素的结构类似于加压素,有抗利尿作用,水的重吸收增加,可出现尿少,需警惕水中毒(稀释性低钠血症)的发生。母体水中毒仅在长时间暴露于高剂量缩宫素时发生,尤其是在低渗溶液中给药时。
C.地西泮静脉推注:地西泮能使宫颈平滑肌松弛,软化宫颈,促进宫口扩张,适用于宫口扩张缓慢及宫颈水肿时。常用剂量为10mg,2~3分钟静脉注射,间隔2~6小时可重复应用,与缩宫素联合应用效果更佳。
(2)第二产程:
对于第二产程发生的宫缩乏力应予重视。宫口开全1小时产程无进展,应再次评估骨盆情况、胎方位、胎头变形及有无产瘤、先露骨质部分高低以及宫缩时先露下降情况,做出经阴分娩还是阴道助产或是剖宫产的正确判断。胎先露若达S+3或以下可阴道分娩。如果宫缩乏力导致第二产程停滞,经阴道检查判断无头盆不称,胎心监护正常,可静脉滴注缩宫素加强宫缩,同时指导产妇在宫缩时屏气用力。
(3)第三产程:
为预防产后出血,当胎儿前肩娩出时,可静脉推注缩宫素10U,并同时给予缩宫素10~20U静脉滴注,增强宫缩,促使胎盘剥离与娩出及子宫血窦关闭。对于产程长、破膜时间长及手术产者,应给予抗生素预防感染。
2.不协调性宫缩乏力
处理原则是调节子宫收缩,恢复其正常节律性及极性,应给予强镇静剂。常用的有哌替啶100mg肌内注射或实施分娩镇痛,使产妇充分休息,不协调性宫缩多能恢复为协调性宫缩。在宫缩恢复为协调性之前,严禁应用缩宫素。若经上述处理,不协调性宫缩未能得到纠正,或伴有胎儿窘迫征象,或伴有头盆不称,均应行剖宫产术。若不协调性宫缩已转为协调性,但宫缩仍弱致产程停滞或延长时,可用缩宫素加强宫缩。
应对孕妇进行产前教育,进入产程后,解除产妇不必要的顾虑和恐惧心理,使孕妇了解分娩是生理过程,增强其对分娩的信心。提倡陪伴分娩。避免过多使用镇静药物,注意检查有无头盆不称等,产程中及时排空膀胱,必要时可行导尿。













