一、口腔共栖菌和口腔正常菌群
术语“共栖”(commensalism)是指两种不同生物在一起生活,对一方有利,能提供营养或其他益处,而对另一方无害或不受影响,或者对双方都有利,两者分开以后均能够独立生活。共栖是两个物种长期生活在一起,逐渐形成相互适应、相互依赖的协同进化结果。例如,有些附生植物附着在大树上生长,借以得到充足的光照,但是并不影响大树的生长。
口腔是人体五大菌库(口腔、肠道、皮肤、鼻腔和阴道)之一,口腔细菌密度高、数量大,唾液中的细菌超过108/ml,牙菌斑生物膜中的细菌则更多,超过1011/g湿重,细菌寄生期长,从出生后3~4小时开始,一直寄生至宿主死亡。人类口腔中大约寄居着700种以上的微生物,有需氧菌、兼性厌氧菌和专性厌氧菌,还有螺旋体、真菌、古细菌、支原体、病毒和原虫等其他微生物。口腔中绝大多数细菌是人类与微生物长期共存进化过程中形成的微生物群,与人体共享空间,共生共栖,和谐生活,为口腔共栖菌(oral commensal bacteria)。口腔共栖细菌能最大限度地利用口腔局部环境生长,能刺激宿主的防御系统,或促使宿主耐受(tolerance),宿主能持续有效地控制共栖细菌,防止其入侵组织。
正常情况下,寄居在口腔的许多细菌以错综复杂的共栖方式,保持着菌群之间的相对平衡,同时保持着菌群与宿主之间的动态平衡,这种平衡对于维持口腔健康很重要,它们一般对宿主无害,甚至有益,称之为口腔正常菌群(oral normal flora),或称为固有菌群(indigenous flora)。它们可以:①作为生物屏障,抑制外源性微生物;②维持口腔或全身(如消化道)微生物的生态平衡;③刺激宿主免疫系统;④发挥营养功能,如有些细菌会产生维生素K等。这种宿主与生活在体内的细菌和谐共栖,反映了宿主和细菌之间的长期适应、高度演变和动态平衡,在口腔健康中扮演着重要角色。
口腔微生物之间关系错综复杂,其中大多数为正常菌群,也有一些为某些情况下短暂发现的过路菌。寄居在口腔表面或牙周特殊部位的各种微生物,具有三种主要的相互关系:一是呈现相互有利的共生(symbiosis),如提供营养物质或能量来源;二是表现为负性关系的竞争(competition),如竞争营养物质和空间位置;另一种是某种微生物抑制或杀死另种微生物的拮抗(antagonism),如血链球菌(Streptococcus sanguis)合成的血链素,能抑制牙龈卟啉单胞菌(Porphyromonas gingivalis,原称牙龈拟杆菌Bacteroides gingivalis)、具核梭杆菌(Fusobacterium nucleatum)和中间普氏菌(Prevotella intermedia)的生长。正常菌群不是固定不变的,各种微生物群体的优势在消长和波动,它们的种类和数量取决于物理、化学和生物因子的影响,还可随口腔卫生习惯、饮食、年龄等口腔局部或全身情况变动。因此,所谓的口腔正常菌群是相对的、动态的、可变的和有条件的,当正常菌群失去相互制约或微生物和宿主失去平衡时,便会变得有害,它们可以;①导致内源性感染;②为外源性感染提供条件;③致敏宿主等,造成牙周组织的破坏。
二、牙周生态系
口腔是一个复杂完整的生态系,主要分为颊上皮生态区、舌部生态区、龈上牙菌斑生态区和龈下牙菌斑生态区。牙周微生物可受口腔相关生态区微生物的影响,牙周菌群之间以及它们与宿主之间的相互作用称为牙周生态系(periodontal ecosystem)。正常情况下,牙龈紧密地包绕牙齿硬组织,形成人体内特殊的软、硬组织结合关系,除牙龈外,牙周膜、牙槽骨和牙骨质之间以组织液相通,不与唾液、龈沟液及细菌等直接接触。患牙周炎时,由于细菌及其产物的作用,牙龈包绕牙齿硬组织的附着关系被破坏,正常龈沟病理性加深形成牙周袋,或造成牙龈退缩,牙周膜、牙骨质及牙槽骨暴露在龈沟液和唾液之中,此时的生态环境和菌群组成较牙周健康时更为复杂。
根据临床和组织学特点,牙周袋病损可分成牙侧和牙周侧,牙侧又分成釉质区、暴露的病变牙骨质区、上皮附着区和结缔组织区,牙周侧再分为牙龈上皮区,牙龈结缔组织区和骨缺损区(图1),这些生态小区或微环境(ecological niche)的解剖位置、组织结构和理化性质均不相同,决定了各区的菌群组成和修复潜能也不同,如此复杂的牙周生态系决定了牙周病的病因远较龋病复杂。此外,值得注意的是,在研究牙周生态系或牙周微生物时,必须考虑在什么生态层次或什么生态区上进行研究,在同一层次上的研究结果才有可比性,才有意义。
牙周微生物的复杂性决定了宿主免疫反应的复杂性,宿主在牙周病发病中的作用也不容忽视,不同个体对各种微生物的易感性和抵抗力均不相同。口腔微生物以及宿主体内、外因素均可影响牙周生态系,口腔微生物和宿主之间既可维持生态平衡,也可发生生态失调,主要取决于下列因素:牙周组织的解剖结构及理化特性,牙周环境的特性(如氧化还原电势、pH、温度、湿度、渗透压和营养源等),唾液和龈沟液的作用,微生物的相互作用(共聚、协同、竞争或拮抗),宿主的健康状况(包括口腔卫生习惯、口腔疾病和治疗、口腔矫治器和义齿、全身性疾病、激素分泌、遗传和种族因素、烟酒嗜好以及抗生素或其他药物影响)等,均能影响牙周细菌生态变化和宿主易感性。
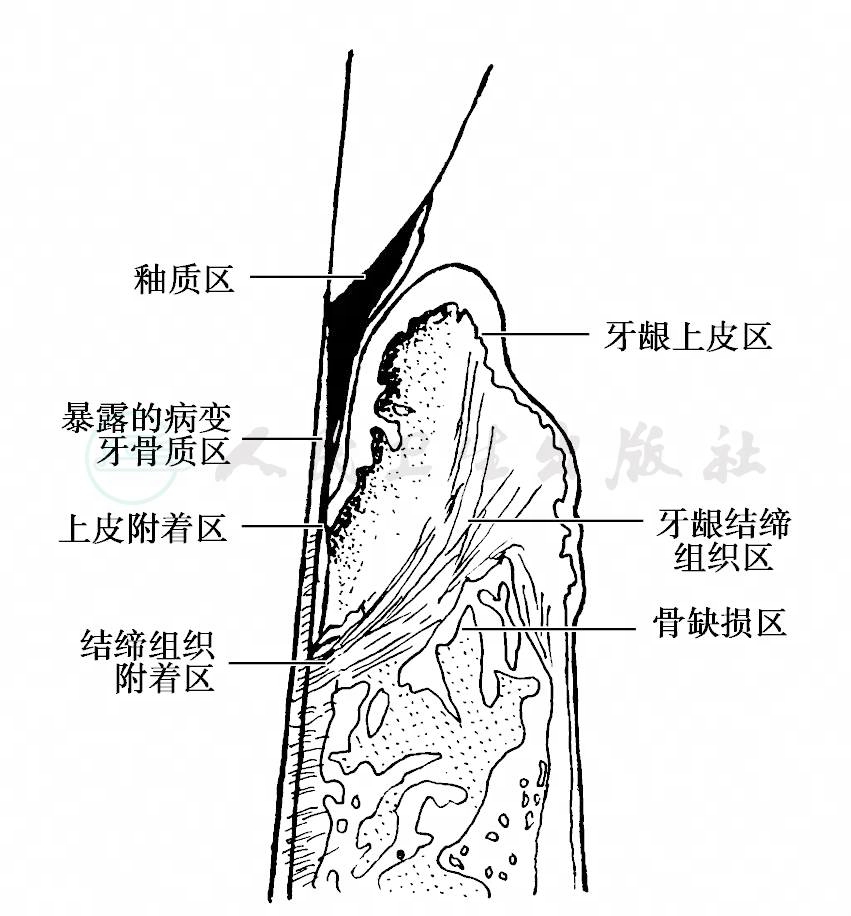
图1 牙周生态区的划分
三、牙周病的致病因子
牙菌斑细菌的抗原成分及其所产生的毒素和酶等毒性因子,可直接造成牙周组织破坏,也可引发宿主免疫反应和炎症反应,间接造成牙周组织破坏。当细菌侵袭和宿主防御之间维持牙周生态系的动态平衡(dynamic equilibrium)时,少量菌斑细菌的致病作用可由宿主的防御功能(如中性粒细胞、巨噬细胞、淋巴细胞、抗体和补体等)所控制,仍可保持牙周组织的健康。牙周感染能否能立,实际上由细菌、宿主和环境三方面条件决定,影响动态平衡的一些局部促进因素,如牙石、牙面色素、牙体和牙周组织的解剖缺陷或异常、食物嵌塞、创伤、不良习惯和不良修复体等,可增强细菌的积聚和侵袭力。宿主的免疫反应虽然在早期是保护性的,企图阻止微生物进入牙周组织或在牙周组织中扩散,但在反应过程中产生的一些细胞因子(cytokines)、前列腺素(prostaglandin)和基质金属蛋白酶(matrix metalloproteinase,MMPs)等,可介导牙周结缔组织以及骨组织的破坏。一些全身促进因素,如遗传因素、内分泌失调、免疫缺陷、吸烟、精神压力、营养不良等,可降低宿主的防御力或加重牙周组织的炎症反应。而牙周病的开始和进展会影响牙周袋pH,影响微生物可利用的氧和各种营养等,反过来又会影响微生物的生长。Page和Kornman归纳的牙周炎致病因子的相互作用见图2。
当正常菌群间失去相互制约,或者牙周微生物与宿主之间失去平衡,转变成生态失调(dysbiosis)时,便可发生牙周病。至于牙周病的防治,一方面可通过祛除牙周细菌或抗菌疗法,减弱细菌的侵袭力;另一方面可阻断宿主反应过程中产生一些生物活性物质(如细胞因子、前列腺素及金属蛋白酶等)对牙周组织的破坏,调整宿主防御能力或增强体质等措施,重建有利于牙周健康的牙周生态系,这便是牙周病防治中涉及的生态调整疗法。
四、牙周病病因研究观点的变迁
牙周病的病因是个古老而复杂的研究领域,祖国医学辨证注重内因与外因、全身与局部的关系,对其病因的认识归纳为口腔不洁、胃肠积热、气血虚弱和肾元亏损,很早就明确了口腔不洁与牙周病的关系,认识了肾虚是引起牙周炎的内因。近一个多世纪以来,虽经过世界各国学者的研究,但牙周炎的发病机制至今仍未完全清楚。历史上曾有主张纯属全身原因者,如牙周变性、营养不良等,也有主张单纯局部原因者。自20世纪60年代中期以来,关于牙周病病因的研究进入了一个崭新的时代,目前人们普遍认识到菌斑细菌及其产物是引发牙周病必需的始动因子。但单有细菌还不至于引起疾病,近代的观点强调牙周病是多因素疾病,认为除了细菌的种类和数量外,全身因素可改变宿主对局部因素的反应,不同宿主对细菌的反应也不尽相同,这会影响牙周病的发生、类型和转归,细菌激发的宿主炎症反应和免疫反应也是造成牙周组织破坏的决定性因素。此外,还受外界环境因素的影响,自然环境如地理、水文、气温、湿度,社会环境如生活方式、口腔卫生状况、医疗条件等,都可能对牙周健康产生影响。
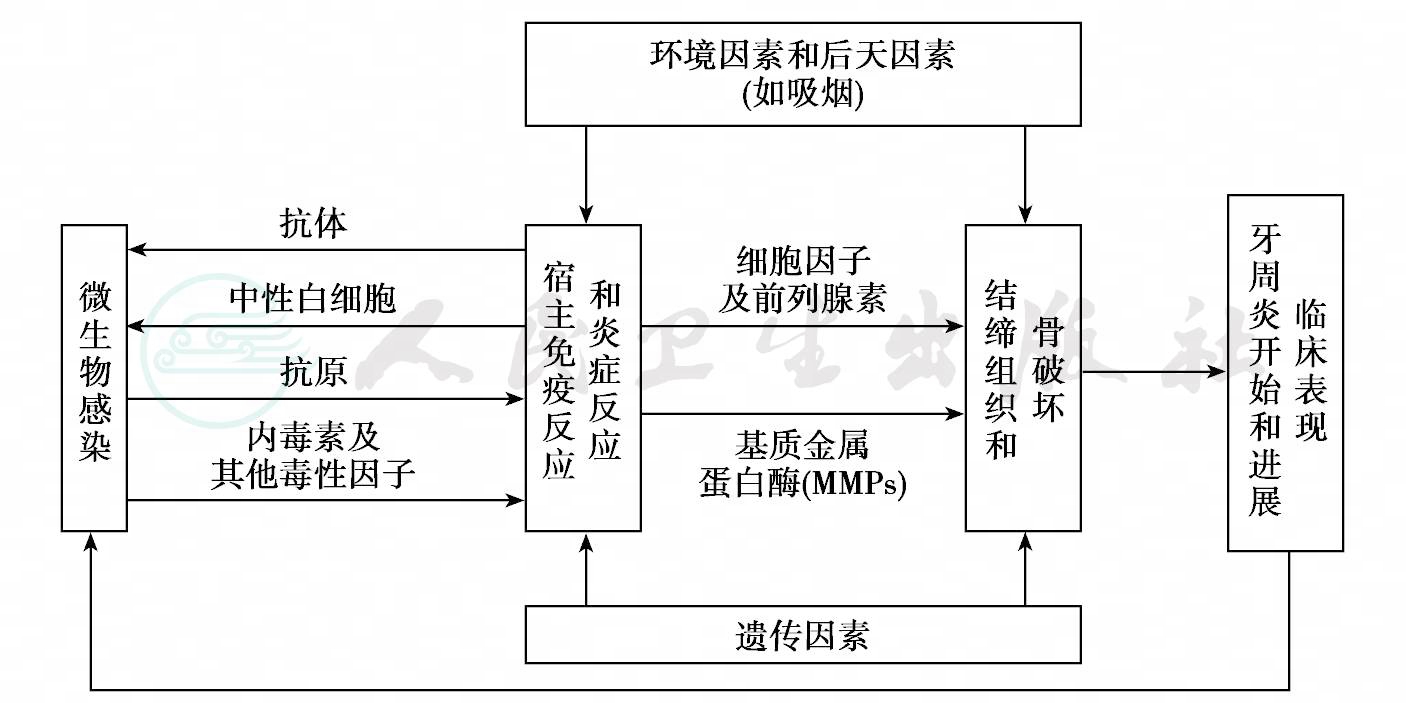
图2 Page和Kornman提出的牙周炎致病机制(1997)
在牙周病的微生物病因研究中,有关细菌的研究较多,病毒的研究日益受到关注,对其他微生物的了解甚少。近100多年来,关于牙周病的细菌病因,由于时代背景、研究方法和认识观点不同,在细菌病因领域形成了特异性菌斑学说、非特异性菌斑学说和菌群失调学说的激烈争论,迄今尚无定论。由于菌斑由许多复杂的细菌复合物组成,约50%以上的龈下菌斑微生物不能用常规培养技术检出,加上牙周细菌大多数为厌氧菌,培养条件要求高、鉴定繁杂、费时耗力、检出率低,因此用常规方法无法鉴定大量牙周样本的微生物。随着现代微生物学、微生态学、免疫学、遗传学及分子生物学等学科的发展,牙周病微生物病因的研究在不断深入,手段在不断更新,如电子显微镜、激光共聚焦显微镜、免疫荧光、免疫组化,聚合酶链反应(Real- time PCR、PCR- DGGE技术)及核酸杂交(特别是利用16S rRNA基因测序)等现代分析技术,细菌分类鉴定已不再受限于培养技术,已从表型特性深化为基因特征,从形态、生化提高到基因、分子水平,在牙周细菌分类、分型或检测、评估牙周致病菌毒力因子、追踪病原体传播途径和发现病原体变异等方面有许多进展。此外,值得一提的是,近年来随着分子生物学、分子遗传学和生物信息技术的发展,诞生了一门崭新的宏基因组学(metagenomics)学科,特别是随着2007年人类微生物组计划(human microbiome project,HMP)的启动,进入了对微生物基因组及其环境宏基因组测序的时代,这种能得到细菌和宿主大量基因信息新方法的“系统思想”和“整体观点”逐渐被接纳,从生态系的观点出发,采用敏感、特异的宏基因组学方法,研究牙周病各阶段的口腔微生物群落整体以及微生物的环境性质,分析复杂口腔微生物的种类和多样性,确定它们在牙周健康和疾病中所起的作用,是当前牙周病病因学研究的另一热点。这些具有前瞻性、交叉性的新兴研究,能将微观的牙周微生物的基因特征与宏观的牙周病发生发展规律联系起来,阐明牙周病的发病机制和流行规律,给病因研究和临床检测带来很大便利,进一步推动了牙周病学的发展。
牙菌斑生物膜
一、牙周病的始动因子———牙菌斑生物膜
生物膜(biofilm)是适于微生物生存的实体,是微生物在自然界存在的主要生态形式,它广泛存在于海洋、湖泊、土壤、船底和沉积物等,也存在于人体和动物的口腔、肠道、膀胱与皮肤等部位,一般在膜表面或界面存在较多。
(一)牙菌斑生物膜的新概念
1898年,Black首先把菌斑这个名词引入口腔医学,将胶黏在牙面上的不能被水冲去的细菌斑块称为牙菌斑(dental plaque)。2002年,Socransky将菌斑生物膜定义为附着于生物或非生物固体表面的、包裹在自身分泌的多糖基质内的一种或多种微生物共同体。近年来,牙菌斑生物膜(dental plaque biofilm)的新概念可归纳为:牙菌斑生物膜是口腔中不能被水冲去或漱掉的细菌性斑块,是由基质包裹的互相黏附或黏附于牙面、牙间或修复体表面的软而未矿化的细菌性群体,它们构成较多相互有序生长的建筑式样(architecture)生态群体,是口腔细菌生存、代谢和致病的基础。这概念强调牙菌斑生物膜的细菌不同于悬浮的单个细菌,它们是整体生存的微生物生态群体,细菌凭借牙菌斑生物膜这种独特结构,黏附在一起生长,相互附着很紧,难以清除;另一方面,牙菌斑生物膜的形成是一种适应过程,使细菌能抵抗表面活性剂、抗生素或宿主防御功能的杀灭作用,使各种细菌长期共存,在合适的微环境中发挥不同的致病作用。
(二)牙菌斑生物膜的形成
牙菌斑生物膜的形成和堆积是牙周疾病的直接原因,了解其形成过程,便可设法采取菌斑控制措施,及时地干扰它的形成,防止其堆积,保持牙面清洁,预防牙周疾病。牙菌斑生物膜的形成过程大致可分为3个基本阶段:
1.获得性薄膜(acquired pellicle)的形成
最初由唾液蛋白或糖蛋白吸附至牙面,形成一层无结构、无细胞的薄膜。它形成的速度很快,在刚清洁过的牙面上,数分钟内便可形成,1~2小时迅速成层增厚,厚度为1~20μm,在龈缘区较厚,牙尖区较薄,由蛋白质、碳水化合物和脂肪等组成,能为细菌黏附提供特殊受体,具选择性吸附细菌至牙面的作用,可促进早期细菌的黏附定植,还为其他细菌附着提供表面,能决定细菌附着的顺序,又可作为细菌的营养,因此,获得性薄膜是牙菌斑生物膜形成的基础。
2.细菌黏附(adhesion)和共聚(coaggregation)
获得性薄膜一旦形成,口腔内的细菌便陆续地定植(colonization)于薄膜,细菌表面与宿主组织表面间存在着高度选择性,仅少数细菌具有直接黏附于薄膜的能力。最初附着的主要是一些革兰阳性球菌,附着机制十分复杂,有的细菌(如某些链球菌、乳杆菌和放线菌等)能将食物中的碳水化合物转化成胞外多糖,如葡聚糖、果聚糖和杂多糖,这些长多糖纤维可包在细菌表面,形成黏性的糖液,构成菌斑的基质,将细菌黏合在一起;还有些细菌可通过综合的识别系统,如菌体表面的菌毛、绒毛、繖等附件,含有称为黏附素(adhesin)的蛋白样大分子物质,与获得性膜上相应的糖蛋白或糖脂受体结合。如早期定植菌链球菌、放线菌可与薄膜内含脯氨酸的酸性蛋白质的不同位点(受体)结合,而这些早期菌的定植又为晚期菌的附着提供表面。不同属(种)细菌表面分子间的特异性识别黏附称为共聚(coaggregation),例如由一种细菌的植物凝集素样蛋白与另一种细菌相应的碳水化合物产生特异的蛋白酶性联结。近年发现口腔微生物的共聚关系相当复杂,除细菌外,螺旋体及真菌也参与了共聚,如牙龈卟啉单胞菌能与密螺旋体共聚。
3.菌斑生物膜的成熟
细菌通过黏附和共聚相互连接,使菌斑成为有规则的细菌群体,定植菌迅速繁殖(multiplication)、生长(growth)或扩散(diffusion),导致菌斑细菌数量和种类增多,形成复杂菌群。假如细菌每3小时可繁殖一代的话,一个细菌在24小时内便可分裂繁殖为256个。在菌斑成熟过程中,细菌定植有一定的顺序,首先吸附到牙面的是革兰阳性球菌,链球菌占优势,然后是放线菌、丝状菌或乳杆菌;以后,随着菌斑的成熟,细菌种类逐渐增多,菌斑大小和厚度随之增加,革兰阴性厌氧菌、能动菌和螺旋体增加,如梭杆菌、月形单胞菌、优杆菌和密螺旋体等比例上升。早期定植菌间可相互共聚,晚期定植菌间也可互相共聚,早期定植菌一般不识别晚期定植菌,仅少数细菌例外,如梭杆菌既可识别早期定植菌,又可识别晚期定植菌,是早、晚期定植菌的黏接桥,在菌斑生物膜形成中起重要作用。早期菌斑增长较快,成熟时则较慢,一般12小时的菌斑便可被菌斑显示剂着色,9天后便形成各种细菌的复杂生态群体,约10~30天的菌斑成熟达高峰。
(三)牙菌斑生物膜的结构
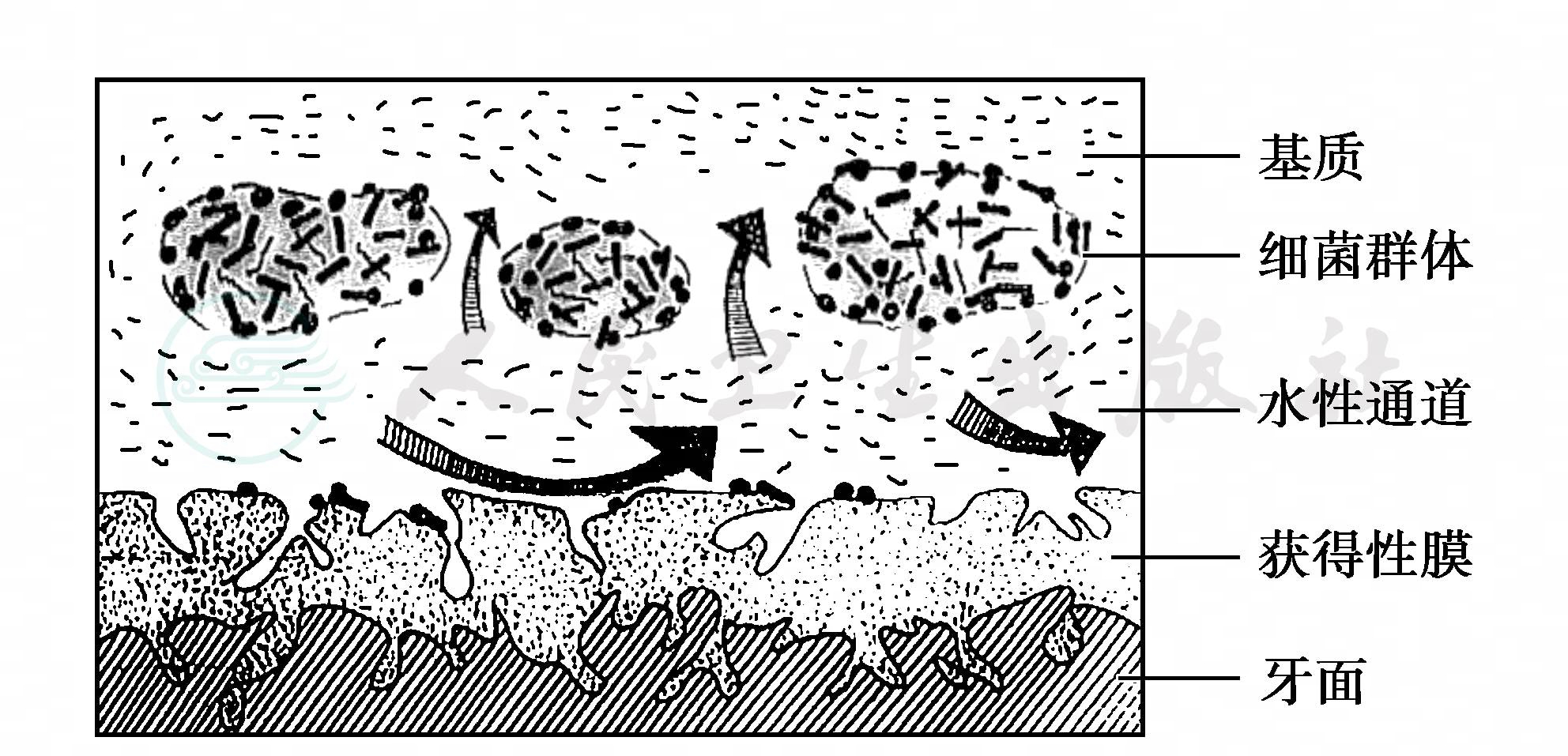
图3 牙菌斑生物膜结构示意图
在激光共聚焦显微镜(cofocal laser scanning microscopy,CLSM)下观察,牙菌斑生物膜显示为有着三维立体结构的生态系,不同生物量的细菌群体被获得性薄膜和(或)胞外基质包裹着,内部为丰富的大小不等的水性通道所间隔,通道内有液体流动,见图3。测定活菌斑内的氧溶解量,显示细菌群体内部几乎无氧,为厌氧生存,而各层水性通道内则发现有效浓度的溶解氧,邻近水性通道的细菌为需氧生存,这种差异使同一生物膜内的不同细菌能和谐地一起生活。该结构与细菌群体的自身结构相关联,水性通道的功能相似于原始循环系统,充满着复杂的信号分子,满足细菌间的信息交流,可给菌斑生物膜内不同细菌输送营养物质、清除代谢废物,使细菌发挥各自的致病作用,是不同细菌共同获益的途径。这种生物间生理协作的独特结构,可能与菌斑内细菌快速增殖及其在宿主体内的高度抵抗力密切有关,菌斑生物膜具较强的抵抗力,高黏度的基质具屏障作用,可耐受干燥,抵抗宿主防御成分或药物渗入,使菌斑对抗菌药物的敏感性降低,还可抵抗流水冲刷。
在模拟口腔环境的恒化器中,结合激光共聚焦显微镜和活菌革兰荧光染色,观察4种代表性G-牙周致病菌[牙龈卟啉单胞菌、伴放线聚集杆菌(Aggregatibacter actinomycetemcomitans,原名伴放线放线杆菌Actinobacillus actinomycetemcomitans)、具核梭杆菌、中间普氏菌]和4种G+致龋菌[变形链球菌(Streptococcus mutans)、血链球菌、嗜酸乳杆菌(Lactobacillus acidophilus)和黏放线菌(Actinomyces viscosus)]的人工菌斑生物膜,使G+活菌发红色荧光,G-活菌呈绿色荧光,并进行连续断层扫描,重建三维立体结构,证实细菌在羟磷灰石表面的附着生长并非杂乱堆积,而是一个有次序的连续过程,G+菌较G-菌易附着于羟磷灰石,随着时间延长,G-菌在生物膜中的比例增加,G-菌主要分布于G+菌团之间或膜表层,见图4。
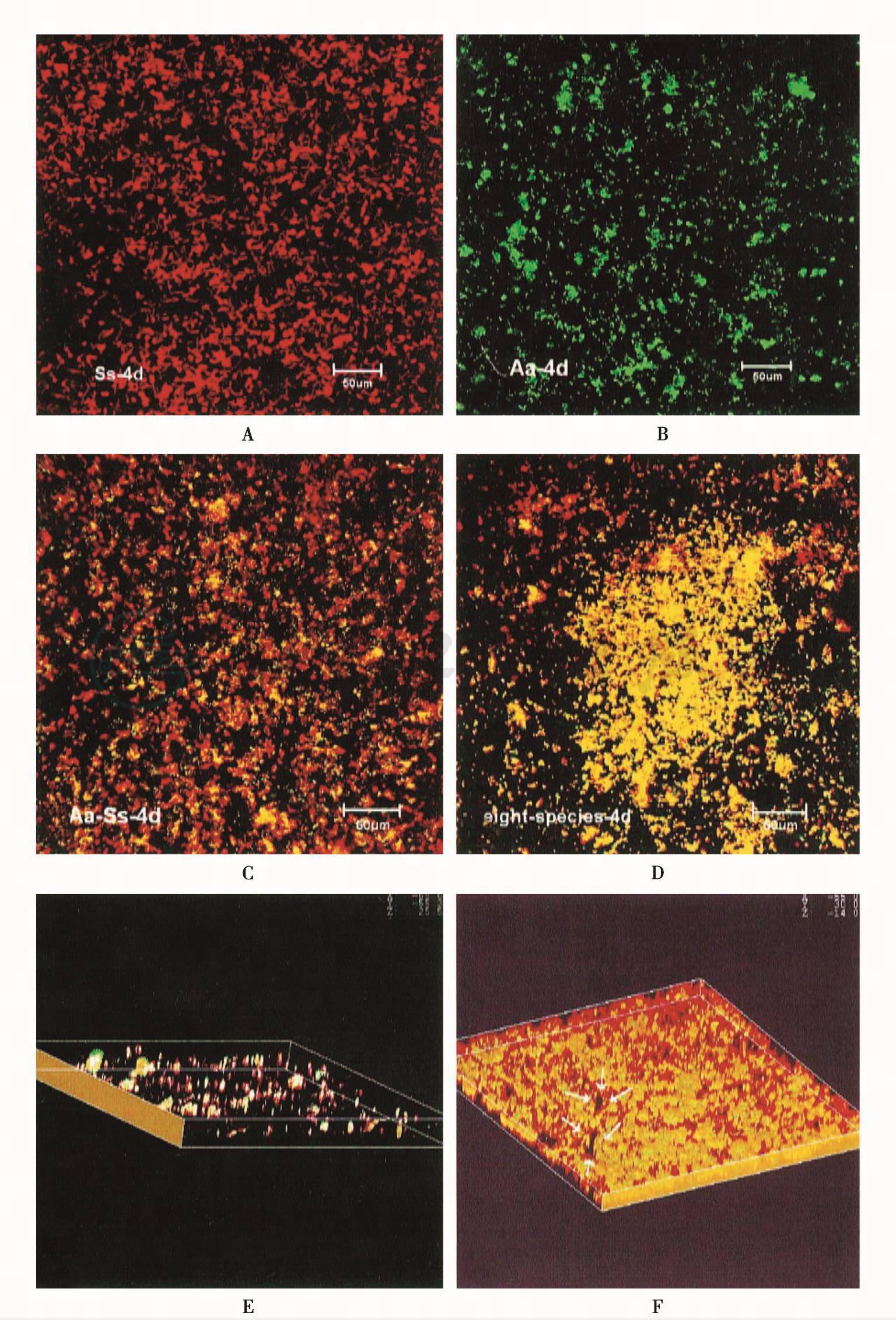
图4 模拟口腔环境恒化器中不同组合细菌形成菌斑生物膜的激光共聚焦显微镜观察
A.96h血链球菌生物膜;B.96h伴放线聚集杆菌生物膜;C.96h血链球菌和伴放线聚集杆菌生物膜;D.96h 8种菌形成的生物膜;E. 24h 8种菌形成生物膜的三维立体图像;F. 96h 8种菌生物膜的三维立体图像,白色箭头所指处为管道结构
2010年,Zijnge等采用原位杂交荧光,观察在牙周炎嵌入牙上的牙菌斑生物膜,提供了多种有序建筑式样的牙菌斑生物膜图像,这些独特结构可能与口腔疾病中相关的细菌作用和分子多样性有关。
(四)牙菌斑微生物作为牙周病始动因子的证据
大量的实验研究、流行病学资料和临床观察证明,牙周病是菌斑微生物引起的感染性疾病,菌斑微生物是引发牙周病的始动因子,是造成牙周病破坏的必需因素,证据如下:
1.实验性龈炎观察
1965年,Le等选择12名牙周健康的牙科学生,停止口腔卫生措施,使菌斑在牙周积聚,所有受试者在10~21天内均发生了实验性龈炎,菌斑量增多,牙龈出现炎症、出血。菌斑的组成也发生改变,牙周健康时菌斑细菌数量较少,革兰阳性球菌和短杆菌约占85%,龈炎形成过程中细菌数量增加,革兰阴性菌的百分比增加至40%~55%。恢复口腔卫生措施,清除牙面菌斑后,发炎的牙龈在1~8天内全部恢复健康。该实验有力地证明了菌斑的堆积可直接引起牙龈炎症。此后在动物试验中还证实长期的菌斑堆积可导致牙周炎的发生。
2.流行病学调查
流行病学调查发现牙周病的分布、患病率和严重程度与该人群的口腔卫生情况、菌斑积聚多少呈正相关。口腔卫生差、菌斑积聚多者,牙周病的患病率明显高于口腔卫生好者。局部如无牙菌斑,仅有修复体和其他机械刺激,则很少引起牙龈炎症。
3.机械除菌或抗菌治疗效果
采用机械除菌的方法,如洁治、刮治、根面平整等,使牙周袋内的细菌数量明显减少,牙龈炎症和肿胀消退,出血或溢脓停止,对阻止牙周破坏有效,甚至可以促进修复。大量临床观察表明,抗菌疗法如用甲硝唑、替硝唑、阿莫西林、四环素、氯己定、螺旋霉素等,治疗牙龈炎和牙周炎有一定疗效,能缓解症状。抗菌药物对急性坏死性溃疡性龈炎有效,是明确支持细菌病因的直接例子。
4.动物实验研究
无菌动物实验证明仅有牙石或丝线结扎等异物刺激,如无细菌,不会引起龈炎;而用加有细菌的食物饲养,则可造成实验动物的牙周炎症,并有组织学证据表明细菌积聚与牙周破坏、骨吸收有关。1964年,Keyes和Jordon的动物实验证明牙周炎可在仓鼠间传播,结果见表1。
表1 仓鼠牙周炎的感染与传播因素
5.宿主免疫反应
在牙周病患者的血清或龈沟液内,常可检测到对牙周致病菌的高滴度特异抗体,这种抗体反应在牙周治疗后下降。有的人抗体形成不足或抗体的亲和性过低,则易发生严重、广泛的牙周炎。
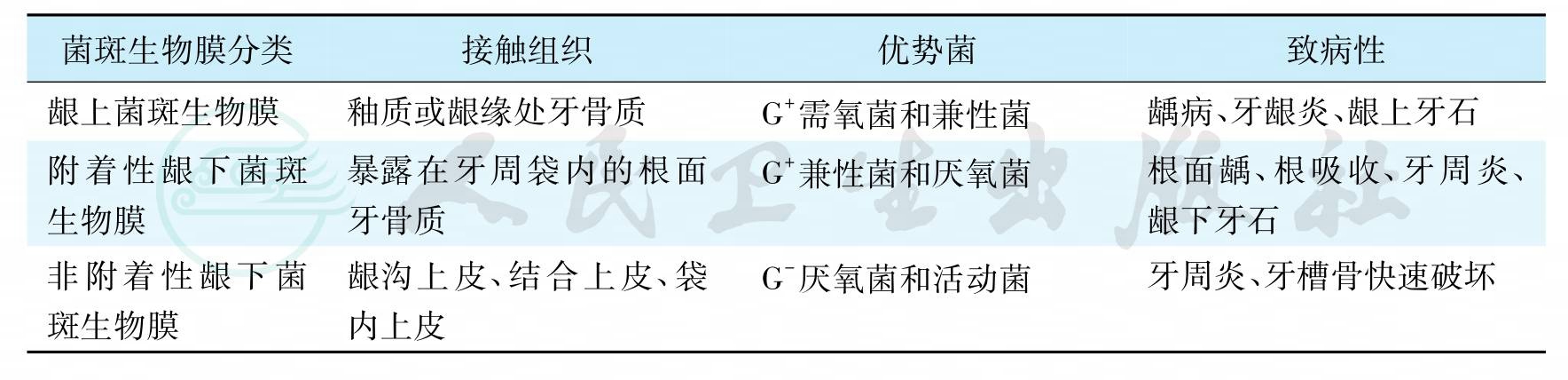
二、牙菌斑生物膜的分类
牙菌斑生物膜在口腔卫生不良时积聚,但菌斑积聚不会无限增加,它受多种因素影响,不同个体之间,即使同一口腔的不同部位之间,菌斑形成的速度和成分也差别很大。牙菌斑生物膜根据其所在部位,以龈缘为界,分为龈上菌斑生物膜和龈下菌斑生物膜两种。
(一)龈上菌斑生物膜
位于龈缘以上的牙菌斑称为龈上菌斑生物膜(supragingival plaque biofilm),主要分布在近牙龈的1/3牙冠处和牙其他不易清洁的窝沟、裂隙、邻接面、龋洞表面等部位,以革兰阳性兼性球菌占优势,包括链球菌、丝状菌、放线菌、乳杆菌和酵母菌等,与龋病发生、龈上牙石形成有关(图5A),龈缘附近的龈上菌斑还会危害牙周组织。在近龈缘的成熟龈上菌斑的表面,常见到细菌聚集成“玉米棒”(comcobs)状或“谷穗”状(图5B),其中心常为革兰阳性丝状菌,包括颊纤毛菌、放线菌或梭杆菌等,表面附有许多球状菌,如链球菌、韦荣球菌和白色念珠菌等,这种细菌间有秩序和谐生长的病理意义尚不清楚。
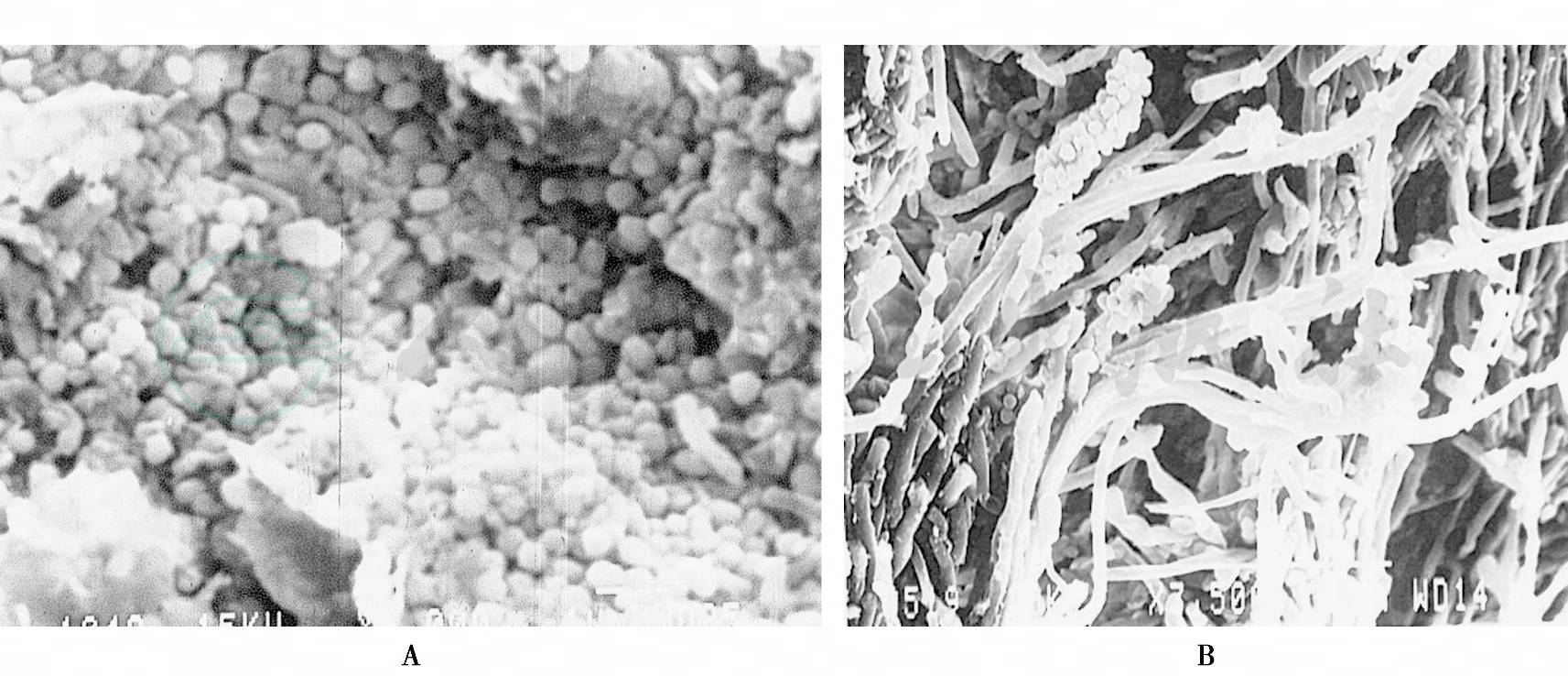
图5 龈上菌斑生物膜
A.牙面球菌占优势的龈上菌斑(SEM×7500);B.龈缘处“玉米棒”状或“谷穗”状龈上菌斑(SEM×7500)
未矿化的牙面沉积物,除上述获得性薄膜和牙菌斑外,还有白垢(materia alba),也称软垢,为疏松地附着在牙面、修复体表面、牙石表面和龈缘处的软而黏的沉积物,通常沉积在牙面的颈1/3区域,或在牙邻面及错位牙不易清洁的区域,不需涂布显示液,肉眼便直接可见。白垢由活或死的微生物团块、脱落的上皮细胞、白细胞、唾液中的黏液素、涎蛋白、脂类及食物碎屑等混合物不规则堆积而成。目前,对菌斑和白垢已不严格区分,因为它们主要的致病成分都是细菌及其产物。
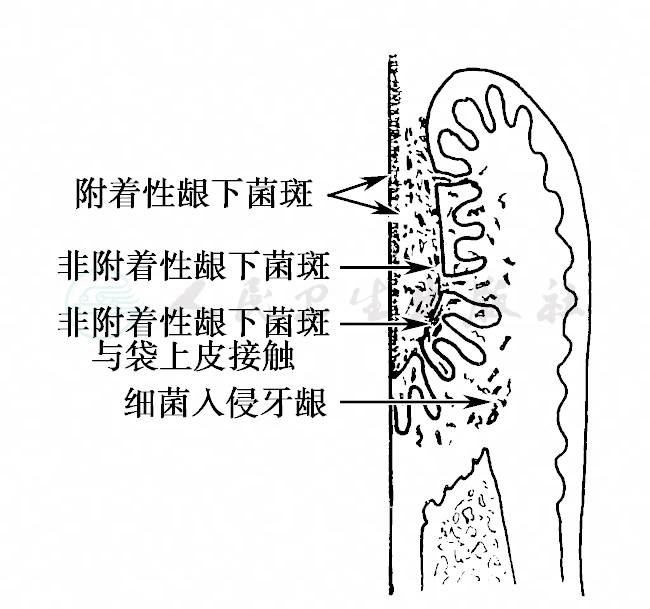
图6 龈下菌斑示意图
(二)龈下菌斑生物膜
位于龈缘以下的牙菌斑称为龈下菌斑生物膜(subgingival plaque biofilm),分布在龈沟或牙周袋内,它可分为附着性龈下菌斑生物膜和非附着性龈下菌斑生物膜两部分,见图6。
1.附着性龈下菌斑生物膜(attached subgingival plaque biofilm)
龈缘以下附着于牙根面的龈下菌斑称为附着性龈下菌斑生物膜,它由龈上菌斑延伸入龈沟或牙周袋内,健康的牙龈因龈沟较浅,龈下菌斑量少,当牙龈有炎症使龈沟加深或形成牙周袋后,龈下菌斑量随之增加。附着性龈下菌斑的结构、成分与龈上菌斑相似,细菌种类增多,主要为革兰阳性球菌、杆菌及丝状菌,还可见革兰阴性短杆菌和螺旋体等(图7A),或呈试管刷(test- tube brushes)样(图7B),最近发现乳杆菌可能是龈下菌斑细菌聚集的中心。附着性龈下菌斑与龈下牙石的形成、根面龋、根面吸收及牙周炎有关。
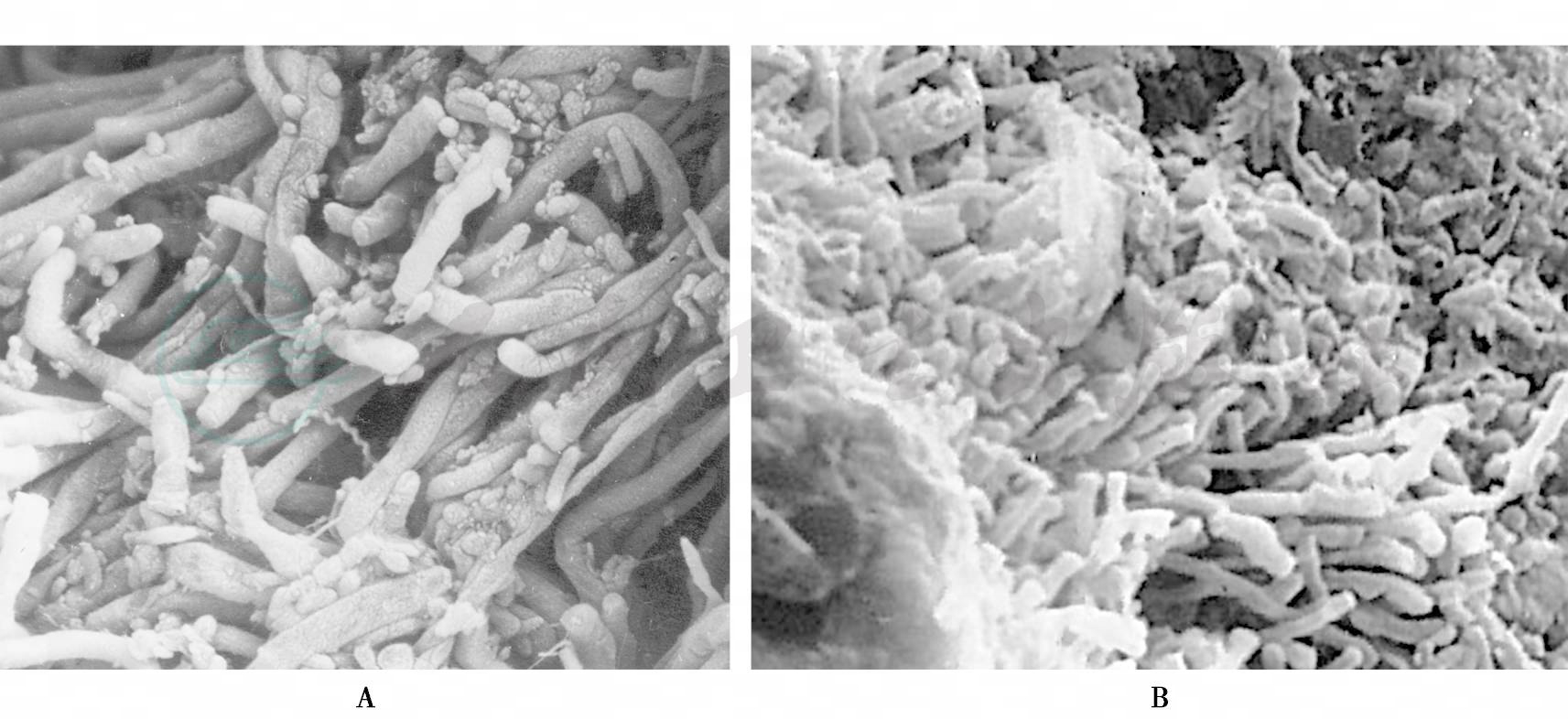
图7
A.附着性龈下菌斑(SEM×5000);B.试管刷样附着性龈下菌斑(SEM×5000)
2.非附着性龈下菌斑生物膜(unattached subgingival plaque biofilm)
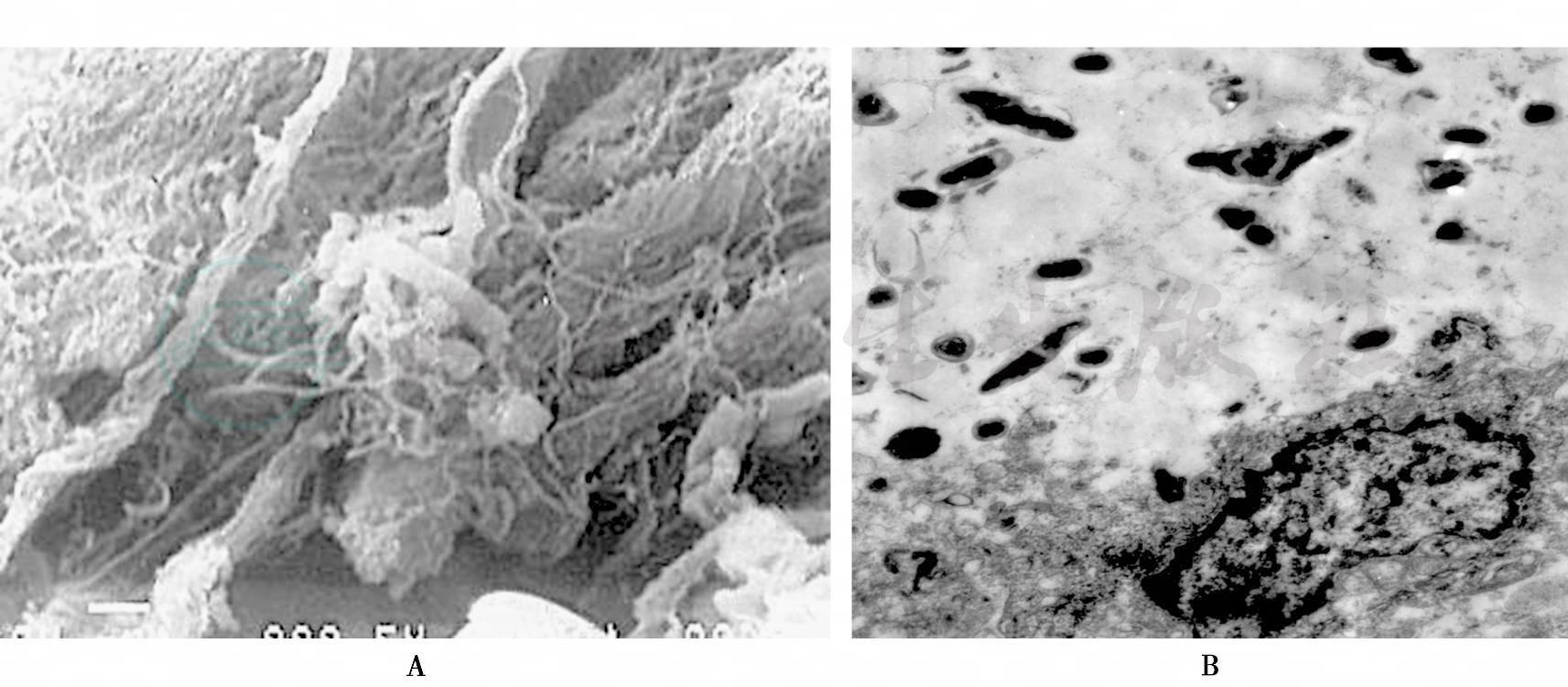
图8
A.非附着性龈下菌斑(SEM×7000);B.袋壁溃烂处可见较多入侵细菌(TSM×6000)
龈缘以下位于附着性龈下菌斑的表面或直接与龈沟上皮、袋内上皮接触的龈下菌斑称为非附着性龈下菌斑生物膜,为结构较松散的菌群,主要为革兰阴性厌氧菌,如牙龈卟啉单胞菌、福赛坦氏菌和具核梭杆菌等,还包括许多能动菌和螺旋体。在牙周炎快速进展时,非附着龈下菌斑明显增多,毒力增强,与牙槽骨的快速破坏有关,与牙周炎的发生发展关系密切,被认为是牙周炎的“进展前沿”(advancing front),有时在袋壁溃烂处可见较多细菌入侵,见图8。
Listgarten等(1978)提倡采用菌斑样本直接涂片,在暗视野显微镜或相差显微镜下检查牙周微生物的螺旋体、活动菌、杆菌、球菌和其他细菌的相对百分比变化,来评估牙周疾病,发现牙周病变区的杆菌和螺旋体数量较健康区多,活动菌(特别是螺旋体)的比例升高。
各种牙菌斑的特性比较见表2。
表2 各种牙菌斑生物膜的主要特性
三、牙菌斑生物膜的生态学
牙菌斑细菌之间以及与宿主之间的相互作用称牙菌斑生态系。基本的生物膜特征虽然对龈上菌斑和龈下菌斑均适用,但两者因物理位置不同,故又具有特殊的决定因素和不同的细菌组成。一般来说,龈上菌斑以G+需氧菌和兼性菌为优势菌,与龋病关系密切。龈下菌斑以G-兼性菌、厌氧菌和(或)活动菌为主,与牙周病关系密切。
龈上菌斑生物膜直接暴露于口腔,易受口内食物的机械作用及咀嚼摩擦作用的影响,还易受唾液冲洗和宿主防御成分的影响,如唾液中含SIgA、乳铁质、溶菌酶和过氧化酶等,细菌积聚受限。此外,食物的硬度也影响龈上菌斑的形成,软的食物(特别是碳水化合物)有利于菌斑的堆积。用光镜和电镜观察到早期龈上菌斑从牙面到菌斑外表面为不同形态的细菌呈栅栏状排列。
龈下菌斑生物膜藏匿在龈沟或牙周袋内,其生长主要受物理解剖空间的限制和宿主先天性防御系统的制约,因此比较薄。牙周健康者可供细菌生长的龈下空间有限,在加深的牙周袋中,龈下细菌不断扩展生长空间,而宿主则通过完整的上皮细胞屏障、吞噬细胞等先天性防御功能和获得性免疫成分来限制其扩展。牙周袋是一个相对停滞的环境,龈下菌斑所处的环境不易受口内摩擦作用的影响,缺乏唾液的冲洗和清洁作用,不易受唾液防御成分的影响,那些不易黏附于牙面的细菌(如能动菌、螺旋体等)有可能定居下来。此外,牙周袋内的氧化-还原电势低,有利厌氧菌的生长。龈沟液虽含细菌生长所需的各种营养物质,有利于牙周致病菌的生长,但龈沟液与血清成分相似,也含有效的抗菌成分,内含先天性和获得性免疫成分如溶菌酶、中性粒细胞、单核细胞、淋巴细胞、补体、抗体和IL-8等,对龈下细菌的抑制作用均较肯定。而机体防御机制之所以不能限制龈下菌斑的形成和扩展,主要原因在于龈下菌斑也是一种细菌生物膜结构,不同细菌间有共聚或黏附倾向,可通过表面分子的相互作用或分泌细胞间黏附基质,以生态群体方式协同地生长繁殖,故能长期生存,难以控制。如牙龈卟啉单胞菌常在黏放线菌定植的部位生长,可能与前者产生的牙龈素与黏放线菌之间的共聚反应有关;又如福赛坦氏菌的定植部位通常有具核梭杆菌,可能与具核梭杆菌能为福赛坦氏菌提供必需的营养成分有关。细菌团块之间基质的屏障作用,能阻止白细胞、抗体、补体等防御成分或药物的渗入,使细菌免于被杀灭。此外,菌斑中的一些细菌,尤其是革兰阴性菌,如牙龈卟啉单胞菌和伴放线聚集杆菌能够不断释放外膜或膜泡,膜泡内含脂多糖、脂质和蛋白质等,能“消耗”宿主免疫成分,从而有助于保护菌斑内细菌。
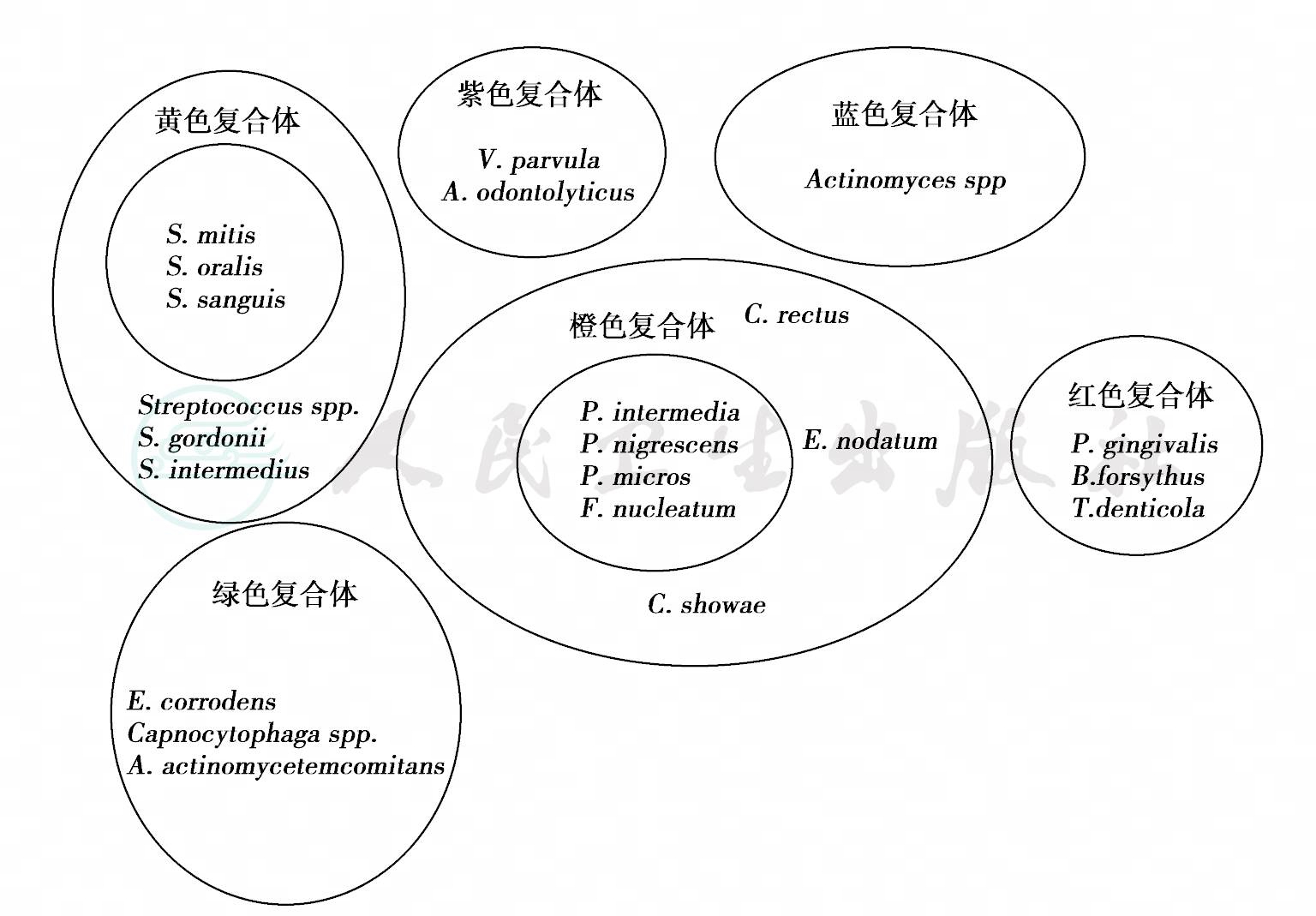
图9 Socransky等观察到龈下细菌的6个主要微生物复合体(1999)
龈下菌斑的常见特点为G+杆菌和球菌在根面形成一条紧密的附着带,而在邻近袋内壁上皮则为一条G-菌和(或)活动菌的带。细菌培养、免疫学或DNA探针等研究证明龈下菌斑样本中某些菌种经常同时存在。1999年,Socransky等对185名51岁±16岁的受试者(牙周炎患者160人,牙周健康者25人)的13 261个龈下菌斑样本,采用全基因DNA探针和棋盘式DNA- DNA杂交,判定40种常见龈下细菌的类别和水平,观察到龈下细菌的聚集有一定规律,按它们的聚集特性以及与牙周状况的关系,分为6个主要微生物复合体(microbial complex),分别以红、橙、黄、绿、紫、蓝表示,见图9。第一复合体(红):与牙周炎紧密相关的菌群,包括牙龈卟啉单胞菌、福赛坦氏菌(Tannerella forsythia,原名为福赛拟杆菌Bacterium forsythus)、齿垢密螺旋体(Treponemas denticola);第二复合体(橙):与牙周炎紧密相关的核心群,包括中间普氏菌、变黑普氏菌(Prevotella nigrescens)、微小微单孢菌(Micromonas micro,原名为微小消化链球菌Peptostreptococcus micros)、具核梭杆菌和直肠弯曲菌(Campylobacter recta,原名直肠沃廉菌Wolinella recta)、缠结优杆菌(Eubacterium nodatum)和昭和弯曲菌(Campylobacter showae);第三复合体(黄):由血链球菌、口腔链球菌、轻链球菌、格登链球菌及中间链球菌(Streptococcus intermedius)等组成;第四复合体(绿):包括3种二氧化碳噬纤维菌(Capnocytophaga)、简明弯曲菌、侵蚀艾肯菌、伴放线聚集杆菌;第五复合体(紫):由小韦荣菌(Veillonella parvula)和溶齿放线菌构成;第六复合体(蓝):由放线菌构成。
其中第一复合体与牙周临床参数、特别与牙周袋深度和探诊出血紧密相关,第二复合体也与牙周袋深度相关,红色与橙色复合体之间有密切联系,在牙周病的诊断方面富有意义。改变红色复合体会影响其他复合体,改变橙色复合体会阻止红色复合体的定植,不同治疗方法影响微生物丛的部位不同。了解龈下菌种之间的关系有助于理解菌斑复合体的生态关系及制定控制菌斑的对策,有助于指导牙周病的诊断治疗。
龋病和牙周病是人类的常见病和多发病,均以牙菌斑生物膜为主要病因,但因为致病细菌、发病机制及临床表现迥异,人们常把牙周病和龋病看成两种独立的疾病,往往将它们隔离开孤立地研究,忽视它们的彼此联系和相互影响。尽管有些临床现象值得注意,有些易患牙周病的人,少有龋齿,而另些易患龋病的人,似对牙周病免疫;也有不少学者企图寻找它们发生发展的关系,有些认为它们相互对抗,另一些又认为它们相关,但至今尚未得到直接的实验证据。近几十年来,口腔微生态日益受到重视,逐渐注重牙周病和龋病这两相关学科“结合部”的微生态联系,揭示它们发生发展以及生态受损、重建等有价值规律,已成为当前研究的热点。不同组合牙周病和龋病致病菌之间消长、共生或拮抗的研究,发现嗜酸乳杆菌和血链球菌,具明显的抑制牙周致病菌作用,在牙龈卟啉单胞菌、伴放线聚集杆菌、具核梭杆菌与嗜酸乳杆菌混合培养后,它们的菌量均较单菌培养显著降低(P<0.01),而嗜酸乳杆菌的菌量在12、24小时时增加(P<0.01),48小时无显著差异(P>0.05),提示将嗜酸乳杆菌等益生菌作为生态调节剂,限制某些牙周致病菌生长的牙周替代疗法值得深入研究。
四、牙菌斑生物膜致病的学说
在为数众多的菌斑微生物中,究竟哪一种或哪一群微生物是牙周病的致病菌,迄今仍是一个悬而未决的问题。近100多年来,关于牙周病的细菌病因,由于时代背景、研究方法、认识观点不同,形成了对立的两大学派:非特异性菌斑学说和特异性菌斑学说。
(一)非特异性菌斑学说(non- specific plaque hypothesis)
早在1890年,Miller就提出牙周病是由非特异性的口腔正常菌群混合感染所致的非特异性菌斑学说。20世纪50~60年代,普遍认为在牙周健康者与牙周病患者之间、同一个体的不同牙位之间或不同类型牙周病之间,其菌斑组成相似,认为牙周病主要由于细菌数量增多、微生物毒力增大或宿主抵抗力降低引起。非特异性菌斑学说强调菌斑细菌的量,认为牙周病不是一种微生物引起的疾病,牙周病的发生、发展是菌斑内总体微生物联合效应的结果,即由非特异性的口腔菌群混合感染所致。其主要依据是:将健康者或牙周病患者的牙菌斑悬液接种于动物皮下,均可引起局部脓肿;临床上和流行病学证据表明,菌斑牙石多者,牙周病较重。根据此假说,牙周病的治疗有赖于清除菌斑和控制菌斑的堆积。
然而,此观点不能解释:为何有些人的菌斑和牙石很多,龈炎很严重,年代经久,却不发展成牙周炎;相反,有些人仅有少量菌斑,却发生严重的牙周组织破坏;为何有的患者仅某些牙发生牙周破坏,而另些牙却不受侵犯。
(二)特异性菌斑学说(specific plaque hypothesis)
早在1890—1930年,曾先后有不少学者试图将原虫、螺旋体、链球菌等与牙周病联系起来,但因未能符合确定病原菌的Koch法则(Koch' s postulate),而不能成立。20世纪70年代初期,随着厌氧微生物培养技术及各种先进研究手段先后应用于牙周微生物学领域,人们对于牙周病细菌病因的认识进入一个新时代。以Loesche、Slots、Socransky及Newman等为代表的学者,对牙周病与某些特殊细菌之间的关系作了大量开拓性研究,提出了许多令人信服的证据,如在局限型侵袭性牙周炎(原名青少年牙周炎)患者的深牙周袋中分离出特异性细菌———伴放线聚集杆菌。1976年,Loesche正式提出特异性菌斑学说,认为口腔中只有某些微生物是牙周致病菌,当它们在菌斑中存在或数量达到一定程度时即可致病。该学说强调菌斑细菌的质,认为菌斑不是均质的细菌团块,在牙周健康区与病损区、不同类型牙周病的病损区之间,菌斑微生物的构成不同,在为数众多的口腔微生物中,绝大多数细菌是口腔正常菌丛,仅少数具毒力和能损害宿主防御功能的特异致病菌,才对牙周病的发生发展起关键作用。
虽然各方面研究支持特异性菌斑学说的观点,但是该学说同样存在着一些有待研究的问题。除了少数细菌的致病作用较明确(如伴放线聚集杆菌与局限型侵袭性牙周炎密切相关)外,对于很多其他细菌来说,究竟何种细菌是何类牙周病的特异致病菌,迄今仍无定论;临床上似乎还没有仅去除某特异致病菌、保留其他细菌而治愈牙周病的足够证据;某些证明有效抑制牙周致病菌的药物,如四环素、螺旋霉素、甲硝唑等,多属广谱抗菌药;某些“特异”牙周致病菌在牙周健康的部位也能检出等。从目前的多数研究结果来看,特异性菌斑学说似乎能较圆满地解释侵袭性牙周炎,而对龈炎和慢性牙周炎尚不能圆满解释。
(三)菌群失调学说(dysbacteriosis hypothesis)
20世纪80年代,Genco等学者根据牙周感染的来源和牙周致病菌的概念提出一个折衷的观点,认为牙周病是一组由不同病因引起的疾病,某些类型的牙周病是由外源性的特异致病菌感染所致,而另一些类型可能由内源性的口腔正常菌群比例失调或某些细菌过度增殖而成为机会性致病菌所致。1986年,Theilade提出看似折中的观点,认为破坏性牙周病(即牙周炎)是由口腔中的正常菌群在龈下定居,其中某些毒力较大的细菌出现的频率高,所占的比例和绝对数也高,并具有干扰宿主防御系统的能力,因此在发病中起的作用较另一些细菌大。实质上就是菌群失调的观点,也就是说,牙周炎是一种机会性感染(opportunistic infection)。
从微生态角度来看,口腔是一个复杂完整的生态区,由众多生态系组成,每个生态系的生物都可能与口腔的健康和疾病有关。某些重要的毒性菌株并非单独致病,可与其他菌共同或先后作用,导致疾病发生和加重。典型的例子如局限型侵袭性牙周炎在发病初期以兼性厌氧的伴放线聚集杆菌为主,在深牙周袋形成和生态环境改变后,有利于牙龈卟啉单胞菌、侵蚀艾肯菌等专性厌氧菌或齿垢密螺旋体的生长,它们可以继续造成组织破坏。
任何研究进展、学说创立或学派形成,均与当时的基础知识和科学水平密切有关。牙周病究竟是外源性特异性致病菌所致,还是内源性口腔正常菌群所致,迄今尚无定论。牙周病学者已不满足于以简单的病原微生物观点来解释牙周病,转向用微生态规律,以宿主的牙周组织内环境为重心,研究牙周微生物和宿主相互之间的动态关系,以综合、全面和动态的观点来探讨牙周病的病因、发病机制和变化规律,这一领域还有待于作大量研究,逐步完善。
五、日益受关注的病毒研究
在牙周病的病因研究中,有关细菌的研究较多,病毒的研究日益受关注。病毒(virus)是19世纪末才被发现的一类由核酸和蛋白质等少数几种成分组成的微小病原体,其本质是一种仅含DNA或RNA的遗传因子。它们既无产能酶系,也无蛋白质和核酸合成酶系,它们能以感染态和非感染态两种状态存在。病毒在宿主体内呈感染态,依赖宿主的代谢系统获得能量,合成蛋白质和复制核酸,通过装配,大量繁殖,有些病毒的核酸还能整合到宿主的基因组中,诱发潜伏性感染;在离体条件下,它们能以无生命的生物大分子状态长期存在,并保持其侵染活性。
病毒学和细菌学的关系最为密切,它们的研究对象都是极微小的生物,在研究方法和技术上有不少共同之处,但是大多数病毒体积很小,直径约为20~200nm,能通过滤过噐,不能用光学显微镜观察,必须借助电子显微镜观察,不能在人工培养基上培养,仅能在活的细胞内生长繁殖。病毒与宿主或细胞的关系复杂,病毒分离、培养和鉴定困难,基因往往具有多态性,不同基因型病毒的致病种类、致病性及预后均有较大差别。一般用血清学方法辅助诊断,或用标记DNA探针核酸杂交或PCR法检测病毒DNA。在病毒数量和毒力测定时,必须观察病毒感染所引起的病征、病理变化或接种组织培养后的细胞变化,因此牙周病的病毒研究年代不久,进展较慢。
目前,牙周病的病毒研究主要集中在疱疹病毒(herpesvirus),普遍认为疱疹病毒与牙周病之间的关系值得探讨。疱疹病毒是一群中等大小、球形、有胞膜的DNA病毒。病毒核衣壳为162个壳微粒组成的立体对称20面体,直径约为120~150nm,其内由线形DNA组成核心,核衣壳周围有一层厚薄不等的非对称被膜,最外层为包膜,表面有病毒编码的糖蛋白组成的刺突。已识别的与人类有关的疱疹病毒有8种:单纯疱疹病毒1型和2型(herpes simplex virus,HSV,HSV- 1、HSV- 2)、带状疱疹病毒(varicella- zoster virus,VZV)、EB病毒(Epstein- Barrvirus,EBV)、人巨细胞病毒(human cytomegnlovirus,HCMV)和人疱疹病毒6、7、8型(human herpesvirus,HHV,HHV6、HHV7、HHV8)。病毒感染宿主细胞可表现为增殖性感染,引起细胞破坏,或病毒DNA稳定地潜伏于细胞核内,表现为潜伏性感染,病毒基因组的表达受抑制,受刺激激活后又转为增殖性感染。近年研究表明HCMV、EBV- 1和HSV可能与牙周炎的发病有关。已知HCMV属β疱疹病毒,可感染各种不同的上皮细胞、T细胞和单核-巨噬细胞。EBV是一种嗜B细胞的γ单纯疱疹病毒,主要侵犯B细胞,过去认为只有B细胞表面有EBV受体,最近发现在腮腺导管、咽部以及某些上皮细胞也有EBV受体,EBV- 1可感染B细胞和T细胞,使之凋亡。HSV是疱疹病毒的典型代表,结构见示意图10,其宿主范围广,复制周期短,致细胞病变作用强,是口腔感染的最常见病毒,皮肤、眼、会阴及中枢神经系统也易受累。
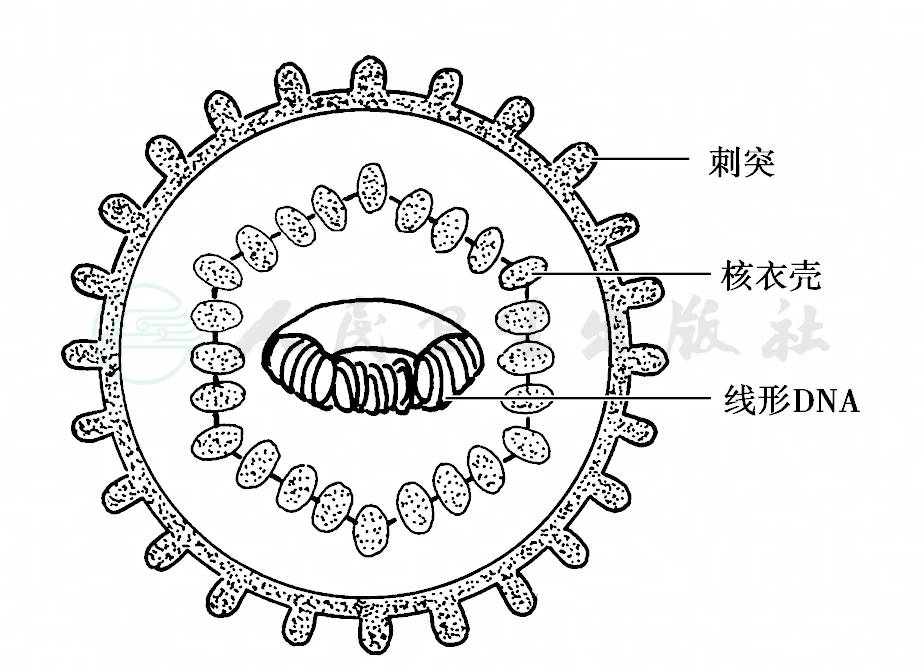
图10 HSV结构示意图
国外有文献报道采用PCR方法,在侵袭性牙周炎、重度慢性牙周炎、掌趾角化-牙周破坏综合征(Papillon- Lefévre综合征)及坏死性溃疡性龈炎的牙周病变活动部位(active sites)常检测到HCMV和EBV- 1。Kamma等检测16例侵袭性牙周炎患者的龈下菌斑样本,发现在病变活动部位(active sites)HSV、HCMV和EBV- 1的检出率显著高于病变稳定部位(stable sites)(43.8%vs 3.1%,P<0.001);此外,还发现活动部位的某些疱疹病毒与牙龈卟啉单胞菌、侵肺戴阿利斯特杆菌(Dialister pneumosintes)、伴放线聚集杆菌或福赛坦氏菌的混合感染率显著意义高于稳定部位(40.6%vs. 0%,P<0.001),这些结果支持某些疱疹病毒和特异菌群的混合感染与牙周炎的活动进展有关。
此外,值得一提的是艾滋病(acquired immune deficiency syndrome,AIDS),即获得性免疫缺陷综合征,病原体为人类免疫缺陷病毒(human immunodeficiency virus,HIV),属于反转录病毒科的慢病毒亚科,是一种典型的C型RNA病毒,病毒颗粒呈星形或卵形,直径约为100~140nm,是一种不耐高温脆弱的病毒,离开人体不易生存,其结构见示意图11。HIV进入人体后,可以选择性地与CD4+各类淋巴细胞表面的CD4受体结合,从而封闭正常抗原呈递过程,下调免疫系统的信号传导功能,诱导CD4+淋巴细胞的凋亡,尤其是T4淋巴细胞,使依赖T4细胞调节的各种免疫功能处于失控状态,细胞免疫功能相应衰退,导致发生机会感染或罕见的卡波西肉瘤(Kaposo' s sarcma)。自1981年在美国首先发现艾滋病后,在世界广泛流行,已成为日趋严重的社会健康问题,其临床症状一旦出现,一般致死。
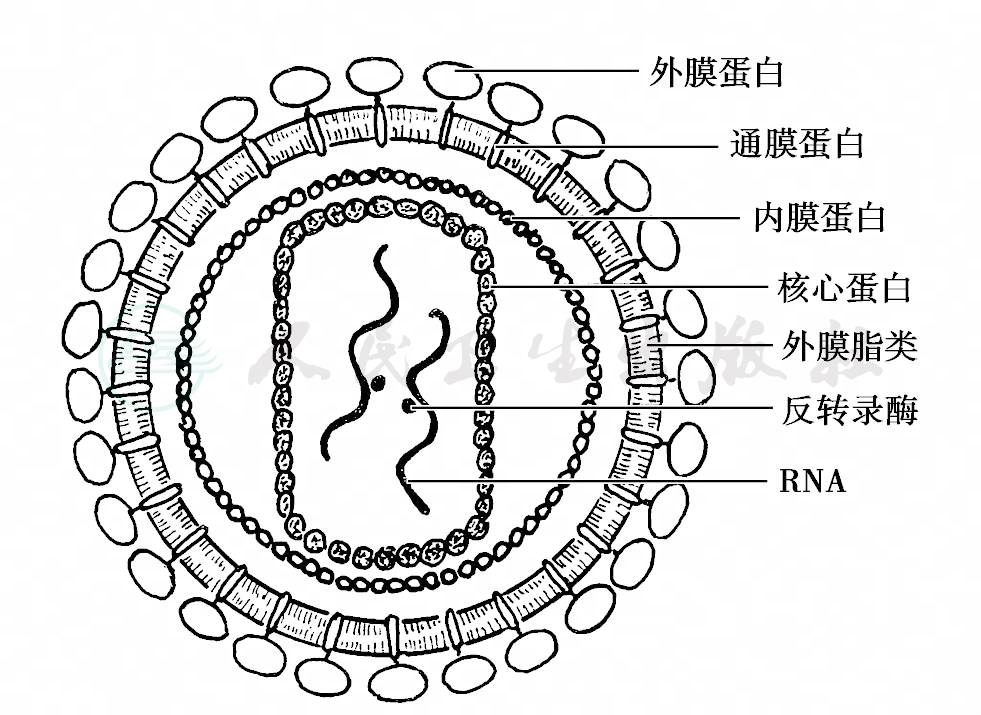
图11 HIV结构示意图
HIV感染的口腔表现很多,牙周损害的早期可以表现为牙龈乳头坏死、溃疡、疼痛及出血,牙周组织丧失和骨组织快速破坏,具弥散至颌骨的非局限性疼痛,还可见一种与AIDS有关的线形牙龈红斑(linear gingival erythema,LGE),为起于游离龈缘的红色线纹及附着龈的红淤,据观察这种LGE可能是由于白色念珠菌感染所至。AIDS在口腔表现还有口腔毛状白斑、白色念珠菌感染、疱疹性口炎、带状疱疹等,约在75%伴HIV感染的牙周炎患者的龈下菌斑中检出白色念珠菌,而龈下厌氧环境通常并非是白色念珠菌集聚处,菌群定居的变化反过来反映了机体的免疫异常。
现已明确HIV可广泛存在于患者的体液中,尤以血液、精液及脑脊髓液中的病毒密度最高,其次为唾液、泪液、尿液、乳汁、羊水及阴道分泌物。然而,早期HIV携带者常无任何症状,临床上不易识别。人体一旦遭受HIV侵入,病毒将会和细胞整合在一起,将终生携带病毒,终生传播病毒,AIDS病例未有自愈者,尚无特效疗法。我国的AIDS发病形势也很严峻,高危人群广发和复杂,口腔医务人员面临着感染HIV的风险,防止意外感染应引起足够的重视,要提高医疗预防措施,如适当的屏障,包括每诊治一个患者换一副手套、使用保护性眼镜、口罩、工作服等,要严格实施抗感染消毒原则。
病毒-细菌之间的作用可能是双向的,一方面病毒感染具有降低宿主抵抗力的潜能,导致局部免疫功能下降或异常,增加细菌感染的风险,有利于牙龈卟啉单胞菌、伴放线聚集杆菌、中间普氏菌、变黑普氏菌、福赛坦氏菌和齿垢密螺旋体等牙周致病菌的定植和繁殖;另一方面,细菌造成的牙龈炎症可能有利于病毒感染细胞,进入牙龈组织。这些感染因子之间的相互作用以及有关的宿主反应在牙周炎进展中的作用需进一步研究,纵向研究可以帮助阐明牙周病发生与龈下牙周致病菌和病毒的因果关系。
一、牙周致病菌的概念
牙菌斑中绝大多数细菌为口腔正常菌丛,是人类与微生物长期共存进化过程中形成的微生物群,对宿主无不良影响,仅少数细菌(约30种左右)与牙周病的发生、发展密切相关,在各型牙周病的病损区,常可分离出一种或几种优势菌,它们具有显著的毒力或致病性,能通过多种机制干扰宿主防御能力,具有引发牙周破坏的潜能,称之为牙周致病菌(periodontal pathogen)。
二、识别牙周致病菌的标准
从人类口腔内已分离出700多种不同微生物,在为数众多的口腔微生物中,哪些是牙周病的致病菌?确定牙周病致病菌的标准是什么?一个多世纪以来,各国学者在锲而不舍地探索。由于菌斑细菌种类繁多,对许多细菌的特征未完全了解,对菌斑生态学的了解十分肤浅,因此至今仍未彻底解决。
确定病原菌一般要符合经典的Koch法则(1884),其规定为:①在同样的疾病中能发现同一种病原菌;②能从该疾病组织中分离出病原菌并纯培养;③这种纯培养物接种至易感动物能引起相似的疾病;④能从实验动物中重新获得病原菌纯培养。随着科学的进展,发现此法则过于偏重病原菌的致病作用,忽视了机体的防御功能。但该法则在确定某一新病原菌时仍有重要的指导意义,可避免从病灶中分离到某菌就轻易下病原菌的结论。
牙周病与Koch当时研究涉及的炭疽、结核和霍乱等传染病(外源性感染)有显著不同,牙周病(内源性感染)伴随着一系列更为复杂的因素,因此确定牙周致病菌时,必须加以修正。
Socransky(1979)对Koch法则修改为:①病原菌必须在病损部位增多,在健康部位或其他类型牙周病较少或缺如;②消灭或减少该病原菌后,疾病应中止;③宿主对某特异细菌的细胞免疫或体液免疫增强或减弱,可为该细菌在疾病过程中起特殊作用提供重要线索;④接种该细菌于易感动物或无菌动物的龈沟,会引起类似人牙周炎的病变,如炎症、结缔组织破坏和骨吸收;⑤明确该细菌的致病性和毒性因子,即该菌引发疾病的机制。
Smith(1979)从另一角度考虑,认为作为牙周病原菌必须满足以下4个基本条件:①能定居于宿主组织;②能利用宿主环境中的营养,存活和繁殖;③能逃避宿主的防卫功能;④具毒力,能进一步损害宿主组织。该判断病原菌的基本条件,简明扼要,有一定的现实意义。
Socransky(1992)归纳了牙周病致病菌的条件:①必须是毒性克隆株;②具有引发疾病的染色体遗传因子;③宿主必须对该菌易感;④数量超过宿主阈值;⑤寄居于适当部位;⑥其他菌群必须促进或至少不抑制其致病过程;⑦局部环境有助于毒性因子的表达。
上述牙周病致病菌的评判标准,均未根本背离Koch法则,只是在研究牙周微生物的过程中,遇到更为复杂的生态关系时,设想得更为全面的衡量标准。
三、牙周细菌与疾病的关系
牙周细菌的数量、组成与牙周健康状况有关。牙周健康时,细菌数量较少,多数为需氧或兼性的革兰阳性链球菌和放线菌,革兰阴性杆菌仅占15%左右,宿主能产生有效的防御反应,维持牙周健康。大量研究表明,牙周组织破坏与龈沟细菌从有发酵能力的革兰阳性需氧或兼性优势菌转向能分解蛋白的革兰阴性厌氧有机营养菌密切有关,牙龈炎时牙周细菌数量增加,革兰阴性菌增加,上升至30%~50%,牙周炎时龈下菌斑细菌的数量显著增加,革兰阴性厌氧菌可高达75%,活动杆菌和螺旋体常占优势,它们释放入牙周的抗原不同,会影响机体的反应。
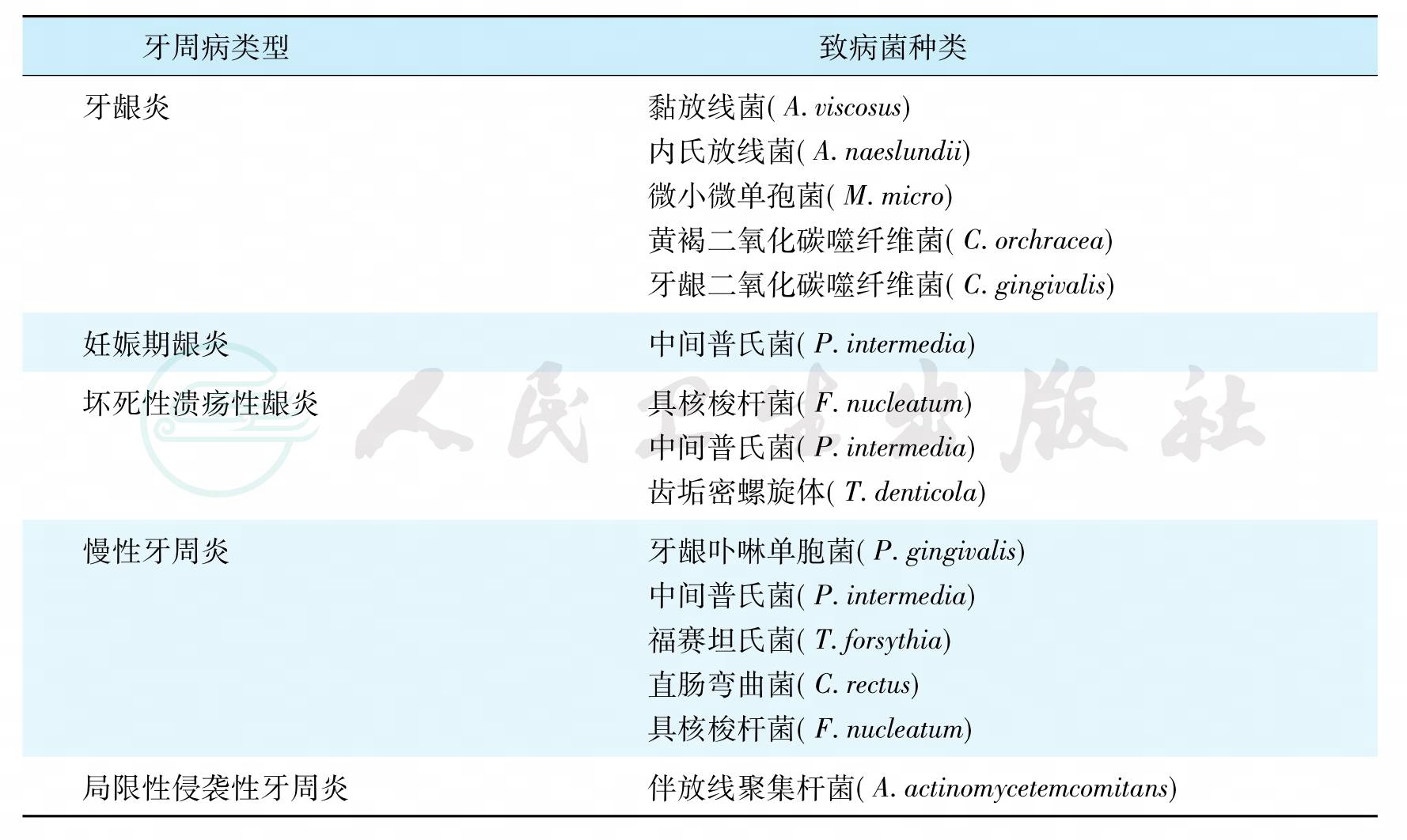
关于与各型牙周病有关的致病菌的检出情况,各家报道不尽相同,但有些结果较为一致,见表3。
表3 各型牙周病有关的致病菌
四、重要的牙周致病菌
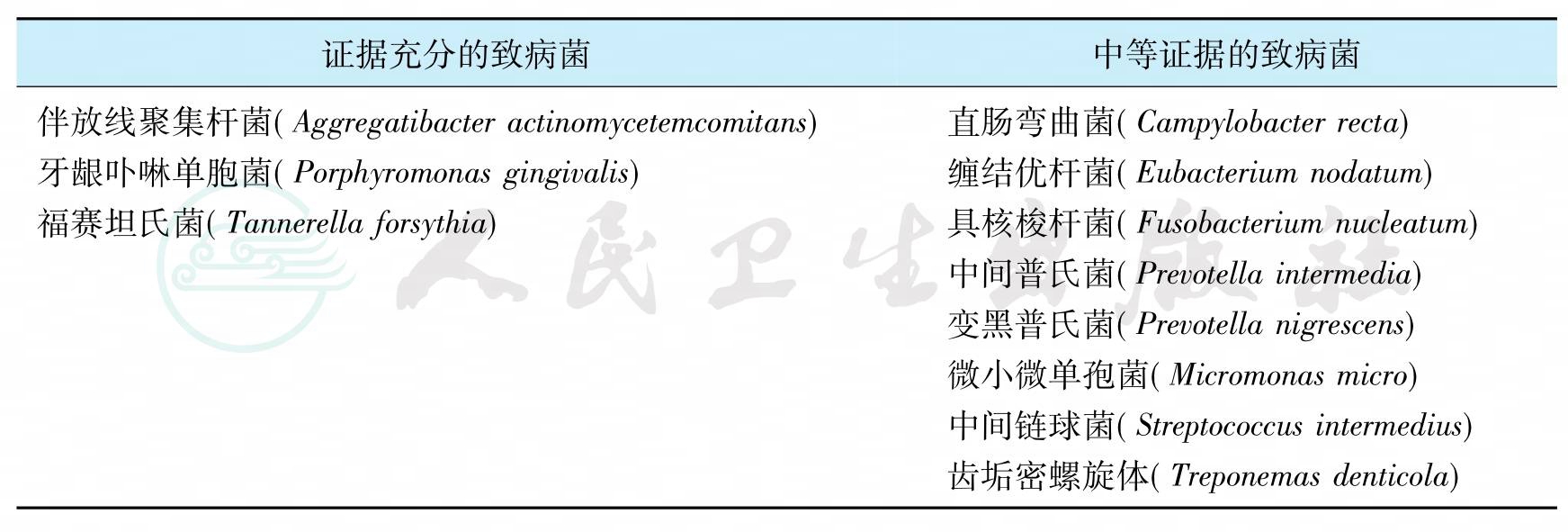
1996年召开的世界牙周病研讨会上,专家们一致认为下列11种微生物与牙周病密切有关,为重要的牙周致病菌,见表4。
表4 各型牙周病有关的致病菌
几种主要的牙周致病菌的生物学特性、致病性和临床意义如下:
(一)伴放线聚集杆菌( Aggregatibacter actinomycetemcomitans)
该菌为20世纪70年代发现之菌种,最先被归于放线杆菌属(Actinobacillus),因常与放线菌共生,命名为伴放线放线杆菌(Actinobacillus actinomycetemcomitans)。一度由于其具有嗜血菌属的生长特征,又被归入嗜血菌属(Haemophilus),称为伴放线嗜血菌(Haemophilus actinomycctemcomitans)。2006年,根据DNA同源性研究和16S rRNA序列分析,该菌归属于全新的聚集杆菌属(Aggregatibacter),被命名为伴放线聚集杆菌(Aggregatibacter actinomycetemcomitans),它们实质上是异名同菌,只是归属不同。A. actinomycetemcomitans是多年来在牙周炎的细菌病因学研究中,讨论得最多和研究较深入的细菌之一,公认其与牙周炎(特别与侵袭性牙周炎)关系密切。
1.生物学特性
革兰阴性短杆菌,有的略弯曲,无芽胞、无动力,成单、成双或小堆状排列,多次传代后菌体可较长。为微需氧菌,但在无氧或5%~10%CO2环境下均可生长,最适生长温度为37℃,在血清琼脂或血琼脂上可形成圆凸、边缘不规则、半透明、湿润、底部有星状或交叉的雪茄烟状菌落,黏着于琼脂不易剥离,见图12。在肉汤培养液中管底生长物呈颗粒状,并牢固地黏附于管壁,多次传代后可呈均匀混浊生长。根据血清学试验结果不同,A. actinomycetemcomitans可分为a、b、c、d、e和f 6个血清型(serotype),国外文献报道,b型为侵袭性牙周炎龈下菌斑中最常见的血清型,毒力最强;d型和e型较少见。但在我国人群中分离出的以c型为主,b型较少。
2.致病性和临床意义
表面有许多细小的突起、不定形结构和菌毛等附着器,因此较容易定植在牙周袋内,它能入侵牙龈组织。有人认为它表面还有荚膜结构,能抵抗吞噬细胞的吞噬和消化。它可产生许多毒性因子,如白细胞毒素、细菌素、趋化抑制因子、细胞毒素因子、Fc黏合蛋白、内毒素、胶原酶和抗生素抵抗因子等。它在生长期间还能排出许多膜泡(图12D),内含内毒素、白细胞毒素和骨吸收因子等毒性因子,均可造成牙周组织的破坏。
A. actinomycetemcomitans的致病作用主要包括3个方面:①降低宿主抵抗力:它是唯一能分泌白细胞毒素(leukotoxin,LTX)的细菌,LTX可损伤人牙龈内和外周血中的中性粒细胞、单核细胞和淋巴细胞的细胞膜,导致白细胞死亡,释放溶酶体,造成牙周组织的破坏,它还能产生中性粒细胞趋化抑制因子、淋巴细胞抑制因子和杀上皮毒素等,可阻止白细胞向炎症部位集中,降低牙龈局部的防御力;②骨吸收作用:它具有内毒素,能刺激巨噬细胞释放白介素(IL- 1、IL- 1β)及肿瘤坏死因子(TNF)等,可通过膜泡释放到细菌外,造成牙槽骨吸收;③组织破坏作用:能产生细胞毒素因子和成纤维细胞抑制因子,能抑制牙周组织内成纤维细胞合成胶原,胶原酶能降解牙周组织中的胶原和结缔组织,促使附着丧失,形成牙周袋,破坏牙周组织。
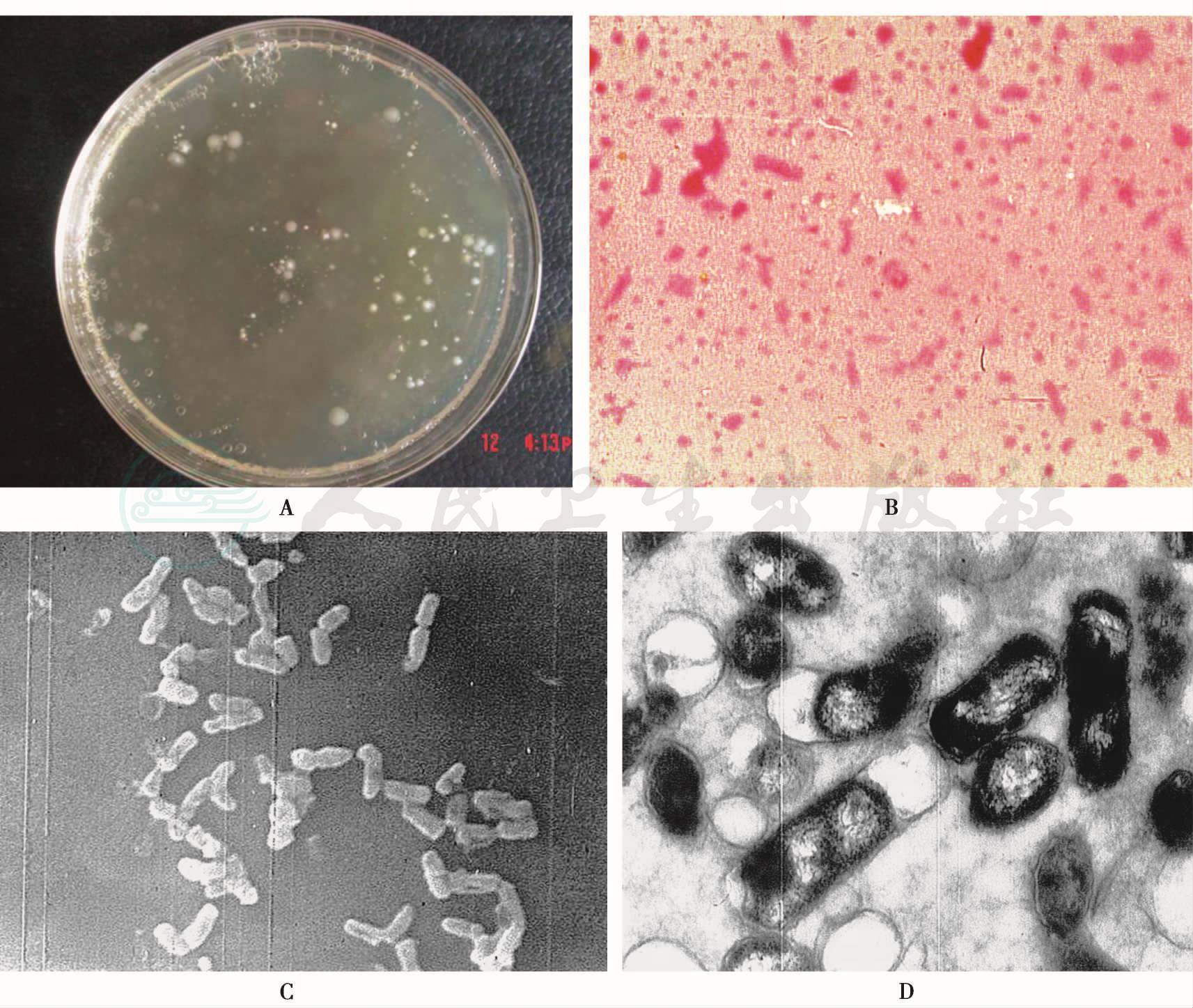
图12 伴放线聚集杆菌
A.菌落形态;B.革兰染色菌体形态;C.扫描电镜图像(SEM×5000);D.透射电镜图像,可见膜泡(TEM×15 000)
在上述毒性因子中,LTX被认为是一个最重要的决定因子,研究得较深入。LTX是一种对高温和蛋白酶敏感的蛋白质,分子量为1.15×105,其C末端为一系列富糖基的重复序列,参与阳离子结合。研究证实高浓度的LTX可在短时间内杀死人的中性粒细胞、单核细胞和淋巴细胞。它是一种孔形成毒素,可使靶细胞膜形成微孔,导致水进入胞内,使细胞溶解死亡,而在低浓度条件下可导致细胞凋亡(apoptosis)。
LTX由多基因操纵子编码,包括1txC、1txA、1txB和1txD基因,这些基因均与LTX的功能有关。其中1txA编码LTX结构,产生无活性的“前毒素”状态;1txC具有激活“前毒素”的功能。多年来,人们一直认为LTX存在于菌体之中。最近研究表明,某些A. actinomycetemcomitans在早期生长阶段,便可分泌大量的LTX到胞外,1txB和1txD基因则参与细菌分泌LTX的过程。
某些A. actinomycetemcomitans菌株具有高毒力,能够产生高水平的LTX,而另些菌株则毒力弱,仅产生低水平的LTX。在对LTX研究中发现白细胞毒素启动基因区的DNA序列有变异,该区域由特异的DNA片段组成,为DNA聚合酶提供一个识别和结合位点,而DNA聚合酶负责DNA合成,不同启动基因的转录水平不同,导致mRNA水平差异及产生的蛋白质差异。
基因表达的调控是以mRNA为基础的,称为转录控制。对1txC基因的DNA序列研究表明高毒力株存在着DNA序列530碱基对缺失。对mRNA分析表明高毒力株存在着发挥作用的P1和P2两个启动基因,产生的mRNA、白细胞毒素量和毒性相当大,与环境中氧浓度无关。而极低毒力菌株仅有一个P3启动基因,负责最初的转录,P3启动基因存在于高毒力株缺失的530碱基对区域,P3启动基因受细菌生长期间氧水平的调控,在厌氧环境下mRNA增多,白细胞毒素表达增加,细菌毒性可增加3~4倍。DNA序列中有无530碱基对缺失为区分高、低毒力株提供标志,该标志可采用PCR技术检测。
据西方国家的学者报道,从局限型侵袭性牙周炎患者牙周袋中分离出A. actinomycetemcomitans的阳性率可高达97%,经过有效的牙周治疗后,该菌消失或极度减少,而同一患者口腔的健康部位、慢性牙周炎患者或健康者则检出率低于20%。但是,亚洲地区国家(包括我国)的一些研究显示,这些国家的侵袭性牙周炎患者牙周袋中该菌的检出率要低得多。近来,还有报道A. actinomycetemcomitans可在局限型侵袭性牙周炎和某些类型牙周炎患者的家庭成员中传播。A. actinomycetemcomitans有在龈下附着、定居、生长和繁殖的条件,又有逃避宿主防卫功能以及损伤宿主牙周组织的致病潜力,表明它很可能是局限型侵袭性牙周炎的重要病原菌。
(二)牙龈卟啉单胞菌(Porphyromonas gingivalis)
牙龈卟啉单胞菌又译作牙龈紫质卟啉单胞菌,以前归拟杆菌属,称为牙龈拟杆菌(Bacteroides gingivalis)。由于其生物、化学特性与拟杆菌的典型菌株———脆弱拟杆菌有明显差异,1988年,Shah等将它从拟杆菌中划出而成一新属———卟啉单胞菌属(Porphyromonas),命名为牙龈卟啉单胞菌(Porphyromonas gingivalis),牙龈卟啉单胞菌和牙龈拟杆菌实质上是异名同菌。P. gingivalis是牙周病、尤其是慢性牙周炎病变区或活动部位最主要的优势菌,而健康龈沟内很少,它的存在与牙周炎治疗后复发或病情继续加重有关。它是目前公认的牙周致病菌,是牙周微生物领域重点研究的厌氧菌之一,已从微生物学、毒理学、分子免疫学、分子生物学和基因遗传工程等方面进行了深入研究,获得了许多重要结果。
1.生物学特性
为革兰阴性无芽胞的球杆菌,表面有纤毛,其模式株为ATCC 33277。专性厌氧,最适生长温度为35~37℃,在血平板上可形成特征性的黑色菌落。P. gingivalis不能降解糖作为生命活动所需的能量来源,也不能利用游离氨基酸作为生命合成所需的前体,它能产生许多蛋白水解酶,将蛋白质降解成短肽链,提供碳、氮和能量。当培养基中加入氯化血红素、维生素K和冻溶血时,黑色出现较快。以前错误地认为它能产生黑色素,现在已明确此黑色是由于吸收血红蛋白和聚集血红素所致,见图13。
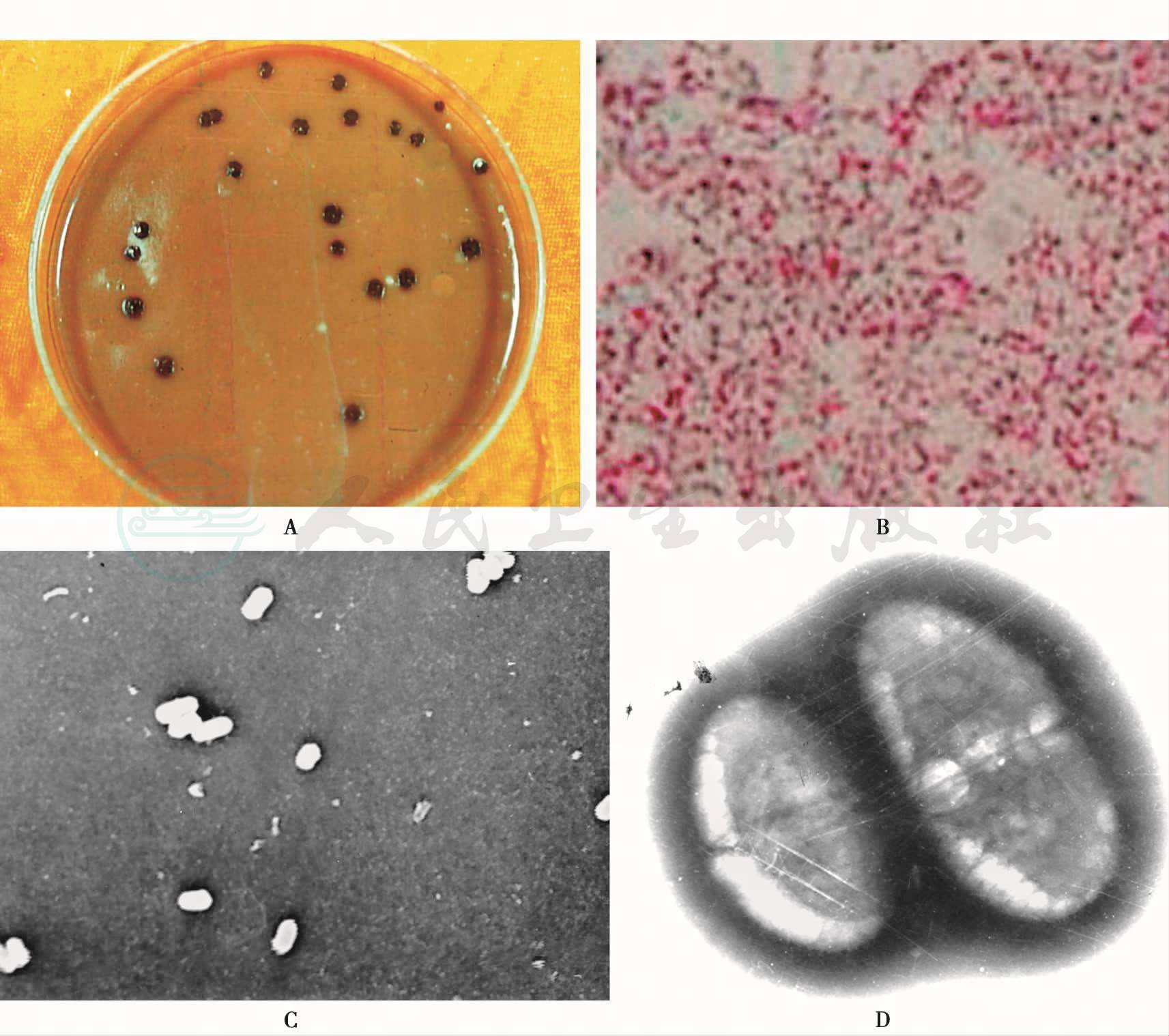
图13 牙龈卟啉单胞菌
A.菌落形态;B.革兰染色菌体形态;C.扫描电镜图像(SEM×5000);D.透射电镜图像,可见菌毛(TEM×20 000)
2.致病性和临床意义
(1)有关附着和凝集的因子:
细菌附着于宿主组织细胞是致病的先决条件,体外实验发现P. gingivalis能附着于颊黏膜、牙周袋上皮及菌斑其他细菌的表面,附着并凝集人或羊红细胞等,它的表面结构(如疏水性强的周边纤毛、荚膜、外膜、膜泡)和一些蛋白酶等均与这些功能有关,它的一些因子[如植物凝聚素(lectin)、脂多糖(LPS)等]直接起着黏聚分子的作用。
(2)抵抗宿主先天性免疫系统:
P. gingivalis能阻断防御反应的关键步骤,如不能直接刺激内皮细胞产生选择素E(E- selectin),使白细胞不能与内皮细胞贴壁,不能向血管外游走。P. gingivalis或它的脂多糖还能抑制单核细胞趋化蛋白- 1(monocyte chemotaxis protein- 1,MCP-1)、白介素-8(IL-8)和细胞间黏附分子(intercellular adhesion molecule,ICAM)等白细胞趋化因子在内皮细胞、牙龈成纤维细胞和牙龈上皮细胞的表达,从而逃避或抑制宿主对细菌的先天性免疫反应,保护其自身和其他菌斑细菌得以定植和生长。它还能释放外膜膜泡或脱落胞壁片段,能吸引和结合宿主的先天性免疫成分,有助于保护菌斑内其他细菌,使它们免受攻击;膜泡包容和浓缩了细菌的许多毒性成分,可作为毒性产物的载体;膜泡体积小,可透过上皮屏障,扩大了毒理作用范围。P. gingivalis还能侵入牙龈上皮细胞,隐藏在宿主细胞内,进入逃避宿主先天防御的安全区,提供再次感染的病原菌。宿主缺乏有效的先天性免疫反应可能是某些牙周病发展的重要因素。
(3)分泌大量的毒力因子:
产生多种胞外蛋白酶(如牙龈素、胶原酶、肽酶)、内毒素、酸性和碱性磷酸酶、吲哚、有机酸等代谢产物,均可对牙周组织产生破坏作用,其中牙龈素是目前研究的热点。
牙龈素(gingipains):最初称为胰酶样蛋白酶(trypsin- like protease,TLP),又称卟啉素(porphypains)。1990年,Shah等证实其为半胱氨酸蛋白酶,是存在于P. gingivalis的外膜、膜泡或胞外的一组蛋白酶,与黏附有关的蛋白区域或功能区有多样性。牙龈素包括精氨酸-牙龈素(Arginine- gingipains,Rgps)和赖氨酸-牙龈素(Lysine- gingipain,Kgp)。Rgps能特异性切断蛋白质中与精氨酸残基结合的肽段,分子研究发现Rgps由rgpA和rgpB两个基因编码。rgpA基因的DNA序列分析显示由氨基端的前肽区(当蛋白酶激活时该区被切断)、蛋白酶区及羟基端的黏附区组成;rgpB基因的前肽区、蛋白酶区与rgpA相应段紧密相关,但无黏附区。Kgp能特异性切断与赖氨酸残基结合的肽段,它由kgp单个基因编码,组成与rgpA相似,也包括前肽区、蛋白酶区和黏附区。kgp蛋白酶区的氨基酸序列与rgpA相应区段有22%相同,主要接触反应区也相同,仅由于非相关区阻力的差异造成它们作用的底物不同。研究还发现rgpA的黏附区、kgp的部分伸长序列与红细胞凝集素黏附区、P. gingivalis外膜上的受体蛋白紧密相关,提示黏附区介导了蛋白酶黏附复合体与结缔组织分子的黏附。对牙龈素同源突变株的研究发现,当rgpA基因失活,细菌黏附能力部分丧失,降解Ⅰ型胶原的能力也丧失;当rgpA和rgpB均突变,抑制中性粒细胞的功能丧失,细菌菌毛缺失;kgp失活,则会影响细菌利用血红蛋白及储存亚铁血红素的能力,使菌落无法变黑;当rgpA、rgpB和kgp基因均失活时,P. gingivalis胞外的蛋白水解活性完全丧失。
牙龈素具有多方面功能:①破坏宿主组织的重要毒力因子,它能降解非常广泛的蛋白质或多肽底物,降解Ⅰ、Ⅱ型胶原,破坏牙周组织细胞,还能促进缓激肽释放,提高血管通透性,增加龈沟液量,造成炎症区渗出增加,组织水肿;②帮助其他细菌生长,牙龈素能将组织的蛋白质降解为短肽链,扩大细菌营养摄取范围,为细菌生长和毒力发挥提供养分;③有助于P. gingivalis在牙周组织的黏附定植,牙龈素对纤维蛋白有强亲和力;④干扰宿主免疫反应,影响中性粒细胞功能,降解宿主细胞的LPS受体CD14,抑制宿主细胞对细菌的识别反应,还有降解细胞因子(如IL- 1β、IL-6、IL-8及TNF等)的作用。
(三)福赛坦氏菌(Tannerella forsythia)
最初由Forsyth牙科中心的Tanner教授等(1979)从活动性重度牙周炎患者口腔中分离出来的新菌种,1986年被命名为福赛拟杆菌(Bacteroides forsythus),经过深入研究,2003年此菌已从拟杆菌属中划出而归入新属———坦氏菌属(Tannerella),改名为福赛坦氏菌(Tannerella forsythia)。
1.生物学特性
革兰阴性梭形球杆菌,两头尖细,中间膨大。模式株为ATCC 43037。专性厌氧、生长缓慢、营养要求很高,最初分离培养时经常像是牙龈卟啉单胞菌或具核梭杆菌喂养的卫星菌群,在培养基中加N-乙酰-胞壁酸或冻溶血,培养7~10天后,才形成直径1~2mm粉红色或黑色的斑点状菌落。T. forsythia在液体培养基中生长较差,仅在补充醋酸钠、硫酸钠、琥珀酸钠和氯化血红素后生长尚好,由于不易培养,故研究较少。
2.致病性和临床意义
常在重度牙周炎的附着丧失处的龈下菌斑中检出,常与牙龈卟啉单胞菌、齿垢密螺旋体或具核梭杆菌同时检出,吸烟者的检出率明显升高。
能产生大量的毒性产物和酶,如吲哚、α-岩藻糖苷酶、N-乙酰-β葡萄糖甙酶和胰蛋白酶样酶等,导致组织损伤。Loesche教授等检测40多种微生物,发现其中P. gingivalis、T. forsythia、T. denticola能产生胰蛋白酶样酶,能分解人工合成的多苯甲酰- DL-精氨酸-β-萘酰胺(BANA),因此,可用BANA试验来快速检测这三种细菌。目前已公认T. forsythia为重要的牙周致病菌之一,但在许多方面尚未作充分研究。
(四)具核梭杆菌(Fusobacterium nucleatum)
具核梭杆菌是龈上菌斑、龈下菌斑、牙周袋及感染根管等口腔感染部位的优势菌,大部分临床研究表明,其检出数量、频率与牙周组织的炎症、破坏程度之间存在着正相关关系。它是口腔坏疽性病变的主要病原菌,如急性坏死性溃疡性龈炎、牙源性颌面部感染等,常在与螺旋体、链球菌或福赛坦氏菌等的混合感染中起协同作用。近年来,随着研究的深入,其在牙周炎中的重要性逐渐显露,但还有许多问题如菌体成分、毒力因子和菌群相互作用等方面尚待进一步阐明。
1.生物学特性
革兰阴性无芽胞的梭形杆菌,两端尖锐,中间膨大,胞内常有革兰阳性颗粒,模式株为ATCC 25586。专性厌氧,最适生长温度37℃,血平板上形成扁平、边缘不齐、中央凸起的半透明菌落,呈玻璃屑或面包屑状,见图14。
2.致病性和临床意义
F. nucleatum有致病潜力,拥有多种凝集素,能凝集人及绵羊红细胞,能附于上皮细胞和羟磷灰石表面;它既可与早期定植菌(如链球菌、放线菌等)共聚,又可与晚期定植菌(如卟啉单胞菌、聚集杆菌、螺旋体等)共聚,可作为早、晚期定植菌的黏接桥;能产生内毒素,可引起局部许瓦茨曼反应、组织出血性坏死和抑制细胞生长等毒性作用,它还可产生蛋白酶、硫酸酯酶以及一些有机酸等,诱导宿主免疫细胞发生凋亡,改变宿主免疫功能,造成牙周组织的破坏;它能作用于甲硝唑,使其产生乙酰胺而失去抗菌作用,使伴随的P. gingivalis得到保护而生长,提示F. nucleatum在菌斑生物膜形成、细菌定植、混合感染的进展变化中起重要作用,在临床药物治疗中应注意其抗药作用。
(五)中间普氏菌和变黑普氏菌
中间普氏菌(Prevotella intermedia)和变黑普氏菌(Prevotella nigrescens)以前均归拟杆菌属,由于生物学特性与拟杆菌属细菌有差异,故划归入新的普氏菌属(Prevotella)。
1.生物学性状
革兰阴性杆菌,长短不一,专性厌氧,最适生长温度为35~37℃,在血平板形成圆形、低凸、半透明、表面光滑的溶血菌落,氯化血红素和维生素K能促进其生长,兔血或冻溶血可加快黑色形成。用366mm紫外光照射新鲜的菌落可见砖红色荧光,还可产生β-半乳糖酶。
2.致病性和临床意义
P. intermedia有许多与P. gingivalis类似的毒力因子,如荚膜、纤毛、内毒素、酸性和碱性磷酸酶、胰蛋白酶样酶、IgA蛋白酶、IgG蛋白酶及氨等,可造成牙周组织的破坏。
P. intermedia与中度或重度牙龈炎、急性坏死性溃疡性龈炎和慢性牙周炎有关,可从牙周袋、冠周炎、感染根管和头颈部感染部位中检出。有报道,特别在妊娠期龈炎,P. intermedia常为主要优势菌,这是由于妊娠期孕激素增多,可利用孕激素来满足它对维生素K的需要,导致它明显增加,在分娩后会减少。
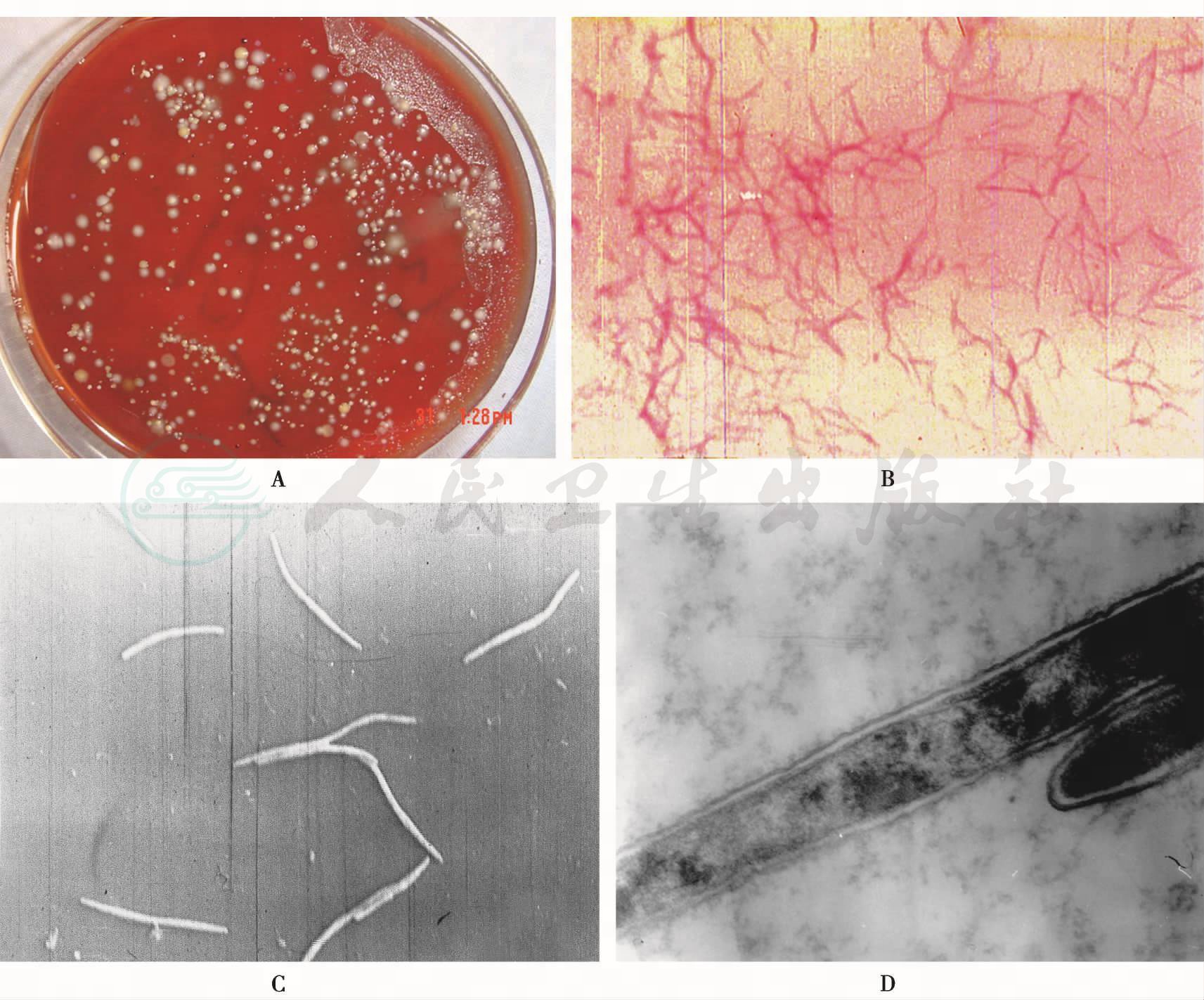
图14 具核梭杆菌
A.菌落形态;B.革兰染色菌体形态;C.扫描电镜图像(SEM×5000);D.透射电镜图像(TEM×30 000)
1983年,Johnson等研究发现P. intermedia具有种内异源性,分为基因型Ⅰ型和Ⅱ型。1992年,Shah等用多位点酶电泳法和DNA- DNA同源性比较证实了这种异源性,便将P. intermedia基因型Ⅱ型从P. intermedia中独立出来成为一新种,命名为变黑普氏菌(Prevotella nigrescens),而P. intermedia即为基因型Ⅰ型。由于以往将P. intermedia与P. nigrescens混在一起研究,加上用常规的表型生化方法又难以区分,因此它们在牙周正常部位、病变部位或活动部位的检出率不一,研究结果常有矛盾之处,它们与牙周病变的确切关系尚待深入研究。
(六)黏放线菌(Actinomyces viscosus)
口腔中存在着数量很多、种类复杂的放线菌,数量仅次于链球菌,是口腔正常菌群成员,主要定植在牙菌斑、牙石、龈沟、口腔黏膜和唾液等部位。临床和流行病学研究证实病原性放线菌可引起内源性感染,常形成有慢性肉芽肿、化脓、窦道的颈部放线病,在感染根管和根尖肉芽肿也常分离到放线菌。最近,黏放线菌(Actinomyces viscosus)与牙周病关系的研究日益增多。
1.生物学特性
为革兰阳性杆菌,可弯曲,末端膨大,长短不一,呈“T”、“V”、“X”和“Y”字状排列,表面有Ⅰ、Ⅱ型菌毛,模式株为ATCC l5987。兼性厌氧,厌氧培养时加5%~10%CO2生长良好,在脑心浸液琼脂上开始为致密菌丝,7天后为平滑型微菌落,圆凸、灰白色、不透明、有黏性,见图15。
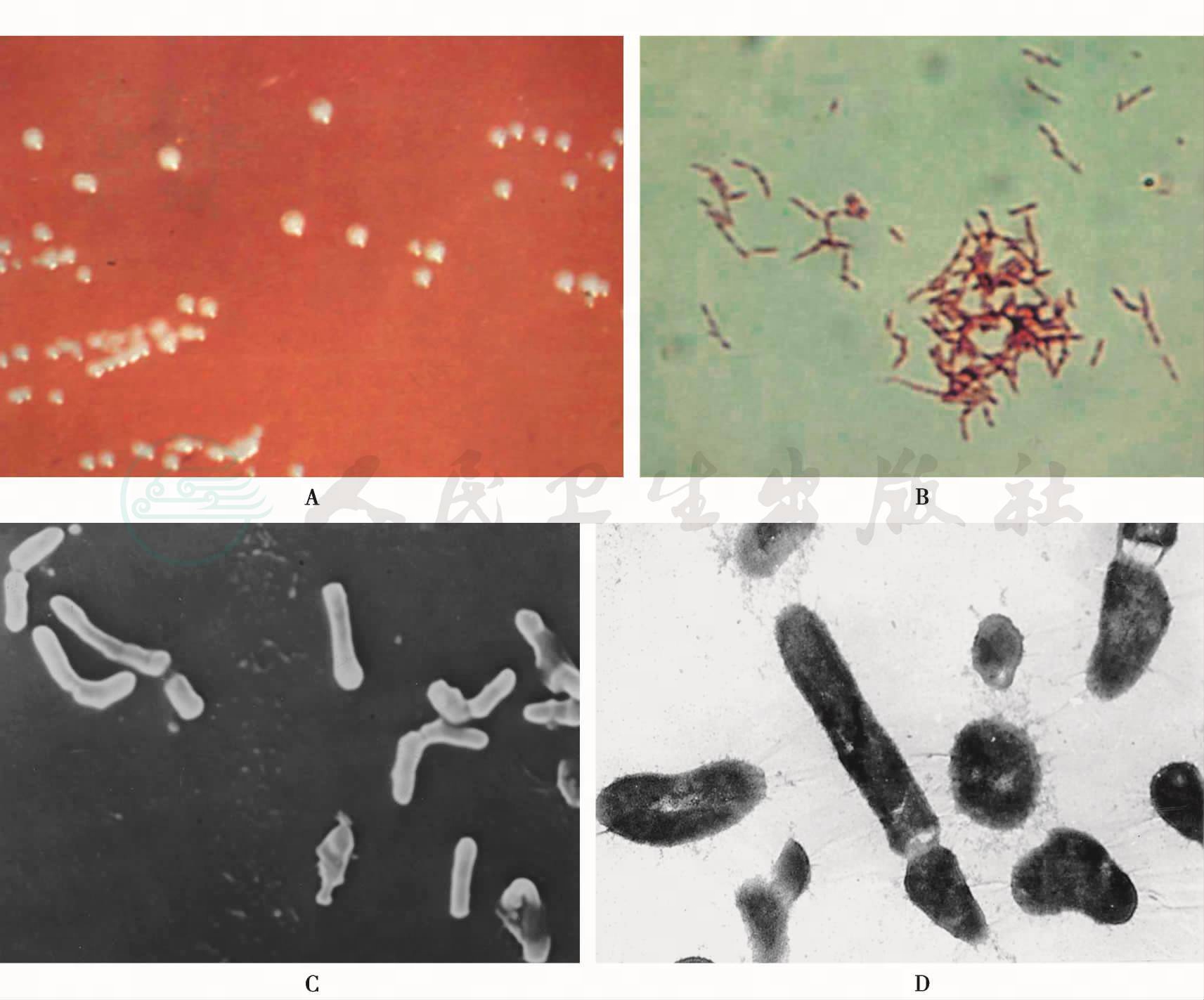
图15 黏放线菌
A.菌落形态;B.革兰染色菌体形态;C.扫描电镜图像(SEM×5500);D.透射电镜图像,可见菌毛(TEM×15 000)
2.致病性和临床意义
在动物实验中,A. viscosus可引起仓鼠牙周炎和根面龋。它是一种产酸菌,可利用葡萄糖、乳糖、麦芽糖和蔗糖,在有氧条件下产生醋酸量最多,在无氧环境下,终产物以乳酸为主,因此在厌氧环境中不能低估A. viscosus的致龋能力;实验性龈炎形成过程中,菌斑内A. viscosus比例增加,数量明显增多,其数目增多常发生在临床症状出现之前,提示可能在形成龈炎的初期起作用。
在放线菌中,目前对A. viscosus的牙周致病潜力研究较深入。一般认为它直接损伤牙周组织的毒力较弱,它不产生易挥发的含硫化合物,酸性终末产物也不如其他细菌强,仅能产生少数蛋白酶和一些其他水解酶。A. viscosus借表面的Ⅰ、Ⅱ型菌毛及合成的果聚糖、杂多糖,黏附定植于牙面、龈沟或浅牙周袋中,对牙本质和牙骨质的主要有机成分胶原有较高的亲和力,Ⅱ型菌毛还可介导它与血链球菌的共聚。A. viscosus定植后的环境,适合许多有毒力或需复杂营养的革兰阴性厌氧菌生长,如A. viscosus产生的琥珀酸盐促进P. gingivalis的生长,进一步造成牙周组织破坏。此外,A. viscosus刺激炎症反应的作用较强,能引起宿主对其抗原的过敏反应,间接影响牙周健康,其机制可归纳为:①合成中性粒细胞趋化物;②使白细胞和巨噬细胞释放水解酶;③影响成纤维细胞功能;④刺激淋巴细胞有丝分裂;⑤抗原刺激宿主过敏反应;⑥刺激破骨细胞,造成骨吸收。目前,它在龈炎和牙周炎中的确切病因学作用值得深入研究。
(七)齿垢密螺旋体(Treponema denticola)
密螺旋体为人、动物体内共生或寄生的厌氧性螺旋体,形态上有时不呈螺旋状,而呈扁平波浪形,具复杂的抗原结构,能自主运动,多呈旋转运动。
口腔螺旋体是口腔常居菌丛之一,很少出现于萌牙前的婴儿或无牙𬌗的成人,50%的学龄儿童及青年存在口腔螺旋体,年龄较大者几乎100%存在螺旋体。主要存在于菌斑的外表面,与龈沟和袋上皮接触,可入侵牙周组织,在一定条件下具有致病性。
1.生物学特性
齿垢密螺旋体为细长螺旋形细胞,末端尖削和稍弯,两根轴丝插入细胞的两端,几乎见不到从细胞末端伸出的轴丝,以颠簸的迅速移动方式运动,幼龄细胞沿它们的轴迅速旋转。革兰染色不易着色,常用暗视野显微镜或荧光显微镜检视。在厌氧条件下,在蛋白胨酵母提取物血清培养基中生长良好,生长需要动物血清或腹水液,最适生长温度37℃,pH 7.0。
2.致病性和临床意义
正常位于牙与牙龈的交界处,一般在牙周袋内氧张力低的部位定居,在龈下菌斑生物膜和牙龈上皮之间,通过酸性黏多糖黏附于牙龈上皮组织,产生一系列毒性物质,其致病机制尚无定论,可能有以下几方面因素:
(1)机械性穿入:
扫描电镜观察发现在冠周炎、急性坏死性溃疡性龈炎及慢性牙周炎的牙龈组织中,螺旋体可以侵入上皮细胞间隙和结缔组织中,侵入到坏死病损前沿的健康组织,提示这种机械性侵入能力可能在致病作用中起先导作用。此外,一些无活动能力的细菌可附着于螺旋体或随螺旋体的滑行运动带入组织,为其他细菌的继发感染开辟道路。
(2)致病性酶和侵袭性酶:
研究证实,T. denticola能产生胰酶样蛋白酶、肽酶、磷酸氢酶、透明质酸酶、酸性磷酸酶和硫酸软骨素酶,这些酶能扩散入组织,水解组织成分,产生破坏作用。螺旋体是否依赖这些酶入侵组织尚待证实。
(3)抑制成纤维细胞:
Hansruedi(1984)发现T. denticola的可溶性超声波提取物可以抑制人和鼠的成纤维细胞增殖,成纤维细胞发育障碍,可导致胶原成分减少,影响牙周组织附着。
(4)抑制免疫作用:
密螺旋体的外鞘具有抗中性粒细胞吞噬的作用,还可抑制外周淋巴细胞反应。
(5)产生毒性物质:
螺旋体细胞壁具有内毒素样物质,可发挥多种生物活性。此外,还可产生大量硫化氢和氨,破坏上皮细胞的完整性。
研究表明,单纯接种螺旋体于实验动物,致病力弱,如将螺旋体与梭杆菌、卟啉单胞菌或厌氧球菌等混合接种,则可发挥协同致病作用,产生明显的免疫反应和显著的牙槽骨吸收。实验表明,混合接种1∶1的T. denticola和P. gingivalis,可引起相当于单接种40倍 P. gingivalis的牙槽骨吸收,T. denticola和P. gingivalis可在蛋白分解、营养利用和促进生长方面起协同作用,说明口腔螺旋体在混合感染(polymicrobial infection)中起十分重要的作用。现已证实口腔螺旋体和其他厌氧菌混合感染可引起多种口腔炎症性疾病,如坏死性溃疡性牙龈炎、冠周炎、急性牙脓肿、牙髓炎及干槽症等均与螺旋体密切有关。目前螺旋体在牙周病中的致病作用还有争论,健康龈沟中口腔螺旋体占正常菌丛的比例低于1%,在牙龈炎、坏死性溃疡性牙龈炎螺旋体比例可达20%~30%,而在慢性牙周炎、广泛型侵袭性牙周炎的牙周袋中,螺旋体的比例明显升高,可高达35%~55%。但螺旋体究竟是致病因子,还是由于局部环境改变后,有利于螺旋体定居繁殖,尚未最终定论,有必要深入研究探讨。但不管螺旋体是因还是果,它的存在可作为观察牙周炎严重程度或监测治疗效果的一项指标。
牙周病的流行情况
牙周病的流行病学(epidemiology)研究主要有3个目的:其一,主要采用描述性流行病学(descriptive epidemiology)方法,了解牙周病在不同人群中的患病情况(prevalence)、分布特点及疾病的严重程度;也可对同一人群在不同时间点监测牙周病的流行趋势;其二,通过上述调查结果分析出可能的危险因素,形成危险因子假说;然后通过分析性流行病学(analytic epidemiology)研究方法对该危险因子进行验证,为预防和控制疾病提供假设;其三,用实验性流行病学(experimental epidemiology)的方法对预防和控制牙周病的措施进行检验和评估。
牙周病是人类最古老、最普遍的疾病之一。在世界各地的原始人颅骨上均可见到牙槽骨吸收以及牙缺失。我国发现的新石器时代(距今8000~9000年前)的人颅骨上,就曾看到严重的牙槽骨破坏,其发生率为42. 3%。有关牙周病流行情况调查的资料甚多,然而20世纪70年代以前,由于对牙周疾病的命名和分类比较混乱,加之缺乏统一的指标和调查方法,使其结果出入较大,缺乏可比性。
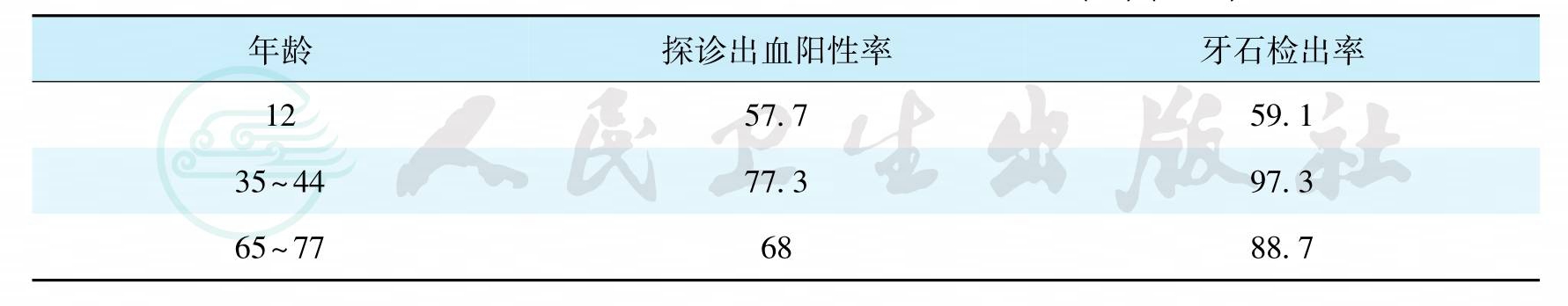
1982—1984年,我国卫生部组织了全国性的龋病、牙周病流行病学调查,对我国29个省、直辖市、自治区的7、9、12、15和17五个年龄组的131 340名中小学生进行了抽样调查。资料表明,该五个年龄组中小学生牙龈炎的患病率为66.80%,其中15岁年龄组为80.46%;牙周炎的患病率为0.87%。1995—1997年,第二次全国口腔健康流行病学调查仍使用社区牙周指数(CPI),抽样检查了11个省市12、15、18、35~44和65~74岁五个年龄组共计117 260人的牙周状况。结果表明,全口6个区段(sextant)均健康的人数很少,且随年龄的增加逐渐减少(表5)。牙石的检出率较高且随年龄的增加而呈逐渐升高的趋势。牙周炎的患病率随年龄的增加而逐渐升高(图16)。2005—2007年,第三次全国口腔健康流行病学调查,抽样检查了30个省市5、12、35~44和65~77岁四个年龄组共计93 826人的口腔状况。这次口腔检查增加了检查和记录牙周附着水平。牙龈探诊出血检出率如表3- 2所示,35~44岁年龄组的牙龈出血检出率最高,达77. 3%,与此相应的是该年龄组的牙石检出率最高,高达97.3%。调查结果还显示该年龄组的牙周健康率为14.5%,65~77岁年龄组的牙周健康率为14.1%。两年龄组的牙周健康率较10年前分别增长了11.65%和13.54%。牙周探诊深度(periodontal probing depth,PD)及牙周附着丧失(attachment loss,AL)随年龄的增加而增加,如图17、图18所示。
表5 全国12~74岁者6个区段均健康的人数和百分数(1995)
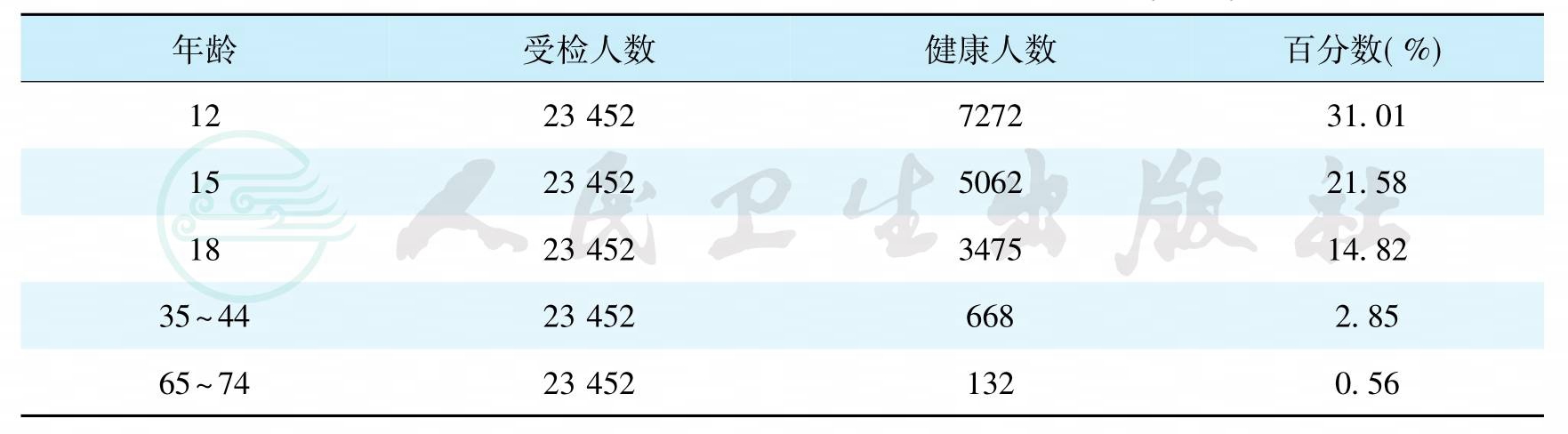
表6 全国12~74岁年龄组探诊出血和牙石检出率(%)(2005)
(一)牙龈炎
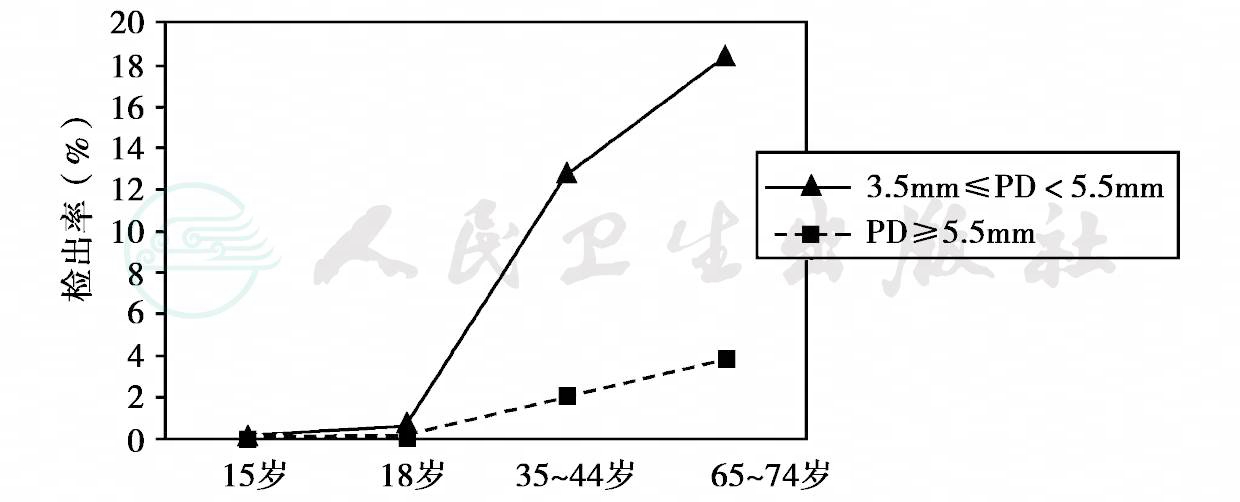
图16 牙周探针深度检出率与年龄的关系(1995)
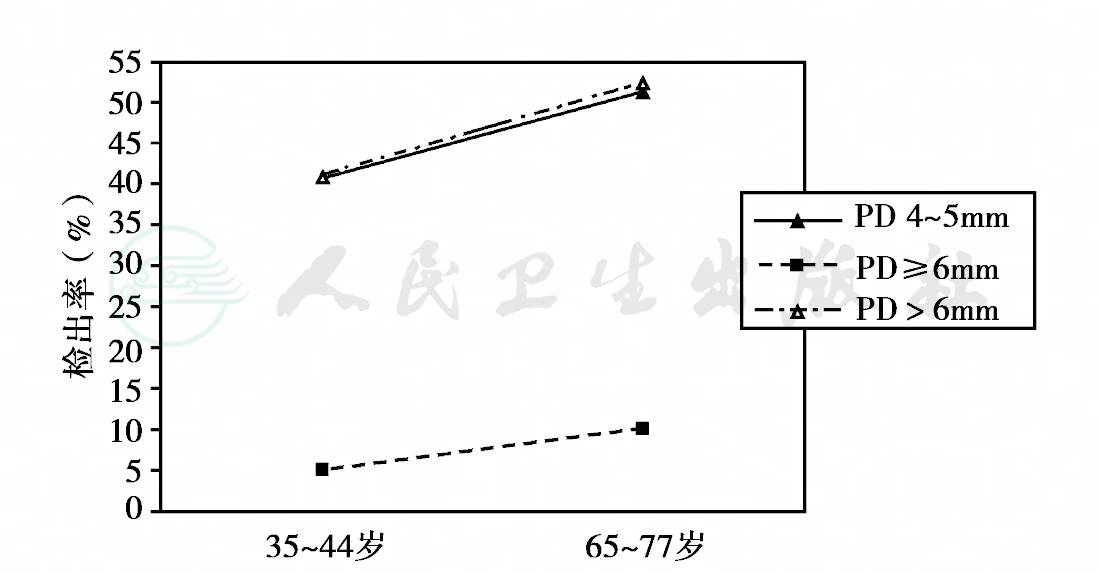
图17 牙周探针深度检出率与年龄的关系(2005)

图18 牙周附着丧失检出率与年龄的关系(2005)
国内外调查显示总的规律是牙龈炎(gingivitis)在儿童和青少年中较普遍,患病率(prevalence rate)在70%~90%左右。牙龈炎最早可见于3~5岁的儿童,随着年龄的增长,其患病率和严重性也逐渐增加,到青春期达到高峰,几乎所有的儿童都有或轻或重的牙龈炎。青春期后,牙龈炎的患病率随年龄的增长而缓慢下降。在发达国家,随着口腔卫生保健措施的实施和口腔卫生习惯的改善,牙龈炎的患病率正逐年缓慢下降。1991年,美国公共卫生部(U. S. Public Health Service)资料显示,发达国家的中小学生中,牙龈炎的患病率约为40%~60%;1985—1986年的成人资料显示,47%的男性和39%的女性口腔中至少有一个牙位点探诊时出血。1988—1994年,美国第三次健康和营养状况调查(the Third National Health and Nutrition Examination survey,NHANES)资料显示,13岁以上年龄组,54%的受检者至少有一个牙位点探诊时出血;21%的受检者至少有一个牙位点探诊深度超过4mm;38.1%的受检者至少有一个牙位点附着丧失超过3mm。1996年,上海地区对700名孕妇的调查显示,妊娠期龈炎的患病率为73.6%。坏死性龈炎自第二次世界大战之后患病率逐渐下降,在发达国家,其患病率在0.001%~0.03%之间。2005~2007年,第三次全国口腔健康流行病学调查结果显示,急性坏死性龈炎在35~44岁农村女性及65~74岁的城市男性中的患病率为0.02%,在35~44岁农村男性及65~74岁城市女性中,其患病率还低于这一水平。
(二)牙周炎
多数成人罹患的牙周炎(periodontitis)为轻至中度。重症牙周炎仅累及少数人群,重症者可能只占人群的5%~20%。Baelum等也曾报告,尽管受检者有大量菌斑、牙石,但牙周袋深度大于3mm、附着丧失大于6mm的牙面不足整个受检牙面的10%,而75%的附着丧失≥7mm的牙位发生在31%的受检者。即大部分的严重牙周附着丧失只发生在少数人的少数牙位。提示牙周炎不是均匀地分布在人群中。1992—1996年,中日合作对无牙科保健的农村人口576人进行了长达5年的牙周病自然进程调查。其中2年纵向调查的结果也表明,牙周活动性破坏阶段性地发生于少数人的少数牙位,极少数部位发生快速进展。2005年,第三次全国口腔健康流行病学调查结果还显示,在35~44年龄组,男性牙周健康情况不如女性,男性的牙周袋检出率为47%,明显高于女性(35.1%)。
牙周炎的患病率和严重性随年龄增高而增加。35岁以后患病率明显增高,50~60岁时达高峰,此后患病率有所下降,这可能是一部分牙周破坏严重的牙已被拔除的缘故。失牙是未经治疗的牙周炎的最终结局。1995年全国流行病学调查资料表明,35~44岁人群中,无牙𬌗者占0.11%,人均失牙0.88个;而65~74岁的人群中无牙𬌗占10.5%,人均失牙剧增为9.86个。国内有学者在1953年和1986年分别在同一个口腔外科门诊各对一万余颗牙齿的拔牙原因进行分析,1953年因牙周病拔除的牙占31%,而1986年时牙周病已占拔牙总数的44%。
随着人们口腔卫生保健措施的实施和口腔卫生状况的改善,牙龈炎和轻到中度的牙周炎患病率将逐渐下降。美国在1988—2000年间分别进行了2次全国牙周病的流行病学调查,NHANESⅢ(1988—1994)的流行病学调查显示牙周炎的患病率是7.3%,而NHANES(1999—2000)的牙周炎患病率降低为4.2%。据分析患病率下降的原因可能是民众健康意识的加强和改变不利健康的危险行为如不吸烟等。瑞典基于1973年的流行病学调查结果,推出了预防牙科保健系统。30年后,40~80岁无牙𬌗人数由14%下降至3%;更值得注意的是牙周健康人数由1973年的8%显著上升至2003年的44%。我国65~74岁年龄组装全口总义齿的百分率也由1995年的8.8%下降至2005年的6.3%。
随着我国人均寿命的延长,龋病的预防和治疗成功,保存了更多的自然牙以及种植牙的普及开展,可以预见,牙周治疗和维护的需求将继续增加。
(三)牙周病损具有部位特异性
同一患者的口腔内,各个牙的病情是不一样的;同一个牙的各个牙面的病损也不一致。牙石的分布也有其部位特征性并与牙槽骨吸收的严重性分布一致,下前牙以及上颌第一磨牙牙石最多。一般而言,牙周炎时牙槽骨吸收程度,以邻间区重于颊侧和舌侧,上颌较下颌为重,但前牙区的牙槽骨破坏则是下前牙重于上前牙。最近,国内有资料显示,慢性牙周炎的下颌骨吸收明显重于上颌骨,侵袭性牙周炎也是下颌骨吸收重于上颌,其中尤以下切牙和下第一磨牙为重。
根据菌斑、牙石量、炎症程度以及牙槽骨吸收程度等综合分析的结果表明,各个牙罹病的概率、次序如下:最易受累的为下颌切牙和上颌磨牙;其次是下颌磨牙、尖牙和上颌切牙、前磨牙;最少受累的为上颌尖牙和下颌前磨牙。
(四)牙周病和龋病的关系
临床上常发现有些患牙周炎的人,少有龋齿,甚或不发生龋。但也有一些牙周炎患者牙龈退缩后多牙发生根面龋。关于牙周病和龋病发生之间的关系尚无定论。龋病和牙周病虽然都以牙菌斑为共同病因,但其菌斑中细菌的组成不同,主要致病菌所在的菌斑位置不同,发病机制和临床表现也迥异,为各自独立的疾病。
牙周病的危险因素
菌斑微生物在牙周病的发病过程中是必需的因素,但其单独存在并不意味着牙周病必然发生,在一些引起牙周病的危险因素共同作用下最终导致牙周病的发生。当前的研究更注重于发现和验证牙周病的危险因素。
危险因素(risk factor)是经纵向流行病学研究证实了的一些与疾病发生有关的因素,如个人行为或生活方式、遗传特征或某些环境条件等。有时用决定因素(determinant)来特指危险因素中那些不能改变的背景因素,如年龄、性别、遗传基因等。另一些危险因素则是可因干预而改变,从而降低该疾病发生的可能性,如吸烟、口腔卫生等。危险因素是疾病原因链的一部分,它们的存在与某一疾病发生的可能性增加有关,但不一定是必然发病,除去危险因素后,疾病也不一定能痊愈。
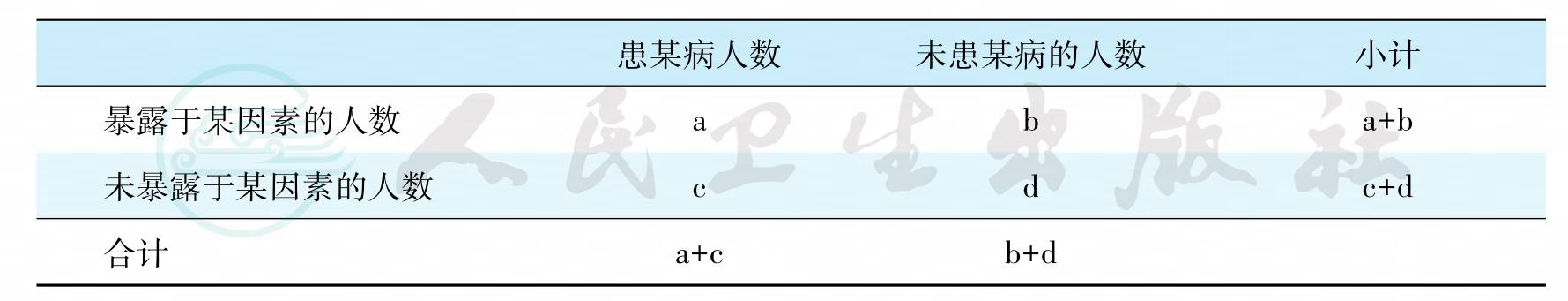
某种危险因素引起某一疾病的危险性大小常用绝对危险度(absolute risk)、相对危险度(relative risk,RR)、归因危险度(attributable risk,AR)或比值比(odds ratio,OR)来表示。绝对危险度是指个体经过一定的时期发生某疾病的可能性。相对危险度是比较两人群的健康程度。这是一种常用的前瞻性和辅助性研究的度量值,用于评估某一疾病在人群中的发病率。在研究中,RR值越高,则表示引起疾病的致病证据越充分。需说明的是RR值仅当出现引起某疾病的病因有两个时使用。归因危险度,也是用于比较两组人群的健康状态。然而,与RR相反,AR用于评估暴露与非暴露于某因素的两组人群或个体,发生某疾病的发病率差异。比值比是常用的一种相对危险度估计。绝对危险度、相对危险度、归因危险度及比值比的计算如表7所示。
表7 发生疾病的危险评估参数
暴露于某因素而发生某疾病的绝对危险度=a/(a+b)
未暴露于某因素而发生某疾病的绝对危险度=c/(c+d)
相对危险度RR=a(c+d)/(ac+bc)
归因危险度AR=a/(a+b)-c/(c+d)
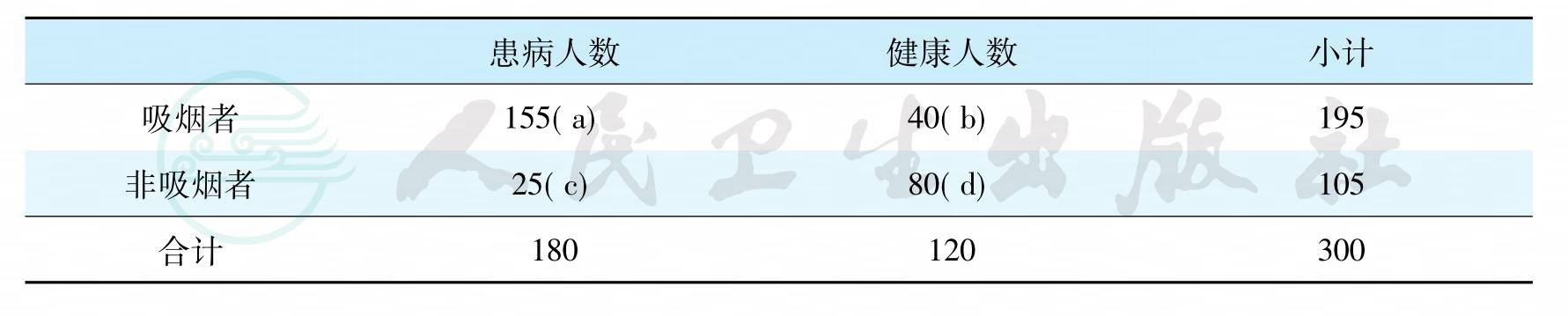
比值比OR=ad/(bc)
OR的计算举例见表8,300名受检者中,有180名患有牙周炎,其中有155例有危险因素(例如吸烟);120例健康者中有40例吸烟。该危险因素与牙周炎的关系即可用OR值表示。OR值=(a/b)∶(c/d)= ad/(bc)= 155×80÷(40×25)= 12.4。意即吸烟使患牙周炎的可能性提高了12.4倍。
表8 比值比的计算方法OR=ad/(bc)
目前,牙周病学研究的共同特点是在寻找危险因素与牙周病的患病率和严重程度之间的相关性时,运用多变量分析方法。比较明确的危险因素有:①口腔卫生情况:牙菌斑、牙石量与牙周病有极明显的正相关;②性别:一般男性重于女性;③年龄:老年人的牙周附着丧失重于年轻人,单纯的牙龈炎多见于年轻人和儿童;④种族:牙周病虽然为全球性的疾病,但其中青少年牙周炎有较明显的种族倾向,黑种人患病率较高;⑤社会经济状况:高收入和受教育程度高者,患病率较低,在我国由于健康教育不普及,此因素不明显;⑥吸烟是一个牙周病发生和牙丧失的独立危险因素,日本一项两年的纵向研究还显示被动吸烟可能加重牙周炎症,增加牙周炎进展的危险性;⑦咀嚼槟榔习惯可加重牙周炎症;⑧某些全身疾病如糖尿病、代谢综合征;⑨某些微生物如牙龈卟啉单胞菌、伴放线聚集杆菌、福赛坦氏菌、中间普氏菌的感染等;⑩过去有牙周炎历史,且不能定期接受治疗者;⑩某些基因背景,如白细胞介素- 1(interleukin- 1,IL- 1)基因多态性等。另一个观察结果是不同的危险因素在不同人群中的重要性可能不同。同一危险因素并不一定在每一次研究中均得到证实,它受受检人群的环境、地理、种族等条件的影响。
近年来的研究还表明,宿主的易感性(susceptibility)在疾病的发生和进展中起重要作用。Le等对从不刷牙且无牙科医疗条件的斯里兰卡茶场工人纵向观察了15年,其中81%的人牙周病情缓慢加重,成为轻、中度牙周炎,11%的人病情稳定不加重,仅有8%的人牙周病情迅速加重,在40岁时已缺失多个牙。这种差别可能部分地受基因控制。在亚洲,尽管存在较大地域、种族、生活习惯、经济状况的差异,但牙周病重症的患病率却十分相近,在15%~20%范围之内。瑞典一项牙周状况的30年纵向研究表明(1973—2003年),人们的口腔卫生状况和牙周健康取得了明显的改善,但侵袭性牙周炎在人群中所占的比例仍没有发生较大的变化。目前,从分子水平上揭示牙周炎的易感基因已成为研究的热点。
牙周流行病学研究的发展及其影响因素
(一)牙周流行病学指数的发展及其评价
1925年,Ainsworth和Young在英国最早进行牙周病的描述性流行病学调查,但该调查没有使用客观的检查标准和指数(index),因而其获得的资料可靠性和可比性均差。1947年,Schour和Massler设计了乳头、龈缘、附着龈指数(papillary- marginal- attached gingival index,PMA),他们认为病变先从牙龈乳头开始,逐渐扩展至龈缘,最后达附着龈,通过目测牙龈病变波及的牙数和方式来反映病变的程度。后来的PMA指数又加以改进,以牙龈的色、形、质的变化分级记录。20世纪50年代,学者们主张用平均数说明牙龈的健康状况和牙周组织的破坏程度,即一个人的牙周组织健康状况是以各受检牙的记分之和的平均值来表示,又以每个人记分之和的平均值来表示该人群的牙周健康状况,此时期的代表指数为Russell(1956年)提出的牙周指数(periodontal index,PI)和Ramfjrd(1959年)提出的牙周病指数(periodontal disease index,PDI)。PI和PDI包含了牙龈炎和牙周炎两个部分,PDI首次对菌斑和牙石提出了数字记分法(numerical score)。Ramfjord提出的牙周病指数中强调了探查附着水平。龈沟底的定位与釉牙骨质界这一固定点的关系是此指数非常重要的特点,这对牙周炎的判定具有重要意义。以后的学者在此基础上提出,在两次检查结果之间,显示出釉牙骨质界至龈沟底的距离增加了,则是疾病处于活动期或曾有过活动期的指标。此后,陆续出现了对牙龈的健康状况以及口腔卫生及菌斑、牙石等的定量标准。代表性的指数有:Greene和Vermillion(1960年)提出的口腔卫生指数和简化口腔卫生指数(simplified oral hygiene index,OHI- S);Le和Silness于1963年和1964年先后提出的牙龈指数(gingival index,GI)和菌斑指数(plaque index,PlI)。Mühleman和Son(1971年)提出了龈沟出血指数(sulcus bleeding index,SBI),然而他们认为龈沟出血早于牙龈红肿等表征的出现,与Le等的GI持相反的观点。
Ainamo等(1982年)提出社区牙周指数(community periodontal index of treatment needs,CPITN或CPI)。世界卫生组织(WHO)使用该指数建立了各国牙周病流行情况的数据库。CPI的设计者认为,牙周组织由健康转变为疾病状态是连续的过程,即从牙龈炎症(出血)发展为牙石沉积、浅牙周袋和深牙周袋。因此,有牙石的牙面也被认定为探诊出血阳性,有中或深牙周袋者也被记为有牙龈探诊出血和牙石。但研究结果显示,有牙石的牙中,实际上有18%并无牙龈探诊出血;有牙周袋处,有54%未探到牙石,13%无探诊出血。CPI只适用于大样本人群的粗筛,根据患病的区段数和病情,决定该人群对牙周治疗的需要和牙科医疗人力的规划等,而对于牙周病的程度、有关危险因素等则不能提供足够的信息量。如我国第二次全国口腔健康流行病学调查采用了CPI指数,结果显示中老年组(35~44岁,65~74岁)的牙石检出率高达94.15%和77.46%,而探诊出血率只有23.29%和13.92%。这些数据显然未能真实地反映牙周病的炎症状况,对于不了解CPI设计目的的人易造成我国人群牙周炎症轻的错觉。为了描述口腔中牙周炎病变的范围和程度,1986年,Carlos等又提出用范围和严重度指数(extent and severity index,ESI)来记录牙周支持组织破坏情况。该指数由两部分组成:①范围:描述受检部位有牙周炎破坏症状位点的比例;②严重度:描述达到牙周附着丧失≥1mm的病损部位,其总的牙周附着丧失均量。另外要求检查包括口腔右上和左下象限的颊侧中央和颊侧近中部位。ESI也只是记录牙周组织破坏的结果,并不能说明牙周组织破坏的进展。但ESI能较好地表达疾病的情况。如ESI(90,2.5),则表示中度弥漫型的牙周组织破坏,即90%的受检位点有平均2.5mm的牙周附着丧失。若ESI(20,7.0),则表示重度局限型的牙周组织破坏,即20%的受检位点有平均7mm的牙周附着丧失。如今学者们仍在探索既能说明牙龈健康状况,又能反映牙周组织的破坏程度,且易于掌握的指数。
某些流行病学指数也可应用于临床工作,探诊出血和探诊深度的变化,特别是附着水平,这些指标在评价患者牙周健康状况的现状及动态变化是十分重要的。现在的许多研究倾向于同时测量附着丧失和牙周探诊深度或牙槽骨丧失的程度以显示疾病的现状。
当前的各种牙周指数尚不能检查牙周病活动性(periodontal disease activity)。计算机辅助的X线减影技术以及龈沟液或唾液成分的分析技术,可能有希望成为将来快速、准确诊断牙周炎活动性的方法。
(二)影响牙周病流行病学研究的因素
流行病学研究的特点是用群体观点研究人类的疾病和健康问题,其基本前提是明确所研究疾病的准确定义。然而,由于牙周病本身的特殊性,如疾病的多类型、缺乏特有的指标等,使得在以往许多的牙周病流行病学调查中,对本病的定义、分类、调查标准及统计分析单位等未能采取统一的方法,因而影响了各调查资料间的比较和分析,如表9所示。这些在定义上和方法上的不一致以及调查对象的年龄分段不一致等等,不可避免地造成牙周病患病率的调查结果有很大出入,对不同资料也难以进行直接比较。此外,同一口腔内的不同牙和不同牙位(site),其疾病进展不均衡,病变程度各异,菌斑微生物的构成也不完全相同,也就是说,牙周病具有个体特异性和牙位特异性(site- specific)。在流行病学调查中,不仅应报告患病者在群体中的比例,还应分析和报告患病部位的分布频率以及病情程度等资料。这些问题在近期的文献中已经强调要加以克服,努力统一疾病的诊断标准和研究方法。
表9 影响牙周病流行病学研究的因素
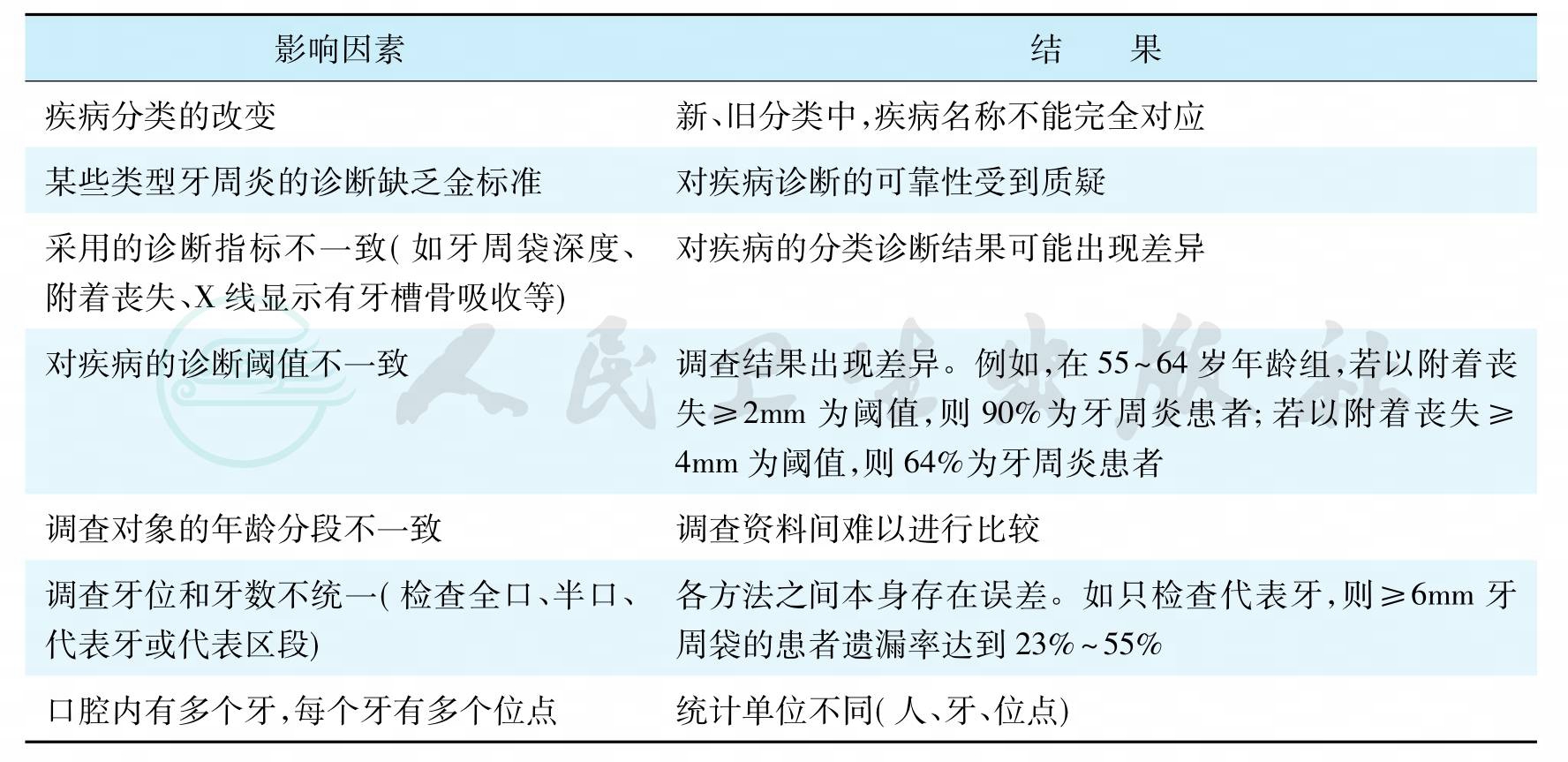
每个受检者的口腔中并非每个牙和每个牙的每个位点均罹患牙周病。因而,理想的牙周流行病学调查应对每位受检者口中每个牙的每个位点均检查,且均拍X线片。但这样做在大规模流行病学调查中是不可能的。出于实际的条件限制,多数流行病学研究只对部分有代表性的牙进行检查和记录。曾有文献报告有些受检的代表牙可以反映整个牙列的牙周状况,如Ramfjrd提出的六个代表牙即属于此。这可能是由于同一个体其左右两侧的牙周状况有明显的对称性,故全口牙与半口牙的附着丧失记分在成年人中有较高的相关性。然而,只检查部分牙,其结果的可靠性取决于受检人群中牙周疾病的实际流行情况及受检者的年龄。在患病率低、患病牙位较少的人群中,采用只检查部分牙的方法,易遗漏患牙,从而低估病情。如,仅检查代表牙,则大于或等于6mm牙周袋的患者比例在25~29岁、40~44岁、50~54岁年龄各组,其被遗漏的百分数分别为55%、39%和23%。全口检查仍是准确评估人群中牙周疾病流行和严重性的最理想的方法。但出于费用、时间、检查者工作强度考虑,选择部分牙或半口牙及每一牙检查六个位点的方法仍将在牙周病流行病学调查中使用。
一、牙周病发病中的直接作用
牙周病相关的微生物主要为革兰阴性的专性厌氧菌和兼性厌氧菌,识别牙周致病菌涉及细菌的毒力、引起动物疾病的能力以及宿主的反应等分析。牙周微生物在牙周病发病中的直接作用主要包括以下几方面:
(一)牙周定植、存活和繁殖
牙周致病菌要发挥作用,首先必须选择性地黏附(adhesion)、定植(colonization)于宿主的适当部位,如牙体、牙周组织或已附着的菌斑团块表面,并在营养环境中生长繁殖,才能引起宿主组织破坏。在体内环境中不能生长和分裂的细菌便无毒力,而对大多数口腔细菌而言,唾液、龈沟液和牙周组织含有足够的营养供它们生长。由于牙周各部位的生态环境特性、生化条件各不相同,对各类细菌繁殖的影响也不同,加上各种细菌对组织的选择性也不一样,因此牙周各部位的菌群组成存在着明显差异。早期定植于口腔环境的细菌很可能附着于获得性薄膜或唾液包裹的牙面,如黏放线菌通过表面的菌毛黏附于牙面唾液的富脯蛋白。细菌也可识别已附着于组织的细菌或菌斑团块,即通过细菌的共聚(coaggregation)作用间接地附着至组织表面,如黏放线菌通过表面的菌毛与血链球菌表面的多糖受体特异性相互作用,这种共聚作用对细菌在牙周环境中定植很重要,导致菌斑内细菌种类和数量增加。
(二)入侵宿主组织
细菌附着后,其抗原成分和(或)毒性产物引发白细胞的趋化、吞噬以及炎症过程,造成表面组织的损伤,细菌及其产物通过上皮细胞或细胞间隙入侵(invasion)表层下组织。
早在1965、1967年,Listgarten电镜证实坏死性溃疡性龈炎有螺旋体入侵坏死部位深层组织,可分成4个区域:①细菌区:在溃疡病变的表面,含有许多不同细菌和螺旋体;②中性粒细胞区:在糜烂损害之下,各种细菌和螺旋体分散于大量炎症细胞之间;③坏死区:主要由破坏的结缔组织、纤维残余、坏死的细胞碎屑和浆细胞等组成,内含大量螺旋体和少量其他细菌如梭杆菌;④螺旋体区:在较健康组织常以中或大螺旋体入侵为主,较深处常无其他种类细菌。过去一般认为,除了急性坏死性溃疡性龈炎外,在牙龈炎或牙周炎早期,菌斑细菌本身没有直接侵入牙周组织,仅细菌的一些酶、毒素或代谢产物进入牙周组织,引起组织的破坏。20世纪80年代,根据电镜观察等组织学研究,在牙龈炎、慢性牙周炎及侵袭性牙周炎等的牙周组织中均发现有入侵的细菌,包括球菌、短杆菌、梭杆菌、螺旋体和真菌等。细菌可通过龈沟或袋壁的溃疡面,或通过白细胞移出所造成的裂隙,或经过增宽的上皮间隙侵入棘细胞层,在基底层的上皮侧常有细菌积聚,该区基底膜常可见穿孔或断裂,沿基底膜集聚的细菌可穿入结缔组织,有的细菌甚至能达到牙槽骨或牙骨质。入侵组织的另一种方式可能涉及细菌直接进入宿主上皮或结缔组织细胞,研究证明伴放线聚集杆菌、牙龈卟啉单胞菌、具核梭杆菌及齿垢密螺旋体均有直接入侵宿主组织细胞的能力。
目前的观点是细菌能入侵牙周组织,这也是牙周炎的一个重要致病机制。至于细菌入侵是否可发生在牙周炎早期,可否作为牙周炎晚期的常规特征,细菌入侵对临床表现影响以及临床意义等均不清楚,尚待进一步研究。
(三)抑制或逃避宿主防御功能
致病菌的生长和繁殖除了需要营养环境以外,它们还必须能逃避(evasion)宿主的防御功能,主要逃避宿主的非特异性免疫功能,特别是吞噬细胞,唾液和龈沟液中含多种杀菌因子,如溶菌酶、过氧化物酶、乳铁蛋白、补体和抗体等。然而,口腔中有毒力的细菌常对这些杀菌因子有抵抗力,有的细菌具有降解IgA和IgG的蛋白酶,有的细菌还能抑制白细胞的吞噬功能。白细胞对细菌的作用包括趋化(chemotaxis)、黏附(adherence)、吞噬(phagocytosis)及细胞内杀死消化(microbicidal activity)四个阶段,有毒力的细菌可在其中任一阶段抑制吞噬细胞的活性,如抑制趋化、抑制黏附、抑制吞噬、释放可杀死吞噬细胞的溶解物质、抑制溶酶体的杀伤消化,有的细菌甚至能在吞噬细胞内生长。疾病的临床结局取决于细菌的侵袭攻击能力与宿主的防御修复能力之间的相互作用,结局可以是宿主征服细菌,或者是细菌破坏组织,或者是介乎两者之间的多种多样情况,故牙周炎就有活动期和静止期的交替出现。
(四)损害宿主牙周组织
细菌即使本身尚未侵入牙周组织,它的抗原成分、各种酶、毒素及代谢产物可进入,直接破坏牙周组织,或引起牙周组织局部的免疫和炎症反应,造成组织损伤(damage),归纳起来可分为以下四大类:
1.菌体表面物质
近年来,许多学者关注细菌表面物质的分子结构与致病性的关系。
(1)内毒素(endotoxin):
为革兰阴性菌细胞壁外膜中的脂多糖(lipopolysaccharide,LPS)成分,是革兰阴性菌独有的一类高度活性的致病物质,可在细菌死亡或菌体崩解时释放出来,也可由活细菌以胞壁发泡的形式释放,对牙周组织具有很高的毒性和抗原性,在牙周病的发生发展过程中起重要作用。许多研究证明细菌内毒素广泛存在于口腔的牙菌斑、牙石、唾液、龈沟液、炎性牙龈及病变牙骨质中,研究表明龈沟液中内毒素量与牙周临床炎症程度、组织学炎症程度显著相关;3H标记的内毒素能通过健康完整的龈沟上皮,穿过基底膜,进入结缔组织;体外试验表明内毒素对牙龈成纤维细胞具有细胞毒作用,并可抑制其对根面的趋动附着;内毒素还能导致和促进骨吸收,提高其他骨吸收因子如前列腺素E2、甲状旁腺激素等的作用。此外,内毒素大分子复合物是一种特殊的抗原物质,经常与牙周组织接触,可引起牙周局部的许瓦兹曼反应(Schwartzman' s reaction)或变态反应,如激活单核细胞,产生细胞因子,或激活补体,诱生和释放介质,如过敏毒素、前列腺素E2、IL- 1、肿瘤坏死因子等,造成牙周组织的破坏。
(2)脂磷壁酸(lipoteichoic acid,LTA):
为革兰阳性菌的细胞壁、细胞膜和荚膜上一种含磷酸甘油残基的聚合物,其主要结构是由16~40个单体组成的1,3-链聚磷酸甘油骨架。LTA可黏附于羟磷灰石、黏膜、红细胞、淋巴细胞、血小板和心瓣膜等多种表面,与细菌毒力密切相关;组织培养条件下,它与内毒素一样具有刺激牙槽骨吸收的作用,它可直接刺激破骨细胞引起骨吸收,它的骨吸收诱导活性约为内毒素的1/10;LTA有细胞毒作用,可减少鼠成纤维细胞的合成,浓度高时可使细胞死亡;可促使巨噬细胞释放溶酶体酶,体外研究还发现它能促使对鼠牙周组织有破坏作用的酸性磷酸酶、N-乙酰-氨基葡萄糖苷酶、β-半乳糖苷酶的释放。
(3)外膜蛋白(outer membrane proteins,OMP):
外膜是细菌与外环境之间的一种物理和化学屏障,具有选择性通透、运输、细胞获能、生物合成和分泌外部组分的功能,它是多种蛋白大分子的嵌合体,包括外膜主蛋白和次蛋白,通过强烈的非共价作用,将外膜锚定在其下面的肽聚糖上。OMP结构及其分布复杂,且具菌株特异性,各菌株有其独特的复杂生物学特性。其活性不受细胞转录酶或翻译的控制,而受外环境的影响,在不同的培养条件下,OMP结构可迅速发生改变,以适应环境。OMP结构对细菌在宿主体内的生存能力、毒力传递和毒力变化都有明显影响,因此,进一步阐明细菌OMP的生物学活性以及在疾病中的作用具有重要意义。
(4)纤毛蛋白:
细菌对牙周组织的黏附是致病的第一步,菌毛或纤毛在黏附过程中起重要作用,许多革兰阴性厌氧菌表面具有由蛋白亚单位组成的菌毛(pili)或纤毛(fimbriae),如牙龈卟啉单胞菌、产黑色素普氏菌、具核梭杆菌及黏放线菌等都发现有菌毛及类似物,它们能凝集人或有些动物的红细胞,或选择性地吸附于牙龈上皮细胞。现已明确此黏附过程为一特异性的识别过程,菌毛或纤毛等为特异配体(ligand),与宿主细胞膜上的特异受体相互作用,为诱发牙周病的先决条件。
(5)膜泡(vesicles):
又称细胞外膜泡(extracellular vesicles,ECV),由细菌外膜向外膨出呈芽状,并可从细菌外膜游离进入周围微环境的一种泡状膜结构。多种口腔细菌可形成膜泡,如伴放线聚集杆菌、牙龈卟啉单胞菌和二氧化碳噬纤维菌等,膜泡是许多革兰阴性菌的一种适应性或功能性生物学特征,它在形成过程中包容并浓缩了许多细菌固有成分和毒性产物,膜泡游离后扩大了细菌毒力作用的范围和强度。膜泡的生物学活性主要包括:①体积小,容易透过上皮屏障;②包含细菌表面相同的主要抗原和功能成分,可与宿主的抗体及免疫细胞反应,“消耗”一部分防御成分,从而削弱了宿主免疫防御反应对细菌的抑杀作用;③可作为细菌毒性产物(如内毒素、白细胞毒素和蛋白分解酶等)的载体,导致深层组织的破坏。
2.有关的致病酶
牙周细菌产生的酶是造成宿主组织破坏的一类重要分子,主要致病酶如下:
(1)胶原酶(collagenase):
宿主和口腔的某些细菌均可产生胶原酶,宿主来源的胶原酶由中性粒细胞和单核细胞释放,口腔中的细菌(如牙龈卟啉单胞菌和伴放线聚集杆菌等)也可产生胶原酶。胶原酶是一种金属蛋白酶,能水解蛋白质,破坏胶原纤维。胶原为牙龈、牙周膜和骨的主要基质成分,牙周组织中有Ⅰ、Ⅲ~Ⅶ6个型别的胶原,其中Ⅰ型胶原数量最多,占牙周膜中胶原含量的80%。患牙周炎时,胶原在形态、数量和型别上均发生明显变化,在早期便有牙龈胶原纤维束的结构变化和纤维变形,这些病理过程与胶原酶有关,胶原酶可使结缔组织破坏和附着丧失,使骨胶原降解,降解的胶原片段可刺激或吸引破骨细胞,进一步造成牙槽骨吸收。
(2)蛋白酶(proteinase):
口腔中有些细菌如卟啉单胞菌属、普氏菌属、二氧化碳噬纤维菌属及放线菌属等,可以产生多种蛋白酶,降解牙周组织细胞的蛋白成多肽,还可供养口腔其他无蛋白分解能力细菌的生长,对牙周组织造成破坏。
(3)胰蛋白酶样酶(trypsin- like enzyme):
牙龈卟啉单胞菌、福赛坦氏菌和齿垢密螺旋体能分泌产生胰蛋白酶样酶,能降解Ⅰ、Ⅳ型胶原,使胶原变性,能激活补体系统,刺激前列腺素介导的破骨细胞骨吸收,还有降解免疫球蛋白SIgA、IgA和IgG,抑制免疫反应等作用,导致牙周组织的破坏。
(4)神经氨酯酶(neuraminidase):
即唾液酸苷酶(sialidase),由许多口腔链球菌、类白喉杆菌、牙龈卟啉单胞菌和福赛坦氏菌等产生。能水解黏多糖,使结缔组织的另一主要成分神经氨酸破坏,造成牙周组织破坏,同时能使唾液中的唾液酸丧失,造成黏糖蛋白沉淀,促进牙菌斑的形成和成熟。
(5)透明质酸酶(hyaluronidase):
可由口腔中的γ-溶血性链球菌和葡萄球菌等产生。牙龈上皮细胞和结缔组织细胞间均有透明质酸,该酶可降解龈沟上皮的细胞间质,促进其他细菌或酶进入深层结缔组织,使基质解聚、组织水肿和血管通透性增高,使炎症扩散。牙骨质内透明质酸的分解,能导致上皮细胞与骨质分离,这些作用与细菌及其产物的穿透和炎症迅速扩散有关。
(6)硫酸软骨素酶(chondrosulfatase):
可由口腔中的类白喉杆菌及齿垢密螺旋体所产生,它能水解牙骨质、骨组织及牙周结缔组织基质中的硫酸软骨素,参与牙周袋形成及牙槽骨吸收等破坏过程。
降解宿主牙周组织的主要细菌酶见表10。
表10 降解牙周组织的重要细菌酶
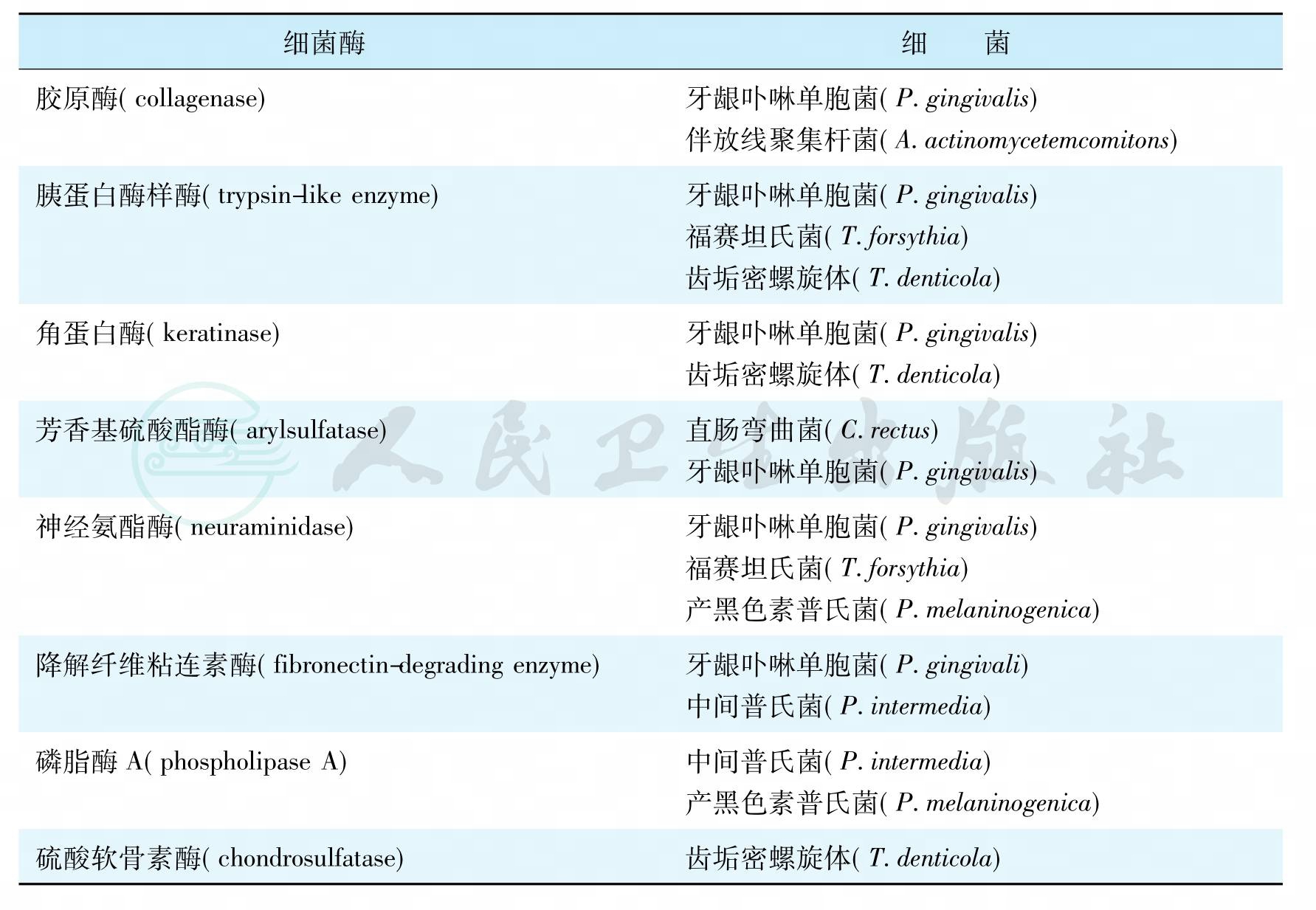
牙周细菌产生的酶几乎能降解牙周组织所有的细胞和间质分子,特别是一些能降解胶原、纤维粘连素、免疫球蛋白的蛋白酶和胰蛋白酶样酶,可造成牙周组织破坏和附着丧失,促使细菌入侵组织,还可降解组织细胞的蛋白成多肽,供养无蛋白分解能力的细菌生长。然而,在牙周疾病过程中细菌产生这些蛋白酶的确切作用尚未确定,因为牙周环境中还存在着宿主来源的类似酶。事实上,细菌能产生酶直接破坏组织,另一方面能间接导致宿主组织产生基质金属蛋白酶和弹性蛋白酶,同样也可造成牙周组织破坏。
3.毒素
(1)白细胞毒素(leukotoxin,LTX):
是伴放线聚集杆菌产生的外毒素,属膜损伤毒素,具有溶血性。LTX仅对人的中性粒细胞、单核细胞和淋巴细胞有毒性,白细胞受LTX作用后1小时内即可死亡。LTX具有强烈的抗原性,能刺激宿主产生相应的IgG型抗体。LTX可损伤龈沟或牙周袋内白细胞的细胞膜,导致白细胞死亡,释放溶酶体,还可诱导白细胞介素、肿瘤坏死因子和干扰素等细胞因子的产生,进而造成牙周组织破坏。不同菌株的毒素水平可有差异,据此可将其分为高毒株和低毒株。
(2)抗中性粒细胞因子(antineutrophil factor):
能使中性粒细胞的形态及其趋化性发生缺陷。它含有两种因子:①白细胞趋化抑制因子(leukocytic chemotaxis inhibitor):是二氧化碳噬纤维菌和伴放线聚集杆菌产生的一种能抑制人类中性粒细胞趋化功能的物质,能阻碍白细胞向炎症中心部位集中,目前有人提出这种物质是致病微生物的第Ⅳ型毒性因子;②膜动抑制因子(membrane mobility inhibitor):最近发现二氧化碳噬纤维菌能产生一种可透析的因子,主要抑制中性粒细胞的运动性,能抑制白细胞膜包绕吞噬细菌的伪足运动,降低中性粒细胞的吞噬功能。
4.代谢产物
细菌的一些代谢产物(metabolic end products),如各种有机酸(丁酸、丙酸、己酸、乳酸和长链脂肪酸)、硫化氢、吲哚、氨和毒胺等,可抑制宿主组织细胞生长或改变宿主组织细胞代谢,直接对宿主的上皮细胞和成纤维细胞等产生不同程度的毒性,导致牙周组织损伤。

图19 牙石
A.龈上菌斑表面矿化的大块牙石(SEM×5000);B.牙根及根面大块牙石的横剖面,有些地方牙石与牙骨质结合很紧密(SEM×30)
(五)牙菌斑矿化成牙石
牙菌斑矿化可形成牙石,龈上菌斑的矿化成分来源于唾液,龈下菌斑的矿化成分来源于龈沟液。在矿化过程中,晶体先在菌斑细菌间的基质和细菌表面形成,最后可进入细菌,形成牙石,表面粗糙的牙石又为细菌继续沉积提供良好的部位。菌斑矿化成牙石,牙石表面再沉积菌斑,再矿化,再沉积,如此往复循环,牙石便层层加厚,见图19。牙石的致病作用主要在于它表面常沉积的未矿化菌斑,牙石的多孔结构也容易吸附大量的细菌毒素,均可刺激牙龈造成炎症;牙石本身坚硬粗糙,对牙龈有机械压迫作用;同时,牙石妨碍日常口腔卫生措施的实施。因此,牙石也是牙龈出血、牙周袋加深、牙槽骨吸收和牙周病发展的一个重要致病因素,在治疗中务必去除牙石。
二、引发宿主免疫反应在牙周病发病中的间接作用
随着对牙周病发病机制的深入研究,虽然认识到菌斑微生物及其产物是牙周病的始动因子,但是牙周病的许多组织破坏不是感染微生物直接引起的,而是宿主在对感染微生物及其毒性产物的免疫应答过程中间接引起的,因此,有学者提出牙周病是全身免疫反应的局部表现。宿主的反应一方面取决于患者的免疫状态(包括遗传因素),另一方面取决于宿主对细菌及其毒性产物刺激的免疫炎症反应,如白细胞、补体、抗体、细胞因子、前列腺素及金属蛋白酶等,均可导致牙周组织破坏。总之,宿主免疫反应的复杂性与牙周微生物的复杂性是一致的,机体在阻止微生物入侵或扩散时发生的免疫反应,也会损害局部牙周组织,宿主免疫的保护-破坏机制也是牙周病进程的重要环节。
一、分类的原则和发展
疾病的分类(classification)是建立在人类对该病的认识的基础上,它又转而指导临床的诊断、治疗和预后判断;准确而统一的分类法,还有助于对该病的病因、发病机制等进行深入的研究。自19世纪以来,牙周病的名称和分类纷杂而多变,这种情况正反映了人们对牙周病的认识还很不统一。由此也影响了人们对各种不同研究结果和资料的比较和分析。随着对牙周病本质认识的深化,分类法也在不断地发展和变化。
自20世纪初以来,各学者提出过的牙周病分类法不下30余种,综观这些分类方法,不外有以下几个原则:
1.按病理学分类
如Orban(1942/1949)提出的按炎症、退行性变、萎缩、创伤等。
2.按病因分类
如Gottlieb(1928)、Weinmann(1934)等认为牙槽骨破坏由内因(如全身疾病、营养、药物、特发性等)或外因(细菌感染、创伤等)引起。
3.按临床表现分类
如急性、慢性、快速进展性;单纯性、复合性(compound)、复杂性(complex);局限型、广泛型(过去称弥漫型)等。
也有些学者将病因与临床表现结合,或将病因与病理结合等。
牙周病(periodontal diseases)包括牙龈病和牙周炎两大类疾病。第一大类是牙龈病,其中最多见的是牙菌斑引起的慢性炎症,即牙龈炎。还有一些是受全身因素(内分泌、血液疾病、药物等)以及局部刺激影响的牙龈疾病。在20世纪后期的主要分类法中大都对牙龈病未做详细的分类。1999年,美国牙周病学会(American Academy of Periodontology,AAP)组织召开的世界牙周病分类研讨会上,对牙龈病做了较详细的分类标准(附表11、12)。
附表11 1999年分类法的大纲

附表12 牙龈病

续表

第二大类牙周病是牙周炎,这是一组有着相似的临床表现和组织学改变、但致病因素和机体反应性不完全相同、病程进展不同、对治疗反应也不尽相同的多因素疾病。
二、1999年新分类法的简介
大多数的牙周炎属于慢性过程,主要发生在35岁以上的成年人。因而1989年召开的世界临床牙周病学讨论会上把此型患者命名为成人牙周炎(adult periodontitis),而另一些类型虽然相对少见,却是病情较重,多发生于青春期前后,且发展迅猛,还有一定的家族聚集性,1989年的分类将这些类型命名为早发性牙周炎(early onset periodontitis)。其中又分为青春前期(prepubertal)、青少年(juvenile)和快速进展性(rapidly progressive)三型。此外,还有伴全身疾病的牙周炎、坏死性溃疡性牙周炎和顽固性牙周炎(refractory periodontitis)等。1993年,欧洲牙周病学研讨会上简单地划分为成人性、早发性和坏死性。
在20世纪末的10年中,大量的临床观察和基础研究都是以上述两种分类法为依据的。然而,它们也有其不足之处,主要是:①没有包括对牙龈病的分类;②过分强调了疾病的始发年龄及进展速度,而这两者在临床上是较难确定的;③有些类型的标准和定义不够明确;④在疾病范畴上有某些重复等。
因此,美国牙周病学会于1999年组织召开了牙周病分类的国际研讨会,根据当时的最新科学资料及概念达成共识,提出新的分类法和对某些疾病/状况(conditions)的定义及说明。该新分类法的主要变动为:
1.增加了牙龈病的分类,主要分为菌斑性牙龈病和非菌斑性牙龈病两大类。
2.用“慢性牙周炎(chronic periodontitis)”取代“成人牙周炎”。因为该型牙周炎虽常见于成人,但也可发生于青少年或任何年龄。
3.用“侵袭性牙周炎(aggressive periodontitis)”取代“早发性牙周炎”。因为临床上很难准确知道发病时间和进展速度,不应以年龄和疾病发展速度作为分类的依据,故建议将那些具有高度破坏方式的牙周炎统称为“侵袭性牙周炎”。
4.侵袭性牙周炎和慢性牙周炎均可表现出阶段性的快速破坏方式,因此建议取消快速进展性牙周炎的命名。大多数广泛型青春前期牙周炎实际上都患有某种全身疾病,应归类为“反映全身疾病的牙周炎”,而对全身健康的牙周炎患儿,则分别诊断为慢性牙周炎或侵袭性牙周炎。
5.顽固性牙周炎缺乏明确的定义,它难以与因治疗不彻底而未能控制病情者或治疗成功后又复发(recurrent)的病例区分,故不能算独立疾病(附表13)。
附表13 1989年和1999年牙周炎分类的变迁
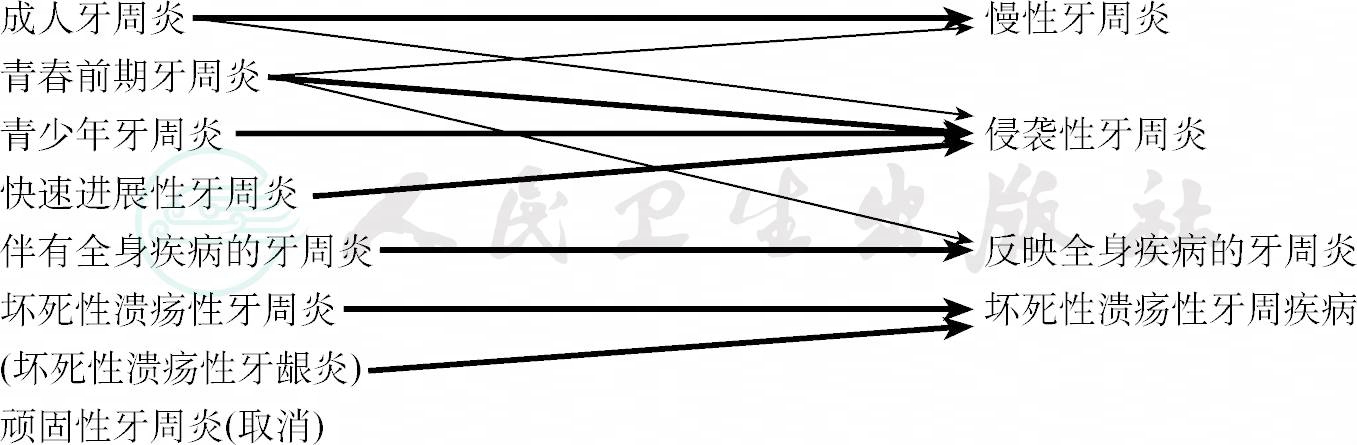
注:粗箭头表示多数病例可直接对应;细箭头表示少部分病例可能另有归类
6.将坏死性溃疡性牙龈炎与坏死性溃疡性牙周炎合并称为坏死性溃疡性牙周病,因为目前的科学资料尚不能确定两者为同一疾病的不同阶段或是两种疾病。
7.将牙周脓肿、牙周-牙髓联合病变、软硬组织的先天或后天形态异常等单独列出(本文作者注:实际上,它们作为易感因素或牙周炎的伴发病损,可发生于任何类型的牙周炎;很多软硬组织的异常和咬合创伤等一般只是作为易感因素可能诱发或加重牙周炎,而不应与牙周炎并列)。
该新分类法在当前为国际牙周病学界所认可和使用,但任何一种分类法都不是完美无缺的,随着人们对牙周炎认识的不断加深,它将得到充实和修正。













