骨质疏松症(osteoporosis,OP)是以低骨量和骨的微结构破坏为特征,导致骨脆性增加及易发生骨折的一种全身代谢性骨骼疾病。国际骨质疏松基金会的统计数据显示,骨质疏松症危害范围波及全球约1/3的50岁以上女性和1/5的50岁以上男性,其发病率在世界常见慢性病中已跃居第7位,仅在美国,每年有150万人骨折,其中包括28万髋部骨折和50万椎骨骨折。随着我国经济的发展,预期寿命的延长,人口老龄化程度越来越高,据统计,我国13亿人口中,有骨质疏松患者9000万人,骨亚健康状态(指骨健康和骨质疏松之间的状态,即骨量丢失、骨密度下降,尚不能诊断为骨质疏松症的状态)者6000万人,骨质疏松性骨折发病率还在逐年递增。据估计,我国在以后的10~20年内,老年人骨折发生率每10年将增加30%,因骨质疏松症所致的医疗费用的急剧增加,骨质疏松已成为危害我国公民健康的严重公共卫生问题。世界人口统计学数据显示,多数国家妇女的平均寿命已达70岁或80岁,由于多数妇女的绝经年龄在45~55岁之间,因而绝经后妇女人数的增加,与绝经相关的骨质疏松症已是不可忽视的重要保健课题。
1993年WHO对骨质疏松症定义为是全身性的骨量减少,伴随骨的微结构改变,导致骨脆性增加,因而骨折危险性增加的一种疾病。2001年美国国立卫生研究院共识会议提出,骨质疏松症是以骨强度受损为特征的骨骼疾病,导致骨折危险性增加。骨强度集中反映骨密度与骨质量。骨质疏松症的病理特点是骨矿含量和骨基质成分等比例地减少,骨皮质变薄,骨小梁减少、变细,绝经后骨质疏松症时骨小梁断裂。低骨量是骨质疏松性骨折的最重要的危险因素,当前对于骨量的判断是测定骨矿含量(bone mineral content,BMC)及骨密度(bone mineral density,BMD)。1994年WHO重新制订的诊断标准,在1996年5月于荷兰阿姆斯特丹召开的国际骨质疏松会议上被专家组接受。对白人妇女提出以下的诊断标准:
1.正常骨量
BMD或BMC较年轻成年人平均值低1个标准差以内。
2.骨量减少
BMD或BMC较年轻成年人平均值低1~2.5个标准差之间。
3.骨质疏松症
BMD或BMC较年轻成年人平均低2.5个标准差或以上。
4.严重的骨质疏松症(确定的骨质疏松症)
符合上述的骨质疏松症诊断标准,同时伴有一处或多处脆性骨折。
绝经后骨质疏松症是多因素性疾病,遗传、生活方式、营养等均与发病有关。具有以下高危因素者易患绝经后骨质疏松症:白人及亚洲妇女、骨质疏松症家族史、或具有影响骨量的特殊基因的妇女、钙摄入不足、缺乏体力活动、大量吸烟及饮酒、早绝经或绝经前行双侧卵巢切除术者。是否发生骨质疏松症,取决于其骨峰值及其骨丢失的速度,骨峰值高及或骨丢失慢者,不易发生,骨峰值低及(或)骨丢失快者容易发生。
(一)骨峰值
骨峰值(peak bone mass)指个人一生中的最高骨量,一般在25~35岁时达到。影响骨峰值的因素很多,其中遗传因素最为重要,营养、生活习惯等也对其产生一些影响。
1.遗传因素
决定骨峰值的70%~80%。例如黑人BMD高于白人及亚洲人,其骨质疏松性骨折发生率低;骨质疏松有家族倾向、单卵双胎的BMD差异较双卵双胎者小、男性的骨峰值高于女性;在有些国家,维生素D受体基因、雌激素受体基因或胶原基因的多态性与BMD有关等,均证明骨峰值受遗传因素影响。
2.营养
青春期内钙摄入量高者,骨峰值较高,对成熟骨BMC的影响可达6%。世界卫生组织推荐,青春期内元素钙摄入量应为每日1000mg。
3.生活习惯
运动可增加BMD,如果坚持每日锻炼,其体力活动量高于平均量1个标准差时,其骨量较活动量低于平均量1个标准差者高7%~10%,但运动过度引起性腺功能低下而发生闭经时,骨量反而降低。儿童时期有规律地进行体育锻炼使峰值骨量达到最大,尤其是那些高负荷、发力运动、负重训练更能引起机械应力改变,促使骨组织重建。骨峰值形成前大量吸烟、嗜酒者的骨峰值较低。
4.原发性性腺功能不足及青春期发育延迟者,骨峰值较低。
(二)骨丢失率
妇女的骨丢失与增龄及绝经有关。
1.与年龄相关的骨丢失
脊椎骨丢失一般自40~50岁开始,丢失率约为每年0.8%~1.2%;四肢骨的丢失大约晚10年,即自50~60岁开始,丢失率为每年0.3%~0.6%,均呈线性,其发生机制不清楚,可能与骨形成减少有关。这种骨丢失的后果是骨小梁变细,不发生骨小梁的穿孔性变化。
2.与绝经相关的骨丢失
不论年龄,妇女一旦绝经,体内的雌激素水平急剧下降,骨丢失呈对数增加,致骨小梁变细、变薄,乃至断裂(穿孔)。双侧卵巢切除术后,卵巢来源的性激素全部消失,骨丢失速度更快,此时脊椎骨丢失是四肢骨的2倍,丢失率高达每年4%~5%,大约持续5~10年后,骨丢失速度才减慢。四肢骨的骨丢失慢,丢失的持续时间也较长。
de Matos等研究显示,参与专项运动的绝经后妇女的腰椎骨密度大于不运动的绝经后对照组,运动减少了绝经后妇女的骨丢失。另外,Pinzon的研究结果表明,较高的体质指数可使骨组织所承受的机械负荷加大,减少骨吸收而刺激骨形成,从而有利于提高骨强度和骨矿物含量,因此,体质指数较大的人不易发生骨质疏松。最近有一项研究分析了绝经后妇女血细胞计数和骨密度之间的关系,结果表明绝经后妇女血细胞计数和骨密度之间呈正相关,说明了造血系统和骨形成之间的紧密相关性,最后提出绝经后妇女的血细胞计数可能是将来评估骨密度的一个标准。动物实验及临床观察性研究证实,去卵巢动物或绝经后妇女补充雌激素后,骨转换率降低,可以有效地防止骨丢失。由此证明,雌激素不足是绝经后骨质疏松症的主要发病原因。
骨质疏松症是一种多因素性疾病,种族、地理环境、饮食习惯,以及生活方式等均影响疾病发生发展。此外,由于尚未发生骨折的骨质疏松症及椎体骨折不易被发现,以及椎体骨折的诊断标准尚不统一等因素,世界各地报道的骨质疏松症及骨质疏松性骨折发生率有很大差异,欧洲各国相差达10倍之多,但以下观点基本一致:
(一)女性骨质疏松症及其相关骨折发生率显著高于男性
如美国白人妇女一生中患髋部骨折的危险性是17%,而男性是6%;澳大利亚60岁以上妇女发生骨质疏松症的危险性为58%,男性为28%;英国45岁以上发生的骨折中,85%为女性,而且不包括椎体骨折;我国40~49岁人群中女性骨质疏松症患病率为4.3%,男性为2.2%。50岁以上人群中女性骨质疏松症患病率为32.1%,男性为6.0%;65岁以上人群中女性骨质疏松症患病率为51.6%,男性为10.7%。女性发病率高的主要原因是骨量峰值低于男性(约25%),同时又有绝经后骨丢失加速的影响。女性在绝经后5~10年内,每年骨丢失率为5%(2%~10%),而男性平均为1%。此外,男性的骨丢失是骨小梁变细,而非断裂,女性的骨脆性较男性高,易发生骨折。
(二)黑人的骨密度较白人高
据报道,美国黑人骨密度高于白种人3%~9%,黑人的骨密度从性成熟开始实际增加量比白人多(黑人为34%,白人为11%)。另有研究表明,非洲和拉丁美洲人种的骨密度高于白种人,而白种人的骨密度则高于黄种人。因此,黑人骨质疏松症发病率较低。
(三)髋部骨折是最严重的骨质疏松性骨折
在2000年,全球范围内估计有160万髋骨骨折,12%~14%的髋部骨折者在发生骨折1年内死于各种并发症,存活者中50%行动受限。髋部骨折的发生率随着年龄的增长呈指数增长,在西方国家,大约3/4的髋部骨折发生在女性中。亚洲髋部骨折的患者,在未来50年内估计将增加2~3倍。近年来,我国髋部骨折的发生率呈显著上升趋势。北京市髋部骨折流行病学研究表明:1990—1992年,50岁以上男性髋部骨折发生率为83/10万,女性为80/10万;而2002—2006年,男性髋部骨折发生率增长至129/10万,女性增长至229/10万。
1.常用的分类法
(1)原发性骨质疏松症(primary osteoporosis):包含以下三种。
1)绝经后骨质疏松症(postmenopausal osteoporosis),或Ⅰ型骨质疏松症:其发生主要与绝经有关,常发生于绝经后5~10年之内,松质骨的变化显著,故常发生脊椎及腕部骨折。
2)增龄性或退化性骨质疏松症(senile or involutional osteoporosis),或Ⅱ型骨质疏松症:主要由年龄相关的骨丢失造成,发生于70岁以后,皮质骨及松质骨均有变化,易发生髋部骨折。70岁以上妇女的骨质疏松症则包括了绝经及增龄两种因素的影响。
3)特发性骨质疏松症(idiopathic osteoporosis):于青、少年期发病,原因不明。
(2)继发性骨质疏松症(secondary osteoporosis):
1)由各种疾病引起的骨质疏松症:如甲状旁腺功能亢进症、甲状腺功能亢进症、库欣综合征、糖尿病、慢性肝炎、肾病、严重的营养不良症等。
2)长期应用药物引起的骨质疏松症:如糖皮质激素、甲状腺素、促性腺激素释放激素类似物(GnRH- a)、肝素、抗惊厥药、化疗药物等。
3)制动。
2.按病因分类
Kanis认为,骨质疏松症可在生命的任何阶段发生,因此,很难提出正确的分类,根据主要病因分类可能更为实用。例如:
(1)性腺功能低下性骨丢失:女性原因为自然绝经(特别是40岁之前的早绝经)、绝经前行双侧卵巢切除术(人工绝经)、初潮过晚、神经性厌食症及其他原因的体重下降与运动引起的闭经、化疗等。男性的原因为类无睾症(eunuchoidism)、睾丸切除术后、曲细精管发育不全(Klinefelter syndrome)、先天性嗅觉丧失-性幼稚综合征(Kallmann syndrome)、青春前去睾综合征(prepubertal castration syndrome)、青春期延迟。男女两性共有的原因为血色素沉着病、慢性营养不良、性腺发育不良、应用GnRH- a、慢性肝病、性腺照射之后、垂体疾病等。
(2)退化性骨丢失:指与年龄相关的骨丢失,发生于老年人。
(3)营养原因:
1)钙摄入量低:低钙摄入加速绝经后的骨丢失,药物剂量的钙能降低绝经后的骨丢失率,因而认为骨质疏松症是钙缺乏疾病,但髋部骨折的发生率在高钙摄入国家较高,如北欧、荷兰,而低钙摄入国家的髋部骨折发生率反而较低。因而钙并不是骨质疏松症发生的决定因素,但补钙确能降低骨丢失。
2)维生素D摄入量低:长期维生素D缺乏引起骨软化症,可以合并骨质疏松症。进行性的骨矿化不足使骨的机械应力降低,增加骨折危险。绝经并不伴随维生素D代谢障碍,但老年人因食入不足,接触日光较少,自身合成的维生素D减少,常常伴有维生素D不足。
3)营养不足或摄入蛋白质过多、高磷及高钠饮食(影响肠钙吸收)、大量饮酒、过量咖啡等均可引起骨质疏松症。
(4)内分泌疾病引起的骨质疏松症:如甲状旁腺功能亢进症,甲状腺功能亢进症,糖尿病,库欣综合征等。
(5)药物引起的骨质疏松症:如糖皮质激素、甲状腺素、促性腺激素释放激素类似物(GnRH-a)、肝素、抗惊厥药、化疗药物等。
全身骨骼系统由骨及关节构成,各部位骨的形状及大小不同,但均由表面的皮质骨及其内的松质骨构成。皮质骨由多层骨板构成,其中有许多骨单位,或称哈弗系统,每个骨单位有一条哈弗管和骨板,哈弗管内有血管及神经,呈管状结构,与骨纵轴平行。骨单位的表面有一层黏合质,含大量骨盐,故皮质骨坚硬、抗压力和抗张力的强度很大,是四肢骨的主要成分,占人体骨量的75%~80%。松质骨由许多骨小梁交错排列而成,骨板层次少而薄,没有或有少数不完整的骨单位,无血管分布,主要位于椎体(占66%~75%)、长骨干骺端和肋骨,其强度比皮质骨小,但可增加骨的抗压缩及抗扭转力,占人体骨量的20%~25%,总面积为皮质骨的6~8倍。
(一)骨的组织结构
骨组织由骨细胞系、骨胶原基质和无机盐构成。
1.骨细胞系
骨细胞系中含3种细胞,即骨细胞(osteocyte)、成骨细胞(osteoblast)及破骨细胞(osteoclast)。
(1)骨细胞由成骨细胞产生,位于骨陷凹内。
(2)骨细胞为骨形成细胞,合成骨胶原及骨蛋白,以构成骨基质的主要成分,尚未矿化的骨基质称类骨质。一旦矿化,即含碱性磷酸酶。陷入骨基质的成骨细胞成为骨细胞,留在骨表面的静止成骨细胞称衬里细胞(lining cell)。
(3)破骨细胞为骨吸收细胞,它在骨表面分泌酸离子和蛋白溶解酶,以其胞浆延伸形成的粗糙缘吸收骨表面,降解骨基质,并溶解吸收钙离子,含酸性磷酸酶。
2.骨基质
位于骨细胞之间,由成骨细胞分泌的胶原矿化后形成,其中有机质占1/3,无机质占2/3。有机质中90%为胶原纤维及少量无定型有机质,随年龄增大,有机质减少。胶原有几种,成人骨中为1型,由成骨细胞产生,每个胶原单位由α-链及β-链构成,经过一系列脯氨酸(proline)及赖氨酸(lysine)等转型(post- translational modification)后合成蛋白,骨代谢时释放羟脯氨酸及赖氨酸,能用做疾病活性的指标。交联(cross- links)及其他原胶原(tropocollagen)大分子经糖基化后形成胶原纤维。骨基质内尚有蛋白多糖(proteoglycan)、糖蛋白(glycoprotein)、骨钙素(bone glaprotein,BGP,osteocalcin)及骨连接素(osteonectin),骨钙素可用于判断骨转换率。无机质的主要成分为羟磷灰石结晶及无定形钙、磷,85%是磷酸钙,10%是碳酸钙,少量氯化钙、氟化钙、碳酸镁等。
(二)骨代谢
骨与身体其他组织一样,处于不断新陈代谢的动态变化之中,即旧骨吸收,新骨形成,以维持骨的坚韧及弹性、并通过骨代谢与细胞外液进行钙、磷交换,参与维持血钙水平。骨代谢的过程亦称骨转换,主要在骨表面进行,皮质骨内的代谢在哈弗系统进行,骨吸收后形成圆锥隧道,松质骨代谢在骨小梁表面进行,骨吸收时形成陷窝。由于松质骨表面积大,故松质骨代谢活跃,发生骨质疏松早于皮质骨。
正常情况下,成年骨骼的代谢周期约为3~4个月,包括激活期、吸收期、反转期、骨形成期及矿化期。此过程涉及的一组细胞称为骨再建单位(bone remodelling units,BRU),完成一个BRU,即建立一个骨结构单位(bone structural units,BSU),此过程称骨再建周期。皮质骨内的BSU是二级哈弗系统及锥体,小梁骨的BSU是扁平的,约40~60μm厚、0. 5~1mm范围。体内共有3500万个BSUs,约40%在小梁骨内,故骨更新发生在小梁骨中较多,每年约为25%,而皮质骨仅有2%~3%。
1.激活期
一组破骨细胞被激活,黏附于矿化骨的表面。破骨细胞胞浆形成粗糙缘、局部酸性增加、溶酶体酶及蛋白溶解酶增加,并集中一些骨吸收因子,骨表面的激活频率(activation frequency,AF)约为每10秒钟一次。激活破骨细胞的原因目前尚不清楚。
2.骨吸收期
骨基质中的无机质溶解,有机质崩解,在骨表面出现挖空的陷窝,每日约吸收20μm深,4~12日内可吸收40~60μm。
3.反转期
单核细胞进入凹陷部位,将吸收腔整理平滑,7~10天后沉积一层胶合物,富有蛋白多糖、糖蛋白及酸性磷酸酶。
4.骨形成期
当吸收期及反转期完成后,一组成骨细胞进入陷凹表面,合成和分泌有机基质,形成按层排列的多层胶原束,即类骨质。
5.矿化期
以无定形磷酸钙沉淀开始,进而形成羟磷灰石结晶,钙∶磷∶碳之比约为10∶6∶1,其中也含其他离子,如钠、镁及氟。完成此期时,成骨细胞变长、变平、填充陷窝,结束一个骨代谢周期。
骨吸收与骨形成同时进行,称为偶联,骨吸收过程在数日内完成,而骨形成及完成矿化则需数月。因此,激活频率愈高,即骨代谢愈活跃,骨吸收愈多,骨丢失愈多。
(三)骨代谢的调节因素
骨吸收与骨形成的偶联过程,受体内多种激素及细胞因子等因素的调节。维生素D、降钙素(calcitonin,CT)及甲状旁腺激素(parathyroid hormone,PTH)共同组成人体内钙代谢的主要调节系统,称为钙调节激素(calcium regulating hormone)。
1.钙调节激素
(1)维生素D:人体的维生素D来源于食物及皮肤的合成,皮肤中的7-脱氢胆固醇经紫外线照射后,转变为维生素D3,进入血液循环与蛋白结合并进入肝脏,在25羟化酶作用下转变为25(OH)D3,然后到肾脏由1α羟化酶作用转变为1,25(OH)2D3,才具有生物活性。肾外合成极少量的活性维生素D。其生理作用复杂,包括促进肠钙吸取、提高血钙浓度,为骨矿化提供原料,促进肾小管重吸收钙,促进成骨细胞形成和骨基质矿化,也刺激破骨细胞的骨吸收作用。
成骨细胞内有1,25(OH)2D3受体,成骨细胞对维生素D有反应时产生骨钙素,表明维生素D对骨形成有直接作用。对骨矿化的作用是增加骨矿化时的钙、磷利用,当血钙水平下降后,体内维生素D和PTH参与骨吸收,以动员骨钙入血。此外,维生素D还刺激成骨细胞产生一些破骨细胞活化因子而促进骨吸收,此作用是间接的。女性绝经后早期,血1,25(OH)2D3下降,提示肠钙吸收不良,而此时钙的需要量增加,钙量不足也是促进骨丢失的原因之一。
(2)降钙素:由甲状腺滤泡细胞合成,用放射免疫法(radioimmunoassay,RIA)测定时,其值变异大,血钙、胆囊收缩素(cholecystokinin)、胃分泌素(gastrin)、β-肾上腺素能物质及酒精均影响其水平。药用剂量的降钙素具有抑制骨吸收、从而有降低血钙的作用,也降低肾小管对钙、磷、镁、钾等离子的重吸收而具有利尿作用,且有中枢性止痛作用,可能与内源性阿片肽分泌增加有关。破骨细胞接触降钙素后,其刷状缘内缩,并从骨表面退出,使其活性下降。妇女的降钙素水平较男性低,但尚未证明骨质疏松是由降钙素缺乏引起,给予外源性雌激素可使女性的降钙素水平升高。
(3)甲状旁腺激素:甲状旁腺激素含84个氨基酸,前32~34个氨基酸有生物活性,部分在肝内裂解为有活性的N末端及无活性的C末端。甲状旁腺激素的靶器官是骨及肾,它促进肾小管重吸收钙、抑制肾小管对磷的重吸收,刺激肾1α-羟化酶而产生活性维生素D(calcitriol),后者增加肠钙吸收,并可能从骨释放钙而使血钙升高。
2.细胞因子(cytokine)
首先提出细胞因子在骨吸收中的作用是因发现单核白细胞能产生激动因子,细胞培养中有丝分裂的上清液有骨吸收活性,激活白细胞可产生白细胞介素-1(interleukin-1,IL-1)等。其后在动物实验、细胞或组织培养中发现以下因子的作用:
(1)肿瘤坏死因子(tumornecrosisfactor,TNF):由激活的巨噬细胞产生,是强的骨代谢抑制剂,既抑制成骨细胞、又刺激破骨细胞的活性。
(2)白细胞介素-1,6(interleukin-1,6;IL-1,6):由单核细胞和巨噬细胞产生,使破骨细胞增殖并增加其活性。啮齿动物去卵巢后,用IL-1受体拮抗剂可使骨丢失减慢。
(3)白介素-2,3(interleukin-2,3;IL-2,3):由活化T细胞产生,促破骨细胞成熟,并刺激其活性。
(4)白细胞介素-4(interleukin-4,IL-4):由活化T细胞产生,抑制破骨细胞的黏附功能,促进基质钙化。
(5)白细胞介素-11(interleukin-11):由骨髓基质细胞产生,诱导破骨细胞分化及成熟。
(6)转化生长因子-β(transforming growthfactor-β,TGF-β):由B淋巴细胞分泌,刺激成骨细胞,抑制破骨细胞。
(7)巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF):促破骨细胞形成或恢复其活性。
(8)胰岛素样生长因子(insulin-like growth factor,IGF)及骨形成蛋白:促进骨形成。
(9)白血病抑制因子(leukemia-inhibitory factor,LIF):对骨代谢有双向作用。
(10)前列腺素(prosta glandins,PGs):是骨代谢的多种功能调节剂,刺激骨吸收,也刺激骨形成,即影响成骨细胞前身的复制和分化,高浓度时抑制胶原合成。其中PGE的作用最强,PGF2也刺激骨吸收,部分原因是它能增加内源性PG的产生。
3.全身激素及局部调节物的相互作用
细胞因子是自分泌或旁分泌的局部作用因子,通常是蛋白或糖蛋白,它们涉及细胞间的正常信号联系、血液生成、免疫反应及骨再塑。骨再塑是一个局部现象,可能受局部因子的控制,而全身激素又影响局部因子,如甲状旁腺激素、1,25(OH)2D3及甲状腺素均刺激骨内产生前列腺素,但与前列腺素刺激骨吸收的能力无关。甲状旁腺激素及甲状腺素促IL-6产生,雌激素抑制IL-1及IL-6产生、刺激成骨细胞内IGF-ⅠmRNA表达。生长激素影响骨组织及肝内产生IGF,而IGF-Ⅰ对生长激素又有反馈抑制作用等。
性激素对骨生理有重要作用,它们参与骨骼的性分化,维持成年骨骼的骨矿平衡,性激素不足时,骨转换加速,引起快速骨丢失,是绝经后骨质疏松症的重要发病因素。女性的性激素包括雌激素、雄激素及孕激素。经BMD测定、骨组织形态计量学、动物实验及细胞培养等方法已证明,各种性激素对骨代谢均有作用,尤以雌激素的作用最为显著。
(一)雌激素对骨代谢的影响
1941年Albright提出绝经与骨质疏松之间的关系后,对雌激素与骨代谢的关系进行了大量研究。
1.临床研究
(1)骨量变化:早期采用X线照片观察到雌激素下降时,掌骨、桡骨、股骨及肱骨骨干的骨膜吸收,骨髓腔扩大,说明皮质骨厚度降低;后来采用定量计算机断层扫描技术(quantitativecomputedtomography,QCT)测量脊椎小梁骨BMD,单光子骨吸收仪(singlephotonabsorptiometry,SPA)测定前臂BMD,双光子骨吸收仪(dualphotonabsorptiometry,DPA)及双能X线骨密度仪(dualenergyX-rayabsorptiometry,DXA)测量脊椎骨、近端股骨及全身的BMD,发现:
1)血雌二醇(E2)低于40~80pg/ml时发生骨丢失。绝经5年内,雌激素下降最快,骨丢失最多,约为总丢失量的50%。用钙动力学测定研究,绝经5年内骨钙吸收较绝经前妇女增加67mg/d,而骨形成只增加50mg/d,此差别在绝经后1~2年内最大,补充雌激素后,骨吸收与骨形成恢复至绝经前的状态。
2)绝经后身体各部位的骨丢失速度加快,小梁骨多于皮质骨,因小梁骨的转换率高、骨吸收面积大于皮质骨所致,从而脊椎骨及四肢骨末端变化显著。
3)绝经前妇女双侧卵巢切除术后,雌激素快速降低,骨丢失速度更快,术后2年内腰椎小梁骨丢失率高达每年8%,中段桡骨皮质丢失率为每年2%。青年妇女因疾病影响卵巢分泌雌激素、或应用促性腺激素释放激素激动剂(GnRH-a)治疗后,体内雌激素水平降低,均可发生类似于绝经后的骨骼变化。
(2)骨代谢生化指标的变化:骨代谢生化指标是利用骨代谢过程中的某些产物,间接评估骨代谢状况。代谢活跃时,各项指标增加,称高转换型骨代谢;指标降低则为低转换型骨代谢。绝经后骨代谢呈高转换型,故骨吸收指标及骨形成指标均增高。外源性补充雌激素可使之恢复正常。
1)骨吸收指标:以往常用尿钙/肌酐比值(Ca/Cr)、尿羟脯氨酸/肌酐比值(hOP/Cr);近年来多用特异性较高的指标,如血或尿中吡啶啉(pyridinoline,Pyr)、去氧吡啶啉(DPYr),N-端和C-端交联(NTx和CTx),血清抗酒石酸酸性磷酸酶等。
2)骨形成指标:包括血总碱性磷酸酶(totalalkalinephosphatase,tALP)或骨特异性碱性磷酸酶(bALP),骨钙素(BGP),1型胶原前肽(prepeptidoftype1collagen),即C-端前肽(PICP)和N-端前肽(PINP)等。
2.实验研究
(1)细胞培养
1)雌激素对成骨样细胞的影响:1988年报道成骨细胞系培养的骨细胞中有高亲和力的雌激素受体(estrogenreceptor,ER),其后很多学者报道,雌激素对体外成骨细胞的增殖及骨基质蛋白与酶的编码基因表达有各种直接作用。胎鼠的成骨样细胞培养中发现,雌激素促使细胞增生,并合成胶原酶消化蛋白(collagenase-digestibleprotein),也使胰岛素样生长因子结合蛋白(IGF-BP)的产生增加。雌激素对骨吸收的抑制作用可能是通过成骨细胞介导的间接机制,其根据是一些细胞因子结合到成骨细胞上的雌激素受体,而影响破骨细胞的募集及活性。
2)雌激素对破骨细胞的影响:鸟的破骨细胞及人骨巨细胞肿瘤中的破骨样细胞中含雌激素受体,推测雌激素可直接抑制破骨细胞的吸收活性。
(2)雌激素对骨组织形态计量的影响
绝经后妇女作为雌激素低下的研究对象,取其髂骨活检显示,雌激素治疗前,骨吸收表面较绝经前妇女高(15%vs.3%),而骨形成表面相似(4.8%vs.4.3%);雌激素治疗3个月后,骨吸收表面由15%降到6.4%,骨形成表面也降低,但降幅较小(4.8%vs.4.0%),可见雌激素治疗抑制骨吸收,也抑制骨形成;治疗1~2年内,BMD增加,其后增加不明显。观察四环素标记的骨标本,其骨再塑状况显示,服用雌激素者骨吸收表面减少,类骨质矿化表面减少,骨形成率降低,骨激活频率明显降低,而单服钙剂者,类骨质表面只轻微降低,提示雌激素治疗后BMD增加,不是骨形成增加,而是骨吸收腔内充填增多。因此骨吸收越活跃,应用雌激素的效果越好。
3.雌激素在骨代谢中的作用机制
尚未完全明了,但已经确定是通过多种途径发挥作用。
(1)雌激素影响骨代谢的局部因子:动物实验及细胞、组织培养中,雌激素抑制IL-1、6及PGE的产生,促进TGF-β及IGF-1的产生,因而有利于维持骨量。
(2)雌激素降低骨对PTH的敏感性:当雌激素不足时,PTH促进骨吸收的作用增强。
(3)雌激素增加降钙素的合成。
(4)雌激素增加肾内1α-羟化酶活性,使体内活性维生素D增多,从而增加肠钙吸收;同时雌激素可降低肾排钙量。
(5)雌激素直接通过骨细胞上的雌激素受体发挥作用。
(6)雌激素降低时,引起B淋巴细胞增殖而导致骨丢失。动物实验发现,大鼠去卵巢后雌激素水平下降,骨髓内前B细胞堆积,破骨细胞分化因子增加,骨量减少;补充雌激素或选择性雌激素受体调节剂SERM,如雷洛昔芬(raloxifene)后,骨髓内前B细胞堆积消失,骨丢失停止。
Stern等随访研究681位45~90岁老年人5~10年,发现血清护骨素(OPG)水平与使用雌激素治疗女性的骨密度有相关性,与不使用雌激素治疗的女性则无相关性;认为雌激素可通过提高血清OPG水平来直接抑制破骨细胞活性。
(二)雄激素对骨代谢的影响
雄激素对骨代谢的作用还不太清楚,但已知雄激素对身体的作用很广泛,靶器官包括性附属器,中枢神经系统、肾、垂体前叶、肝及肌肉。骨内有低水平的芳香化酶活性,睾酮经芳香化酶转变为雌激素对骨骼起作用,也可通过5α-还原酶将睾酮转变为双氢睾酮,而增加与雄激素受体(androgenreceptor,AR)的亲和力。人体内研究发现,雄激素增加骨内钙、磷含量,增加ALP活性,也增加骨矿化及前体细胞的增生与分化。血清雄激素水平影响青春期的骨发育,也影响绝经前、围绝经期及绝经后妇女的BMD。
1.雄激素对实验动物的影响
雄激素在骨骼生长及维持中有重要作用,在生长鼠中它刺激骨膜形成,而在老年鼠中则预防骨内膜吸收。当雄激素缺乏造成骨转换增加,小梁骨及皮质骨丢失明显。
2.雄激素对培养的骨细胞的影响
骨细胞中有雄激素受体并对雄激素发生反应。维持骨量的作用是通过维持肌肉量的间接影响,以及对成骨细胞及软骨细胞的直接作用。对成骨细胞的作用是:产生TGF-β、IGF-1,抑制IL-1及IL-6的产生,提高IGF-2受体水平,增加对成纤维细胞生长因子的敏感性,促使成骨细胞分化;对破骨细胞的作用可能是通过抑制其形成。
(三)孕激素对骨代谢的影响
孕激素在绝经前妇女是否有维持骨平衡的作用还不清楚。绝经后孕激素水平下降,可能在骨丢失中起一定作用,因孕激素可与糖皮质激素受体结合,阻断糖皮质激素的作用,从而阻止了糖皮质激素造成的骨形成率下降及骨吸收率升高。人体应用孕激素后,骨吸收指标降低,而骨形成指标的变化尚不明确;使用雌激素后血清钙及尿钙、羟脯氨酸降低,表明骨吸收降低,加孕激素后血清BGP及ALP升高,表明骨形成增加,但如不用雌激素,单用孕激素可能无效。
动物实验中发现,大鼠去卵巢后发生快速的骨丢失,补充孕激素后,骨吸收率下降,同时伴随骨形成率的升高;然而,单纯补充雌激素时,只见到骨吸收下降,而对骨形成无作用。组织学上,用孕激素后,成骨细胞及破骨细胞数量均上升,骨量增加;雌激素治疗时,破骨细胞数、吸收窝深度及形成陷窝的总数明显减少,未见骨量明显改变。由此可见,孕激素对骨代谢的作用不同于雌激素。
孕激素对培养的骨细胞的影响:正常的人成骨样细胞有孕激素受体(PR)表达,体外应用孕激素处理时,有报道孕激素可直接刺激成骨样细胞的增生及分化。
临床表现只能作为诊断的参考。
(一)BMD测定
目前是诊断骨质疏松的主要依据,因为骨密度在很大程度上可以预测骨折的危险性。WHO于1994年修订骨量测定值的诊断标准为BMC或BMD较正常成年人平均值低2.5个标准差以上,称为T分(t-score),其计算方法为(测定的BMD-正常成年人平均BMD)÷标准差。但骨折的发生不仅仅取决于BMD,而是与骨强度有关,骨强度由BMD与骨质量组成,因此,诊断方法还有待完善。
1.BMD的测定方法
(1)X线照片:是最早应用的定性或半定量的骨量测定法。所谓定性,是用肉眼观察骨组织与其旁的软组织之间的密度差,差别大者骨密度高,差别小者骨密度低,无差异者骨密度最低。此外,骨纹粗而密集者骨密度高,骨纹细而稀疏者骨密度低;骨皮质厚者骨密度高,反之则低。严重的骨质疏松症时,骨纹细少且伴随皮质骨呈线状。1955年Lachman提出,BMD丢失30%~50%才能在X线照片上发现,故不能用于早期诊断。后来出现了半定量的方法,即股骨颈小梁指数法(Singh指数)及跟骨小梁指数法等。股骨颈小梁指数法是根据股骨颈骨小梁的分布多少分为Ⅰ~Ⅶ级,Ⅲ级以下者,肯定为骨质疏松。跟骨小梁指数法是根据骨小梁密度分为5度,5度及4度者为正常,3度可疑,1度及2度为骨质疏松。
目前X线照片在骨质疏松症中的应用价值,在于诊断是否合并骨折,是否伴有骨质增生及骨骼变形,并与其他骨病鉴别,如骨肿瘤、骨软化症等,因此,此法尚不能废弃。
(2)SPA:SPA是20世纪60年代发展的骨量测定技术,其原理是放射性同位素产生的射线透过人体时,可被骨组织吸收,未被吸收的部分由放射源对侧的探测器接收,射线计数经电脑自动处理,以数字显示骨矿含量(BMC)、骨宽度(BW)及BMD(BMC/BW)。BMC以g/cm表示,BW以cm表示,BMD则为g/cm2。骨量高时,探测器接收的射线量低,反之则高。
同位素用碘-125(125I)或镅-241(241Am)。125I的半衰期为60天,需定期更换,241Am的半衰期为433年,可长期使用。此法适用于测定肌肉少的四肢骨,不能测定深部骨骼,如脊椎骨及股骨。前臂骨形态规律,骨周围为均一性薄层软组织,而且骨与软组织的比例高,测定中不易受技术因素的影响,故多用于前臂骨的测定。其精确度为1%~2%,准确度为4%~6%,一次测定约需5~10分钟,放射量小于1μSv。因价格较低、适用于普查,但前臂中、外1/3交界处的皮质骨较多,绝经后变化较小,而测量前臂远端,虽松质骨较多,但因接近关节,骨形态不规则,测定值不甚理想,是其主要缺点。
测定方法:将前臂浸泡于水槽内,或包一水囊(使其吸收的光子相等于软组织,那么,对放射线的吸收差异只由骨组织构成)。选定测量部位,机器即自动在肢体上移动探测器,并自动显示测定值。
(3)DPA:DPA与SPA的区别是应用两个能量不同的放射源,将两种能量的计数经处理后相减,则消除全部软组织的计数,剩下的就是骨组织的计数。故可测量脊椎骨及股骨等深部骨骼,但因其测量的精确度及准确度较差,检查时间长,于20世纪80年代末已被DXA取代。
(4)DXA:原理与DPA相同,但放射源不用同位素,而是利用X线管。用滤光板将X线球管产生的光子束分为两种能量的X线,故能消除骨组织周围肌肉厚薄不同的影响,可测量脊椎骨,髋部及全身任何部位骨骼的BMC及BMD,并可测量肌肉及脂肪含量。用笔形X线束扫描时间需6~15分钟,用扇形X线束扫描只需2分钟。精确度为1%~2%,准确度为4%~8%,放射剂量为1μSv。目前认为是诊断骨质疏松症及判断疗效的可靠方法。
测定方法:被测者平卧于机器上,测定脊椎骨时,可经前后位或侧位测定。前后位测定的缺点是老年患者易受骨质增生及主动脉硬化的影响而出现假阴性(测定值比实际高)。测定髋部时,一般测定股骨颈、Ward三角区及大粗隆,故需内旋股骨45°,使测定部位显露清楚。
(5)SXA:与SPA的用途及原理相同,不同之处是放射源用X线,而不用同位素。北京协和医院用SXA测定前臂与DXA测定腰椎、股骨颈、Ward区、大粗隆相比,两种方法的相关性良好。
(6)QCT:是目前唯一可以在三维空间测量BMD而得出真实体积BMD的方法,测定值为g/cm3,也是目前可以分别测量皮质骨与松质骨BMD的唯一方法,用于测量腰椎BMD。测量时将标准体模置于患者的背部,与患者同步扫描,扫描时间约为10~20分钟,精确度为2%~5%,准确度为3%~6%,放射剂量约为100μSv,因放射剂量较大,不宜多次重复检查。
用于测量四肢的QCT为pQCT,其精确度提高到0.5%~1%,放射剂量也大大减少。日本妇女中用pQCT测量桡骨BMD与DXA测量脊椎、桡骨及股骨颈BMD相比,有中度相关,预测骨折的可靠性次于DXA。故能否用于诊断尚有争议。
2.BMD测定的质控指标
精确度指重复测量一个部位的变异,亦称重复误差,或精确度误差。通常以变异系数(CV)表示,CV越大,精确度越差。CV计算法为:CV%=(标准差/BMD均值)×100%。精确度的临床意义在于:判断疗效时,如精确度为1%,取95%可信限时,BMD变化大于±2.8%才有意义,否则为仪器本身的误差,不能判断有效或无效。取90%可信区间,BMD变化在±2%即有临床意义。如果骨丢失率为每年3%,用精度为1%的仪器可以测量出变化,而精度差(即大于1%)的仪器则测不出来。设计临床疗效观察应入组的例数,例如精度为1%时,发现BMD增加0.5%,需要42人(按统计学公式)。
准确度:指测量值与真值(如骨灰量)之间的误差,即仪器的误差,由厂家提供。误差大者易出现假阳性,小于真值则出现假阴性。
(二)骨超声检查
利用超声通过骨组织的速度(SOS,单位为m/s)、振幅衰减(BUA,单位为dB/MHz)及硬度指数(SI)反映骨结构与骨量,在理论上,超声检查既反映骨量又反映骨结构,且具有无放射线、价格较低、机器易搬动等许多优点。有人将超声检查值与DXA检查结果相比,二者有相关性,故可用于观察病情变化及治疗效果,但超声检查结果不是BMC,故不能与真值相比,无准确性指标,目前尚无公认的诊断标准。Tao等学者认为将定量超声诊断和OSTA综合应用在骨质疏松非脊椎性骨折的筛检上,具有较好的预测准确性,灵敏度为83%,特异度为84%。
(三)骨组织活体切片检查
将活体骨组织制成切片,在显微镜下观察结构与形态,测量骨小梁面积、骨小梁周径、类骨质宽度等骨形态计量学指标,可用于疑难病例的鉴别诊断,研究骨代谢状况。与上述的几种方法相比,诊断更为可靠,但是观察结果有一定的主观性,故各实验室间、各观察者之间有一定的差异,此外,骨活检是有创性检查,不宜普遍进行。
(四)骨代谢生化指标测定
前面已经介绍,骨代谢过程中的某些产物可用于间接评价骨代谢状况,可用于测骨质疏松症及骨折的危险性(生化指标显示骨代谢为高转换型者,骨丢失较快,容易发生骨质疏松症及骨折),与其他骨病进行鉴别诊断(绝经后骨质疏松症者,血ALP虽可上升,但在正常范围,如ALP异常升高,伴随血清钙、磷改变,则为其他骨病),并根据骨代谢状况选择合理的治疗药物(高转换型者应用骨吸收抑制剂,而低转换型者应用骨形成刺激剂)及判断疗效。不是诊断标准。
1.骨吸收生化指标
(1)尿Ca/Cr:骨吸收时骨钙进入血液循环,引起血钙升高,之后尿钙升高,故尿钙可以反映骨吸收状况。饮食中的钙含量、肠钙吸收及肾功能情况等影响血及尿钙水平,故特异性不强。空腹12小时后的尿钙可避免食物的影响,主要反应骨吸收状况,为避免前日饮食的影响,空腹12小时后的第一次尿弃去,留取空腹的第二次尿测定。
(2)尿HOP/Cr:尿HOP的50%为骨胶原的代谢产物,骨吸收增加时,比值升高。为避免饮食的影响,除需留取空腹的第二次尿之外,应在留尿标本的前三日禁食含胶原多的食物。
(3)Ⅰ型胶原吡啶交联物及末端肽(pyridinium crosslinks and telopeptide of type I collagen):是骨、软骨及其他结缔组织中胶原的代谢产物,骨吸收增加时,血或尿中的含量增多。因为骨组织的转化率远高于软骨及结缔组织,故主要反应骨的吸收状况,其水平不受饮食影响,较尿Ca/Cr及尿HOP/Cr反映骨吸收的特异性强。目前多测定尿Pyr/Cr、DPYr/Cr;血的Ⅰ型胶原交联氨基末端肽(NTx)或C-端多肽(CTx)。NTx是破骨细胞降解胶原的直接产物,而CTx的结构为所有组织中的Ⅰ型胶原所共有,故其特异性较NTx差。
(4)血抗酒石酸酸性磷酸酶(tartrate-resistantacidphosphatase,TRAP):TRAP由破骨细胞合成并直接分泌入血,因而反映破骨细胞的状况,骨吸收增加时,血TRAP升高。
2.骨形成生化指标
(1)血清tALP及bALP:tALP由肝及成骨细胞产生,小肠来源者占25%,空腹时比例减少,肾来源者很少,可以不计,故在肝功能正常时,它反映成骨细胞的活性。bALP只来源于成骨细胞,故特异性强。
(2)血清BGP:BGP是骨组织中最丰富的非胶原蛋白,由成骨细胞产生,成熟的BGP分子分泌到细胞外,其中大部分进入细胞外骨基质,小部分进入血液循环。绝经后骨质疏松妇女血中的BGP可能升高、降低或正常,取决于其骨形成速率。骨形成刺激剂治疗后,BGP水平升高,而使用骨吸收抑制剂后,BGP水平降低。肾功能不良者,血BGP升高(BGP由肾滤过及降解)。
(3)血清Ⅰ型胶原前肽:Ⅰ型胶原由成骨细胞合成,其氨基端(N-端,PINP)和羧基端(C-端,PICP)延长肽被特异酶切下后,可以测定,反映胶原的合成状况,然而皮肤、牙齿、心血管等能合成Ⅰ型胶原的组织也可产生。
由于护骨素(OPG)能早期调控骨代谢变化,近年来由一些研究报道,提出检测血清OPG可较早反映全身骨代谢水平,其敏感性和特异性较传统的骨密度及骨代谢转换指标高,因此有望成为早期预测绝经后骨质疏松症的新生化标志物。Luvizuto等研究显示,OPG基因敲除鼠模型表现为严重的骨质疏松,髋部缺乏骨小梁,破骨细胞数量增加及骨转换效率高。Nabipour等研究382位平均年龄58岁的伊朗健康绝经后妇女,测定腰椎L2~4骨密度及血清OPG水平,发现OPG和OPG-RANKL比均与腰椎骨密度呈显著正相关。Lee等最近对OPG基因多态性进行Meta分析,发现G1181C的GC基因型与腰椎骨密度明显相关,而A163G和T950C基因的多态性与骨密度无关。
尽管BMD检测是目前诊断骨质疏松的金标准,但它无法预测骨折的发生风险,而骨折才是绝经后骨质疏松症最严重的结局。WHO推出了一项骨折风险评估工具(fracture risk assessment tool,FRAX),通过临床危险因素(年龄、骨折史、家族骨折史、低体质指数、激素治疗、吸烟和过量饮酒)可评估个体发生骨质疏松性骨折的风险。已相继在英国、日本、中国、比利时、瑞士等国家开展应用研究。最新有一项研究利用FRAX对意大利绝经后妇女人群进行骨折危险分层,结果提出对于在意大利临床实践中使用FRAX来限定标准是一个良好的起点。在此基础上,骨质疏松症指数(MOI)被提出,其由骨折指数(FI)发展而来,是一个有效的骨折危险性评分指标。骨质疏松症指数的危险因素包括年龄、体重、既往骨折史、家族性髋部骨折或脊柱骨质疏松症史、吸烟、身材矮小等。在芬兰一个300例骨折的绝经后妇女和434名年龄在65~72岁的妇女作为对照组的试验研究中,发现测量骨密度后,MOI可以为单一的数值来评估骨质疏松症和骨折的危险因素,其干预的阈值与FRAX一致。
(一)治疗
已患骨质疏松症者,一方面应防止病情的进一步加重,采用减少骨丢失的措施,同时应增加以下治疗方法:
1.并用骨形成刺激剂,促使骨量增加
两种或两种以上的药物联合应用,已显示了提高疗效、减少药物副作用等优点。
2.预防骨折
即减少跌倒及外伤的机会,如少服用镇静剂,穿合适的鞋子,活动于不易滑倒的地方,适当锻炼身体以增加平衡能力等。
3.每日摄入元素钙1200~1500mg,维生素D400~800单位。
4.配带髋部护垫
一旦跌倒,可能减少髋部骨折机会。
(二)防治绝经后骨质疏松症的药物
1.骨吸收抑制剂
(1)雌激素类
绝经早期(一般指绝经5年以内)补充雌激素(ERT),可以预防骨丢失。绝经5~10年以后补充也可防止骨量继续丢失,但如骨量已经降低,预防骨折的作用较差。国外报道,应用5年以上者,脊椎骨折率降低60%~80%,应用10年以上者,髋部骨折发生率降低50%。妇女健康初探(WHI)对16608名50~79岁绝经后妇女的随机对照研究显示,每日常规使用雌孕激素联合治疗者脊椎和髋骨骨密度显著升高(分别升高4.5%和3.7%),骨折发生率降低(11.1%vs.8.6%,风险比为0.76)。有研究者对绝经早期女性随机给予HRT、维生素D及安慰剂,随访5年发现,HRT组非椎骨骨折风险显著低于安慰机组(P=0.042)。目前,多项研究已证实,骨密度与HRT开始时间相关,及早开始HRT更利于维持骨密度和降低骨质疏松风险。2011年IMS“绝经相关问题”全球高峰论坛概要中指出:HRT对预防所有骨质疏松症相关性骨折有效,甚至包括有低骨折风险的患者(A级证据);我国《绝经过渡期和绝经后期激素治疗临床应用指南(2008)》推荐,HRT是预防绝经后骨质疏松症的合理选择,同时指出60岁以后当预防骨折为唯一目的时不推荐开始进行标准剂量的HRT。应用雌激素预防骨质疏松的注意点:
1)无雌激素应用的禁忌证,如已知或怀疑妊娠、原因不明的阴道出血或子宫内膜增生、已知或怀疑患有乳腺癌、已知或怀疑患有与性激素相关的恶性肿瘤、6个月内患有活动性静脉或动脉血栓栓塞性疾病、严重肝肾功能障碍、血卟啉症、耳硬化症、系统性红斑狼疮、与孕激素相关的脑膜瘤等,故使用前需经医生检查,在医生指导下应用。
2)有子宫者必须加用合适剂量及合适时间的孕激素,即雌、孕激素补充治疗。
3)使用最低有效剂量。
4)激素治疗个体化。
5)雌激素经皮应用及口服均能预防骨丢失,经皮应用的优点是药物不首先进入肝脏,无肝的首过效应,其药物作用及代谢可能更接近于生理状态,用药量较少。经阴道用药时,因吸收入血的雌激素量不稳定,不宜用于骨质疏松症的防治,而适用于治疗萎缩性阴道炎及萎缩性泌尿系的改变。
6)配伍应用的孕激素也有抑制骨吸收及促进骨形成的作用,但应用多大剂量、应用多长时间有效的问题尚不清楚,故配伍应用的目的仍然是对抗雌激素的子宫内膜增殖作用,因此应用剂量及时间,应以“足以对抗”为合适。如何判断“足以对抗”,以往的根据是子宫内膜全部转变为分泌期,后来有学者提出,以核分裂率为标准,即能抑制核分裂的剂量即可,而不必达到子宫内膜全部变为分泌期的剂量。近几年北京协和医院经动物实验后提出,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)与核分裂率同样具有良好的可靠性,可用于判断配伍的孕激素是否适当。由此可见,雌、孕激素的合理配伍还需继续探索。目前主张于周期序贯应用时,每28天的周期中,后10~14天并用孕激素,连续联合应用时,每日均使用雌、孕激素,孕激素的每日剂量为周期应用时每日量的一半即可。
7)定期评估相关指标,权衡利弊使用:应用前及应用中均需对每一个妇女应用HRT可能获得的好处及风险进行比较,只在好处大于风险时,才有应用价值。
(2)降钙素类
降钙素是32个氨基酸组成的多肽,它的生物学功能及其在骨质疏松症发病中的作用尚不清楚。药用剂量时,它抑制骨吸收,试验证明,降钙素作用于破骨细胞,使其毛刷状边缘发生反折而降低其活性。初用时骨吸收受抑制,骨形成正常,骨量可能少量增加,继续用药后,骨形成也减少,骨量不再增加,骨代谢处于一种新的平衡状态,适用于高转换型骨丢失的预防及治疗。
少量开放性研究显示,它降低脊椎骨折发生率,但对髋部骨折率的影响,还缺乏长期的前瞻性的研究资料。此外,它有中枢性止痛作用,故特别适用于已发生骨折及伴随疼痛的患者。降钙素抑制骨吸收时,血钙下降,可引起继发性的PTH升高,因此,必须同时补充钙剂。另有学者最新研究发现,鼻喷降钙素治疗6个月后可见绝经后骨质疏松患者股骨颈和腰椎骨密度均较治疗前有所增加,但仅在腰椎差异有统计学意义(P<0.05),而在股骨颈治疗前后骨密度的差异无统计学意义(P>0.05),血清TRACP-5b、NTX/Cr较治疗前明显降低;治疗12个月时股骨颈和腰椎骨密度均较治疗前明显升高,差异有统计学意义(P<0.05),血清TRACP-5b、NTX/Cr较治疗前明显降低(P<0.01),BALP较治疗前有升高(P<0.05)。对照组在治疗6个月时的腰椎和治疗12个月时的股骨颈和腰椎部位骨密度均较治疗前降低,差异有统计学意义(P<0.05);BALP较治疗前有降低,差异有统计学意义(P<0.05)。研究结论为鼻喷降钙素治疗6个月有效,12个月效果显著,可预防绝经后骨丢失,增加其骨量。
制剂、用量及用法:
1)密盖息(miacalcic,SCT):是合成的鲑鱼降钙素,有注射剂及鼻喷雾剂两种。
注射剂:每支含50单位或100单位,皮下注射,每日1次,连续注射7~10次后,当骨痛有所减轻,可改为隔日1次,或每周2次,乃至每周1次。应用时间长者,对预防骨折有意义,短期应用的目的是缓解疼痛。鼻喷剂:每喷一次,药量为50单位。根据病情需要,每日喷1~2次(即喷一个或两个鼻孔)。一般初用时,每日喷2次,维持量为每日1次。因鼻黏膜的吸收率较低,现倾向于使用大剂量,即每日喷200单位,维持量为100单位。
2)依降钙素(elcatonin,ECT):是合成的鳗鱼降钙素,每支10单位或20单位,肌内注射,每周1次(20单位)或2次(10单位)。日本报道,每周注射20单位,连续使用6个月后,骨量增加。
降钙素的副作用比较少见,少数患者出现短暂的面部潮红、恶心、呕吐,不需处理可自然消失。因降钙素是多肽,长期应用可能产生抗体。Reginster等报道,鼻喷剂50单位每周用药5天,共用2年,61%的患者产生抗体,但是不影响腰椎BMD的变化。
(3)双膦酸盐类
是20世纪50年代开发的强力骨吸收抑制剂,用于治疗骨吸收加速的疾病,如变形性骨炎(Paget病)、恶性肿瘤骨转移及其伴随的高钙血症等。当骨转换加快时,效果最好,因此,也适用于绝经后骨质疏松症的预防及治疗。作用机制是双膦酸盐与体内的焦磷酸盐结构相似,对羟磷灰石有强的亲和力,与之结合后集聚在骨内,抑制磷酸钙结晶形成,并延迟磷灰石结晶凝聚而预防骨溶解;同时,双膦酸盐改变破骨细胞形态,使其数量减少、活性降低,从而抑制骨吸收。近年有学者提出双膦酸盐药物治疗骨质疏松是通过防止小GTP酶的异戊烯化起到抑制破骨细胞的活性,以及诱导破骨细胞凋亡而发挥作用的。治疗后脊椎骨折率明显下降,非脊椎骨折率轻微降低。
制剂、用量及用法:
1)羟乙膦酸钠(etidronate):因治疗剂量即有抑制骨矿化的作用,故需间断应用。一般每3个月中连续口服14日,每日400mg,停药期间只服钙剂及维生素D,即每3个月为一疗程。国外报道,按上述方案治疗2年后,脊椎骨折率轻微下降,停药1年后脊椎骨折率回升,与安慰剂组相似。服药期间如发生骨折,则需停药,以免骨折愈合延迟。肾功能不良者慎用(因未被骨吸收的药物经肾排出)。
2)氯甲双膦酸盐(clodronate):进口的商品名为“骨膦(Bonefos)”,抑制骨矿化的作用较弱,可连续或间断服用,用量范围较大,推荐为每日400~1600mg,国内产品每日服用400mg,连续6个月后,腰椎BMD上升。
3)氨基双膦酸盐(alendronate):其抑制骨吸收的强度是羟乙膦酸钠的1000倍,抑制骨矿化的剂量是防治骨丢失剂量的600倍,故不干扰骨矿化,可以连续用药。每日口服10mg,3个月后,即出现骨代谢生化指标下降及腰椎BMD上升,随服药时间延长,髋部及全身的BMD均升高。在34个国家的153个中心进行的随机、双盲、安慰剂对照研究中,1908例绝经后妇女每日服用阿仑膦酸钠(Fosamax)10mg,1年后腰椎、股骨颈、大粗隆及全髋BMD均较安慰剂组增高,幅度为2.4%~4.9%,非脊椎骨折率降低47%。阿仑膦酸钠与鼻喷降钙素(200单位/日)及安慰剂组相比,1年后,阿仑膦酸钠组的NTx及bALP明显下降,腰椎、股骨颈及大粗隆BMD升高,而降钙素组的上述指标与安慰剂组相似。阿仑膦酸钠与雷洛昔芬(60mg/d)相比,前者的骨代谢生化指标及BMD变化幅度大于后者,如合并应用阿仑膦酸钠与雷洛昔芬,则各项指标的改变均大于单独应用。改变服药为每周(7日)服药一次,每次70mg,其效果与每日服用10mg者相同,而且,由于减少了服药次数,用药的依从性明显改善。
国内学者采用阿仑膦酸钠治疗绝经后骨质疏松症妇女2年,发现腰椎及左侧髋部BMD均有不同程度提高,腰椎BMD上升15.7%,股骨颈BMD值上升20.8%,明显优于对照组(P<0.05);且治疗组用药4周时疼痛缓解有效率达80.7%,治疗3个月时疼痛缓解有效率达89.2%,而对照组分别为24.4%和30.5%,两组之间比较具有统计学意义(P分别为0.021和0.029);治疗组仅发生1例骨折事件,对照组发生7例骨折事件,两组相比差异有统计学意义(P<0.05);两组治疗均无明显不良反应。
服用双膦酸盐制剂的注意事项:正常情况下,口服吸收率在2%以内,故应减少影响吸收的一切因素。阿仑膦酸钠的试验观察表明,食物及饮料中的阳离子影响其吸收,故必须空腹服用,且只能用白水服药,而不能用牛奶、水果汁或矿泉水。服药后至少等待30分钟后再进食或服用其他药物,如餐后2~3小时服药,其吸收率也降低,故如空腹未服药,餐后不能补服。
双膦酸盐的副作用主要为:①消化道反应:少数出现轻度的恶心,呕吐或腹泻,见于口服帕米膦酸二钠(pamidronate)时,与剂量相关。口服羟乙膦酸钠及氨基双膦酸盐时几乎无反应,或与钙剂相似;②抑制骨矿化:用药剂量大时发生。如用羟乙膦酸钠,必须间断应用。最新有学者提出在绝经后骨质疏松症的妇女应用双膦酸盐时,应注意长期使用可能会引起先前报告未确认的不良事件的发生,包括胃肠道不耐受、下颚骨坏死、非典型股骨骨折、食管癌、房颤和慢性肌肉骨骼痛。
4)唑来膦酸(zoledronicacid):为静脉用第3代含氮双膦酸盐制剂,在绝经后骨质疏松和新发生的低创性髋骨骨折患者中,降低骨折风险的作用优于安慰剂。在绝经后骨质疏松症,新发生低创性髋部骨折患者中,应用唑来膦酸可改善骨密度及早期减少骨重建标志物;且耐受性良好,使用方便。值得提醒的是,严重肾功能不全患者不建议使用唑来膦酸治疗,且在使用唑来膦酸治疗前,应纠正维生素D的缺乏。
(4)钙剂
只有轻微的骨吸收抑制作用,通常作为各种药物治疗的辅助或基础用药。因为钙是骨骼的主要矿物质,全身钙的99%储藏在骨骼内,当血钙降低时,刺激甲状旁腺分泌PTH;同时,活性维生素D合成增多,引起骨转换增加,骨钙吸收入血,以维持血钙稳定,因此,骨是身体的钙库。为减少骨吸收,必须保证摄入足够的钙量。国内观察单纯补钙可轻微地减少骨丢失,国外报道,绝经晚期妇女补充钙可预防骨丢失,并降低脊椎骨折发生率。根据钙平衡试验,西方国家提出,绝经前妇女每日应摄入元素钙1000mg,绝经后妇女因肠钙吸收率降低,摄入钙量应增加。美国NIH(National Institutes of Health)于1994年推荐,绝经后妇女的适当钙摄入量为1000(用雌激素者)~1500mg/d(不用雌激素者),65岁以后应为1500mg/d。摄入元素钙在2000mg/d以内时,对绝大多数人是安全的。补钙的方法,首先是饮食补充,即增加食物中的奶制品(每100ml牛奶中的元素钙量约为100mg)、绿色素菜(花菜、甘蓝、萝卜、大白菜)、豆制品、干果等。食物不能补足的部分以钙剂补充。最新的临床试验结果表明,补钙并不能显著减少绝经后妇女骨折的危险性,然而,那些坚持补钙治疗的妇女,补充钙剂对降低骨折的危险性有益,提出绝经后妇女应继续补钙,以减少骨质疏松症的风险。
1)各种钙剂含有的元素钙量不同(表1),应选择含量高的钙制剂。
表1 各种钙制剂中的元素钙含量
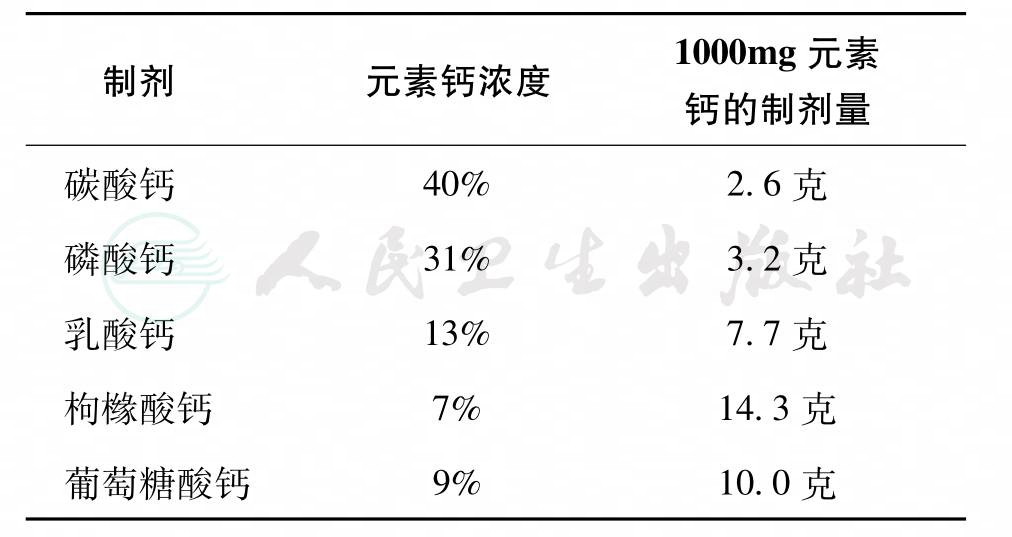
2)钙制剂的副作用:主要为便秘,少数发生腹胀及食欲下降。一般在服用初期出现,继续服用后可自然减轻,饭后服用对食欲影响较小,增加食物中的纤维素成分可以缓解便秘。
3)补充钙剂的禁忌证:①高钙血症;②高尿钙性肾结石;③类肉瘤;④服用治疗量的维生素D制剂。
(5)维生素D
对骨代谢的影响比较复杂,但因维生素D的重要作用是促进肠钙吸收,而常与钙剂一同服用。单用维生素D后,BMD的变化很不一致,可能与体内维生素D含量不同、维生素D需要量随体内钙的状况不同、有些人的骨组织对维生素D有抵抗等因素有关。但多数研究表明,老年妇女补充维生素D后,BMD的下降幅度减少,与她们缺乏户外活动、有不同程度的维生素D缺乏有关。
维生素D制剂及其用量:
1)维生素D:安全用量为每日400单位,经肝、肾的α-羟化酶转变为1,25(OH)2D3后才有生物活性。故肝或肾功能不正常者,效果不好。有项对年龄在50~80岁之间的297名妇女的为期1年的临床研究表明,在提高髋关节和脊椎的骨密度方面,维生素D36500IU/d的剂量与标准剂量为800IU/d相比并没有优势。
2)1α-羟基维生素D3(α-calcidol,alfacalcidol):作用强度为活性维生素D的1/2,用量常为每日0.5~1.0μg,适用于肾功能不良者。
3)钙三醇(calcitriol):为活性维生素D,在体内直接发挥作用,用量为每日0.25~0.5μg,适用于肝、肾功能不良者。
维生素D的副作用较少,活性维生素D可能引起高钙血症,短期内可能损害肾功能,但恢复较快。其唯一的禁忌证是高钙血症。
(6)选择性雌激素受体调节剂(selective estrogen receptor modulator,SERM)
SERM在某些器官表现雌激素样的作用,而在另外的器官中则无雌激素样作用。因此,它既是雌激素激动剂(agonist),又是雌激素拮抗剂(antagonist),或两者兼有,取决于所用剂量、靶器官及内分泌环境。第一代SERM的代表是他莫昔芬,它在骨、心血管系统及子宫内膜的作用与雌激素相似,可以预防绝经后的骨丢失、减少心血管疾病的危险因素,也增加子宫内膜的增生,并有发生内膜癌的危险。第二代SERM的代表为雷洛昔芬(raloxifene),它在骨及心血管系统为雌激素激动剂,即有预防绝经后骨丢失、减少绝经后心血管疾病发生的风险,在子宫内膜及乳腺则为雌激素拮抗剂,不引起子宫内膜增生及乳腺增生,因而,对于需要长期预防骨丢失的妇女,增加了一个选择。近年被应用的巴多昔芬(bazedoxifene)和拉索昔芬(lasofoxifene)为第三代SERM。
盐酸雷洛昔芬,商品名为Evista,用量为每日60mg。在欧洲11个中心进行的、安慰剂对照的两年临床研究,提出了以下结果:①腰椎及髋部BMD增加2.4%,全身BMD增加2%;②骨代谢生化指标(crosslaps,BGP,ALP)降低,治疗3~6个月时,降至绝经前水平;③血总胆固醇(TC)及低密度脂蛋白胆固醇(LDL-C)水平下降,对高密度脂蛋白胆固醇(HDL-C)及甘油酸酯(TG)则无影响;④每6个月用超声检查子宫内膜一次,未发现内膜增厚;⑤耐受性好,副作用为潮热,下肢痉挛及水肿,发生率较低,血栓病的发生率与雌激素补充治疗时相似。
在25个国家(包含中国)进行的3年、随机、双盲、安慰剂对照研究显示,不论是否曾经发生骨折,脊椎骨折率降低30%~50%,与氨基双膦酸盐及经皮应用雌激素的效果相似,用雷洛昔芬治疗后骨转换生化指标下降及BMD上升比氨基双膦酸盐低;子宫内膜癌及乳癌发生率与安慰剂组相同。我国郑淑蓉等在200例绝经后妇女中观察1年,腰椎BMD平均增加2.3%,髋部BMD平均增加2.4%,骨代谢生化指标(BGP、CTX、tALP)降低,与安慰剂组的差异显著。
另在390例健康的绝经后妇女的研究中,用雷洛昔芬每日60mg或120mg,与HRT(每日口服普雷马林0.625mg+MPA2.5mg)比较,6个月后,两个剂量雷洛昔芬组的LDL-C下降12%,与HRT相似(下降14%);Lp(a)下降7%~8%,次于HRT(下降19%);HDL2-C增加15%~17%,次于HRT(增加33%);HDL-C、TG及纤溶酶原激活抑制剂-1(PAI-1)不变,而HRT组内HDL-C上升11%,TG上升20%,PAI-1下降29%;雷洛昔芬组内纤维蛋白原下降12%~14%,HRT组无变化。在5129例绝经后骨质疏松妇女中,连续服用雷洛昔芬3年,与同期的2576例安慰剂对照病例比较,浸润性乳癌的危险性下降了76%。
巴多昔芬为一种新的第三代选择性雌激素受体调节剂,对骨和血脂代谢有利,同时减少了对子宫或乳腺组织的刺激。两个大型Ⅲ期临床试验表明,与安慰剂组相比,巴多昔芬和雷洛昔芬可增加骨密度,降低骨转化标志物的水平,并显著降低绝经后妇女新脊椎骨折发生的风险。尽管使用巴多昔芬或雷洛昔芬,非脊椎骨折的发生率与安慰剂组相比没有明显差异,但一项对高骨折风险妇女组的分析结果显示,相对于安慰剂和雷洛昔芬,巴多昔芬显著减少非脊椎骨折的风险降低50%(P=0.02),5年后减少了37%(P=0.06)。一项研究评估了巴多昔芬治疗绝经后骨质疏松症超过5年的疗效和安全性,提出在骨质疏松症的绝经后妇女和高风险的妇女亚群,巴多昔芬能够发挥持续抗椎体骨折的作用,但非椎体骨折的发生率在所有组群中都是相似的。另有报道,在正常或低骨密度的健康绝经后妇女,每天服用20mg巴多昔芬能明显防止骨流失;而在骨质疏松症的妇女的研究中,服用巴多昔芬3年后,骨质疏松症的妇女发生脊椎骨折的风险减少了42%(P<0.05),5年后,减少了35%(P=0.014)。利用巴多昔芬对乳腺和子宫内膜的刺激较小,将巴多昔芬和雌激素的配伍使用。一项Ⅲ期临床试验表明,巴多昔芬和混合雌激素结合疗法显著增加骨密度,降低骨转换标志物水平,缓解潮热和改善阴道萎缩的症状。巴多昔芬副作用可能为血管扩张(潮热)、腿抽筋、静脉血栓栓塞事件的发生率有所增加。
拉索昔芬(lasofoxifene)也是第三代选择性雌激素受体调节剂,在体外和体内药效和口服生物利用度明显高于其他SERMs。在临床前研究以及第Ⅱ期和Ⅲ期临床试验中,该药物明显改善了骨密度和骨生化标志物。在另一项对绝经后妇女进行为期2年的研究中,发现拉索昔芬和雷洛昔芬能够同样有效地提高全髋关节的骨密度(BMD),而拉索昔芬增加腰椎骨密度(BMD)作用更加显著,不良事件包括潮热、腿抽筋等。
2.骨形成刺激剂
(1)氟
美国于20世纪60年代发现,饮水中含氟高的地区内,骨质疏松症发病率低,提出氟可用于防治骨质疏松症。至今,近40年的试验研究及临床应用,已积累了相当多的资料。由于氟的剂型、剂量、实验动物的种类、是否同时补充钙剂等诸多不同,观察的结果互相矛盾,对氟产生了不同的评价,但是对它的研究和应用并未中断。当前多数认为氟是唯一能用于患者的促骨形成药物,尤其对中轴骨的效果显著。如氟的用量适当,同时补充钙剂,可以降低脊椎骨折发生率,也不损害四肢骨。
1)氟的药效学研究:①骨组织形态:髂骨活检的骨切片中显示,氟增加成骨细胞数量,充填吸收陷窝,小梁骨增厚,骨量增加。氟用量大时,成骨反应快,如补钙不足,则新骨矿化不良,发生骨软化;如用量较小,成骨反应缓慢,同时补钙充足,则新骨矿化好。氟治疗时补充生理剂量的维生素D,可以改善肠钙吸收,对于预防骨矿化延迟有利。②骨代谢生化指标:成骨的生化指标升高,表示氟治疗有效。如血ALP异常升高,应注意补钙不足,可能发生骨软化,此时血PTH升高,可帮助诊断。③BMD:中轴骨经DXA及QCT测定证明,随治疗时间延长,BMD增加显著,但增加的幅度有较大差异,与所用机器及个体反应有关,疗效与骨质疏松程度、病因及患者年龄无关。国外报道,绝经后妇女服用缓释氟化钠25mg,一日2次,同时服钙,连续12个月后停服1~2个月,然后重复,前4年的BMD每年增加4%~5%。一氟磷酸谷酰氨(MFP)加钙(商品名为Tridin,特乐定)嚼服,一日3次,每次一片(每片含氟离子5mg,钙离子150mg),连用4年后,腰椎BMD均上升,只服钙剂者则下降。我国绝经后妇女服用上述剂量的特乐定6个月,腰椎BMD平均上升2.5%,而服钙剂组下降。四肢骨:对氟治疗的反应较小,较慢;部分原因可能是四肢骨含皮质骨量多,其骨转换较小梁骨低。下肢骨的反应较上肢骨明显,其原因尚未肯定,可能下肢受重力影响较上肢大,刺激生长因子产生,从而使氟起成骨作用。比利时用氟化物加替勃龙(tibolone)与单用氟化物比较,2年后,前者腰椎BMD增加32.6%,髋部增加7.9%,单用氟化物者腰椎BMD增加14%,髋部增加7.6%,表明氟化物并用替勃龙时,腰椎BMD明显增加,同时不刺激皮质骨丢失。④骨强度:是判断骨折危险性的重要指标之一。少数骨强度指标显示,氟治疗后骨强度下降,其原因是钙补充不足,新骨矿化不全而致骨结构异常。实际上,氟治疗后的骨折率降低,原因是氟治疗后骨体积增大,BMD增加,足以补偿骨结构改变的影响;此外,补充足量的钙,可以预防骨矿化不良。⑤骨折率:是判断疗效的关键性指标。缓释氟化钠及特乐定治疗后,腰椎骨折率较安慰剂组低1/3。⑥症状:氟治疗后患者骨痛减轻或消失,患者的体力及活动能力增加,有利于骨质疏松症的治疗。
2)氟的成骨机制:尚未完全阐明。目前认为,微克分子浓度的氟,抑制成骨细胞中磷酸酪氨酸蛋白磷酸酶(PTPP),使磷酸酪氨酸蛋白增多,后者刺激成骨细胞分裂。
3)氟制剂及用量:①氟化钠是最早使用的氟制剂,因引起较重的胃肠道反应,又不能同时补钙(因降低氟吸收率),致使新骨矿化不良,骨折率未能降低,现已不再使用此种制剂。②缓释氟化钠。③一氟磷酸盐类(葡萄糖酸钙):与缓释氟化钠均为改良的剂型,克服了氟化钠刺激胃、不能与钙剂同时服用的问题。安全用量为每日服用的氟离子在20mg以内。葡萄糖酸钙每片含氟离子5mg,每日用3~4片,即每日摄入氟离子15~20mg,均在安全剂量之内,如与其他药物合并应用,可再减少用量。葡萄糖酸钙还含钙离子150mg,如每日用3片,即可同时补充450mg元素钙,可有效地预防因钙摄入不足带来的麻烦。
各种氟化物均为氟离子的载体,进入体内的氟离子才起到治疗作用。经肠道吸收的氟化物,一部分进入骨骼,一部分经肾排出。氟离子在肾的廓清取决于滤过负荷(滤过率X血清氟浓度)及水廓清,肾功能不良时廓清率降低,可能发生氟积蓄,故不宜使用,必须使用时,则应减量。
4)氟治疗的副作用:①胃肠反应:氟化钠治疗时的发生率为25%,其他氟制剂则反应极小或无反应,不会因反应而中断治疗;②关节周围疼痛:常见于膝、踝关节处。有时为下肢关节疼痛,称下肢疼痛综合征,发生率约为10%~40%,与剂量有关。氟离子量在每日20mg以下时,很少发生,周期性用药时发生率低,停药或减量时症状消失。疼痛原因可能是:应力性骨折或局部的成骨反应,也可能伴随局部缺钙。
(2)雄激素及同化类固醇
1940年左右即开始应用雄激素治疗骨质疏松症,因男性化的副作用,难被绝经后妇女接受。近20年内合成的睾酮类似物,其男性化的副作用减轻,同化作用增强,应用有所增多。与其他药物联合应用的资料显示,加用雄激素后,BMD增加较多;目前缺乏单独应用雄激素的资料。
作用机制尚不清楚,动物实验发现,雄激素治疗后的骨骼变化与氟化物治疗者相似,提示为成骨作用。骨细胞上已发现雄激素受体,可能对骨代谢有直接作用。此外,同化类固醇尚能增加肌肉量、增加皮肤厚度,以及提高性欲、增加食欲等作用,肌肉量增多可刺激骨形成,因此,适合于瘦弱的老年妇女。
1)同化类固醇制剂及用量:①司坦唑醇(stanozolol):每日口服一次,一次5mg,连续服用。②癸酸诺龙(nandrolonedecanoate):每3~4周肌内注射一次,每次25~50mg。
2)同化类固醇的副作用:①肝毒性:大剂量时可发生,服用司坦唑醇者约50%转氨酶升高,停药后恢复。②声音变粗及男性化:用癸酸诺龙时多见,与剂量相关,故一般只用1年左右,停药后约3/4患者声音改善,但不易完全恢复。③血脂改变:促使动脉硬化的脂质增加,而保护动脉不发生硬化的脂质降低。④钠潴留:轻度,可并用利尿剂。
3)替勃龙:鉴于同化类固醇的上述问题,目前,绝经后妇女如需使用雄激素,又无应用雌激素的禁忌证者,选用具有雌、孕、雄激素作用的合成类固醇制剂替勃龙,效果良好,而且方便,副作用极少。
替勃龙是人工合成的7-甲基异炔诺酮,也称Org14,口服后迅速代谢为Δ4异构体及3α-OH、3β-OH代谢物。它们在不同的组织中起不同的作用。Δ4异构体在子宫内膜上产生,与内膜上的孕激素受体结合,产生孕激素的作用,与体内的雄激素受体结合产生雄激素作用。3α-OH及3β-OH代谢物只与雌激素受体结合而显示雌激素的作用,有组织特异性HRT之称。每日口服2.5mg2年后,腰椎小梁骨BMD与安慰剂组相差15.5%,趾骨相差7.2%,而子宫出血的发生率极低,没有任何男性化的副作用,如多毛、痤疮或脱发。
(3)甲状旁腺激素(PTH)
由甲状旁腺分泌,其生理作用是调节体内的钙代谢,即增加肾1α-羟化酶活性,使体内的活性维生素D增加,后者促进肠钙吸收。PTH也增加肾小管重吸收钙,抑制对磷的重吸收,从而维持血钙在正常水平,当血钙降低时,PTH促使骨吸收(动员骨钙入血)。
人体的PTH由84个氨基酸组成,仅仅前32~34个氨基酸具有生物活性。部分PTH在肝内自然分裂为N末端生物活性片段及无活性的C端片段。1920年后已知PTH可能对骨有同化作用,但直到1980年以后,才在去卵巢鼠中证实,其作用机制未完全阐明,似与骨细胞内产生的骨衍化生长因子(如TGF-β及IGF-Ⅰ)有关。PTH的作用主要在中轴骨的小梁骨,对皮质骨几乎无影响。绝经前和绝经后妇女通过24小时持续静脉内钙注入导致PTH分泌的短暂抑制和骨代谢标记物的抑制有明显相关性,说明血清PTH的增加是骨代谢增加的直接原因之一。
美国应用PTH1-34(teriparatide,特立帕肽)证明,它是一种很强的骨形成刺激剂,其效果是增加骨量,改善骨的微结构,增加对骨折的抵抗,以及维持皮质骨质量。我国学者探讨重组人甲状旁腺素(rhPTH)1-34对绝经后骨质疏松患者血清核心结合因子a-1(Cbfa-1)和基质金属蛋白酶13(MMP-13)水平的影响,结果发现rhPTH1-34治疗绝经后骨质疏松妇女6个月后,其血清Cbfa-1及MMP-13水平显著降低,结论为rhPTH1-34能促进骨形成。有学者比较rhPTH1-34和依降钙素在治疗绝经后骨质疏松症妇女中的疗效和安全性,结果显示rhPTH1-34组和依降钙素组L1~4的BMD均增加,股骨颈的BMD没有明显变化;治疗3个月和6个月时,rhPTH1-34组L1~4、股骨颈的BMD较基线分别增加2.2%(P<0.05)、0.37%和5.5l%(P<0.01)、0.65%;依降钙素组分别增加0.41%、-0.10%和1.55%(P<0.05)、0.11%;与依降钙素组相比,rhPTH1-34对L1~4BMD改善更明显。结论为rhPTH1-34与依降钙素相比,在治疗绝经后妇女骨质疏松症中能更好地促进骨形成,提高BMD,并具有较好的耐受性、且副作用少。
3.其他
(1)植物雌激素
有关植物雌激素对绝经后妇女骨密度和骨代谢指标影响的临床试验结果总还不一致,大多数的争议在于研究设计、受试者年龄、绝经状态以及植物雌激素的剂量和类型的差异。有一项研究对2580名没有使用激素补充治疗的绝经后妇女和4973名男性进行了调查,研究他们的骨密度和植物雌激素的摄入量之间的关联,结果发现绝经后妇女总的植物雌激素摄入中位数是876μg/d,男性是1212μg/d。给该人群饮食中添加膳食钙,给予钙的最低摄入量的1/5后,大豆异黄酮类的摄入与绝经后妇女骨密度呈正相关。虽然西方女性可能会继续在她们的饮食中加入大豆食品和大豆补充剂以增加利用度,但结果是否支持大豆等植物雌激素在防止绝经后骨量丢失中的作用还不完全一致。
依普拉封(ipriflavone)是一种较早且较常被使用的植物雌激素,1960年后在匈牙利合成,与植物中的提取物成分相似,属黄酮类。1970年后发现大鼠、鸡、羊口服后,增加钙在骨内贮留,提示可用于防治骨质疏松症。1980年后,匈牙利、日本、意大利及阿根廷四国用600~1200mg/d治疗骨质疏松症,发现有效,副作用小而安全;后来英国、比利时、丹麦、德国、法国及美国也进行观察。其作用机制与雌激素相似,即与雌激素受体结合,亦称植物雌激素,但它不具有雌激素对生殖器官及对促性腺激素的影响。因而它作用在雌激素受体的什么部位尚不清楚,对心血管、呼吸系统、肾、神经、肌肉或胃肠功能无影响。
依普拉封对骨代谢的药效学影响有以下的结果:
1)动物实验:依普拉封可以预防各种原因引起的骨丢失及骨质疏松症,表现在BMD升高,骨组织形态计量学上显示骨形成增加,骨矿成分不变,改善骨的生物力学性质等。胎鼠的长骨显示,它也抑制骨吸收。
2)细胞培养:依普拉封促使人的骨祖细胞分化,刺激基质矿化,也抑制破骨细胞分化及募集,抑制IL-6的释放。
3)临床应用:人工绝经及应用GnRH-a的妇女服用后,骨代谢生化指标显示成骨活跃。绝经后骨质疏松症、增龄性骨质疏松症及Paget病患者服用后,骨代谢生化指标或BMD均有不同程度的改善。常用方法及剂量:口服200mg,一日3次,长期服用。
(2)中医治疗
有学者发现补肾中药能提高去卵巢大鼠的血E2、ALP及PICP水平,对绝经后骨质疏松有防治作用,且中药组和雌激素组比较,差别无统计学意义(P>0.05)。有学者观察了疏肝健脾益肾针法治疗绝经后骨质疏松的临床疗效,发现观察组总有效率为81.3%,与对照组比较差异有统计学意义(P<0.05);观察组治疗后各部位的BMD明显提高(P<0.05),且治疗后E2水平较治疗前明显提高(P<0.01),说明此方法防治绝经后骨质疏松症有效。
(3)运动及物理磁场治疗
运动可增加BMD,防治骨质疏松症。最新动物实验研究发现,正常对照雌鼠及去势+运动训练雌鼠的腰椎骨密度明显高于单纯去势组的雌鼠;血清生化指标检测显示,正常对照组及去势+运动训练组钙离子、碱性磷酸酶和骨钙索水平均明显低于单纯去势组;腰椎椎体组织病理学检测显示,去势+运动训练组骨小梁质量优于单纯去势组,提出运动对于预防和治疗绝经后骨质疏松有着很好的效果。临床研究显示,参与专项运动的绝经后妇女的腰椎骨密度大于不运动的绝经后对照组,说明运动可治疗绝经后妇女的骨质疏松。但国外有一项最新Meta分析表明,运动疗法对青春期早期的男孩显著提高其负重部位的骨骼强度,而在青春期的少女、青少年、绝经前或绝经后的妇女人群中则效果不明显。规律的负重训练可使青春期男孩负重部位骨骼的强度提高1%~8%,而运动依从性高的绝经前妇女,骨骼强度仅仅提高0.5%~2.5%。有学者观察了脉冲电磁场治疗绝经后骨质疏松的疗效,结果发现治疗组疼痛明显改善(P<0.01),BSAP、BGP较基线水平明显提高(P<0.05),但BMD、尿NTX/Cr与基线水平相比没有明显改变。
近年有学者提出阿司匹林可治疗绝经后骨质疏松症。有学者进行了去势大鼠的实验研究,建立骨质疏松大鼠模型,灌胃阿司匹林治疗3个月后,发现阿司匹林治疗组椎体的BMD明显高于OVX组;外围血检测显示,治疗组的碱性磷酸酶明显低于OVX组,而骨钙素与OVX组无明显差别;组织形态学结果显示,治疗组骨小梁的连接、粗细较OVX组好;Micro-CT分析表明,治疗组腰椎椎体骨小梁厚度、骨小梁数量及骨密度率均显著高于OVX组,并且A3组与Sham组相近;生物力学结果示,治疗组腰椎压缩载荷及股骨干三点弯曲载荷均明显高于OVX组。提出阿司匹林能促进大鼠绝经后骨质疏松骨小梁的改建,改善骨小梁的三维结构,增加骨质的骨密度和力学强度,有可能成为治疗骨质疏松的新型药物之一。
关于地诺单抗注射液(denosumab,狄诺塞麦)在绝经后骨质疏松治疗中的作用,最近已有报道。地诺单抗是一种人源化的单克隆抗体类的生物制剂,通过与人核因子-κB受体活化因子配体相结合,阻断骨吸收过程中信号转导通路的关键性蛋白质———核因子-κB受体活化因子,减缓骨吸收过程,从而有效降低骨折发生的风险。2009年2月地诺单抗被美国食品药品管理局(FDA)批准用于治疗绝经后骨质疏松和绝经后妇女骨质疏松骨折的高风险人群,包括那些“用其他治疗方法失败或不能耐受”的患者。在绝经后妇女研究中,发现注射地诺单抗后脊椎,髋部和桡骨远端的骨密度增加,减少了脊椎、非脊椎和髋部骨折的发生。在美国、欧洲及日本,地诺单抗已被批准用于绝经后骨质疏松症妇女。目前应用方法为每6个月皮下注射地诺单抗一次,不良反应包括相关的湿疹、蜂窝织炎等,长期安全性的评估正在进行中。
1.提高骨峰值
在儿童期内即开始注意以下事项:
(1)摄入足够的钙量。
(2)户外运动:接触紫外线可以增加体内合成的维生素D,有利于肠钙吸收;运动则促进骨骼发育及骨量增加。
(3)避免不良习惯:如吸烟、嗜酒及偏食等。
2.减少骨丢失率
如前所述,绝经后骨丢失受年龄增加及绝经的影响。年龄增加的影响较绝经的影响小,绝经后补充雌激素可以阻止雌激素降低引起的快速骨丢失。适时启动应用雌激素同时可治疗绝经期血管舒缩症状、绝经后泌尿生殖器官萎缩、可能预防或推迟阿尔茨海默病的发生等。因此,雌激素是绝经早期妇女预防绝经后骨质疏松症的首选药物。如果绝经后妇女患有某些不适合于应用雌激素的疾病(即有禁忌证者),则可使用其他的骨吸收抑制剂,如双膦酸盐类、降钙素类、SERM(雷洛昔芬)等。钙虽有轻度的抑制骨吸收作用,但不能单独作为骨吸收抑制剂用于绝经后骨质疏松症的防治,而是作为必要的基础治疗。













