英文名称 :congenital adrenal hyperplasia
中文别名 :先天性肾上腺皮质增生;先天性肾上腺增生症
先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)是较常见的常染色体隐性遗传病,由皮质醇激素合成过程所需酶的先天缺陷所致。皮质醇激素合成不足使血中浓度降低,由于负反馈作用刺激垂体分泌ACTH增多,导致肾上腺皮质增生并分泌过多的皮质醇前身物质如11-去氧皮质醇和肾上腺雄酮等,而发生一系列临床症状。最常见的酶缺陷是21-羟化酶缺乏症(21-OHD),约占CAH的95%,其次为类固醇生成的急性调节蛋白缺陷(StAR),17α-羟化酶/17,20 碳链裂解酶缺乏症(17α-OHD),11β-羟化酶缺乏症(11β-OHD),3β-羟类固醇脱氢酶缺乏症(3β-HSD),细胞色素 P450氧化还原酶缺乏(POR)等。
1.21-羟化酶缺乏症(21-hydroxylase deficiency,21-OHD)
21-羟化酶(CYP21)缺乏为最常见的一种类型,约占所有CAH患者的95%。21-羟化酶催化17-羟孕酮(17-OHP)转化为11-去氧皮质醇,催化孕酮转化为11-去氧皮质酮,由于该酶的缺陷使最终产物皮质醇和盐皮质激素产生不足和17-羟孕酮(17-OHP)的堆积,伴肾上腺来源的雄激素分泌过多。
对21-OHD肾上腺来源雄激素主要包括经典途径产生的睾酮、雄烯二酮、脱氢表雄酮和硫酸脱氢表雄酮等;近期对于肾上腺类固醇激素合成途径研究提示,雄激素后门合成途径可能在宫内CAH高雄激素血症中起到更为关键的作用。
人类21-羟化酶(CYP21)存在两个基因位点,一个是功能性CYP21A2基因,一个是非功能性基因CYP21A1,即假基因。21-羟化酶由位于第6号染色体短臂6p21.3的CYP21A2基因编码,该基因包含10个外显子,在HLA-B位点与HLA-DR位点之间。由于大多数有活性的基因突变中可以发生有活性和无活性基因间的重组现象,这为基因诊断带来复杂性。21-羟化酶缺乏症可由CYP21A2基因缺失、基因转换、点突变等导致,目前报道的CYP21A2突变有300多种,以IVS-13A/C→G、c.293-13A/C>G、c.518T>A 及 c.1069C>T 等较为常见。
2.11β-羟化酶缺乏症(11β-hydroxylase deficiency,11β-OHD)
11β-羟化酶(CYP11B1)缺乏为 CAH 高血压类型,约占5%,在普通人中的发病率约1/100 000~1/200 000 活产儿。
CYP11B有两种同工酶,即CYP11B1和CYP11B2,这两个同工酶有93%氨基酸序列相同,95%编码区序列相同,90%内含子序列相同。这些酶由第8号染色体的两个基因(8q21~q23)编码。CYP11B1 基因(11β-羟化酶)主要在球状带和束状带表达,参与11-脱氧皮质酮(11-deoxycorticosterone,DOC)合成皮质酮以及 11-脱氧皮质醇合成皮质醇,受ACTH调控。CYP11B2基因(醛固酮合成酶)仅在球状带微量表达。由于CYP11B1基因突变,肾上腺不能进一步合成皮质醇,11-脱氧皮质醇增多和11-脱氧皮质酮、脱氢表雄酮(DHEA)和Δ4雄烯二酮(AD)分泌增多,引起女性男性化和男性假性性早熟。虽然醛固酮的生成受阻,但11-脱氧皮质酮是一种盐皮质激素,其合成增多具有潴钠排钾作用,引起患儿出现高血压,具有低钾低肾素低醛固酮特点。
3.17α-羟化酶缺乏症(17α-hydroxylase deficiency,17α-OHD)
17α-羟化酶(CYP17)具有 17α-羟化酶/17,20裂解酶双重生理作用,前者参与糖皮质激素合成,两种酶共同参与性激素的合成。17α-羟化酶的作用是将孕烯醇酮转化为17羟孕烯醇酮,将孕酮转化为17-羟孕酮。17-羟孕烯醇酮转变成DHEAS,17-羟孕酮转变成AD,AD是性类固醇激素睾酮和雌激素的主要前体物质,进而合成雌、雄激素,这是人体合成性类固醇激素至关重要的步骤。17-OHD是由CYP17A1基因突变所致。CYP17基因在肾上腺和性腺表达,位于第10号染色体10q20~q25。CYP17缺陷使肾上腺、睾丸、卵巢的性激素的合成完全被阻断。由于胎儿期肾上腺雄酮缺乏,而影响男性胎儿性器官的分化,使男婴表现为女性外生殖器形态,对女性性分化无影响;但两性至青春期均不能合成性激素,垂体促性腺素(FSH及LH)分泌增多,无第二性征的发育,女性表现为原发闭经。17α-羟化酶缺乏,皮质醇合成亦受阻,ACTH升高,引起肾上腺皮质增生,由于合成盐皮质激素途径畅通,使合成盐皮质激素前体如11-脱氧皮质酮、皮质酮增多,导致水钠潴留,患儿表现为明显高血压,低血钾和碱中毒。
4.3β-羟类固醇脱氢酶缺乏症(3β-hydroxysteroid dehydrogenase,3β-HSD)
3β-羟类固醇脱氢酶(3β-HSD)缺乏症是先天性肾上腺皮质增生症中较为罕见的一类,如果不在婴儿早期诊断和治疗,该疾病具有致命性。3β-羟脱氢酶不属于P450细胞色素氧化酶系统,是由于3β-HSDB2基因突变所致。3β-HSD基因定位于1号染色体短臂(1p13.1),主要包括Ⅰ型和Ⅱ型两种类型,分别由HSD3B1和HSD3B2基因编码合成,HSD3B1基因主要在胎盘、皮肤及乳腺组织中表达,目前在人类尚无HSD3B1基因突变报道,HSD3B2基因几乎仅在肾上腺、睾丸和卵巢组织中表达,两者蛋白序列有93.5%的同源性。经典型的3β-HSD缺乏症是由HSD3B2基因突变所致。3β-HSD的生理作用是催化Δ5类固醇(孕烯醇酮、17-羟孕烯醇酮和DHEA)合成为活性较强的Δ4类固醇(孕酮、17-羟孕酮和雄烯二酮)。3β-HSD缺乏症是由HSD3B2基因突变导致Ⅱ型同工酶缺陷,使Δ5类固醇向Δ4类固醇转变过程受阻,Δ5/Δ4类固醇比例增高,使醛固酮、皮质醇及性激素合成均受阻,DHEA增加,尿中类固醇排出量增多,合成Δ5类固醇增多,皮质醇和盐皮质激素的合成均严重受阻,患儿往往出生后即严重失盐、脱水、休克。雄激素产生亦减少,只能合成DHEA,其雄激素作用较弱。由于3β-羟类固醇脱氢酶可能部分不足,合成部分Δ4(雄烯二酮),导致男性外生殖器两性畸形和女性外生殖器表现正常或轻度男性化,如不能及早诊断和治疗,可引起死亡。
5.先天性类脂质性肾上腺增生症(lipoid congenital adrenal hyperplasia,LCAH)
是先天性肾上腺皮质增生症中罕见和最严重的类型,韩国和日本人相对常见。由于类固醇生成急性调节蛋白(steroidogenic acute regulatory protein,StAR)缺陷或CYP11A1基因突变,导致胆固醇不能转变为孕烯醇酮,所有肾上腺及性腺类固醇的生物合成均受阻,出现肾上腺皮质功能减退及性激素合成障碍。StAR基因位于染色体 8p11.23,长约20kb,含有7个外显子和6个内含子,编码285个氨基酸。类固醇激素合成中有2个重要的限速步骤:一为类固醇激素前体胆固醇经StAR传递至类固醇激素细胞线粒体内膜,二为线粒体中的胆固醇侧链裂解酶(P450scc)将胆固醇转化为孕烯醇酮。StAR基因突变及编码P450scc的基因CYP11A1突变均可使胆固醇向孕烯醇酮转变受阻,导致其下游产物皮质醇、醛固酮及睾酮、雌二醇生成均减少,引起LCAH。
1.血皮质醇和ACTH水平
皮质醇降低程度因不同型别而异,经典型皮质醇明显降低,ACTH明显升高,非经典型者ACTH轻度升高或正常,皮质醇大致正常。
2.血17-羟孕酮(17-OHP)
21-羟化酶缺乏症、11β羟化酶缺乏症及CYP17缺乏症(主要17,20裂解酶缺乏)时17-OHP均可有不同程度升高。但17-OHP升高对诊断CYP21的缺乏有特殊意义,明显增高,可高于正常几十倍,甚至几百倍,是可靠的诊断依据。但因受年龄、性别及21-羟化酶缺乏症分型的影响,注意对结果的分析。17-OHP有昼夜的变化,应在清晨未服药时早上8:00前取血为宜。
3.DHEA、AD及睾酮(T)
21-羟化酶缺乏症时血清AD、DHEA和T增高,AD比T更敏感,且比17-OHP稳定,它们是诊断、治疗和监测的重要指标。
4.快速ACTH 1-24激发试验
对非经典型21-OHD患者,当17-OHP正常或轻度异常时,需做该实验协助诊断有重要意义,激发后60分钟大部分患儿17-OHP值比正常增高,超过 30nmol/L(>1 000ng/dl),杂合子患者激发后 17-OHP 常在 10~30nmol/L(330~1 000ng/dl)。
5.血浆肾素、血管紧张素(PRA)及醛固酮(Aldo)
可有不同程度的增高,但诊断特异性不高。小婴儿有生理性醛固酮抵抗,使婴儿早期有肾素和醛固酮升高,此时按之诊断失盐型21-OHD需慎重。在单纯男性化者Aldo可正常或偏低。经典型11β-OHD血浆肾素低。
6.血电解质
典型21-OHP患儿可有低钠血症、高钾血症及代谢性酸中毒。
7.皮质醇代谢产物测定在诊断和筛查中应用
近年来应用液相色谱质谱联用(LC-MS/MS)方法,能同时测定30种以上血和尿中类固醇代谢产物,用于诊断各类肾上腺疾病(如CAH和肾上腺肿瘤),但目前尚未在临床作为常规检测。21-羟化酶缺乏时尿17-酮(17-KS)和孕三醇水平排量比正常同龄儿增多。由于正常新生儿尿中17-酮排量亦高诊断时应注意鉴别,需要反复测定核实。尿11-脱氧皮质醇及11-脱氧皮质酮排量增多对CYP11B缺乏的诊断有特异性。尿Δ5类固醇增多时,说明3β-羟类固醇脱氢酶的缺乏。测定尿或血中增多的类固醇产物可以证明酶缺陷的类型。
8.染色体核型及基因
染色体核型分析可鉴别真正遗传性别,婴儿期发现有皮质醇低下者,无论有无性别模糊都必须做染色体核型检查。必要时做CAH相关基因诊断确诊。
2018年共识中指出17-OHP是 21-OHD诊断的重要指标,按基础17-OHP值来指导诊断和分型。①经典型 21-OHD,空腹 17-OHP>300nmol/L(10000ng/dl)。②非经典型为空腹 17-OHP在 6~300nmol/L(200~10000ng/dl)。③不支持 CAH的诊断为空腹17-OHP<6nmol/L(<200ng/dl)。当临床疑似诊断时或考虑非经典型21-OHD时,均应进一步做 ACTH1-24激发试验,ACTH1-24激发后60分钟的判断界值为17-OHP>300nmol/L(10000ng/dl)时,为经典型 21-羟化酶缺乏症;激发后17-OHP 在 31~300nmol/L(1000~10000ng/dl)时为非经典型;当激发后 17-OHP<50nmol/L(<1666ng/dl)时可排除对21-OH的诊断,激发后17-OHP在31~50nmol/L之间的患者建议进行基因检测明确诊断。
治疗的目的:
用糖和盐皮质激素替代治疗,预防肾上腺危象发生,同时合理抑制高雄激素血症;目标是保证患者正常的线性生长和青春发育,减少成年终身高受损;在停止生长和青春发育完成后保护生育能力,预防骨质疏松和减少心血管的风险。治疗原则:各种类型的CAH女性和失盐型患者,应终身治疗;单纯男性化型的男性患者进入青春期或成人,可适当停药动态观察;当应激情况下需补充糖皮质激素;皮质醇剂量由大开始,逐渐减量到维持量,以防药物副作用;定期随诊,调整剂量,评估疗效;注意治疗的个体化。
1.皮质醇替代治疗
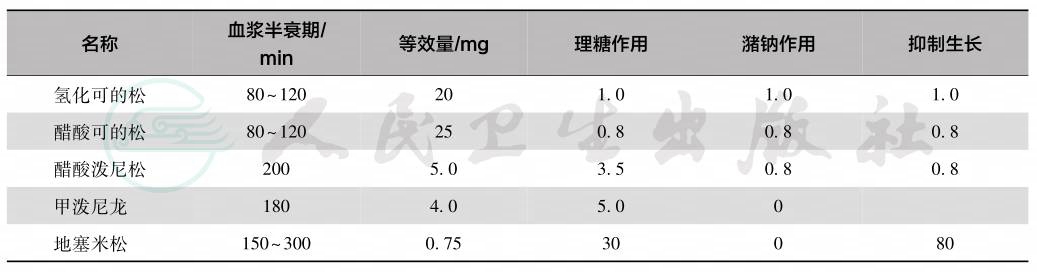
皮质醇是治疗各种类型CAH的重要手段,不仅可补充肾上腺皮质醇分泌不足,同时抑制垂体ACTH的分泌,从而使雄激素的产生减少,并阻止男性化的继续发展,发挥正常生长潜能。临床选择药物以氢化可的松为最佳,因为此药是生理性的糖皮质激素,同时具有一定的潴钠作用,半衰期短。由于1岁内对糖皮质激素(glucocorticoid,GC)抑制生长效应具高敏感性和婴儿期对雄激素的低敏感性,婴儿期应用只需覆盖皮质醇生理分泌量的低剂量8~12mg/(m2·d),大于1岁至青春期前 10~15mg/(m2·d),控制雄激素在青春前期正常范围内。青春期氢化可的松清除率增高,尤其是女孩,剂量需求量相对大,但为避免对生长的负面影响,建议不超过17~20mg/(m2·d),分 3次口服,最好每8小时1次,按照生理节律服药或将全日的2/3量或半量在睡前服下,以期能在清晨抑制ACTH的释放高峰。醋酸氢化可的松与氢化可的松类似,为氢化可的松的0.8倍。希望能以最小有效量维持达到最好的抑制作用。青春期生长停滞阶段,氢化可的松15~25mg/d,此时可选用半衰期较长的其他类固醇制剂替代治疗,如强的松 5~7.5mg/d,分2次口服;或泼尼松龙4~6mg/d,分2次口服;或地塞米松,0.25~0.5mg/d,每日1次口服。任何年龄均需个体化用尽可能低的剂量。常用类固醇激素的特性见表2。
表2 常用类固醇制剂的特点
2.盐皮质激素
对经典失盐型的CAH,婴儿期应给高盐饮食,1~2g/d氯化钠分次加入奶中服用。目前仅有一种盐皮质激素即9α-氟氢化可的松(9α-Fluorohydrocortisone),0.05~0.2mg/d,分 1~2 次口服。新生儿和小婴儿对盐皮质激素不敏感,相比大年龄儿童需要更大剂量。对婴幼儿单纯男性化型的CAH,虽然无失盐症状,原则上除糖皮质激素每日10~15mg/m2,分3次口服外,也应给予盐皮质激素治疗。有些患者青春期后可能由于食盐增多,而不需要盐皮质激素,一旦停药,还可出现失盐症状,应加注意。高血钾在应用盐皮质激素或补充食盐后可以得到纠正,不需要用降血钾的特殊处理。氢化可的松有明显的类盐皮质激素作用,20mg氢化可的松类盐作用相当于0.1mg 9α-氟氢化可的松,因此,应激剂量的氢化可的松可提供足够的类盐皮质激素作用,可以暂停盐皮质激素替代。
3.抗雄激素治疗
近来有报道联合抗雄激素药物治疗可减少皮质激素的用量,降低女性多囊卵巢综合征(PCOS)的发生率。如:①睾内酯(testolactone),为芳香化酶抑制剂,阻止雄激素转化为雌激素,可延缓骨骺闭合,用量 20~30mg/(kg·d),分3次口服。②氟他胺(flutamide)为雄激素拮抗剂,结构与睾酮相似,可与性激素结合蛋白竞争性结合,起到抑制睾酮、同时阻断17α-OHP转化为雄烯二酮的作用。剂量5~10mg/(kg·d),分2次口服。
4.肾上腺危象的治疗
失盐型伴有电解质紊乱、低血糖、脱水或临床发生休克时,需及时静脉输液,补充糖皮质激素,扩充血容量和升高血压。
5.应激状态的治疗
CAH在应激情况下需增加氢化可的松的剂量,主要常见的应激原因是发热或感染性疾病、手术、创伤等,对于心理情绪应激和运动(剧烈运动或较长时间的中等量运动)不强调增加氢化可的松剂量,但需监控血糖。感染性疾病时的应激氢化可的松剂量建议:轻中度感染(发热体温高于38℃、中等程度腹泻)增加至原剂量2~3倍,分4次服用至病愈。重度应激(体温高于39℃、腹泻呕吐伴脱水)增加至原剂量4~5倍,分4次服用至病愈。也可以按年龄调整每日剂量:0~3 岁以下 25mg,3~12岁 50mg,≥12 岁 100mg。已达到成年状态者氢化可的松剂量上午60mg,下午30mg(或等效剂量的长效制剂)。不能口服时用胃肠外给药(肌注或静脉)。病愈后在1周内逐步减量至原替代量。氢化可的松有类盐作用,应激时不增加盐皮质激素剂量。需注意部分患儿的肾上腺髓质也有发育不良,血儿茶酚胺低下;应激时(包括剧烈运动)与皮质醇的不足叠加可致低血糖。
6.外科手术治疗
女孩阴蒂增大,需手术治疗,最适宜手术年龄为2岁前。早期手术有助于恢复正常解剖结构、减少尿路感染发生、降低患者及其父母的心理压力及缓解焦虑情绪,减少心理损伤。手术目的是去除多余的勃起组织,保存性敏感的阴蒂腺体,提供正常的尿道阴道开口,减少由于尿液在阴道或泌尿生殖道内聚集而引起的感染。术前需进行染色体核型的检查,以确定遗传性别。女性假两性畸形中外生殖器表现为不同程度的男性化,染色体核型为46,XX,社会性别可为女性。阴蒂轻型增大经过早期适当药物合理治疗,可免除手术。但严重者需早期进行外生殖器矫形手术,应向家长说明在月经来潮之前还应确定阴道是否有先天畸形,若能及时手术矫形对患者的性心理和性行为有好处。对需要手术患者,可根据手术的大小调整静脉用药的时间和剂量。通常在术前1~3天静脉滴注氢化可的松50mg/(m2·d),分 2 次,手术日可增加至 100mg/(m2·d),术后 1~2 天可减至 50mg/(m2·d),之后根据患儿情况快速减少剂量,并改为口服,术后数日至1周内减量至原维持剂量。
7.CAH继发中枢性性早熟
当治疗过程中出现中枢性性早熟,骨龄明显超速时,可联合应用促性腺激素释放激素类似物(GnRHa)治疗,抑制中枢性性早熟,延缓骨骺闭合,尽量达到理想的终身高。
8.定期随访与监测
经过治疗的患儿应根据年龄和开始治疗后的反应,开始需要每1~3个月复查1次,剂量调整好后可3~6个月复查1次。在出生后前3个月,每月评估1次治疗反应,在婴儿期每3个月评估1次,以后每3~6个月评估1次。为了观察用药的效果,需观察以下指标:①身高和发育:生长速度和性成熟情况可说明激素治疗是否恰当。生长速度减慢及骨骺早闭,说明过量。②骨龄:每隔1~2年行X线检查(腕骨或其他骨骼),观察骨骼的成熟速度,当药量合适时,骨骺成熟速度可以减慢,理想的剂量可使骨龄的增长与年龄的增长逐渐达到一致。如果骨骺成熟进展快,说明激素剂量不足。③雄激素水平:最好早上空腹未服药之前采血,每隔3~6个月监测血中17-羟孕酮、睾酮、孕酮、ACTH、雄烯二酮、11-脱氧皮质酮等监测治疗反应。一般小婴儿和青春期男孩不能用睾酮作为判断治疗的效果。④血压、血肾素活性(PRA)和电解质水平:用来监测盐皮质激素剂量,维持血压、电解质和肾素活性在正常范围。婴儿期对盐皮质激素不敏感,1岁后需要重新评估盐皮质激素状态,并根据需要调整剂量。
一般在青春期前,空腹未服药物时血清17-OHP控制目标范围在 400~1 200ng/dl(12~36nmol/L),雄烯二酮控制在正常范围。肾上腺雄激素的分泌不应被完全控制,17-OHP水平正常通常提示治疗过度。这些血清检测值可以作为治疗有效性和依从性的指标。血浆肾素水平应保持在相应年龄的正常范围,肾素活性抑制表明治疗过度,患儿有发生高血压的风险。目前不同国家17-OHP控制范围没有固定标准,需要综合生长发育情况、临床特征、激素水平、电解质水平综合判断,来调整激素替代剂量。强调激素替代剂量个体化。
较大儿童能自觉地增加食盐量,一般不发生危象。用药适量时,雄激素的分泌得到适当抑制后,女孩可在适当年龄月经初潮,如16岁还无月经初潮,可能是药量不合适。男性可发生睾丸内肾上腺剩余瘤(testieular adrenal rest tumor,TART),是睾丸内残留的肾上腺原基细胞过度增殖性良性病变,多见于控制不良患者,是CAH不少见的并发症。故3岁后每年行睾丸B超检查,围青春期更要密切监测。出现TART时首先应用较大剂量皮质醇等药物治疗,部分剩余瘤可能缩小或消失,对瘤体较大的儿童和青春期患者,药物治疗控制不佳者,可以考虑外科行TART剔除术,保护瘤外正常睾丸组织功能。但是对于病程长和瘤体巨大者,即使剔除,剩余的睾丸功能也会有不同程度的损害。部分患者可发生治疗后卵泡刺激素(FSH)显著升高,提示Leydig细胞功能治疗前已受损。
1.向家长详细介绍疾病的病因、预后,使家长树立信心。
2.CAH需终身激素治疗,指导正确服用激素的重要性,详细介绍服用的时间、剂量及药物不良反应。
3.如患儿出现拒食、呕吐、腹泻、嗜睡、体重不增或下降等症状,立即就诊。
4.出院后定期复查,随访内容包括身高、骨龄、雄激素、电解质等。
失盐型21-OHD患者早期可出现肾上腺危象,新生儿筛查能够降低疾病死亡率,目前已被逐渐推广。应用荧光免疫法检测血清17-OHP浓度是21-OHD的一级筛查方法。正常儿童出生后17-OHP可轻度升高,生后1~2天迅速下降,因此建议在48~72小时后采足跟血滤纸片血样。早产儿17-OHP较足月儿童升高,因此需要建立不同胎龄17-OHP筛查切值。除此之外,疾病状态、应激等也会导致17-OHP升高。限于检测方法,其他肾上腺类固醇激素交叉免疫反应也可以导致筛查结果呈现假阳性,因此对于上述儿童需要进行二级筛查。目前推荐的二级筛查指标是采用液相色谱-串联质谱法(LC-MS/MS)检测17-OHP浓度,早产儿建议在生后2周及4周进行17-OHP复测。近期有研究显示其他生物标记物如21-脱氧皮质醇、尿孕三酮、尿6α-羟基四氢可的松等也可以用作筛查指标,其中21-脱氧皮质醇在不同胎龄新生儿中浓度无明显差异,避免了胎龄对筛查造成的影响。但是21-脱氧皮质醇应用化学发光免疫法检测受交叉反应影响较大,建议采用液相色谱-串联质谱法进行检测,但该技术由于难度较高,目前尚未在临床广泛推广。新生儿筛查主要筛查21-OHD经典型患儿,正常足月新生儿阳性切值为30nmol/L,大于30nmol/L召回,进一步确定诊断;早产儿阳性切值为50nmol/L。失盐型患儿的随机17-OHP浓度>105nmol/L。基础值17-OHP<6nmol/L,排除 21-OHD。如果筛查发现17-OHP升高在6~30nmol/L,需要进行促肾上腺皮质激素(ACTH1-24)激发试验或进行相关基因检测明确诊断。激发试验结果判定见图1。但由于17-羟孕酮易受多种因素(如体质、胎龄、应激、感染、情绪、疾病、服药时间、检测方法等)影响而波动,研究发现即使基因型相同,17-羟孕酮浓度差异也很大,故不能单纯用17-羟孕酮浓度进行分型。
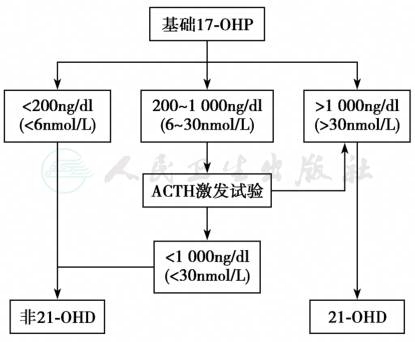
图1 CAH新生儿筛查流程













