乳腺癌是女性中常见的恶性肿瘤,最新的Globocan 2012数据报道每年全世界有超过167万女性罹患乳腺癌。乳腺癌的发病率及死亡率有明显的地区差异,欧美国家高于亚非拉国家。52.9%的新发病例发生在发展中国家,成为严重的疾病负担。在我国乳腺癌的发病率逐年上升,每年有近20万女性被诊断出乳腺癌,尤其是东部沿海及经济发达的大城市,其乳腺癌的发病率增加尤其显著,上海市的发病率居全国之首。从死亡率的曲线也可以发现,虽然新的治疗策略和方法的普及,全球乳腺癌的死亡率逐步下降,然而在中国特别是绝大多数的农村地区,乳腺癌的死亡率并未见到明显的下降趋势。
乳腺癌大都发生在40~60岁,绝经期前后的妇女,病因尚未完全明确,但与下列因素有关:①内分泌因素:已证实雌激素中雌酮与雌二醇对乳腺癌的发病有明显关系,黄体酮可刺激肿瘤的生长,但亦可抑制脑垂体促性腺激素,因而被认为既有致癌,又有抑癌的作用。催乳素在乳腺癌的发病过程中有促进作用。临床上月经初潮早于12岁,停经迟于55岁者的发病率较高;第一胎足月生产年龄迟于35岁者发病率明显高于初产在20岁以前者;②饮食与肥胖:影响组织内脂溶性雌激素的浓度,流行病学研究脂肪的摄取与乳腺癌的死亡率之间有明显关系,尤其在绝经后的妇女;③家族史及遗传史:有10%~15%的患者有家族史,一级亲属中有乳腺癌患者,其家属常为高危人群。患者如有BRCA基因突变,其子女发生乳腺癌的机会更高,且发病年龄较轻亦常同时伴有卵巢癌;④以往乳腺良性疾病、放射线照射等与乳腺癌发病有一定关系。
目前常用的临床分期是按国际抗癌联盟建议,2010年最新的第7版TNM国际分期法如下:
T (原发肿瘤)
Tis 原位癌、限于乳头的湿疹样癌
Tis(DCIS) 导管原位癌
Tis(LCIS) 小叶原位癌
Tis(Paget) 没有肿瘤的乳头Paget
T0 未发现原发肿瘤
Tx 原发肿瘤无法评估
T1 肿瘤最大径≤2cm
T1mic 微小浸润性癌,最大径≤0.1cm
T1a 肿瘤最大径>0.1cm,≤0.5cm
T1b 肿瘤最大径>0.5cm,≤1cm
T1c 肿瘤最大径>1cm,≤2cm
T2 肿瘤最大径>2cm,≤5cm
T3 肿瘤最大径>5cm
T4 任何大小的肿瘤直接侵犯胸壁(a)或皮肤(b)(胸壁包括肋骨、肋间肌、前锯肌,但不包括胸肌)
T4a 侵犯胸壁
T4b 乳房皮肤水肿(包括橘皮样改变),溃疡或限于同侧皮肤的卫星结节
T4c 上述两者(T4a和T4b)同时存在
T4d 炎性乳腺癌
N (区域淋巴结)
Nx 区域淋巴结无法评估(如先前已切除)
N0 无区域大淋巴结
N1 同侧腋窝扪及活动的淋巴结
N2 同侧腋淋巴结转移融合成团块或与其他组织粘连,或无明显腋窝淋巴结转移情况下同侧内乳淋巴结转移
N2a 同侧腋淋巴结转移融合成团块或与其他组织粘连
N2b 同侧内乳淋巴结但无腋淋巴结转移
N3 同侧锁骨上、下淋巴结有转移或临床明显的内乳淋巴结转移
N3a 同侧锁骨下和腋窝淋巴结转移
N3b 同侧内乳淋巴结和腋淋巴结转移
N3c 同侧锁骨上淋巴结转移
M (远处转移)
M0 无远处转移
M1 有远处转移(包括皮肤浸润超过同侧乳房)
临床分期:
Stage 0 Tis N0 M0
StageⅠ T1 N0 M0
StageⅡA T0 N1 M0
T1 N1 M0
T2 N0 M0
StageⅡB T2 N1 M0
T3 N0 M0
StageⅢA T0 N2 M0
T1 N2 M0
T2 N2 M0
T3 N1 M0
T3 N2 M0
StageⅢB T4 N0 M0
T4 N1 M0
T4 N2 M0
StageⅢC 任何T N3 M0
StageⅣ 任何T 任何N M1
国内乳腺癌的病理分型如下:
(一)非浸润性癌
1.导管内癌
癌细胞局限于导管内,未突破管壁基底膜。
2.小叶原位癌
发生于小叶,未突破末梢腺管或腺泡基底膜。
(二)早期浸润性癌
1.导管癌早期浸润
导管内癌细胞突破管壁基底膜,开始生芽,向间质浸润。
2.小叶癌早期浸润
癌细胞突破末梢腺管或腺泡壁基底膜,开始向小叶间质浸润,但仍局限于小叶内。
(三)浸润性特殊型癌
1.乳头状癌
癌实质主要呈乳头状结构,其浸润往往出现于乳头增生的基底部。
2.髓样癌伴大量淋巴细胞浸润
癌细胞密集成片、间质少、癌边界清楚,癌巢周围有厚层淋巴细胞浸润。
3.小管癌
细胞呈立方或柱状,形成比较规则的单层腺管,浸润于基质中,引起纤维组织反应。
4.腺样囊性癌
由基底细胞样细胞形成大小不一的片状或小梁,中有圆形腺腔。
5.黏液腺癌
上皮黏液成分占半量以上,黏液大部分在细胞外,偶在细胞内,呈印戒样细胞。
6.顶泌汗腺癌
癌细胞大,呈柱状,可形成小巢、腺泡或小乳头状。主、间质常明显分离。
7.鳞状细胞癌
可见细胞间桥、角化。
8.乳头湿疹样癌
起源于乳头的大导管,癌细胞呈泡状,在乳头或乳晕表皮内浸润,大多伴有导管癌。
(四)浸润性非特殊型癌
1.浸润性小叶癌
小叶癌明显向小叶外浸润,易发生双侧癌。
2.浸润性导管癌
导管癌明显向实质浸润。
3.硬癌
癌细胞排列成细条索,很少形成腺样结构,纤维间质成分占2/3以上,致密。
4.单纯癌
介于硬癌与髓样癌之间,癌实质与纤维间质的比例近似。癌细胞形状呈规则条索或小梁,有腺样结构。
5.髓样癌
癌细胞排列呈片状或巢状,密集,纤维间质成分少于1/3,无大量淋巴细胞浸润。
6.腺癌
癌实质中,腺管状结构占半数以上。
(五)其他罕见型癌
有分泌型(幼年性)癌、富脂质癌(分泌脂质癌)、纤维腺瘤癌变、神经内分泌癌、化生性癌、乳头状瘤病癌变等。
(六)特殊型癌
炎性乳腺癌、副乳腺癌、男性乳腺癌。
乳腺癌的治疗目前多依据患者不同的分子分型采用综合治疗,对早期能手术的患者应用手术治疗,同时术后应用辅助治疗。对局部晚期乳腺癌可应用术前新辅助治疗以后手术,对晚期不宜手术或复发病例以全身性药物及对症治疗。通过多基因表达谱技术可以将乳腺癌划分为不同的亚型,然而多基因检测在全球很多地方难以获得,2015版St Gallen共识采用临床病理学的方法鉴别出这些分型(表1)。
表1 更新的乳腺癌亚型临床病理特征
1ER阳性率1%~9%之间,还存在争议。对这部分患者单用内分泌治疗可能还不足够。
(一)治疗原则
按照临床病期、肿瘤部位、乳腺癌治疗方法的选择大致如下原则:
1.Ⅰ、ⅡA期
以手术治疗为主,可以采用根治性手术或保乳手术。术后根据淋巴结情况及预后指标决定是否需要辅助治疗。
2.ⅡB、ⅢA期
以根治性手术为主,术前根据病情常应用辅助化疗,内分泌治疗或放疗,术后常需应用辅助治疗。如患者肿块较大并有意愿接受保乳手术,可行新辅助治疗后手术。
3.ⅢB、ⅢC期
局部病灶较大或同侧锁骨上、下淋巴结有转移或内乳淋巴结有明显转移者,可用放疗、化疗、内分泌及放射治疗,手术可作为综合治疗的一个组成部分。特别是部分不可手术的局部晚期患者,通过新辅助治疗降期后可获得手术治疗的机会。
4.第Ⅳ期
以化疗、内分泌治疗为主,手术及放疗是局部辅助治疗的方法。
其中,早期乳腺癌全身治疗策略的制定主要依据如下原则(表2):
表2 早期乳腺癌全身治疗策略

(二)手术治疗
自从1894年Halsted创立了乳腺癌根治术以来,该术式一向被认为是典型的常规手术。1948年Handley在第二肋间内乳淋巴结的活检手术中,证实该淋巴结亦是乳腺癌的第一站转移途径,从而开展了各种清除内乳淋巴结的扩大根治手术。1970年以后较多采用是改良根治手术。20世纪80年代以后,对临床Ⅰ、Ⅱ期乳腺癌应用保留乳房的手术,缩小了手术范围,术后应用放射治疗。缩小手术范围的原因除了目前发现的早期病例增多,还由于患者对外形的要求,加上放射设备的改善,超高压直线加速器到达肿瘤的深部剂量增加,可减少皮肤反应。还有一些资料认为即使手术范围扩大,但疗效无明显提高,其原因主要是癌细胞的血道播散,即使临床Ⅰ期病例手术后仍有10%~15%因血道转移而失败。因而认为乳腺癌一开始就有波及全身的危险。以往在根治性手术时,需将腋淋巴结作常规的清除,术后常有上肢水肿、功能障碍等后遗症。然而各期乳腺癌的淋巴结转移率仅为40%~50%,因而常规作淋巴结清除,可能使50%~60%的患者接受了不必要的手术。因而近年来提出“前哨淋巴结活检”。根据活检结果再决定是否需要清除腋窝淋巴结。手术目的是:①控制局部及区域淋巴结,以减少局部复发;②了解原发灶的病例类型、分化程度、激素受体、淋巴结转移及其转移部位和程度等,以及肿瘤的生物学特性检测,以帮助选用手术后综合治疗的方案。
1.手术方法
乳腺癌的手术方式很多,手术范围可自保留乳房同时应用放射治疗直到扩大根治手术,但是没有一种固定的手术方式适合各种不同情况的乳腺癌。对手术方式的选择应结合患者病情及医疗条件来全面考虑,如手术医师的习惯,放疗的条件,患者的年龄、病期、肿瘤的部位等具体情况,以及患者对外形的要求。
(1)乳腺癌根治术及扩大根治术
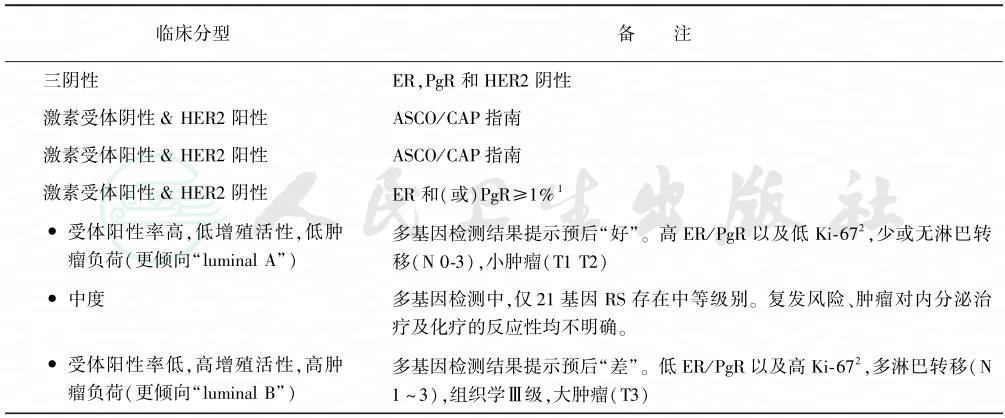
是最早期应用的手术方式,一般可在全身麻醉或高位硬膜外麻醉下进行。目前多采用横切口,皮肤切除范围应在肿瘤外4~5cm。细致剥离皮片,尽量剥除皮肤下脂肪组织,剥离范围内侧到胸骨缘,外侧达腋中线。先后切断胸大、小肌的附着点,保留胸大肌的锁骨份,可用以保护腋血管及神经,仔细解剖腋窝及锁骨下区,清除所有脂肪及淋巴组织,尽可能保留胸长、胸背神经,使术后上肢高举及向后动作不受阻碍。最后将乳房连同其周围的脂肪组织、胸大肌、胸小肌、腋下和锁骨下淋巴结及脂肪组织一并切除,皮肤不能缝合或缝合时张力较大,予以植皮。在切口下方另作小切口,置负压吸引48~72小时,以减少积液,使皮片紧贴于创面(图4)。
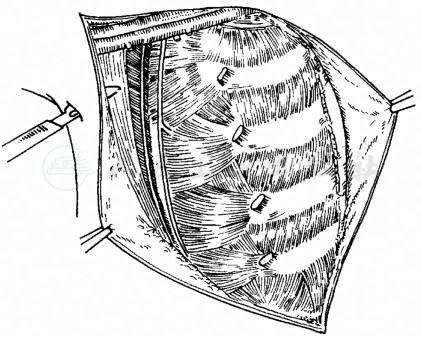
图4 乳腺癌根治术的创面(伤口缝合前)
Handley(1948)在根治术的同时作第二肋间内乳淋巴结的活检,国内李月云等(1955)报道根治术时内乳淋巴结活检的阳性率为19.3%(23/119),证实内乳淋巴结与腋下淋巴结同样是乳腺癌的第一站转移淋巴结。复旦大学附属肿瘤医院在1242例乳腺癌扩大根治术病例中,腋下淋巴结转移率为51%,内乳淋巴结转移率为17.7%。临床检查腋下未扪及肿大腋淋巴结的病例中,内乳淋巴结转移率为3%;有肿大淋巴结时,内乳淋巴结转移率为21%。肿瘤位于乳房外侧者内乳淋巴结转移率为12.9%,位于内侧及乳房中央者为22.5%。
上述手术同时清除内乳淋巴结称为扩大根治术。手术方式有两种:①胸膜内法(Urban)手术,是将胸膜连同内乳血管及淋巴结一并切除。胸膜缺损需用阔筋膜修补,术后并发症多,现已较少采用;②胸膜外(Margottini)手术,手术时保留胸膜。切除第2~4软骨,将内乳血管及其周围淋巴脂肪组织连同乳房、肌肉及腋窝淋巴脂肪组织整块切除。对病灶位于内侧及中央者该手术方式还是值得应用的(图5)。该两种术式目前已很少应用,但在适当的病例中仍有其一定的价值。
图5 胸膜外乳腺癌扩大根治术
(2)乳腺癌改良根治术
本手术的特点是保留胸肌,使术后有较好外形,术时尽量剥离腋窝及胸肌淋巴结,方法有:①保留胸大、小肌的改良根治Ⅰ式(Auchincloss手术);②仅保留胸大肌的改良根治Ⅱ式(Patey手术)。大都采用横切口,皮瓣分离时保留薄层脂肪。术后可保存较好的功能及外形,便于需要时作乳房重建手术。此方式适合于微小癌及临床第一、二期乳腺癌。
(3)单纯乳房切除
仅切除乳腺组织、乳头、部分皮肤和胸大肌筋膜。术后用放射线照射锁骨上、腋部及内乳区淋巴结,此方法适用于非浸润性癌、微小癌、湿疹样癌限于乳头者,亦可用于年老体弱不适合根治手术或因肿瘤较大或有溃破、出血时配合放射治疗。
(4)保留乳房的局部切除
术后应用放射治疗是近年来逐步应用较多的手术方式,适合于临床一、二期,尤其肿瘤小于3~4cm,与乳头乳晕不明显粘连,可完整切除并且切缘阴性,患者有保乳意愿并且实施保乳手术后有较好外形的患者,可接受保乳手术。当前已经明确,所需要的安全切缘,并非5mm抑或1mm,只要切缘墨汁染色无肿瘤即可,也不推荐根据肿瘤亚型、年龄小、小叶癌、接受新辅助、存在弥漫性导管内癌成分等传统的局部复发高危因素予以扩大切缘,一旦切缘染色无肿瘤,其局部复发风险将等同于切缘1mm或以上,同时保证了更好的术后外形。腋淋巴结可以同时清扫或作前哨淋巴结活检,术后应用全乳及同侧锁骨区的照射,在合适病例中,其疗效与根治术相同。
(5)前哨淋巴结活检
前哨淋巴结是指第一个接受乳腺回流的区域淋巴结,在乳腺手术时可以用核素或染料注入乳晕皮下,探查前哨淋巴结,并活检。前哨淋巴结活检的准确性95%,而假阴性率<5%。淋巴结无转移时,腋淋巴结可不作清除,以避免不必要的手术;如果该淋巴结有转移时,曾推荐作补充腋淋巴结清除,目前认为前哨1~2枚阳性,如患者预期接受辅助放疗,无需进一步接受补充腋部淋巴结清扫,特别是接受保乳的患者。同样,临床腋窝阳性在新辅助治疗后转阴的患者中也可以实施前哨淋巴结活检,但新辅助后如果前哨活检为阳性,还是需要补充腋窝清扫。
根治性手术后,手术侧上肢的功能常受到一定的障碍,同时上肢常因淋巴回流受阻而引起肿胀。术后应用负压吸引,防止腋窝积液,早期开始上肢功能锻炼,可使功能恢复,减少肿胀。
2.手术禁忌证
有以下情况不适合手术治疗:①乳房及其周围有广泛皮肤水肿,其范围超过乳房面积的一半以上;②肿块与胸壁固定;③腋下淋巴结显著肿大且已与深部组织紧密粘连;④患侧上肢水肿或有明显肩部酸痛;⑤乳房及其周围皮肤有卫星结节;⑥锁骨上淋巴结转移;⑦炎性乳腺癌;⑧已有远处转移。
3.乳房重建手术
部分不能接受保乳手术但对外形有追求的患者,越来越多的接受了乳房重建手术,在保证治疗效果的基础上,提高后续的生活质量。乳房重建手术,按手术的时机主要分为即刻重建和延期重建。即刻乳房重建,指在切除乳腺肿瘤的同时进行乳房整形,其优点包括:①切除和重建一次完成,减少住院时间和费用;②患者不会存在失去乳房的心理痛苦;③再造乳房外形更好;④不推迟后续辅助治疗的时间,也不会增加局部复发的风险。通常适合于保留皮肤的乳房切除患者,留下了足够的乳房皮肤以供即时重建时使用,这些自体的皮肤具有最自然的外观和手感。延期乳房重建,指在乳腺肿瘤切除后,完成辅助治疗后再进行重建手术。目前常用的几种重建技术,包括自体组织重建(背阔肌肌皮瓣乳房重建、带蒂/游离腹直肌皮瓣乳房重建),假体重建(扩张器置换假体)以及乳头重建技术等。
(三)放射治疗
与手术相似,也是局部治疗的方法。
1.术后放疗
保留乳房手术后作全胸壁及锁骨区放疗,常规根治术或改良根治术后有腋淋巴结转移的患者,照射锁骨上及内乳区淋巴结。放射设备可以用直线加速器,照射野必须正确,一般剂量为50Gy(5000cGy)/5w。可以减少局部及区域淋巴结的复发,并改善患者的生存率。全乳切除后对于转移淋巴结大于3个、肿块超过5cm、前哨淋巴结转移未行腋窝淋巴结清扫、转移淋巴结1~3个含其他高危因素的患者,标准辅助放疗是必需的。保乳治疗后淋巴结阴性的放疗区域可仅针对于乳房,一旦淋巴结阳性,需联合区域淋巴结的放疗。大分割放疗可用于保乳患者,特别是未化疗或腋窝受累的患者。
2.术前放疗
主要用于第三期病例或病灶较大、有皮肤水肿、经新辅助化疗后疗效不明显的患者。照射后局部肿瘤缩小,水肿消退,可以提高手术切除率。术前放疗可降低癌细胞的活力,减少术后局部复发及血道播散,提高生存率。一般采用乳腺两侧切线野,照射剂量为40Gy(4000cGy)/4w,照射结束后2~4周手术。
炎性乳腺癌可用放射治疗配合化疗。
3.肿瘤复发的放射治疗
对手术野内复发结节或锁骨上淋巴结转移,放射治疗常可取得较好的效果。局限性骨转移病灶应用放射治疗的效果也较好,可以减轻疼痛。
(四)新辅助治疗
新辅助治疗起源于20世纪70年代,过去主要采用化疗的治疗方式,历史上曾采用过的名称包括术前化疗、初始化疗、诱导化疗等。通过新辅助治疗将不可手术的变为可手术、将不可保乳的变为可保乳患者。乳腺癌已进入分子亚型的个体化治疗时代,新辅助治疗的选择也有必要基于患者ER、PR、HER2以及Ki-67的状态,化疗已经不再是新辅助治疗的唯一手段。对于三阴性患者可给予含蒽环联合紫杉类的新辅助化疗;对于HER2阳性患者,有必要化疗联合抗HER2治疗;对于部分ER或PR阳性的局部晚期患者也有理由行术前内分泌治疗,尤其是在老年患者。更多针对不同靶点的靶向药物也正逐步进入临床试验,例如针对细胞周期、PI3K/AKT/mTOR通路等的新药,将进一步增加临床新辅助治疗的可选择性。
新辅助治疗越来越多地被临床所接受,其优点包括:①肿瘤机制角度,使肿瘤远处微小转移病灶获得更早和更有效的治疗;防止因血管生成抑制因子减少和耐药细胞数目增加所导致的术后肿瘤迅速发展和转移;②临床角度,使乳腺癌的原发病灶及区域淋巴结降期,使原先不能手术的肿瘤通过新辅助治疗后可以进行根治术;使原先不能保乳的患者,可以接受保留乳房手术;使原先需要腋窝清扫的患者腋窝降期后避免腋窝淋巴结清扫;监测肿瘤对治疗方案的敏感性,为术后辅助治疗的选择提供依据;③科研角度,提供一个研究平台,加速生物标志物的发现,确立预测疗效的指标、药代动力学的预测指标,以及残留肿瘤或耐药肿瘤的相关生物标志物;检测新的联合治疗的疗效,可快速地评估新药疗效,加快抗肿瘤新药的开发。目前建议将完整的系统性辅助治疗全程用于新辅助治疗,即化疗需6~8个疗程,而内分泌起效慢,通常需要4~8个月。对于HER2阳性、受体阳性患者,建议手术后继续完成既定的一年靶向治疗和常规的全程内分泌治疗。
(五)化学治疗
在实体瘤的化学治疗中,乳腺癌应用化疗的疗效较好。化疗对晚期或复发病例也有较好的效果。常用的化疗药物有环磷酰胺、氟尿嘧啶、甲氨蝶呤、多柔比星、紫杉类、卡培他滨、吉西他滨、长春瑞滨等,在应用单一药物中多柔比星及紫杉类药物的疗效较好。近年来联合应用多种化疗药物治疗晚期乳腺癌的有效率达40%~60%。
术后化疗可以杀灭术中可能散播的癌细胞以及“亚临床型”转移灶。常应用多种药物的联合化疗。近年来常用的以蒽环类及紫杉类为主的联合化疗。如CAF、CEF及TAC、AC-T、AC-P等方案(A为多柔比星、E为表柔比星、T为多西他赛、P为紫杉醇)。根据细胞动力学的理论,术后化疗宜早期开始,术后一般不超过1个月,时间为6~8个疗程。
(六)内分泌治疗
目前应用激素受体的免疫组织化学检测可以准确地判断应用内分泌治疗的效果。
1.内分泌疗法的机制
乳腺细胞内有一种能与雌激素相结合的蛋白质,称为雌激素受体。细胞恶变后,这种雌激素受体可以继续保留,亦可以丢失。如仍保存时,细胞的生长和分裂仍受内分泌控制,这种细胞称为激素依赖性细胞;如受体丢失,细胞就不再受内分泌控制,称为激素非依赖性细胞或自主细胞。
雌激素对细胞的作用是通过与细胞质内雌激素受体的结合,形成雌激素受体复合物,然后转向核内而作用于染色体,导致基因转录并形成新的蛋白质,其中包括孕激素受体。孕激素受体是雌激素作用的最终产物,孕激素受体的存在也说明雌激素受体确有其活力。雌激素受体测定阳性的病例应用内分泌治疗的有效率约50%~60%,如果孕激素受体亦为阳性者,可达70%~80%,雌激素受体测定阴性病例的内分泌治疗有效率仅为5%~8%。目前常用的测定乳腺癌组织内雌激素受体及孕激素受体的方法为免疫组织化学法可在冷冻切片或石蜡切片上测定,阳性细胞群占整个癌细胞数的1%以上者为阳性病例。雌激素受体及孕激素受体测定的阳性率约为50%~60%。影响雌激素受体及孕激素受体阳性率的因素很多,绝经后病例的阳性率高于绝经前病例,阳性病例的细胞分化程度常较好,预后亦较阴性病例为佳。
雌激素受体及孕激素受体的测定可用以制订治疗方案,在晚期或复发病例中如激素受体测定阳性病例可以选用内分泌治疗,而阴性病例应用内分泌治疗的效果较差,应以化疗为主。
2.内分泌治疗的方法
有切除内分泌腺体及内分泌药物治疗两种。切除内分泌腺体中最常用的是去势方法,即卵巢切除术或用放射线照射卵巢,其目的是消除体内雌激素的来源,对雌激素受体测定阳性的绝经前妇女常有较好的疗效,对骨转移、软组织及淋巴结转移的效果也好,而对肝、脑等部位转移则基本无效。对于放射线照射卵巢目前已较少应用。近年有药物卵巢抑制剂,如戈舍瑞林为抑制脑垂体促性腺激素,用药后可抑制卵巢功能而致停经,停药后卵巢功能可以恢复。
绝经前乳腺癌患者,对于小于35岁、辅助化疗后还处于绝经前雌激素水平、复发风险高特别是淋巴结4个及以上转移的患者,辅助内分泌治疗中联合卵巢功能抑制可改善无病生存。晚期男性乳腺癌病例切除睾丸常有较好的效果,有效率可达60%~70%。
内分泌药物治疗常用的为雌激素受体调变剂。雌激素受体调变剂常用的为他莫昔芬(三苯氧胺,tamoxifen),其作用是与雌激素竞争雌激素受体,从而抑制癌细胞的增长。雌激素受体阳性患者的有效率约55%,阴性者则小于5%。对软组织、骨、淋巴结转移的效果较好。2011年早期乳腺癌临床研究协作组(EBCTCG)对全球共计10 645例患者对照术后应用他莫昔芬,对激素受体阳性患者可降低术后15年的复发风险(46.2%下降至33%)及死亡风险(33.1%下降至23.9%),对淋巴结阳性及阴性患者均有一定的疗效。他莫昔芬用法为10mg,每日2次,作为辅助治疗应用的时间通常为5年,高危患者可延长至10年,不良反应有潮热、白带增多、子宫内膜增厚、肝功能受损、视力模糊等。极少数患者增加了子宫内膜癌的发生率。
托瑞米芬(法乐通,toremifen)的作用与他莫昔芬相似,其类雌激素作用同他莫昔芬。新的甾体类雌激素受体调变剂有氟维司群(fulvestrant)等。
绝经后妇女的雌激素来源于肾上腺分泌的雌激素前体物及胆固醇转为雄烯二酮及睾酮,经芳香化酶作用后转为雌二醇及雌酮,因此应用芳香化酶抑制剂可以阻断体内雌激素的合成,用药后可抑制体内98%~99%的雌激素合成。目前常用的第三代芳香化酶抑制剂有非甾体类的阿那曲唑及来曲唑,以及甾体类的依西美坦。在辅助治疗阶段和晚期治疗中,均提示其疗效优于他莫昔芬。而三个芳香化酶抑制剂之间没有显著差异,推荐起始应用,或转换应用(用2~3年的他莫昔芬后转换用芳香化酶抑制剂)。对高危患者,可延续应用(用5年他莫昔芬后再改用芳香化酶抑制剂),将进一步提高无病生存率。第三代芳香化酶抑制剂的不良反应有骨质疏松、骨关节病变等。
黄体类制剂有甲羟孕酮、甲地孕酮等对乳腺癌都有一定疗效,目前作为内分泌治疗二线或三线药物。
3.靶向治疗
在乳腺癌中,约20%左右患者中有Her-2/neu基因的扩增或其蛋白质的过度表达,此类患者的预后往往较差。近年来抗Her-2/neu基因的单克隆抗体和(或)小分子酪氨酸激酶抑制剂(赫塞汀、Putuzumab、Lapatinib、TDM-1等)已广泛用于临床,对各期患者均有较好效果,其中赫塞汀使用最为广泛。作为辅助治疗,Ⅱ期及以上分期的HER2阳性患者,采用蒽环序贯紫杉联合赫塞汀的靶向治疗,能显著提高患者的生存率;而HER2阳性的Ⅰ期患者,特别是T1b、T1c患者,分别每周紫杉醇联合赫塞汀也是可行的。治疗前需通过免疫组织化学或FISH明确患者为Her-2/neu基因的扩增或过度表达,目前标准的抗HER2治疗仍然是赫塞汀1年。
乳腺癌是常见的浅表肿瘤。早期发现,早期诊断并不困难。早期手术及术前后合理的综合治疗的效果较好,乳腺癌目前尚无一级预防方法,但要选择既符合计划生育要求,又能防止乳腺癌发病率增加的合理生育方案。提倡母乳喂养,绝经后减少脂肪摄入量,有助于预防乳腺癌的发生。在妇女中提倡自我检查,对高危险人群进行定期筛查,有助于乳腺癌的早期发现。













