英文名称 :multiple sclerosis
多发性硬化(multiple sclerosis,MS)是最常见的CNS特发性炎性脱髓鞘疾病(idiopathic inflammatory demyelinated diseases,IIDDs),是导致青壮年非创伤性残疾的主要疾病之一。
多发性硬化本质上是一种自身免疫性疾病,环境因素和遗传基因易感性也共同参与发病。
“炎症”和“变性”贯穿多发性硬化的整个疾病病理生理过程。在某些诱因,特别是非特异性病毒感染激发的自身反应性T细胞介导的免疫性炎症,这些炎症反应的消退和再发与临床上的反复发作缓解有关。而随着患病时间延长,逐渐加剧的轴索断裂、缺失和脑萎缩这一“变性”过程则与患者不断累积的神经功能残疾相关。
(一)遗传因素
多发性硬化患者的一级亲属发病的风险约为正常人群的7倍。双胞胎研究显示:单卵双生的共患率(20%~35%)比双卵双生的共患率(约5%)显著提高。分子水平的研究提示:本病在一定程度上与HLAⅡ类分子有关,特别是 HLA-DRB1∗15和 HLA-DRB1∗06。
(二)环境因素
遗传易感性是多发性硬化发病的内因。此外,环境因素作为外因在本病的发病中也扮演着重要的角色。主要的环境因素包括:①病毒感染。长时间的观察研究发现,多发性硬化患者在疾病早期血清抗EB病毒抗体的阳性率较正常人群高;脑组织的多发性硬化斑块中,EB病毒抗原表达水平较高。②维生素D和日照。维生素D和日照不足可能是多发性硬化特殊地理分布的潜在原因。流行病学及实验室数据证实高水平维生素D可以降低罹患多发性硬化的风险,甚至发现使用维生素D可减少多发性硬化的复发。③吸烟会增加多发性硬化的患病风险。
多发性硬化典型的组织病理特征:散在于中枢神经系统白质(脑、脊髓和视神经)内多发的脱髓鞘斑块,血管周围炎症细胞浸润和星形胶质细胞增生。病灶多分布于视神经、脑室周围白质、胼胝体、脑干、小脑、颈段脊髓白质等。
传统的观点认为,多发性硬化病灶内轴索相对保留,中枢神经系统灰质很少受累。临床病理学最近发现很多新的组织病理特征包括轴索的病变,皮质和深部灰质的病灶,脑白质和灰质变性,软脑膜炎症细胞浸润,不同程度的髓鞘再生等。这些发现提示MS的多元病理机制,不仅仅是一种免疫相关的炎性疾病,还存在神经变性的病理生理过程。
1.MRI
敏感性高,能检出MS患者的亚临床病灶。典型的病灶主要分布在脑室周围、胼胝体、紧贴皮质的弓状纤维处、脑干、小脑和脊髓(图1、图2)。病灶通常较小(直径3~10mm),呈圆形或椭圆形。侧脑室周围的病灶其长轴常垂直于侧脑室表面,被称为“Dawson finger征”。脊髓病灶多在一侧脊髓的后部和侧面,长度不超过1个椎体节段。急性病灶均可被钆造影剂增强。每次发作常能在MRI中发现新的T2病灶或T1增强病灶,所以MRI被普遍用于疾病的监测和随访。
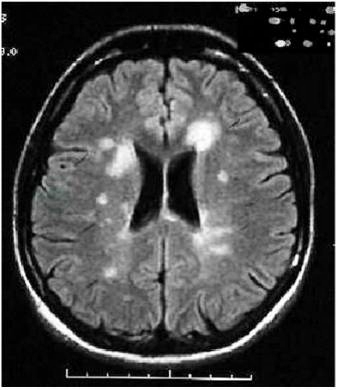
图1 多发性硬化患者头颅MRI示脑室周围病灶
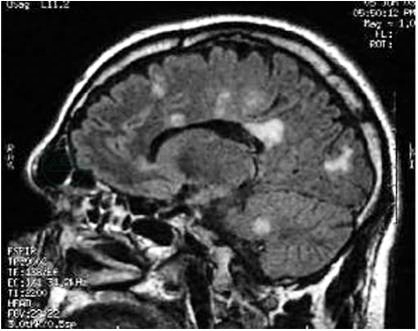
图2 多发性硬化患者头颅MRI示胼胝体、灰白交界处和小脑病灶
2.脑脊液检查
急性期脑脊液细胞数可轻至中度增高,一般不超过50/mm3,以淋巴细胞为主。蛋白质可轻度增高,并以球蛋白增高为主。
出现特异性的寡克隆带(OB)和IgG指数增高(>0.7为升高),这说明鞘内中枢神经系统的免疫反应。
3.诱发电位
应用视觉诱发电位、脑干听觉诱发电位和体感诱发电位,分别能检出视神经、听神经和周围神经传入中枢通路的亚临床病变。
(一)急性发作期的治疗
目的是缓解急性加重的或新发神经系统症状。
1.糖皮质激素
急性发作的首选治疗。甲泼尼龙500mg/d连用5天,或甲泼尼龙1 000mg/d连用3天。之后可直接停用,或口服递减:如甲泼尼龙60mg/d,口服1周,随后每5日减10mg直至减完,4~6周为一疗程。注意激素不良反应的预防和处理。但激素治疗不能预防疾病复发,也不能改变疾病的进展趋势。
2.血浆交换
对激素治疗反应不好的患者作为二线治疗措施。血浆交换量通常为每次50ml/kg体重,进行3~5次。
3.大剂量免疫球蛋白(immunoglobulin,Ig)静脉滴注
剂量为每天0.4g/kg体重,连用5天。对激素治疗反应不好者,可联合激素使用免疫球蛋白静脉滴注。
(二)预防复发和防止疾病进展的治疗
又称疾病修正治疗。口服药有富马酸二甲酯、特立氟胺、芬戈莫德、西尼莫徳等;注射剂有干扰素β-1a、醋酸格拉替雷、米托蒽醌、那他珠单抗、阿伦单抗和奥法妥木单抗。对无法获得上述治疗或有禁忌者,则选用环磷酰胺、硫唑嘌呤或甲氨蝶呤。
(三)对症及康复治疗
疼痛者用卡马西平等。用5-羟色胺再摄取抑制剂等抗抑郁。排尿障碍者通过尿流量测定和尿道括约肌肌电、决定用药或留置导尿。













