英文名称 :gout and hyperuricemia
痛风(gout)是单钠尿酸盐晶体诱发的炎症性疾病,分为原发性和继发性两类。长期嘌呤代谢活跃,嘌呤摄入过多,或尿酸排泄障碍,均可导致高尿酸血症(hyperuricemia)。长期高尿酸血症可引起关节及周围软组织尿酸盐晶体沉积,进而出现反复发作的急性关节和软组织炎症、痛风石沉积、慢性关节炎和关节损坏。高尿酸血症亦可累及肾脏,引起慢性间质性肾炎和尿酸盐结石形成。原发性痛风患者有不到1%为嘌呤合成酶缺陷所致。其余大多病因未明。继发性者可由肾脏病、血液病及药物等多种原因引起。痛风患者早期积极降尿酸治疗可延缓或阻止脏器损害。
单钠尿酸盐晶体沉积是导致痛风发作的根本原因。体温在37℃时,血中尿酸饱和度为420μmol/L(7mg/dl),如持续超过这个饱和点则称为高尿酸血症。血中过多的尿酸在关节或周围软组织以钠盐的形式析出,并形成晶体沉积,进而诱发的急性炎症则称为痛风。人体内尿酸的来源有:①食物中核苷酸分解而来的属外源性,约占体内尿酸的20%;②由体内氨基磷酸核糖及其他小分子化合物合成或核酸分解而来的属内源性,约占体内总尿酸的80%。正常人体内尿酸池平均为1 200mg,每天产生约750mg,排出500~1 000mg。排出的尿酸中约2/3是以游离单钠尿酸盐形式由肾脏经尿液排泄,另1/3由肠道排出,或被肠道内细菌分解,这部分尿酸的排泄方式在肾功能不全时有重要代偿意义。肾脏排泄尿酸有赖于肾小球滤过(正常状态下100%滤过),近端肾小管再吸收(98%~100%)、分泌(50%)和分泌后再吸收(40%~44%),最终尿酸的排泄量仅占肾小球滤过的6%~12%。正常人每天产生与排泄的尿酸量维持在平衡状态,此时血尿酸保持稳定水平。如尿酸产生增加和/或肾排泄尿酸不足(绝对不足或相对不足)则可产生高尿酸血症。
尿酸是人体嘌呤代谢的中间产物。嘌呤的合成代谢与反馈调节途径见图1。嘌呤合成有两条途径:①主要途径,在肝内从非嘌呤基前体简单物质如氨基酸、CO2、磷酸核糖+ATP形成磷酸核糖焦磷酸(PRPP),在谷氨酰胺作用下形成氨基磷酸核糖。在甘氨酸及磷酸核糖焦磷酸酰胺转换酶(PRPPAT)催化下形成次黄嘌呤核苷酸(IMP),而后转换成腺嘌呤核苷酸(AMP)或鸟嘌呤核苷酸(GNP),最终生成尿酸;②补救途径,直接在脑或骨骼等组织内,利用游离的嘌呤或嘌呤核苷合成嘌呤核苷酸参与嘌呤代谢。
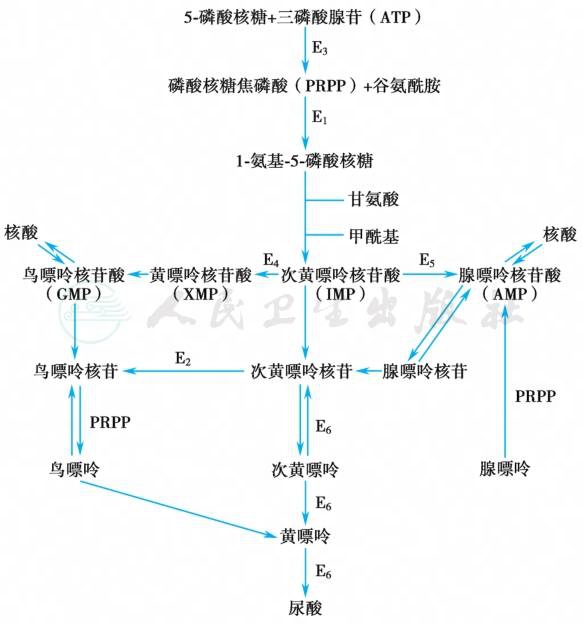
图1 嘌呤合成和代谢途径及其反馈调节机制
注:E1:磷酸核糖焦磷酸酰胺转换酶;E2:次黄嘌呤-鸟嘌呤磷酸核糖转换酶;E3:磷酸核糖焦磷酸合成酶;E4:次黄嘌呤核苷-5’-磷酸脱氢酶;E5:腺苷酸代琥珀酸合成酶;E6:黄嘌呤氧化酶。
(一)原发性高尿酸血症
1.尿酸生成增加
(1)多基因遗传是原发性高尿酸血症和痛风的关键原因:
约10%原发性高尿酸血症是尿酸生成增多所致,而酶的缺陷是导致尿酸生成增多的原因,这种缺陷与多基因遗传有关,如N5,N10-亚甲基四氢叶酸还原酶(MTHFR)基因C677T突变,最终导致:①次黄嘌呤-鸟嘌呤磷酸核糖转移酶(HGPRT)部分缺乏;②PRPP合成酶(PRS)的浓度和活性增高,使PRPP的量增加;③黄嘌呤氧化酶活性增加等。另外编码尿酸盐转运蛋白基因SLC2A9、ABCG2、SLC17A1、SLC22A12 的单核苷酸多态性与血尿酸水平及痛风发病密切相关。
(2)饮食因素:
高嘌呤饮食、高蛋白饮食和酗酒可增加尿酸合成,使血尿酸浓度升高。乙醇能促进腺嘌呤核苷酸转化而使尿酸增多。饥饿可使血浆乙酰乙酸和β-羟丁酸水平增加而导致高尿酸血症。如果饥饿时摄入大量乙醇和高嘌呤、高蛋白饮食,可引起血尿酸水平迅速增高,造成痛风发作。
2.尿酸排泄减少
由于肾小管排泌尿酸的能力下降所致,其病因为多基因遗传。确切的发病机制尚不清楚。
(1)肾脏对尿酸盐的排泄的影响:
肾脏对尿酸盐的排泄主要包括肾小球的滤过、近曲肾小管的重吸收和主动分泌。近年来研究发现,16号染色体短臂上的UMOD基因与肾脏的浓缩功能相关,其中的组织阴离子和尿酸盐运输基因(UAT、UAT2、URAT1、hOAT1)和溶质传送家族基因对尿酸盐在肾脏的代谢具有重要的作用。
(2)脂代谢与尿酸排泄:
高尿酸血症患者尿酸排泄可能与血浆极低密度脂蛋白(VLDL)水平呈负相关。研究表明痛风患者载脂蛋白E2等位基因与肾脏分泌尿酸盐有相关性,其胆固醇、甘油三酯和血尿酸水平均显著高于对照组,提示痛风患者肾脏尿酸排泄的减少由高VLDL水平及高载脂蛋白E2等位基因介导。
3.其他
葡萄糖激酶调节蛋白(GCKR)基因、LRRC16A基因、PDZK基因和β3肾上腺受体基因等的单核苷酸位点多态性与血尿酸水平有关。值得关注的是β3肾上腺受体基因被认为与高尿酸相伴随的胰岛素抵抗相关。
(二)继发性高尿酸血症
继发性高尿酸血症大多发生于骨髓增生性疾病如急、慢性白血病,红细胞增多症,多发性骨髓瘤,溶血性贫血,淋巴瘤及癌症化疗时,细胞内核酸大量分解而致尿酸产生过多;或在肾脏疾病、高血压、动脉硬化晚期,由于肾衰竭导致尿酸排泄障碍而使血尿酸增高。药源性的高尿酸血症常发生于较长时间使用噻嗪类利尿药后。水杨酸钠在大剂量时有利尿酸作用,而在小剂量时抑制肾小管排泄尿酸而使血尿酸增高。慢性铍、铅等金属中毒时由于肾小管损害,亦可引起高尿酸血症及痛风。体内大量消耗ATP可导致血尿酸增高。ATP代谢过程中形成ADP或AMP。AMP进一步分解形成IMP(次黄嘌呤核苷酸)或腺苷,最后形成次黄嘌呤和黄嘌呤分解而形成尿酸。代谢综合征和胰岛素抵抗导致尿酸增高。血脂代谢紊乱使血脂增高,增高的血脂使体内酮体增多,肾小管对尿酸的排泌受到竞争性抑制而排出减少。糖尿病致高血糖损害肾功能从而导致尿酸排泄减少。胰岛素能刺激靶器官对阴离子(如尿酸)的再吸收,因此胰岛素抵抗和高胰岛素血症使尿酸重吸收增加。
(三)痛风性关节炎、痛风石及痛风性肾病
1.痛风性关节炎
痛风发病机制和自我缓解机制极其复杂,近年研究热点集中于炎症细胞因子(IL-1、IL-8、TNF-α)及相关信号通路、补体系统、免疫球蛋白、中性粒细胞凋亡、巨噬细胞极化等。血尿酸过饱和后析出单钠尿酸盐(monosodium urate,MSU)晶体并沉积于关节及软组织,诱导白细胞趋化聚集,并作为一种内源性危险信号被巨噬细胞模式识别受体(如Toll样和NOD样受体即TLR2/4和NLRP3)识别,激活下游的免疫炎症信号通路,最终导致痛风急性炎症发作。国外研究已证实 TLR4、NF-κB、IL-1β、NLRP3 炎症小体、IL-1β、IL-1R 信号通路在痛风炎症与免疫调节中发挥重要作用。
2.痛风石
痛风石是痛风的特征性病变之一。痛风石的核心为尿酸盐沉积,细小针状结晶可诱导慢性异物反应,其周围被上皮细胞、巨核细胞所包围,有时还有分叶核细胞的浸润,形成异物结节,即所谓痛风石。常见于关节软骨、滑囊、耳轮、腱鞘、关节周围组织、皮下组织和肾脏间质等部位。
3.痛风性肾脏病变
痛风性肾病的特征性组织学表现为肾髓质或乳头处尿酸盐结晶,其周围有炎症细胞反应。痛风患者尸检中发现痛风性肾病发生率高,并常伴有急性和慢性肾间质炎症性改变、纤维化、肾小管萎缩、肾小球硬化和肾小动脉硬化等。这些变化是轻度、缓慢进展的病变,却是引起慢性肾功能不全的原因之一。尿酸(非尿酸盐)结晶在肾集合管、肾盂肾盏及输尿管内沉积,可诱发急性肾衰竭。痛风患者肾结石的发生率也较正常人高200倍,为35%~40%。其中84%为单纯性尿酸(非尿酸盐)结石,4%为尿酸和草酸钙结石,余为草酸或磷酸钙结石。结石的发生率随血尿酸浓度的增高、尿尿酸排出量的增多而增加。
(一)血清尿酸测定
正常男性尿酸酶法一般为≤420μmol/L(7mg/dl),绝经前女性比男性低 1mg/dl左右。 痛风患者多伴有血尿酸的增高,但由于尿酸本身的波动性及急性痛风性关节炎发作时肾上腺皮质激素分泌增多,利尿酸作用加强、饮水利尿和治疗药物等因素影响,有时血尿酸水平可以正常,须反复检查才能免于漏诊。
(二)尿液尿酸(即尿尿酸)测定
对诊断急性痛风性关节炎帮助不大,但可区分是尿酸排泄减少还是尿酸生成增多,对高尿酸血症和痛风的临床分型和指导用药有一定帮助。既往临床工作中大多以24小时尿尿酸定量法来加以区分,在摄取低嘌呤饮食5天后,若24小时尿尿酸排泄少于600mg(3.6mmol)则定义为尿酸排泄减少型,24小时尿尿酸排泄超过800mg(4.8mmol)定义为尿酸产生过多型。也有学者建议采用尿酸排泄分数来分型:按下式计算尿酸排泄分数(fraction excretion of uric acid,FEUA),FEUA=[(血肌酐×24小时尿尿酸)/(血尿酸×24小时尿肌酐)]×100%,以百分数表示。根据尿酸排泄分数结果将高尿酸血症和痛风分为三型:排泄减少型(FEUA<7%)、混合型(7%≤FEUA≤12%)及生成增多型(FEUA>12%)。该指标更能反映肾脏排泄尿酸的情况。
(三)滑囊液检查
急性期如踝、膝等较大关节肿胀时可抽取滑囊液进行偏振光显微镜检查,可见双折光的针形尿酸钠晶体,具有确诊的意义(痛风性关节炎的“金标准”)。
(四)X线检查
早期急性关节炎除软组织肿胀外,关节显影多正常,反复发作后才有骨质改变,首先为关节软骨缘破坏,关节面不规则,关节间隙狭窄,病变发展则在软骨下骨质及骨髓内可见痛风石沉积,骨质呈凿孔样缺损,其边缘均锐利,缺损呈半圆形或连续弧形,骨质边缘可有骨质增生反应。
(五)关节超声
高分辨率超声可用于评估软骨和软组织尿酸盐结晶沉积、滑膜炎症、痛风石及骨侵蚀。在超声图像中,MSU晶体沉积可有多种表现:关节腔积液时关节液内出现不均质的细小点状回声,类似云雾状,称为“暴雪征”。受累关节软骨靠近关节腔表面出现条线状强回声,轮廓欠清晰,与软骨下骨皮质形成无回声软骨周围的双层平行强回声,该现象是因为尿酸盐结晶在关节软骨表面沉积所造成,称为“双轨征”。关节内或肌腱内的高回声聚集灶提示存在痛风石。目前研究认为双轨征和痛风石的超声影像特异性高于“暴风雪”征,对痛风诊断有很高的特异性。
(六)双能(源)CT
双能CT(dual-energy computed tomography,DECT)是为两个X线放射管,在两种不同能量水平获得两组组织图像,之后进入CT站的处理,通过组织化学成分不同导致的对不同能量的X线吸收差别,以此区分不同的组织。双能CT较特异地显示组织与关节周围尿酸盐结晶(见彩图3),有助于痛风性关节炎诊断和评价降尿酸治疗疗效。
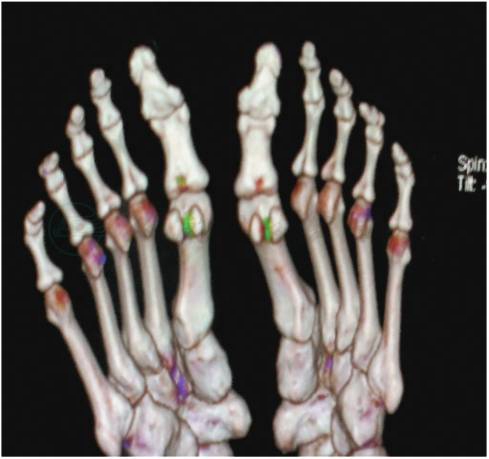
图3 绿色为双能CT显示的尿酸盐结晶沉积
痛风治疗的目的:①迅速有效地缓解和消除急性发作症状;②预防急性关节炎复发;③纠正高尿酸血症,促使组织中沉积的尿酸盐晶体溶解,并防止新的晶体形成,从而逆转和治愈痛风,并防止高尿酸所致并发症;④治疗其他伴发的相关疾病如肥胖、高血压、糖尿病等。通过长期血尿酸的达标治疗,可以减少痛风急性发作并缩小痛风石。
(一)一般治疗
饮食控制对痛风或高尿酸血症患者非常重要,建议痛风患者应避免进食动物内脏、高果糖饮料和酒,限制肉、海鲜和甜点的摄入,鼓励多食蔬菜、樱桃和低脂或无脂奶,可适量饮用咖啡。痛风患者还应注意控制体重,保持健康的生活方式,多饮水,保持>2 000ml/d的尿量。严格的饮食控制只能使血尿酸下降1~2mg/dl。故目前多限制高嘌呤食物,鼓励低嘌呤饮食以综合防治。肥胖患者必须减少热量的摄入,同时降低体重;宜多饮水以利尿酸排出,每天尿量在2 000ml以上,慎用抑制尿酸排泄的药物如利尿剂。考虑到小剂量阿司匹林对心脑血管疾病的获益,必要时仍可继续使用。避免过度劳累、紧张、受冷、受湿及关节损伤等诱发因素。
(二)急性发作期治疗
急性期治疗的目的是迅速控制急性关节炎症状。急性期应卧床休息,抬高患肢及局部冷敷,局部冷敷有利于减少滑膜渗液量及缓解炎症关节疼痛,一般建议卧床休息至关节疼痛缓解后方可逐步恢复活动。急性痛风发病后24小时内,应该给予药物治疗,因为早期治疗效果更佳;急性发作期,已经使用的降尿酸药可以继续使用。非甾体抗炎药(NSAIDs)、秋水仙碱、糖皮质激素是急性关节炎发作的一线治疗药物,亦有专家将糖皮质激素作为二线药物,仅在NSAIDs、秋水仙碱治疗无效或者有禁忌时使用。近年来,IL-1抑制剂阿那白滞素、卡那单抗和利纳西普已开始在国外使用于临床。
1.秋水仙碱
能稳定溶酶体膜,通过抑制白细胞趋化、吞噬作用及减轻炎症反应而起到止痛作用。推荐在痛风发作36小时内尽早使用。起始负荷剂量为1.0mg口服,1小时后追加0.5mg,12小时后按照0.5mg每天2~3次服用。使用细胞色素P3A4或P-糖蛋白抑制剂者(如环孢菌素、克拉霉素、维拉帕米、酮康唑等)避免使用秋水仙碱。秋水仙碱不良反应随剂量增加而明显,常见有恶心、呕吐、腹泻、腹痛等胃肠反应,症状出现时应立即停药;少数患者可出现肝功能异常,转氨酶升高超过正常值2倍时需停药;肾脏损害可见血尿、少尿、肾功能异常,中重度肾功能损害患者需酌情减量,肾小球滤过率(GFR)35~49ml/min时不超过0.5mg/d,GFR 10~34ml/min时减量至每2~3天口服0.5mg,GFR<10ml/min时或透析患者禁用;秋水仙碱可引起骨髓抑制,使用时注意监测。
2.NSAIDs
具有抗炎、止痛和解热作用,并可迅速起效。因使用方便(多数每天只需服药1~2次),并在24~72小时控制症状,疗程1周左右。对于有胃肠道禁忌及不耐受非选择性COX抑制剂的患者可选用COX-2抑制剂NSAIDs。使用过程中需监测肾功能,严重慢性肾脏病(G4~5期)未透析患者不建议使用。
3.糖皮质激素
主要用于严重的急性痛风发作伴有较重全身症状,且秋水仙碱或NSAIDs治疗无效的患者。口服剂量泼尼松0.5mg/kg,连续用药5~10天停药。急性痛风累及一个或两个大关节可关节内给药,并可与口服糖皮质激素、NSAIDs或秋水仙碱联合应用。一般关节腔内注射糖皮质激素1年不超过4次。全身应用糖皮质激素者应注意预防和治疗高血压、糖尿病、水钠潴留、感染等。
4.IL-1阻断剂
研究表明阻断IL-1在急性痛风治疗中获得很好疗效。IL-1阻断剂包括阿那白滞素(anakinra)、利纳西普(rilonacept)、卡那单抗(canakinumab)。
(三)慢性期及间歇期治疗
慢性痛风治疗以长期血尿酸达标治疗为目标,同时对痛风石及可能并发的肾脏疾病等合并症进行治疗,必要时对痛风石进行外科手术处理以提高患者的生活质量。
1.降血尿酸药物的选择
(1)抑制尿酸生成药物:
该类药物通过抑制黄嘌呤氧化酶,减少尿酸合成,包括别嘌醇、非布司他、奥昔嘌醇、托比司他等。①别嘌醇:成人初始剂量50~100mg/d,每2周测血尿酸水平1次,未达标患者每周可递增50~100mg,最大剂量600mg/d。肾功能不全患者起始每天剂量应小于1.5mg×GFR(ml/min),每4周的剂量增加不超过50mg/d,GFR<60ml/min患者推荐剂量为50~100mg/d;GFR<15ml/min或急性肾损伤患者禁用。别嘌醇可引起皮肤过敏反应及肝肾功能损伤,严重者可发生致死性剥脱性皮炎等超敏反应综合征,HLA-B∗5801基因阳性、应用噻嗪类利尿剂和肾功能不全是别嘌醇不良反应的危险因素。HLAB∗5801基因在中国(汉族)、韩国、泰国人中阳性率显著高于白种人,推荐在服用别嘌醇治疗前进行该基因筛查。②非布司他:为新型黄嘌呤氧化酶选择性抑制剂,初始剂量40mg/d,2周后血尿酸不达标者,加量至80mg。因其主要通过肝脏清除,在肾功能不全和肾移植患者中具有较高的安全性,轻中度肾功能不全患者无须调整剂量,重度肾功能不全患者可谨慎使用。非布司他40mg/d降尿酸水平与别嘌醇300mg/d相当,但其导致肝功能异常的不良反应较少。有报道非布司他可能与增加心血管不良事件相关,因此在心血管高风险患者中需谨慎使用。
(2)促尿酸排泄药物:
通过抑制肾脏重吸收尿酸而促进尿酸排泄,降低血尿酸,主要包括苯溴马隆。常用剂量50mg/d,严重肾功能不全(GFR<20ml/min)或肾结石患者禁用。服用时需碱化尿液,将尿液pH调整至6.2~6.9,保持尿量1 500~2 000ml/d。少数患者可有胃肠不适、腹泻和皮疹等,罕见肝功能损害。
(3)新型药物:
尿酸酶制剂可将尿酸分解为可溶性产物排出。包括拉布立酶(rasburicase)和普瑞凯希(pegloticase),适用于放化疗所致高尿酸血症和难治性痛风。雷西纳德(lesinurad)通过抑制URAT1和OAT4尿酸转运子发挥疗效,用于单一足量使用黄嘌呤氧化酶抑制剂仍不能达标的联合治疗。
(4)其他:
氯沙坦、氨氯地平、非诺贝特和阿托伐他汀均具有较弱的降尿酸作用,在需要降压、降脂治疗的患者中可优先选用。
2.痛风石治疗
(1)药物治疗:
当血尿酸水平维持在低于300μmol/L(5mg/dl)时,痛风石会逐渐被溶解,同时需要预防关节及肾损害的发生。
(2)手术治疗:
痛风石手术治疗的目的是解除痛风石对关节、组织和神经的压迫及其可能造成的进一步损害或去除破溃后长期不能愈合的痛风石,另外也适用于痛风石过大、影响外观而积极要求手术的患者。手术去除痛风石可有利于提高患者的生活质量并改善其关节功能。
(四)降尿酸药物治疗初期急性痛风性关节炎的预防
在开始进行降尿酸药物治疗初期,因为血尿酸水平的波动,易诱发急性痛风性关节炎的发作,因此初始降尿酸治疗的时候,应合并使用预防痛风发作的药物。推荐口服小剂量秋水仙碱0.5mg/次,每天1~2次,肌酐清除率低于50ml/min时剂量减半。小剂量NSAIDs也可以作为一线预防药物。当患者对秋水仙碱和小剂量NSAIDs不能耐受或者有禁忌或者疗效不佳时,也可使用小剂量泼尼松或泼尼松龙(≤10mg/d),但是风险/获益仍需观察。预防性用药的疗程为:①持续6个月;②体格检查未发现痛风石者,血尿酸达到目标值后3个月;或者③之前体格检查发现的痛风石溶解者,血尿酸达到目标值后6个月。积极治疗高血压、高脂血症、糖尿病、肾病等高尿酸伴随疾病。
(五)药物降尿酸治疗原则及目标
2017年《中国高尿酸血症相关疾病诊疗多学科专家共识》提出了药物降尿酸治疗原则及目标(表2)。
表2 《中国高尿酸血症相关疾病诊疗多学科专家共识》中药物降尿酸治疗原则及目标














