英文名称 :disseminated intravascular coagulation
弥散性血管内凝血(disseminated intravascular coagulation,DIC)是一种在严重原发病基础之上,以机体广泛的微血栓形成,伴继发性纤维蛋白溶解亢进为特征的获得性全身性血栓-出血综合征。由于血管内皮细胞损伤,血小板活化,凝血反应启动,从而导致弥散于血管内,特别是毛细血管内的微血栓形成。在这一过程中,血小板和凝血因子因大量消耗而减少,继发性纤溶亢进又导致凝血因子大量降解,产生具有抗凝血活性的纤维蛋白(原)降解产物,从而引起多脏器栓塞和功能衰竭,广泛严重的全身出血,微血管病性溶血性贫血。大多数DIC起病急骤,病情复杂,发展迅猛,诊断困难,预后凶险,如不及时识别处理,常危及患者生命。
2001年,国际血栓与止血学会(International society on thrombosis and hemostasis,ISTH)所设立的科学标准化委员会(SCC)对DIC的定义:DIC是指不同的病因导致局部损害而出现的以血管内凝血为特征的一种继发性综合征,它既可由微血管体系受损而致,又可导致微血管体系损伤,严重者可导致多器官功能衰竭。
(一)病因
1.严重感染性疾病
包括细菌、病毒、真菌、螺旋体及原虫感染等。革兰阴性杆菌最为常见,如脑膜炎双球菌、大肠杆菌、铜绿假单胞菌等;某些革兰阳性菌如金黄色葡萄球菌;偶有结核菌的报道。病毒感染包括出血热病毒、肝炎病毒以及风疹和麻疹病毒等。立克次体、疟原虫、钩端螺旋体和组织胞浆菌等病原体感染也是DIC的病因。
2.恶性肿瘤
多种造血系统肿瘤如急慢性白血病、淋巴瘤、噬血细胞性淋巴组织细胞增生症等;其他实体瘤以肺癌、胰腺癌、前列腺癌、肝癌多见,且广泛转移者更易诱发DIC。
3.病理产科
为急性DIC常见病因,包括妊娠高血压综合征、羊水栓塞、胎盘前置、胎盘早剥、死胎滞留及感染性流产等。
4.外科大手术及严重创伤
特别是涉及富含组织因子的器官如肺、前列腺、胰腺、肾上腺、颅脑手术,联合器官移植及严重创伤如多发性骨折、挤压伤综合征、严重烧伤等,均可诱发DIC。
5.内科与儿科疾病
各种原因所致休克;恶性高血压;严重缺氧;重症肝病及急性胰腺炎;急性肾小管坏死及肾病综合征;溶血性贫血;糖尿病酮症酸中毒和系统性红斑狼疮;动脉瘤和Kasabach-Merritt综合征(巨大海绵状血管瘤)、主动脉和其他大血管缩窄、Takayasu动脉炎;大的人造动脉移植物、发绀型先天性心脏病等。
6.医源性因素
包括药物、手术等医疗操作;肿瘤放射治疗和化学治疗;溶血性输血反应;细菌污染性输入;严重输液反应;中药或大量非等渗性液体输入所致溶血等。
(二)诱因
1.休克
休克为DIC之表现,亦是DIC的发病诱因,主要原因包括:①血流动力学的紊乱,血流缓慢。②多种生物介质活化血小板,激活凝血过程。③组织细胞的缺氧坏死,引起组织释放。④合并代谢性酸中毒。⑤血管通透性增加,血浆外渗,引起血液浓缩及黏滞度增高。
2.酸中毒
败血症合并酸中毒,DIC发生率增加3~4倍。酸中毒诱发DIC机制:①血液凝固性升高。②血小板聚集性增强。③酸性代谢产物对内皮细胞损伤。
3.单核-巨噬系统功能受抑
严重肝病、脾切除术后、肾上腺皮质激素大量应用可封闭单核-巨噬细胞功能,降低其清除已激活凝血因子的能力。
4.缺氧
组织坏死细胞溶解,内皮细胞损伤,组织因子表达释放。
5.妊娠
妊娠期多种凝血因子水平增高如高纤维蛋白原血症、血小板活性增强、纤溶活性减低、血流动力学异常均影响DIC发生。
(一)微血管体系损伤
1.血管壁损伤
在缺血、缺氧、内毒素、抗原抗体复合物、酸中毒等作用下,血管内皮细胞发生轻度损伤,包括:vWF合成释放增加;PAF释放;合成FⅤ、HMWK,表达TF;合成分泌PAI。或发生重度损伤血管壁结构破坏,包括:血小板黏附于胶原;伴随血小板黏附聚集出现血小板释放反应;TF合成和活性增加;抗凝蛋白含量及活性下降。
2.血小板活化
包括血小板聚集形成血小板血栓;刺激花生四烯酸代谢与TXA2生成;活化的血小板释放PF3促进凝血;ADP和5-HT释放加速诱导血小板聚集及缩血管作用。
3.凝血途径的激活
凝血途径的激活是DIC发病机制中最重要的一环。组织损伤、内毒素血症、感染等可使组织因子及其类似物释放入血而启动外源性凝血过程,抑制TF/Ⅶa可完全阻断内毒素诱导的凝血过程。血管内皮受损,因子Ⅻ和内皮下胶原组织发生接触激活而启动内源性凝血过程,细菌内毒素、血浆中游离饱和脂肪酸、抗原抗体复合物等可直接激活因子Ⅻ。
4.抗凝系统受损
AT是最主要的凝血抑制物,其血浆水平下降,一方面由于激活的中性粒细胞释放弹性蛋白酶的水解作用,另一方面则由于AT的生成受到干扰;PC系统维持血液循环中抗凝系统稳定的能力下降;DIC患者存在获得性TFPI的不足或功能缺陷。
5.纤维蛋白溶解系统功能紊乱
DIC早期凝血系统被激活,而由于血管内皮细胞持续高表达PAI-1,同时缺氧使t-PA合成减少,PAI-1释放增加导致纤溶系统则极度受抑;晚期DIC可产生继发性纤溶亢进。
(二)发病机制
DIC的发病机制非常复杂,但以凝血酶生成为中心关键环节。TF在DIC凝血反应启动中起着关键作用,同时,细胞因子也在DIC发病中发挥作用;免疫性血栓形成(immunothrombosis)失衡通过TF启动了凝血途径,参与了DIC的发病。
1.TF在DIC发病中的主导作用
外科大手术、创伤、产科意外导致TF直接释放入血;细菌感染、内毒素血症、抗原抗体复合物、炎症因子激活机体单核巨噬细胞和血管内皮细胞以跨膜蛋白形式表达TF,启动外源性凝血;内皮细胞损伤后,内皮下胶原暴露,Ⅻ因子启动内源性凝血过程;抗凝血酶系统、PC系统、TF通路抑制剂系统的缺陷共同作用导致凝血功能失衡,凝血酶过度产生,导致广泛的微血栓形成。同时,凝血过程消耗大量的凝血因子和血小板,激活纤维蛋白溶解系统,进一步发生消耗性低凝和继发性纤溶亢进从而引起微血栓形成、广泛出血、休克和微循环障碍等一系列临床表现。
2.炎症因子在发病中的作用
多种细胞因子可以调节血管内皮细胞和单核巨噬细胞的TF表达:TNF、IL-1α、IL-1β、IL-6、IL-8、MCP-1可以上调 TF 表达;TGF-β、IL-4、IL-10、IL-13可以抑制多种因素介导的TF表达增加。细胞因子对PC和PS的作用可以解释DIC病理过程中抗凝系统的缺陷,TNF和IL-1可以降低培养的内皮细胞凝血酶调节蛋白(TM)的活性及基因的表达;TNF也可降低内皮细胞的内皮细胞PC受体(EPCR)的表达及信号传导;IL-1β可以促进EPCR由内皮细胞上脱落、抑制PC的活化;TNF和IL-1可以降低多种组织PC的表达而影响凝血过程,TNF和IL-1亦影响纤溶系统。
3.免疫性血栓形成失衡
外伤后,血液凝固防止血液丢失的同时,也使得外来病原体局限化,以此发挥防御功能,此为免疫性血栓形成。这种作用失去平衡则可导致病理性血栓形成。生物病原体相关分子模式(PAMPs)和损害相关分子模式(DAMPs)与DIC的发生和进展存在密切关系。
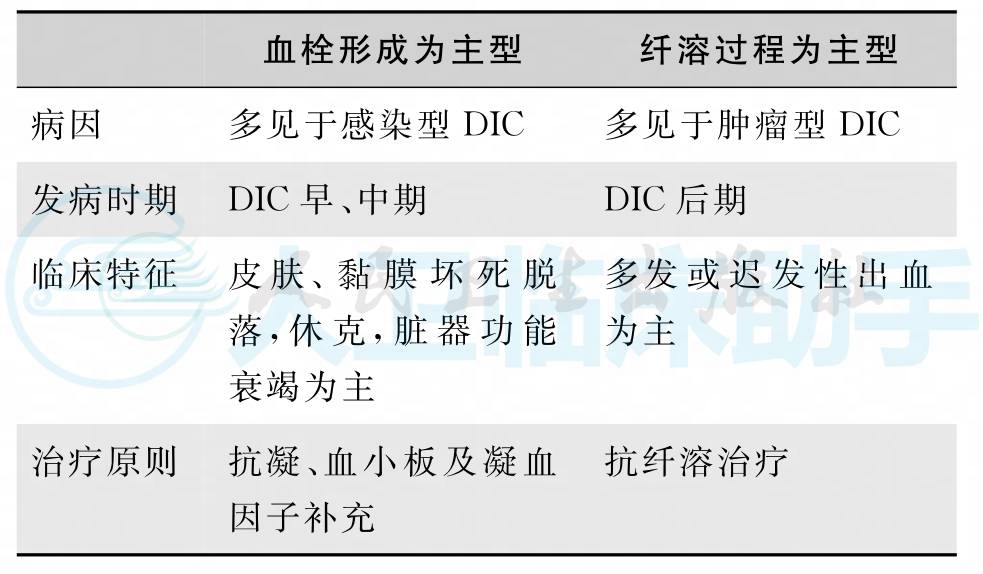
1.根据患者病理过程,可以分为血栓形成为主型和纤溶过程为主型(表1)。
表1 血栓形成为主型与纤溶过程为主型的DIC主要特点
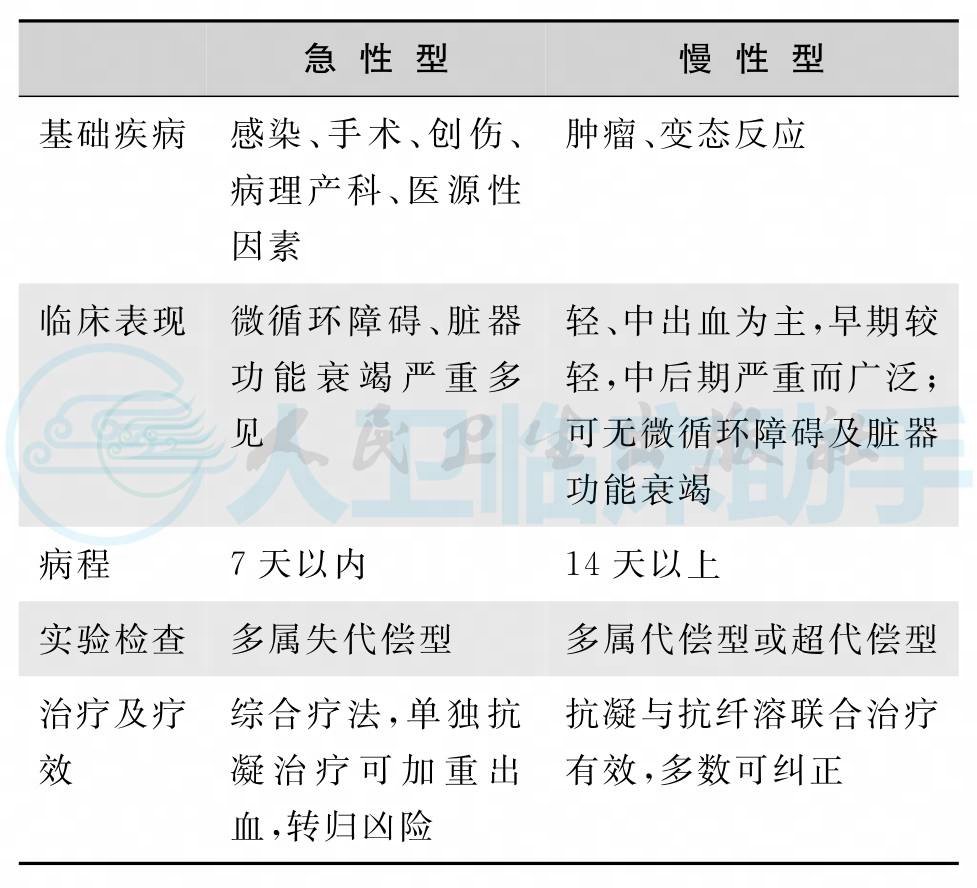
2.根据临床经过分为急性型和慢性型(表1)。
表2 急性型与慢性型DIC的不同特点
3.根据患者内环境调节功能紊乱的情况,DIC可分为代偿性DIC和失代偿性DIC。ISTH/SSC将DIC分为两型,显性DIC与非显性DIC,前者包含了既往分类命名的急性和失代偿型DIC,后者包含了慢性和代偿性DIC及DIC前期。
4.临床分期DIC在临床上分4期,即临床前期、早期、中期及后期。①临床前期亦称前DIC(pre-DIC),指在基础病因下,体内凝血纤溶系统发生一系列变化,但尚未出现典型DIC症状及体征,或尚未达到DIC确诊标准的一种亚临床状态。此期特点为血液呈高凝状态,血小板的活化、凝血过程已经开始但尚无广泛的微血栓的形成,纤溶过程尚未或刚刚启动,血小板、凝血因子的消耗均不明显。此时如能及时识别,对DIC的防治有重要意义。②早期DIC,属于病理过程中的初发性高凝期。③中期DIC,属于病理过程中的消耗性低凝期。④后期DIC,属于病理过程中的继发性纤溶亢进期。
(一)微血栓形成
是DIC最本质的病理变化。血栓成分早期为血小板血栓,随后大量的纤维蛋白沉积形成DIC的主要类型血栓,此后红细胞被包绕形成混合血栓。微血栓的发生部位广泛,以肺、心、脑、肾最为多见,并引起相应的功能改变。DIC微血栓形成的主要原因包括:①血小板活化、聚集形成血小板血栓;②酰键式纤维蛋白聚体形成;③内毒素、缺氧、酸中毒致内皮细胞脱落,形成小块堵塞血管;④可溶性纤维蛋白单体复合物(SFMC)在PF4及粒细胞释放的某些蛋白作用下沉积于微循环。
(二)凝血障碍
是DIC最常见的病理变化。可分为三个阶段:①初发性高凝期:为DIC早期改变,以血小板活化、黏附聚集并释放大量血小板因子、凝血酶及纤维蛋白大量形成为特征。②消耗性低凝期:以血小板、纤维蛋白原、凝血酶原及其他因子因广泛微血栓形成而大量消耗,从而以血栓形成过程减弱为特征。③继发性纤溶亢进期,以凝血过程中因子Ⅻa激活激肽释放酶,进而激活纤溶酶原,微血栓刺激血管内皮细胞释放t-PA使纤溶系统激活而实现,临床上以广泛再发性出血倾向为特征。
(三)微循环衰竭
微循环衰竭与DIC互为诱因,是DIC最常见的后果。DIC休克机制如下:①因子Ⅻa激活激肽和补体系统。激肽、缓激肽及由此诱生的EDRF、PGI2及某些补体碎片(C3a、C5a等)使微动脉及毛细血管前括约肌舒张,外周阻力显著下降,导致低血压;②PAF产生,导致血小板活化及释放反应,参与休克的发生;③凝血纤溶产物:大量纤维蛋白肽A(FPA)及肽B(FPB)可引起微静脉及小静脉收缩;FDP引起血管舒张,毛细血管通透性升高,血浆外渗,导致休克的发生。
(四)微血管病性溶血
①缺氧与酸中毒使红细胞可塑变形能力降低;②微血栓形成,可塑性降低的红细胞在通过纤维蛋白网时受到挤压而破碎;③败血症DIC时,内毒素与纤溶碎片D激活补体系统,引起白细胞的趋化反应,产生大量自由基,使红细胞代谢及结构发生改变,导致溶血。
DIC实验室检查主要针对其病理过程中的血管壁(血管内皮细胞为主)、血小板数量及质量、凝血和抗凝系统及纤溶的变化进行检测,这对DIC的诊治有至关重要的意义。由于DIC表现缺乏特异性,常与基础疾病的表现重叠,多数DIC的判断需有实验指标的支持;DIC的多种检查项目不具备高度特异性,检查结果需密切结合临床综合分析,动态观察十分重要;鉴于DIC的危重性,对实验室检查要求简单实用,先易后难,超过90%的患者可通过血小板计数、活化的部分凝血活酶时间(APTT)和凝血酶原时间(PT)、纤维蛋白原(FIB)定量、3P试验及D-二聚体确诊。
(一)血管内皮细胞的检验
1.血浆内皮素-1(ET-1)测定
ET-1是血管内皮细胞损伤的分子标志物之一,正常参考值<5ng/L,其参与DIC的发病和发展过程,并可能与预后有关。
2.血管性血友病抗原(vWF:Ag)测定
采用免疫火箭电泳法,参考值(94.1±32.5)%,因检测耗时不适于急诊应用。
3.血浆凝血酶调节蛋白(TM)活性测定
采用发色底物法,参考值(100±13)%,敏感度高,可用于前DIC诊断,DIC好转时TM迅速下降,有助于疗效判断。
(二)血小板检查
1.血小板计数
血小板数目减少是DIC中最常见而重要的实验异常,若血小板计数正常,诊断难以成立。动态观察血小板进行性减少更有价值。
2.血小板活化的分子标志物改变
β-TG、PF4存在于血小板颗粒中,是血小板特有的蛋白质,可作为血小板体内活化的指标,急性DIC时增高尤为显著,对慢性或代偿性DIC诊断意义更大;PF4可与血浆游离肝素结合,DIC时血栓形成导致血浆肝素样物质减少,因此PF4升高可作为广泛血小板聚集活化的指标;P选择素是血小板α颗粒膜外显糖蛋白,其水平的变化可反映血小板活化的程度;TXB2是花生四烯酸代谢启动的分子标志物,在急性DIC的早、中期其水平显著升高,后期由于血小板数量减少,逐渐下降至正常,在慢性或代偿性DIC,TXB2也有较大的诊断意义。
(三)血浆凝血因子的检查
1.APTT和PT
分别反映内、外源性凝血过程的改变。DIC时由于凝血因子的广泛消耗,APTT和PT可有不同程度的延长,两者同时延长诊断意义更大。
2.纤维蛋白原(FIB)
DIC时纤维蛋白原减少甚为多见,严重者可呈乏纤维蛋白原血症状态,但是由于纤维蛋白原在体内代谢快、代偿能力强且为急性时相反应蛋白,因此在慢性、亚急性DIC,甚至急性DIC早期纤维蛋白原可正常,甚至升高,所以观察纤维蛋白原水平动态变化更有意义。
3.组织因子
TF是凝血反应(特别是病理性)的始动因子,鉴于TF的可诱导性表达,因此对评估前DIC、早期DIC尤为重要。
4.因子Ⅴ、Ⅶ
因子Ⅴ是组成凝血活酶所必需的消耗性因子,因子Ⅶ是外源性凝血途径中必需的非消耗性因子,两者均产生于肝脏。DIC时因子Ⅴ呈消耗性减少,因子Ⅶ理论上并不减少,以此与肝病两者合成障碍性减少相鉴别。
5.因子Ⅷ
DIC时Ⅷ:C减低发生率为60%~80%,早期Ⅷ:C可有暂时性升高,中后期因子Ⅷ虽有消耗,但Ⅷ:C仍在正常低限;在慢性DIC,因生成加速也罕见Ⅷ:C下降。
6.因子Ⅹ
组成凝血活酶的重要成分,DIC时呈消耗性减少,其异常敏感度明显高于PT、APTT和纤维蛋白原等指标。
7.分子标志物
血浆凝血酶原片段1+2(F1+2)是凝血酶原转变为凝血酶过程中最早释放出来的片段,它直接反映凝血酶生成的总量;FPA反映凝血酶水解纤维蛋白原的活性。两者均有助于前DIC、早期DIC的诊断。
(四)抗凝物质检测
1.血浆抗凝血酶(AT)活性测定
DIC时AT与凝血酶结合而呈消耗性减少,敏感度达90%,对前DIC及早期DIC诊断意义更大。但AT由肝脏生成,故对重症肝病性DIC诊断价值有限。
2.血浆蛋白C(PC)、蛋白S(PS)测定
PC和PS在发病过程中明显下降,其主要原因在于消耗性减少及肝功能受损的生成障碍,但由于其依赖于维生素K合成,因此在维生素K缺乏及肝功能不良患者,PC和PS不宜作为DIC实验诊断指标。
3.血浆组织因子途径抑制物(TFPI)测定
TFPI抑制TF/Ⅶa的活性,DIC时存在TFPI的调控不足。
4.血浆凝血酶-抗凝血酶复合物(TAT)测定
AT-Ⅲ与产生的凝血酶迅速结合形成TAT,从而时使凝血过程减弱,TAT反映凝血酶与抗凝血酶结合形成复合物的量,间接提示凝血酶的生成,是前DIC及早期DIC敏感指标之一。
(五)纤溶活性检查
1.血浆鱼精蛋白副凝固试验(3P试验)
是临床上常用的SFMC定性试验,它反映凝血和纤溶两个病理过程的存在。DIC血浆中出现的SFMC主要是纤维蛋白单体与FDP中的碎片X所组成的复合物,鱼精蛋白可使此复合物解离,纤维蛋白单体聚合形成纤维蛋白丝胶状物,此称为副凝固现象。本试验阳性,主要表明血液中有SFMC存在;而血清鱼精蛋白副凝固试验阳性,才表明有FDP增多。碎片X是一种分子量较大的早期降解产物,在DIC早期,纤溶系统尚未启动,血浆内无足够的FDP和SFMC产生;而晚期,由于继发性纤溶亢进,体内无过量的纤维蛋白单体存在,碎片X极少,而分子量较小的晚期降解产物Y、D、E增多,此类小碎片不能与纤维蛋白单体形成SFMC,因此在这两种情况下,3P试验可呈阴性结果。此外血液中医源性肝素增多,可干扰鱼精蛋白的作用,导致3P试验假阴性。在手术、创伤的情况下,血液中凝血酶及纤溶酶水平增加,可导致3P试验假阳性。
2.优球蛋白溶解时间(ELT)
血浆优球蛋白组分中含有Fg、PLG和PA,但不含纤溶酶原抑制物。在pH为4.5时可使优球蛋白沉淀,将此沉淀溶解于缓冲液中,再加Ca2+或凝血酶使其凝固;在37℃条件下观察凝块完全溶解所需要的时间。参考值为120分钟以上。DIC时,如纤溶亢进,则ELT缩短;反之,则提示纤溶活性降低。
3P试验和ELT检查历史悠久,但两者共同的缺点在于敏感度低,比如,在典型的DIC患者中,ELT的阳性率仅在20%~30%,在三级医院中已经逐步被其他检查所替代,在基层医院中仍有其价值。
3.FDP
反映血液中纤维蛋白(原)在纤溶酶作用下生成X(x)、Y(y)、D(d)、E(e)碎片的含量,DIC时阳性率85%~100%,诊断有效率75%,血清FDP>20mg/L,对继发性纤溶有诊断价值。
4.D-二聚体
D-二聚体增高表明体内有纤维蛋白的形成及纤溶的发生,其敏感度及特异度均较高,被认为是目前诊断DIC有价值的指标之一。
5.血浆纤溶酶原(PLG)活性
血浆纤溶酶原活性降低,表明其被消耗而提示纤溶活性增强。
6.血浆纤溶酶与抗纤溶酶复合物(PAP)
在DIC的早期PAP可正常或轻度下降,而在继发性纤溶亢进期,PAP明显上升。
7.血浆纤维蛋白肽Bβ 1-42和Bβ 15-42测定
前者为纤维蛋白原的降解产物,后者是纤维蛋白的降解产物,两者升高表明纤溶酶的激活,是DIC的敏感指标之一。
8.可溶性纤维蛋白单体复合物(SFMC)定量
反映凝血和纤溶两个病理过程的存在,对DIC的早期诊断极有价值,与3P试验相比,本试验更直接、敏感、特异。
(六)中性粒细胞细胞外捕获网(neutrophil extracellular traps,NETs)
病原体或炎症通过PAMPs和/或DAMPs活化中性粒细胞释放NETs,血浆NETs增高。组蛋白H2A、H2B、H3和H4是主要的染色质组成成分,DIC时这些组蛋白的血浆水平增高。
(七)评价
DIC实验室检查项目繁多,国外DIC研究机构通过荟萃分析5个独立的临床研究得出结论,诊断项目出现异常的概率由高至低分别为血小板减少、纤维蛋白降解产物增加、PT延长、APTT延长、纤维蛋白原降低。
血小板减少或进行性下降是诊断DIC敏感非特异的指标。FDP和D-二聚体是继发性纤维蛋白溶解亢进的指标,前者是纤维蛋白原和交联纤维蛋白单体的降解产物,而后者仅为交联纤维蛋白单体的降解产物,D-二聚体对诊断DIC更有特异性,需动态观察。SFMC产生于血管内,外界影响小,其诊断DIC敏感性几乎达100%,但特异性低。
APTT和PT在50%以上的患者疾病的某一阶段存在着延长,亦即半数DIC患者PT和APTT正常或缩短,这是由于活化的凝血因子(如凝血酶或因子Ⅹa)所致,因此PT和APTT正常不能排除凝血系统的激活,必须动态监测。
纤维蛋白原属于急性时相反应蛋白,尽管在DIC时持续消耗,但其血浆水平仍可在正常范围,临床上,典型DIC病例中,纤维蛋白原降低的敏感性不足30%,对DIC诊断帮助不大。有关细胞游离DNA及其结合蛋白测定尚处于研究阶段,对于肿瘤和创伤相关的DIC诊断意义较大,具有良好应用前景。DIC常用实验室指标及其评价见扩展阅读16-7-13-1。

扩展阅读16-7-13-1 DIC常用实验室指标及其评价
DIC的主要治疗措施包括:去除病因和诱因;根据临床分期,干预DIC病理生理过程,阻断血管内凝血过程,恢复正常的血小板和血浆凝血因子水平,抗纤溶治疗;对症支持治疗。
(一)治疗原发病、消除诱因
积极控制感染,抗生素应足量早期联合应用,选择敏感杀菌药物。对于革兰氏阴性菌感染,应考虑到抗生素诱导的内毒素释放效应,应尽可能使用低诱导内毒素释放的抗生素。积极抢救休克,改善微循环,纠正酸碱失衡、电解质紊乱及缺氧,改善心肌代谢、增强心肌收缩力。
(二)根据临床分期进行分层治疗
1.DIC早期(弥散性微血栓形成期)
抗凝治疗是阻断DIC病理过程的最重要措施之一,目的在于抑制广泛性微血栓形成,防止血小板和凝血因子的进一步消耗。
(1)普通肝素
肝素治疗DIC的机制主要包括:①抑制凝血因子Ⅻa、Ⅺa、Ⅸa活性;②抑制因子Ⅹa对凝血酶原的激活,在肝素辅因子(HC-2)存在条件下肝素结合AT后可与凝血酶形成复合物,降低凝血酶活性;③肝素与血管内膜结合使内皮细胞释放t-PA,促进纤溶活性;④通过抗血小板聚集作用,使凝血活性受抑;⑤肝素诱导TFPI活性,抵抗TF作用。
肝素的剂量选择:多数学者认为,①首剂50~100U/kg,一般5000U,静脉滴注,每6~8小时半量重复,皮下注射,以APTT调整用量,根据病情连续使用3~5天,适用于急性DIC患者;②50~100U/kg使用,或每日总量200U/kg,分3~4次给药,皮下注射,每疗程8天,适用于慢性DIC患者;③每日总量10~15U/(kg·h),持续静脉滴注可逆转DIC的病理过程而无严重出血危险,无须血液学监测,适用于急性DIC患者;④每日总量50U/kg,小剂量应用,分3~4次给药,皮下注射,连续5~8天,适用于DIC预防。
肝素治疗时血液学监护:①凝血时间(CT)(试管法):CT正常在8~12分,肝素的有效治疗应控制CT在正常高限的2倍左右,即25分钟;超过30分,意味肝素过量;低于15分,则肝素用量不足。②APTT:控制APTT较正常延长1.5~2.5倍意味用量适宜。
肝素的剂量调整:①根据DIC的临床类型和病期,急性型、重症DIC早期,肝素用量适当增加;②酸中毒时,肝素灭活快,用量宜偏大;③肝素在肝脏代谢,50%由肾排出,肝肾功能障碍时,用量宜小;④血小板重度减少,凝血因子明显低下时,应减少肝素用量;⑤血浆AT减少时,肝素用量增加,但应提高AT水平。
肝素治疗有效指标及停药指征如下。提示肝素治疗有效:①出血停止或逐步减轻;②休克改善或纠正;③尿量增加;④PT比治疗前缩短5秒以上,纤维蛋白原及血小板计数不再进一步下降或有不同程度的回升;⑤其他凝血现象检查逐步改善。停药指征:①诱发DIC的原发病已控制或缓解。②临床上病情改善明显,如停止出血、休克纠正、有关脏器恢复正常。③PT缩短到接近正常,纤维蛋白原升到1.0~1.5g/L以上,血小板数量逐渐回升或至少不再下降。④APTT超过肝素治疗前2.5倍以上;或PT超过30秒;凝血酶时间超过50秒;APTT延长接近100秒。⑤出现肝素过量的表现。
肝素无效的原因:①病因未去除;②血小板因素:血小板大量破坏,PF4大量释放于血液循环,拮抗肝素的作用;③AT减少:因肝素的抗凝作用是通过AT发挥的,故此造成肝素作用减弱。
(2)低分子量肝素(LMWH)
DIC凝血的启动几乎均首先形成Ⅹa,再形成凝血酶。一般认为抗凝治疗中,抗Ⅹa活性与其抗凝能力密切相关,而抗凝血酶活性则与用药后出血并发症有关。鉴于LMWH抗Ⅹa作用远大于抗凝血酶活性(4∶1),而普通肝素为1∶1,因此LMWH抗DIC疗效优于普通肝素。
LMWH用法:①预防:每日总量50~100U/kg,分2次皮下注射,疗程5~10天或更长。②治疗:每日总量200U/kg,分2次皮下注射,疗程5~8天。为预防治疗相关性出血,可以行抗Ⅹa活性试验检测,使其维持在0.4~0.7IU/ml的最佳治疗剂量;也可用APTT监测,标准同普通肝素。
2.DIC中期(消耗性低凝血期)
此期微血栓仍在形成,应抗凝治疗,但因凝血因子进行性消耗,所以应充分抗凝基础上,进行血小板和凝血因子的替代治疗,适当输注新鲜全血、新鲜血浆、纤维蛋白原、血小板悬液、凝血酶原复合物浓缩剂。
新鲜血浆所含凝血因子和新鲜全血相似,并可减少输入液体总量,有助于纠正休克、改善微循环。
纤维蛋白原适用于急性DIC出现低纤维蛋白原血症或出血倾向严重者,首剂2~4g静脉输注,以后根据血浆纤维蛋白原水平而补充,使血浆纤维蛋白原达到1.0g/L以上为宜。纤维蛋白原血浆半衰期96~144小时,可根据病情每周使用2~3次。
血小板悬液适用于当血小板≤20×109/L,或<50×109/L伴活动性出血时输注单采血小板。
凝血酶原复合物浓缩剂(PCC):剂量为20~40U/kg,每次以5%葡萄糖液50ml稀释,要求在30分钟内静脉滴注完毕,每日1~2次。PCC缺少因子Ⅴ,而且有可能加重凝血功能紊乱,发生血栓形成,因此应谨慎使用,密切观察,同时应注意到输注PCC 6个小时内应避免使用抗纤溶药物。
3.DIC晚期(继发性纤溶亢进期)
此期继发性纤溶为主要矛盾,若临床确认纤溶亢进是出血的首要原因,则可适量应用抗纤溶药物。对于有出血倾向而没有排除DIC,或怀疑为DIC的患者,不宜将抗纤维蛋白溶解制剂作为首选的止血药,以免诱发或加重DIC。
常用的抗纤溶药物包括:①6-氨基己酸(EACA),常用剂量每次4~10g,以5%葡萄糖或生理盐水100ml稀释,静脉输注,小剂量每日5g以下,中等剂量每日10g以下,大剂量每日可达20g,本品快速静脉注射可引起血压下降,休克者慎用。②氨甲苯酸(对羧基苄胺,PAMBA),每次200~500mg加入葡萄糖液20ml中,静脉注射,每日1~2次。③氨甲环酸,用量为 EACA的1/10,小剂量每日0.5g以下,中等剂量每日1.0g以下,大剂量每日可达2.0g。④抑肽酶:抑肽酶兼有抑制纤溶酶和因子Ⅹ等激活作用,每日8万~10万U,分2~3次使用,或首剂5万U,随后每小时1万U,缓慢静脉注射。
(三)其他治疗
1.抗凝血酶A
T是一种重要的凝血抑制物,AT可改善DIC患者实验室参数、减少出血、纠正凝血异常,但不能降低死亡率。因此在欧洲国家和日本对AT使用存在明显分歧:英国指南不推荐,而日本专家共识却强烈推荐。
2.组织因子通路抑制剂
TFPI抑制TF的活性,在败血症患者中开展的TFPIⅡ期临床中显示了预期的治疗效益,但在Ⅲ期临床中,患者存活率未显示有显著改善。
3.活化蛋白C
PC系统在DIC发病中起了重要作用,补充APC可能对DIC治疗有益。













