英文名称 :acute leukemia
目前临床并行使用法美英(FAB)分型和世界卫生组织(WHO)分型。FAB分型是基于对病人骨髓涂片细胞形态学和组织化学染色的观察与计数,是最基本的诊断学依据。WHO分型是整合了白血病细胞形态学(morphology)、免疫学(immunology)、细胞遗传学(cytogenetics)和分子生物学特征(molecular biology)(简称MICM)的新分型系统,可为病人治疗方案的选择及预后判断提供帮助。
(一)AL的FAB分型
1.AML的FAB分型
M0(急性髓细胞白血病微分化型,minimally differentiated AML):骨髓原始细胞>30%,无嗜天青颗粒及Auer小体,核仁明显,光镜下髓过氧化物酶(MPO)及苏丹黑B阳性细胞<3%;在电镜下,MPO阳性;CD33或CD13等髓系抗原可呈阳性,淋系抗原通常为阴性。血小板抗原阴性。
M1(急性粒细胞白血病未分化型,AML without maturation):原粒细胞(Ⅰ型+Ⅱ型,原粒细胞质中无颗粒为Ⅰ型,出现少数颗粒为Ⅱ型)占骨髓非红系有核细胞(NEC,指不包括浆细胞、淋巴细胞、组织嗜碱细胞、巨噬细胞及所有红系有核细胞的骨髓有核细胞计数)的90%以上,其中至少3%以上细胞为MPO阳性。
M2(急性粒细胞白血病部分分化型,AML with maturation):原粒细胞占骨髓NEC的30%~89%,其他粒细胞≥10%,单核细胞<20%。
M3(急性早幼粒细胞白血病,acute promyelocytic leukemia,APL):骨髓中以颗粒增多的早幼粒细胞为主,此类细胞在NEC中≥30%。
M4(急性粒-单核细胞白血病,acute myelomonocytic leukemia,AMMoL):骨髓中原始细胞占NEC的30%以上,各阶段粒细胞≥20%,各阶段单核细胞≥20%。
M4Eo(AML with eosinophilia):除上述M4型各特点外,嗜酸性粒细胞在NEC中≥5%。
M5(急性单核细胞白血病,acute monocytic leukemia,AMoL):骨髓NEC中原单核、幼单核≥30%,且原单核、幼单核及单核细胞≥80%。如果原单核细胞≥80%为M5a,<80%为M5b。
M6(红白血病,erythroleukemia,EL):骨髓中幼红细胞≥50%,NEC中原始细胞(Ⅰ型+Ⅱ型)≥30%。
M7(急性巨核细胞白血病,acute megakaryoblastic leukemia,AMeL):骨髓中原始巨核细胞≥30%。血小板抗原阳性,血小板过氧化酶阳性。
2.ALL的FAB分型
L1:原始和幼淋巴细胞以小细胞(直径≤12μm)为主。
L2:原始和幼淋巴细胞以大细胞(直径>12μm)为主。
L3(Burkitt型):原始和幼淋巴细胞以大细胞为主,大小较一致,细胞内有明显空泡,胞质嗜碱性,染色深。
(二)AL的WHO分型
1.AML的WHO分型(2016年)
(1)伴重现性遗传学异常的AML
AML伴t(8;21)(q22;q22.1);RUNX1-RUNX1T1
AML伴inv(16)(p13.1q22)或t(16;16)(p13.1;q22);CBFB-MYH11
APL伴PML-RARA
AML伴t(9;11)(p21.3;q23.3);MLLT3-KMT2A
AML伴t(6;9)(p23;q34.1);DEK-NUP214
AML伴inv(3)(q21.3;q26.2)或t(3;3)(q21.3;q26.2);GATA2,MECOM
AML(原始巨核细胞性)伴t(1;22)(p13.3;q13.3);RBM15-MKL1
暂命名:AML伴BCR-ABL1
AML伴NPM1突变
AML伴CEBPA双等位基因突变
暂命名:AML伴RUNX1突变
(2)AML伴骨髓增生异常相关改变
(3)治疗相关AML
(4)非特殊类型AML(AML,NOS)
AML微分化型
AML未分化型
AML部分分化型
急性粒-单核细胞白血病
急性单核细胞白血病
纯红血病
急性巨核细胞白血病
急性嗜碱性粒细胞白血病
急性全髓增生伴骨髓纤维化
(5)髓系肉瘤
(6)Down综合征相关的髓系增殖
短暂性异常骨髓增殖(TAM)
Down综合征相关的髓系白血病
2.ALL的WHO分型(2016年)
(1)原始B淋巴细胞白血病
1)B-ALL,非特指型(NOS)
2)伴重现性遗传学异常的B-ALL
B-ALL伴t(9;22)(q34.1;q11.2)/BCR-ABL1
B-ALL伴t(v;11q23.3)/KMT2A重排
B-ALL伴t(12;21)(p13.2;q22.1)/ETV6-RUNX1
B-ALL伴超二倍体
B-ALL伴亚二倍体
B-ALL伴t(5;14)(q31.1;q32.3)/IL3-IGH
B-ALL伴t(1;19)(q23;p13.3)/TCF3-PBX1
3)暂命名
B-ALL,BCR-ABL1样
B-ALL伴21号染色体内部扩增(iAMP21)
(2)原始T淋巴细胞白血病
1)暂命名:早期前体T淋巴细胞白血病(ETP-ALL)
2)暂命名:自然杀伤(NK)细胞白血病
1.血象
大多数病人白细胞增多,>10×109/L者称为白细胞增多性白血病。也有白细胞计数正常或减少,低者可<1.0×109/L,称为白细胞不增多性白血病。血涂片分类检查可见数量不等的原始和幼稚细胞,但白细胞不增多型病例血片上很难找到原始细胞。病人常有不同程度的正常细胞性贫血,少数病人血片上红细胞大小不等,可找到幼红细胞。约50%的病人血小板<60×109/L,晚期血小板往往极度减少。
2.骨髓象
是诊断AL的主要依据和必做检查。FAB分型将原始细胞≥骨髓有核细胞(ANC)的30%定义为AL的诊断标准,WHO分型则将这一比例下降至≥20%,并提出原始细胞比例<20%但伴有t(15;17)/PML-RARA,t(8;21)/RUNX1-RUNX1T1,inv(16)或t(16;16)/CBFB-MYH11者亦应诊断为AML。多数AL骨髓象有核细胞显著增生,以原始细胞为主;少数AL骨髓象增生低下,称为低增生性AL。
3.细胞化学
主要用于协助形态鉴别各类白血病。常见白血病的细胞化学反应见表1。
表1 常见AL的细胞化学鉴别

4.免疫学检查
根据白血病细胞表达的系列相关抗原,确定其来源。造血干/祖细胞表达CD34,APL细胞通常表达CD13、CD33和CD117,不表达HLA-DR和CD34,还可表达CD9。其他常用的免疫分型标志见表2。急性混合细胞白血病包括急性双表型(白血病细胞同时表达髓系和淋系抗原)和双克隆(两群来源于各自干细胞的白血病细胞分别表达髓系和淋系抗原)白血病,其髓系和一个淋系积分均>2(表2)。
表2 白血病免疫学积分系统(EGIL,1998)
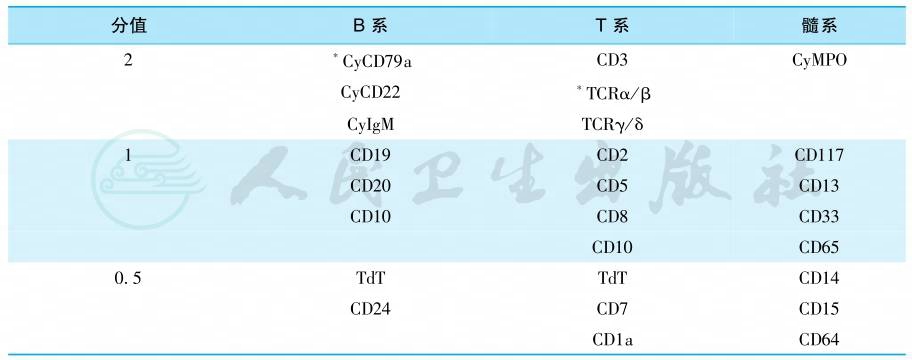
∗注:Cy,胞质内;TCR,T细胞受体
5.细胞遗传学和分子生物学检查
白血病常伴有特异的细胞遗传学(染色体核型)和分子生物学改变(如:融合基因、基因突变)。例如99%的APL有t(15;17)(q22;q12),该易位使15号染色体上的PML(早幼粒白血病基因)与17号染色体上RARA(维A酸受体基因)形成PML-RARA融合基因。这是APL发病及用全反式维A酸及砷剂治疗有效的分子基础。AL常见染色体和分子学异常见表3和表4。
表3 AML常见的染色体和分子学异常的预后意义

表4 ALL常见染色体和分子学异常的检出率
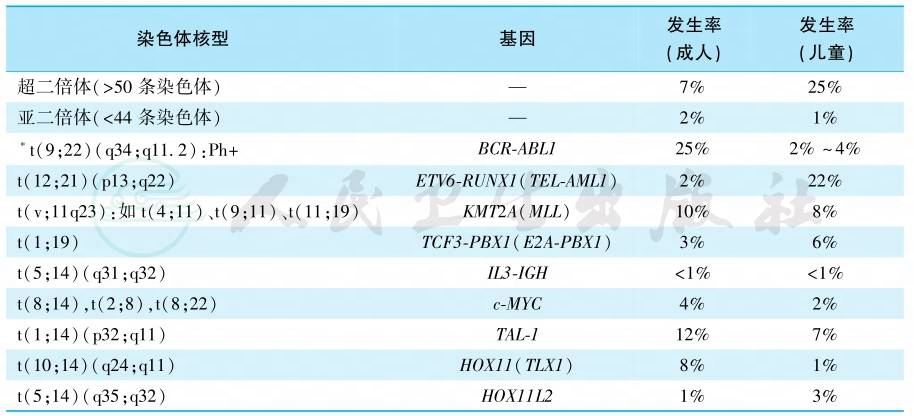
∗注:伴t(9;22)(q34;q11.2)的ALL又称Ph+ALL
6.血液生化检查
血清尿酸浓度增高,特别在化疗期间。尿酸排泄量增加,甚至出现尿酸结晶。病人发生DIC时可出现凝血象异常。血清乳酸脱氢酶(LDH)可增高。
出现CNSL时,脑脊液压力升高,白细胞数增加,蛋白质增多,而糖定量减少。涂片中可找到白血病细胞。
根据病人的MICM结果及临床特点进行预后危险分层,按照患方意愿、经济能力,选择并设计最佳完整、系统的治疗方案。考虑治疗需要及减少病人反复穿刺的痛苦,建议留置深静脉导管。适合行异基因造血干细胞移植(allo-HSCT)者应抽血做HLA配型。
(一)一般治疗
1.紧急处理高白细胞血症
当循环血液中白细胞数>100×109/L,病人可产生白细胞淤滞症(leukostasis),表现为呼吸困难、低氧血症、反应迟钝、言语不清、颅内出血等。病理学显示白血病血栓栓塞与出血并存,高白细胞不仅会增加病人早期死亡率,也增加髓外白血病的发病率和复发率。因此当血中白细胞>100×109/L时,就应紧急使用血细胞分离机,单采清除过高的白细胞(APL一般不推荐),同时给予水化和化疗。可根据白血病类型给予相应方案化疗,也可先用所谓化疗前短期预处理:ALL用地塞米松10mg/m2,静脉注射;AML用羟基脲1.5~2.5g/6h(总量6~10g/d)约36小时,然后进行联合化疗。需预防白血病细胞溶解诱发的高尿酸血症、酸中毒、电解质紊乱、凝血异常等并发症。
2.防治感染
白血病病人常伴有粒细胞减少或缺乏,特别在化疗、放疗后粒细胞缺乏将持续相当长时间,此时病人宜住层流病房或消毒隔离病房。G-CSF可缩短粒细胞缺乏期,用于ALL,老年、强化疗或伴感染的AML。发热应做细菌培养和药敏试验,并迅速进行经验性抗生素治疗。详见本篇第七章。
3.成分输血支持
严重贫血可吸氧、输浓缩红细胞,维持Hb>80g/L,但白细胞淤滞时不宜马上输红细胞,以免进一步增加血黏度。血小板计数过低会引起出血,需输注单采血小板悬液。为防止异体免疫反应所致无效输注和发热反应,输血时可采用白细胞滤器去除成分血中的白细胞。为预防输血相关移植物抗宿主病(TA-GVHD),输血前应将含细胞成分的血液辐照25~30Gy,以灭活其中的淋巴细胞。
4.防治高尿酸血症肾病
由于白血病细胞大量破坏,特别在化疗时更甚,血清和尿中尿酸浓度增高,积聚在肾小管,引起阻塞而发生高尿酸血症肾病。因此应鼓励病人多饮水。最好24小时持续静脉补液,使每小时尿量>150ml/m2并保持碱性尿。在化疗同时给予别嘌醇每次100mg,每日3次,以抑制尿酸合成。少数病人对别嘌醇会出现严重皮肤过敏,应予注意。当病人出现少尿、无尿、肾功能不全时,应按急性肾衰竭处理。
5.维持营养
白血病系严重消耗性疾病,特别是化疗、放疗引起病人消化道黏膜炎及功能紊乱时。应注意补充营养,维持水、电解质平衡,给病人高蛋白、高热量、易消化食物,必要时经静脉补充营养。
(二)抗白血病治疗
抗白血病治疗的第一阶段是诱导缓解治疗,主要方法是联合化疗,目标是使病人迅速获得完全缓解(complete remission,CR)。所谓CR,即白血病的症状和体征消失,外周血无原始细胞,无髓外白血病;骨髓三系造血恢复,原始细胞<5%;外周血中性粒细胞>1.0×109/L,血小板≥100×109/L。理想的CR为初诊时免疫学、细胞遗传学和分子生物学异常标志均消失。
达到CR后进入抗白血病治疗的第二阶段,即缓解后治疗,主要方法为化疗和HSCT。诱导缓解获CR后,体内的白血病细胞由发病时的1010~1012降至108~109,这些残留的白血病细胞称为微小残留病灶(MRD),MRD水平可预测复发,必须定期进行监测。MRD持续阴性的病人有望获长期无病生存(DFS)甚至治愈(DFS持续10年以上)。
1.ALL治疗
经过化疗方案的不断优化,目前儿童ALL的长期DFS已经达到80%以上;青少年ALL宜采用儿童方案治疗。随着支持治疗的加强、多药联合和高剂量化疗方案以及HSCT的应用,成人ALL的CR率可达80%~90%,预后亦有很大改善。ALL治疗方案的选择需要考虑病人年龄、ALL亚型、治疗后的MRD、是否有干细胞供体和靶向治疗药物等多重因素。
(1)诱导缓解治疗
长春新碱(VCR)和泼尼松(P)组成的VP方案是ALL的基本方案。VP方案能使50%的成人ALL获CR,CR期3~8个月。VCR主要毒副作用为末梢神经炎和便秘。VP加蒽环类药物(如柔红霉素,即DNR)组成DVP方案,CR率可提高至70%以上,但需要警惕蒽环类药物的心脏毒性。DVP再加门冬酰胺酶(L-ASP)或培门冬酶(PEG-Asp)即为DVLP方案,是目前ALL常采用的诱导方案。L-ASP或PEG-Asp可提高病人无病生存率(DFS),主要副作用为肝功能损害、胰腺炎、凝血因子及白蛋白合成减少和过敏反应。在DVLP基础上加用其他药物,包括环磷酰胺(CTX)或阿糖胞苷(Ara-C),可提高部分ALL的CR率和DFS。
(2)缓解后治疗
缓解后的治疗一般分强化巩固和维持治疗两个阶段。强化巩固治疗主要有化疗和HSCT两种方式,目前化疗多数采用间歇重复原诱导方案,定期给予其他强化方案的治疗。强化治疗时化疗药物剂量宜大,不同种类要交替轮换使用以避免蓄积毒性,如高剂量甲氨蝶呤(HD MTX)、Ara-C、6-巯基嘌呤(6-MP)和L-ASP。HD MTX的主要副作用为黏膜炎,肝肾功能损害,故在治疗时需要充分水化、碱化和及时亚叶酸钙解救。对于ALL(除成熟B-ALL外),即使经过强烈诱导和巩固治疗,仍必须给予维持治疗。口服6-MP和MTX的同时间断给予VP方案化疗是普遍采用的有效维持治疗方案。如未行allo-HSCT,ALL在缓解后的巩固维持治疗一般需持续2~3年,定期检测MRD并根据ALL亚型决定巩固和维持治疗的强度和时间。成熟B-ALL采用含HD CTX和HD MTX的方案反复短程强化治疗,长期DFS率已由过去不足10%达到现在的50%以上,且缓解期超过1年者复发率很低,故对其进行维持治疗的价值有限。
另外,Ph+ALL诱导缓解化疗可联用酪氨酸激酶抑制剂(TKIs,如伊马替尼或达沙替尼)进行靶向治疗,CR率可提高至90%~95%。TKI推荐持续应用至维持治疗结束。异基因HSCT联合TKIs的治疗也可使病人生存时间及生活质量进一步提高。
(3)中枢神经系统白血病(CNSL)的防治和睾丸白血病的治疗
中枢神经系统和睾丸因存在血脑屏障和血睾屏障,很多化疗药物无法进入,是白血病细胞的“庇护所”。“庇护所”白血病的预防是AL治疗必不可少的环节,对ALL尤为重要。CNSL的预防要贯穿于ALL治疗的整个过程。CNSL的防治措施包括颅脊椎照射、鞘内注射化疗(如MTX、Ara-C、糖皮质激素)和(或)高剂量的全身化疗(如HD MTX、Ara-C)。颅脊椎照射疗效确切,但其不良反应如认知障碍、继发肿瘤、内分泌受损和神经毒性(如白质脑病)限制了应用。现在多采用早期强化全身治疗和鞘内注射化疗预防CNSL的发生,而颅脊椎照射仅作为CNSL发生时的挽救治疗。对于睾丸白血病病人,即使仅有单侧睾丸白血病也要进行双侧照射和全身化疗。
复发指CR后在外周血重新出现白血病细胞或骨髓原始细胞>5%(除外其他原因如巩固化疗后骨髓重建等)或髓外出现白血病细胞浸润,多在CR后两年内发生,以骨髓复发最常见,此时可选择原诱导化疗方案或含HD Ara-C的联合方案或者新药进行再诱导治疗。但ALL一旦复发,无论采用何种化疗方案,总的二次缓解期通常短暂,长期生存率低。靶向CD19的嵌合抗原受体T细胞(CAR-T)治疗可使约90%CD19阳性的复发ALL病人获得CR。髓外复发以CNSL最常见。单纯髓外复发者多能同时检出骨髓MRD,血液学复发会随之出现。因此在进行髓外局部治疗的同时,需行全身化疗。
HSCT对治愈成人ALL至关重要。allo-HSCT可使40%~65%的病人长期存活。主要适应证为:①复发难治ALL;②CR2期ALL;③CR1期高危ALL:如细胞遗传学分析为Ph+染色体、亚二倍体者;MLL基因重排阳性者;WBC≥30×109/L的前B-ALL和WBC≥100×109/L的T-ALL;获CR时间>4~6周;CR后在巩固维持治疗期间MRD持续存在或仍不断升高者。详见本篇第二十章。
2.AML治疗
近年来,由于强化疗、HSCT及有力的支持治疗,60岁以下AML病人的预后有很大改善,30%~50%的AML(非APL)病人可望长期生存。
(1)诱导缓解治疗
①AML(非APL):采用蒽环类药物联合标准剂量Ara-C(即3+7方案)化疗,最常用的是IA方案(I为IDA,即去甲氧柔红霉素)和DA(D为DNR)方案,60岁以下病人的总CR率为50%~80%。在好的支持治疗下,IDA 12mg/(m2•d)的IA方案与DNR 60~90mg/(m2•d)的DA方案均取得较高的CR率。我国学者率先以高三尖杉酯碱(HHT)替代IDA或DNR组成的HA方案诱导治疗AML,CR率为60%~65%。HA与DNR、阿柔比星(Acla)等蒽环类药物联合组成HAD、HAA等方案,可进一步提高CR率。剂量增加的诱导化疗能提高1疗程CR率和缓解质量,但治疗相关毒性亦随之增加。中、大剂量Ara-c联合蒽环类的方案不能提高CR率,但可延长年轻病人的DFS。1疗程获CR者DFS长,2个标准疗程仍未CR者提示存在原发耐药,需换化疗方案或行allo-HSCT。②APL:多采用全反式维A酸(ATRA)+蒽环类药物。ATRA作用于RARA可诱导带有PML-RARA的APL细胞分化成熟,剂量为20~45mg/(m2•d)。砷剂作用于PML,小剂量能诱导APL细胞分化,大剂量能诱导其凋亡。ATRA+蒽环类的基础上加用砷剂(如三氧化二砷,ATO)能缩短达CR时间。低/中危组和不能耐受蒽环类药物者采用ATRA+ATO双诱导。治疗过程中需警惕出现分化综合征(differential syndrome),初诊时白细胞计数较高及治疗后迅速上升者易发生,其机制可能与细胞因子大量释放和黏附分子表达增加有关。临床表现为发热、肌肉骨骼疼痛、呼吸窘迫、肺间质浸润、胸腔积液、心包积液、体重增加、低血压、急性肾衰竭甚至死亡。一旦出现上述任一表现,应给予糖皮质激素治疗,并予吸氧、利尿,可暂停ATRA。除分化综合征外,ATRA的其他不良反应有头痛、颅内压增高、肝功能损害等;ATO的其他不良反应有肝功能损害、心电图QT间期延长等。APL合并凝血功能障碍和出血者积极输注血小板、新鲜冷冻血浆和冷沉淀,可减少由出血导致的早期死亡。
(2)缓解后治疗
其特点如下:①AML的CNSL发生率不到3%,对初诊WBC≥40×109/L、伴髓外病变、M4/M5、伴t(8;21)或inv(16)的病人应在CR后做脑脊液检查并鞘内预防性用药至少1次,以进行CNSL筛查。而APL病人CR后至少预防性鞘内用药3次。②AML(非APL)比ALL治疗时间明显缩短。③APL在获得分子学缓解后可采用化疗、ATRA以及砷剂等药物交替维持治疗近2年,期间应定期监测并维持PML-RARA融合基因阴性。
年龄小于60岁的AML病人,根据表3的危险度分组选择相应的治疗方案。预后不良组首选allo-HSCT;预后良好组(非APL)首选大剂量Ara-C为基础的化疗,复发后再行allo-HSCT;预后中等组,配型相合的allo-HSCT和大剂量Ara-C为主的化疗均可采用。无法行allo-HSCT的预后不良组、部分预后良好组以及预后中等组病人均可考虑行自体HSCT。无法进行危险度分组者参照预后中等组治疗,若初诊时白细胞≥100×109/L,则按预后不良组治疗。因年龄、并发症等原因无法采用上述治疗者,也可用常规剂量的不同药物组成化疗方案轮换巩固维持,但仅10%~15%的病人能长期生存。
HD Ara-C的最严重并发症是小脑共济失调,发生后必须停药。皮疹、发热、眼结膜炎也常见,可用糖皮质激素常规预防。
(3)复发和难治AML的治疗
可选用:①无交叉耐药的新药组成联合化疗方案;②中、大剂量阿糖胞苷组成的联合方案;③HSCT;④临床试验:如耐药逆转剂、新的靶向药物(如FLT3抑制剂等)、生物治疗等。再诱导达CR后应尽快行allo-HSCT。复发的APL选用ATO±ATRA再诱导,CR后融合基因转阴者行自体HSCT或砷剂(不适合移植者)巩固治疗,融合基因仍阳性者考虑allo-HSCT或临床试验。
3.老年AL的治疗
多数大于60岁的AL病人化疗需减量用药,以降低治疗相关死亡率。少数体质好、支持条件佳者可采用类似年轻病人的方案治疗,有HLA相合同胞供体者可行减低剂量预处理的allo-HSCT。由MDS转化而来、继发于某些理化因素、耐药、重要器官功能不全、不良核型及基因突变携带者,更应强调个体化治疗,如采用表观遗传学调控药物治疗或支持治疗等。













