英文名称 :leukemia
白血病(leukemia)是一组异质性恶性克隆性疾病,系造血干细胞/祖细胞突变引起的造血系统恶性肿瘤。其主要表现为异常血细胞(即白血病细胞)在骨髓及其他造血组织中失控制地增生,浸润各种组织,而正常造血功能受到抑制,正常血细胞生成减少,产生相应的临床表现,周围血细胞有质和量的变化。
人类白血病的确切病因至今未明。许多因素被认为与白血病的发病有关。病毒可能是主要的因素,此外尚有遗传因素、放射、化学毒物或药物等因素。某些染色体的异常与白血病的发生有直接关系,染色体的断裂和易位可使癌基因的位置发生移动和被激活,染色体内基因结构的改变可直接引起细胞发生突变,免疫功能的降低则有利于白血病的发生。
表1 急性白血病WHO分型构成比
(一)病毒
早已证实,C型RNA肿瘤病毒或称反转录病毒是哺乳类动物(如小鼠、猫、牛、绵羊)和灵长动物自发性白血病的病因,这种病毒能通过内生的反转录酶按照RNA顺序合成DNA的复制品,即前病毒,当插入宿主的染色体DNA中后可诱发恶变。肿瘤病毒携有病毒的原癌基因(v-onc),大多数脊椎动物(包括人)的细胞基因体内也有与v-onc同源的原癌基因。V-onc被整合入宿主细胞的基因后可使邻近的基因发生恶变。反转录病毒的感染也可致原癌基因激活,成为恶性转变的基因,导致靶细胞恶变。进入体内的病毒基因即使不含有v-onc,如果改变了基因的正常功能,也有可能引起白血病。
人类白血病的病毒病因研究已有数十年历史,但至今只有两种少见类型的白血病是和病毒相关:成人T细胞白血病肯定是由反转录病毒引起;EB病毒属DNA病毒,被认为和Burkitt白血病(成熟B-ALL)发病有关。1976年日本人发现了成人T细胞白血病/淋巴瘤(ATL),以后流行病学调查,发现在日本西南部、加勒比海区域及中部非洲为高发流行区。1980年在ATL细胞系中发现ATL相关抗原,并在电镜下发现了病毒颗粒。美国的Gallo和日本的日昭赖夫分别从患者培养细胞株中分离出C型反转录RNA病毒,命名为人类T细胞白血病/淋巴瘤病毒(HTLV-Ⅰ)和成人T细胞白血病病毒(ATLV),以后证实HTLV-Ⅰ和ATLV是一致的。这是对人类白血病病毒病因研究的重大贡献。在ATL细胞中发现有HTLV-Ⅰ前病毒DNA,ATL患者血清中可检出HTLV-Ⅰ抗体。ATL的高发区也是HTLV-Ⅰ感染的高发区。血清流行病学调查表明,日本ATL流行区40岁以上的健康人群中HTLV-Ⅰ抗体阳性率达6%~37%。而非流行区抗体阳性率仅0~0.015%。HTLV-Ⅰ具有传染性,可通过乳汁母婴传播,通过性交和输血传播,除ATL外其他类型白血病尚无法证实具有传染性。我国东南沿海的地理位置和气候条件与日本西南部相似,并且日本与我国相邻,两国交往密切。这些地区是否也有本病流行?我国预防医学科学院病毒学研究所等单位曾调查我国28个省、市、自治区人群的10013份血清标本,发现8例HTLV-Ⅰ抗体阳性,其中3例日本人,2例中国台湾人,2例中国妇女系前述阳性者的妻子,1例系我国海员,常在日本港口居住。说明病毒可由与日本人密切接触而传播。1989年吕联煌在福建沿海地区发现HTLV-Ⅰ小流行区。共调查518人,包括白血病患者210人,发现2例成人T淋巴细胞白血病患者和5例血清HTLV-Ⅰ抗体阳性者,其中1例ATL,患者的妻子和次子血清HTLV-Ⅰ抗体均为阳性,1例毛细胞白血病患者血清HTLV-Ⅰ抗体也呈阳性。1982年Kalyanaraman从1例T细胞型毛细胞白血病患者的细胞株中分离出HTLV,他认为该例患者的病毒有别于以前分离出的HTLV,称为HTLV-Ⅱ型病毒,提出毛细胞白血病的病毒是HTLV-Ⅱ。HTLV-Ⅰ和HTLV-Ⅱ虽是两型病毒,但在血清学上可发生交叉反应,因此上述吕联煌报告的毛细胞白血病者HTLV抗体阳性,尚难确定其所感染的病毒是HTLV-Ⅰ或HTLV-Ⅱ。
(二)遗传因素
遗传因毒和某些白血病发病有关。白血病患者中有白血病家族史者占8.1%,而对照组仅0.5%。近亲结婚人群ALL发病率比期望值高30倍。单卵双胎者如一人患白血病,另一人患白血病的机会为20%,并且双胎可得同型白血病。家族性白血病占白血病病例总数的7%,国外已报道100多例。国内张氏和程氏曾报道11户22例和8户16例家族性白血病,主要为父母与子女或兄妹之间。1985年以来我国报道先天性白血病(congenital leukemia)11例,其中有急性粒细胞白血病(简称急粒)4例,急粒单1例,急单3例,急淋3例。在白血病的第1代家族中患白血病者,急性白血病占2%,CLL占3.5%,CML只占0.8%,故CLL的家族性较显著。
某些染色体有畸变、断裂或DNA修复有缺陷的遗传性疾患常伴较高的白血病发病率,如Down综合征(Down syndrome)、先天性血管扩张红斑症即Bloom综合征(Bloom syndrome)、共济失调毛细血管扩张症(ataxia telangiectasia)、遗传性8号染色体三体综合征和Fanconi贫血(Fanconi anemia)等。Down综合征有21号染色体三体异常,其发生急性白血病的危险性比一般人群高20倍,且发病比其他儿童为早(中数发病年龄2~3岁vs 5~6岁),并且常伴AML-M7。Bloom综合征易有染色体断裂,其发生急性白血病的危险性可高达50%。Fanconi贫血是常染色体隐性遗传性疾病,具有自发性染色体断裂,患者及其家族中白血病的发病率甚高。上述遗传性疾患不仅有染色体的异常,并且其体细胞在体外病毒作用下有很高的恶变率。先天性无丙种球蛋白血症虽未检出有染色体异常,但均有细胞免疫及体液免疫的缺陷,严重联合免疫缺陷者白血病的发生率也很高。
白血病和HLA抗原型别有某种联系尚有争议,如ALL常伴HLA-A2和A9等。上述说明遗传因素与白血病的发病有某种联系,但对大多数白血病而言,白血病毕竟不是遗传性疾病。
(三)放射因素
电离辐射有致白血病作用,其作用与放射剂量大小、放射部位及年龄有关。短期内较大剂量照射、全身和放射野较大的照射,特别是骨髓受到照射,可导致骨髓抑制和免疫抑制,照射后数月可观察到染色体的断裂和重组。尤其是年幼患者危险性较高。放射可诱发AML、ALL和CML,但未见CLL,并且发病前常有一段骨髓抑制期,其潜伏期为2~16年。1945年日本广岛和长崎遭原子弹袭击后幸存者中发生白血病数比未经辐射者高数十倍。在广岛和长崎严重辐射地区的白血病发病率分别较未辐射地区高30倍和17倍,到1978年止发现了135例急性白血病和53例CML,并发现其发病数和受照剂量有关。放疗也可致白血病,强直性脊柱炎患者放疗后白血病发生率较一般人群高十几倍,并且与剂量有关:累积剂量>20Gy,其相对危险度为14.4,<5Gy,相对危险度为4.2。真性红细胞增多症采用随机对照设计,不同治疗方法观察以后发生白血病危险性:放血治疗1%,32P治疗6%,苯丁酸氮芥治疗11%。说明化疗致白血病作用高于放疗。职业性长期照射也可致白血病,据我国1950—1980年调查,临床X线工作者白血病发病率为9.61/10万(标化率9.67/10万),而其他医务人员为2.74/10万(标化率2.77/ 10万)。对1950—1990年间放射诊断工作者白血病的危险性进行分析,发现其白血病发病率为对照组的2.25倍。诊断性照射是否会致白血病尚无确切的根据,但孕妇胎内照射可增加出生后的小儿白血病的危险性。超低频非离子化电磁场也可致白血病,但作用甚小。
(四)化学因素
苯的致白血病作用比较肯定。苯的毒性作用和累积剂量有关,1~10ppm可致染色体损伤,124~200ppm有致白血病危险。我国对接触苯的工人调查,其发生白血病的危险性是一般人群的4~7倍,平均潜伏期11.4年,暴露在≥25ppm,危险性最高,并有剂量反应关系。据报道40例苯致白血病的类型包括急粒(15例)、红白血病(7例)、白血病前期(7例)、急淋(4例)、急单和急粒单(3例)、CML(2例)、早幼粒及不能分类白血病各1例,未见CLL。苯致急性白血病以AML和红白血病为主,红白血病占相当比例值得引起注意;并且在出现白血病临床表现常有一阶段骨髓抑制期。上海医科大学经调查还发现长期接触氯乙烯工人发生白血病危险性是对照组的10~11倍,长期接触铅者发生白血病危险性是对照组的4倍,尚需要进一步研究它们与白血病发病的关系。
烷化剂和拓扑异构酶Ⅱ抑制剂可致继发性白血病也较肯定。烷化剂可致点突变,激活癌基因致染色体异常,拓扑异构酶Ⅱ抑制剂可致DNA复制关键酶缺失,导致染色体异常。Curtis调查了美国1973—1980年诊断为癌症的44万例患者,其中单用化疗者发现了47例继发性白血病,显著高于预期数,其中AML34例。多数继发性白血病是在原有淋巴系统恶性肿瘤和易产生免疫缺陷的恶性肿瘤经长期烷化剂治疗后发生,乳腺癌、卵巢癌和肺癌化疗后也易发生继发性白血病。文献中搜集到22986例霍奇金淋巴瘤,经化疗后0.17%~2.4%发生白血病,发病间隔2~8年。2861例多发性骨髓瘤,经化疗后0.6%~7.9%发生白血病,发病间隔2.5~6年。烷化剂应用后发生继发性白血病,潜伏期常为5~9年,老年人危险性增加,潜伏期可缩短,发生白血病前均有MDS前期,常呈骨髓低增生和纤维化,白血病类型多数是AML,很少有Auer小体,累及染色体异常多为复杂核型、单体7(-7)、del(5q)和-5。拓扑异构酶Ⅱ抑制剂致继发白血病潜伏期短(6个月~5年),无MDS前期,多数为AML-M4和M5,累及染色体异常为11q23和21q22。
近年来国内陆续报道乙双吗啉所致继发性白血病近80例。该药是乙亚胺的衍生物,用于治疗银屑病,是一种极强的致染色体畸变的物质。服乙双吗啉后1~7年发生白血病(中位数4年),白血病类型主要为AML,其中以M3最多,可能是乙双吗啉作用于15号和17号染色体。与白血病发病有关的药物还有氯霉素和保泰松,但尚无非常肯定的结论。
(五)细胞遗传学和分子生物学发病机制
白血病是一组造血细胞恶性克隆性疾病。恶性克隆的产生可能有多种因素,其中反转录病毒感染使原癌基因激活可能是主要的,而放射线、化学毒物、烷化剂以及遗传因素致染色体异常和免疫功能降低等促使了恶性克隆的产生和发展,但大多数自发白血病缺乏上述因素。某些染色体的异常与白血病的发生有直接关系,染色体的断裂和易位可使癌基因的位置发生移动和被激活,染色体内基因结构的改变可直接引起细胞发生突变。白血病细胞染色体重排对细胞癌基因结构或调节发生改变,使基因产物发生质和量的改变,后者可能和白血病的发生和维持有一定关系。
t(8;21)(q22;q22)是AML中最常见的染色体易位之一,t(8;21)-AML中90%具有FAB-M2的形态表现,t(8;21)引起21号染色体上核心结合因子(CBF)α亚单位和8号染色体上ETO基因融合。inv(16)或t(16;16)是FABM4EO的染色体异常,inv(16)引起16号染色体长臂CBFβ亚单位和短臂的MYH11基因融合。两个累及“核心结合因子”AML可以干扰DNA转录致白血病。t(8;21)和inv (16)AML有较高缓解率,有利于长期生存。t(15;17)致APL(M3),系17号染色体维甲酸受体α基因(RARα)和15号染色体早幼粒细胞基因(PML)融合成PML/RARα融合基因,含PML/RARα融合基因转基因鼠,经长期潜伏期可发生白血病,正常PML基因有肿瘤抑制功能,RARα基因有促分化和抑制生长的作用。染色体11q23的MLL基因易位是肿瘤中常见染色体异常,MLL基因重排见于拓扑异构酶Ⅱ抑制剂引起的继发性白血病。FMS样酪氨酸激酶3(FLT3)基因突变主要包括两种形式:串联重复突变和ASP835点突变,在急性白血病,尤其是AML发生中起重要作用。FLT3基因突变见于20%~40%AML,其中10%~30%为串联重复突变,5%~10%为点突变。FLT3阳性AML常呈高白细胞性,对治疗反应差。90%以上典型CML有Ph染色体,t(9;22),断裂点在第9号染色体长臂,使细胞癌基因C-ABL和22号染色体上BCR基因融合成BCR/ABL融合基因,编码P210蛋白,是一种酪氨酸激酶,促发CML细胞无限增殖。成人ALL最常见的染色体异常是Ph1染色体,也形成BCR/ABL融合基因,但BCR断裂点和CML略有差别,因此ALL产生P190蛋白,见于20%成人ALL和5%儿童ALL。儿童ALL最常见易位是t (12;21)累及TEL和AMLI基因,也因干扰CBF正常功能致DNA转录异常,见于25%儿童ALL和4%成人ALL。近年来研究发现白血病细胞中仅有极少数具有无限自我更新和起始白血病能力的细胞,称为白血病干细胞(LSC),在AML(除外M3)、ALL和CML都证明了白血病干细胞的存在,白血病的发生和维持都依赖于白血病干细胞。
白血病是一种常见的恶性肿瘤,占癌症总发病数的3%~5%。据西方国家统计,白血病总年发病率8~10/10万,近30年来都稳定在此水平,据推算全世界每年有新病例20万~25万,在同一时期的估计病例数可达50万。在我国各年龄组恶性肿瘤的死亡率中白血病占第6位(男性)和第8位(女性),在儿童及35岁以下的人群中则占第1位。
(一)发病率与死亡率
白血病的分布是世界性的,其发病率和死亡率有相当大的地区差别。据统计,全球最高年龄标化死亡率见于西欧、大洋洲和北美洲,男性达4.8~7.4/10万人年,女性达3.2~4.6/10万人年,据以色列、哥斯达黎加的统计和上述工业化国家类似。但亚洲及拉丁美洲则较低,男性为3.7~4.5/10万,女性为2.8~3.5/10万。据美国统计,1970-1994年年龄标化白血病死亡率,白种人男性8.80/10万,女性5.16/10万,与前20年类似。根据我国恶性肿瘤3年(1973-1975年)死亡回顾调查,白血病年龄校正死亡率男性为2.79/10万,女性为2.23/10万,与亚洲国家相近而明显低于欧美国家。20世纪70年代以后随着化疗方案和造血干细胞移植技术的不断改进,已有更多的患者能长期生存,因此上述死亡率已不能完全代表目前的发病情况。
白血病发病率和死亡率的地区差异基本相一致。根据1997年五大洲癌症发病率统计,白血病发病率最高的还是北美洲、澳大利亚和新西兰的白种人;其次是北欧、西欧;南欧和以色列犹太人为中等水平;中国、日本、印度为低水平,美国非西班牙裔白种人男性年龄较正年发病率高达14.1/ 10万人,女性为8.3/10万人。我国白血病的发病率与亚洲国家相近而明显低于欧美国家。中国医学科学院血液学研究所曾组织了全国22个省、市、自治区46个调查点,60557127人(1986-1988年)的白血病发病率调查,年发病率为2.76/10万,大部分地区的发病率与全国发病率相比无明显差别,但油田和污染地区的发病率明显增高,大城市的发病率高于农村。
白血病发病率的种族差别只有CLL较肯定,而其他类型白血病并不明显。男性CLL的发病率北美洲为0.9~3.1/10万,欧洲为0.1~2.7/10万,大洋洲为0.5~1.6/10万,而亚洲为0.1~0.4/10万,我国为0.05/10万。
白血病的发病率是否逐年升高未有肯定的结论。国外多数统计资料认为从全球范围看,自20世纪60年代以来,白血病的发病率基本上是平稳的。所谓白血病总死亡率的增高主要和老年人白血病死亡率显著升高有关,儿童白血病发病率反而有不同程度的降低。我国平顶山市10年白血病发病率追踪观察也未发现有明显差别。
(二)性别和年龄发病率
据各地区、各年代白血病的性别发病率调查,男女之比为1∶1~1.6∶1。我国1986—1988年调查资料表明男性白血病发病率为2.98/10万,女性为2.52/10万,男性发病率略高于女性,尤其是青少年和老年人发病率的性别差别更明显,前者尤见于ALL,后者尤见于AML。CML各年龄组都是男性发病率高于女性,CLL在50岁以上年龄组,男性发病率明显高于女性。
观察白血病年龄的发病率曲线,发现在5岁以下及15~20岁间有两个小高峰,在40岁以后随年龄增加发病率逐渐升高,高峰年龄在60岁以后。各型白血病发病年龄不尽相同,据美国统计,ALL在5岁以下发病率较高(3.8/ 10万),5岁以后逐渐下降,至25~29岁最低(0.2/10万),到老年期又升高(3.7/10万);AML在30岁以前发病率较低(0.8/10万)以后随年龄逐渐升高,至70岁以后可高达14.8/10万;CML发病率在25岁以前甚低(0.2/10万),中年后发病率增高;CLL在30岁以前罕见,而老年人可达28.3/10万。我国1986—1988年的调查资料也有类似情况。白血病发病高峰年龄为50~69岁;ALL发病高峰年龄在10岁之前,之后逐渐降低,进入老年期又略为升高;CML发病率随年龄增长逐渐升高,50~59岁达高峰;CLL发病率在50岁以后才有明显升高。据上海地区报道;老年急性白血病的构成比已从1984年的9.3%上升至1993年的21.2%,并且逐年升高。
(三)各型白血病的发病率与构成比
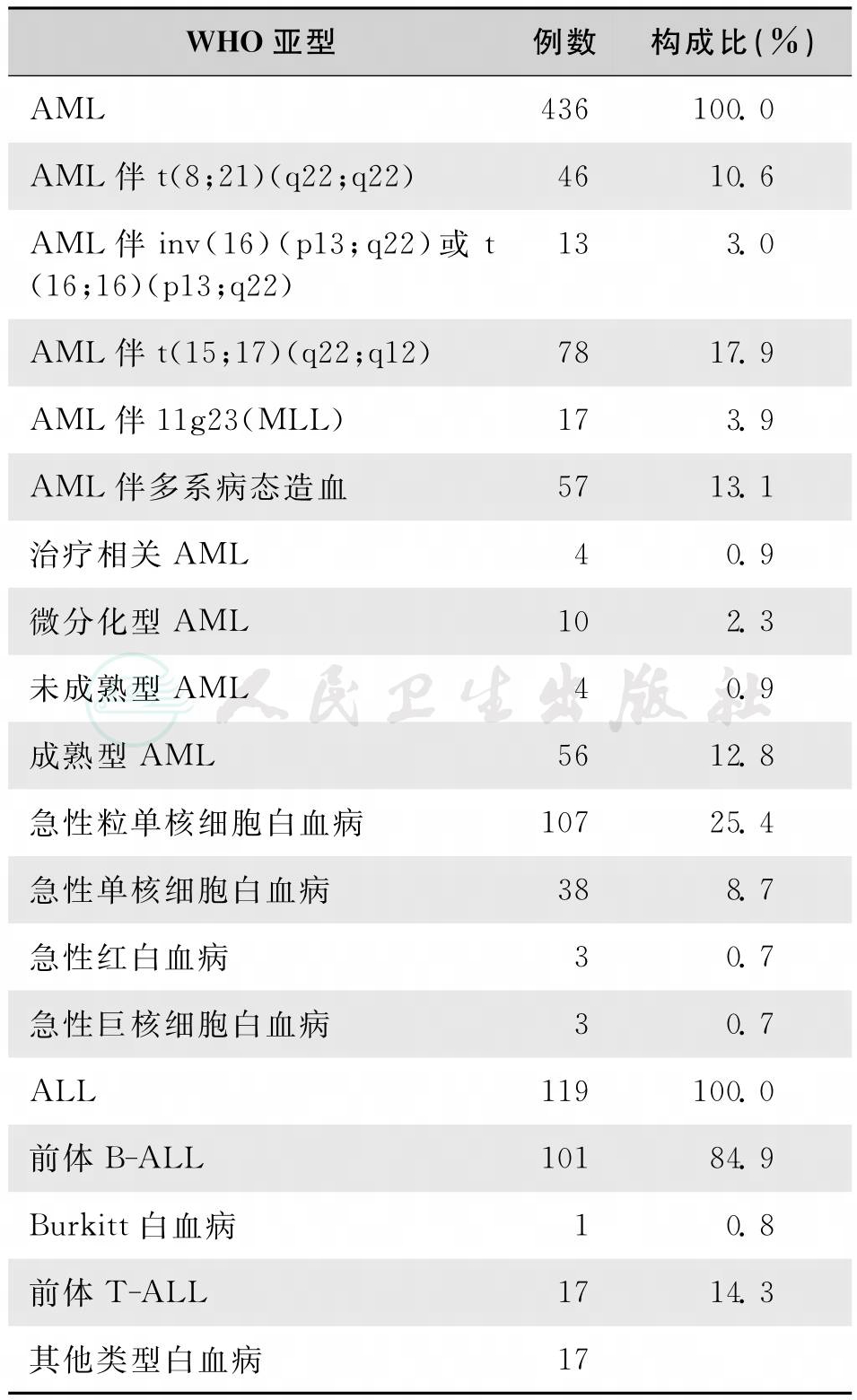
各型白血病的构成比以急性多于慢性。据美国统计各型白血病的构成比:AML34%,CLL28%,CML13%,ALL11%,其余为其他类型白血病。日本由于CLL发病率低(构成比2.5%),因此急性白血病占70%以上。在儿童中绝大多数为急性,慢性仅占2.7%~5.7%,几乎所有儿童的慢性白血病均为慢粒。根据我国1986—1988年调查资料,各型白血病的发病率以AML最高(1.62/10万),ALL次之(0.69/10万),CML(0.36/10万)、CLL(0.05/10万)和特殊类型(0.03/10万)最低。1999年上海市白血病协作组统计2867例急性白血病FAB分型资料,各亚型构成比:AML 61.6%,ALL 35.4%,其他3%;其中儿童分别为31.3%、66.3%、2.5%;青壮年分别为70.6%、26.8%、2.6%;老年人分别为77.5%、17.0%、5.5%。ALL中L143.6%,L248.4%,L3 8%。AML中M17%、M224.9%、M322.7%、M415.1%、M526.5%、M63.1%、M70.7%。2007年上海市中美联合白血病协作组采用MICM分型统计572例成人急性白血病的WHO分型,各亚型构成比见表1。
一般可根据临床表现、细胞形态学、细胞化学、细胞免疫学及细胞和分子遗传学进行分类。常用的有下列分类方法。
(一)按病程缓急以及细胞分化程度分类
可将白血病分为:①急性白血病(acute leukemia):病情发展迅速,骨髓及外周血中以异常的原始及幼稚细胞为主,一般要超过20%;②慢性白血病(chronic leukemia):病程较缓慢,骨髓及外周血中以异常的较成熟细胞为主,其次为幼稚细胞,原始细胞常不超过10%~15%。
(二)按白血病细胞的形态和细胞化学特征分类
1976年FAB(法-美-英)协作组将急性白血病分成急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL),简称急淋,和急性髓系白血病(acute myeloid leukemia,AML)两类。FAB分类以形态学为主,自1976年发表以来,因方法简易实用,对白血病的治疗和和估计预后有一定价值。20世纪80年代以来经多次修订完善,已为世界各国血液病学家所采用,成为国际上统一的分型方法。FAB分类将ALL按原始淋巴细胞的大小及形态学分为L1、L2和L33个亚型,将AML分成M0至M78个亚型,其中M0、M1、M2、M3系按髓系白血病细胞的分化程度依次分型,M4为急性粒单核细胞白血病(acute myelomonocytic leukemia,AMMoL),简称急粒单,M5为急性单核细胞白血病(acute monocytic leukemia,AMoL),简称急单,M6为急性红白血病(acute erythroid leukemia,AEL),M7为急性巨核细胞白血病(acute megakaryoblastic leukemia,AMKL)。我国1986年在天津召开全国白血病分类、分型讨论会,以FAB分型方法为基础将AML分成M1、M2a、M2b、M3a、M3b、M4a、M4b、M4c、M4EO、M5a、M5b、M6、M7等亚型。
慢性白血病分为慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL),简称慢淋;慢性粒细胞白血病(chronic myelogenous leukemia,CML),简称慢粒;慢性粒-单核细胞白血病(chronic myelomonocytic leukemia,CMML);慢性中性粒细胞白血病(chronic neutrophilic leukemia,CNL);毛细胞白血病(hairy cell leukemia,HCL)和幼淋巴细胞白血病(prolymphocytic leukemia,PLL)等。
少见和特殊类型白血病包括低增生性白血病(hypoplastic leukemia)、髓系肉瘤(myeloid sarcoma)、嗜酸性粒细胞白血病(eosinophilic leukemia)、嗜碱性粒细胞白血病(basophilic leukemia)、肥大细胞(或组织嗜碱细胞)白血病(mast cell leukemia)、成人T细胞白血病(adult T cell leukemia)、浆细胞白血病(plasma cell leukemia)、毛细胞白血病、急性混合细胞白血病(mixed phenotype acute leukemia)和急性全髓增殖症伴骨髓纤维化(acute panmyelosis with myelofibrosis)等。
(三)根据白血病细胞形态、免疫学标记及细胞遗传学分类
随着单克隆抗体在白血病中的应用,又可根据免疫学标记把ALL分成6个亚型;早B前体型、普通型、前B型、B细胞型、早T前体型和T细胞型。但大多数髓系细胞的单克隆抗体缺乏特异性,且髓系白血病细胞在不同成熟阶段的表面抗原并不呈一致性顺序出现,所以髓细胞白血病免疫学分类尚有待探索。由于单克隆抗体的较为广泛应用,已发现了有两系甚至三四系标记并存的恶性造血细胞。成人ALL中有23%表达髓系抗原,AML中有20%表达淋巴细胞相关分化抗原,这是细胞系间反常抗原表达。而急性混合细胞白血病系指髓细胞系和淋巴细胞系共同累及的一组急性白血病。
对白血病细胞遗传学的研究,尤其是染色体高分辨技术的应用等,发现某些类型的白血病存在着特异或相对特异的遗传学特征。随着研究的不断深入,人们逐步认识到在白血病这组高度异质性的疾病中,细胞分子遗传学的标志性改变往往较形态学、细胞化学及免疫标志的变化更能深刻反映疾病本质。所以自20世纪90年代起,国际上白血病分型倾向于形态学(M)、免疫学(I)和遗传学(C)相结合的MIC分类法,如再加上分子生物学方法(M)则为MICM分类法。2001年正式公布的世界卫生组织(WHO)造血和淋巴组织肿瘤分类,该分类于2008年第4版又作了重要修订(简称WHO分类)即是应用MICM分类法的典范。WHO分类中疾病实体之间界限较FAB分类更为清晰,解决了某些单凭形态难以分型或易混淆白血病的诊断,目前已为国外众多国家的血液和肿瘤工作者所采用,国内有条件的单位也正在逐渐推广。WHO分类将急性白血病分为AML、ALL和系列不明急性白血病三大类(详见表2、表3、表4)。将AML和ALL中伴有重现性遗传学异常单独分开具有重要意义,对了解急性白血病发病机制,判断预后及采用不同治疗方案都有重要价值。以AML为例,仅25%~30%的病例诊断为AML,NOS。随着遗传学研究深入,今后诊断为AML,NOS的病例将逐渐减少。按WHO分类,原始淋巴细胞白血病(lymphoblastic leukemia,ALL)和淋巴母细胞淋巴瘤(lymphoblastic lymphoma,LBL)同属一种疾病实体,称ALL/LBL。FAB分类中的ALL-L3已命名为Burkitt淋巴瘤/白血病(Burkitt lymphoma/leukemia),归入成熟B细胞肿瘤,不应称B-ALL;将慢性白血病中慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(chronic lymphocytic leukemia/small lymphocytic lymphoma,CLL/ SLL)、B-幼淋巴细胞白血病(B-PLL)、毛细胞白血病(HCL)归入成熟B细胞肿瘤;将T-幼淋巴细胞白血病(TPLL)、T-大颗粒淋巴细胞白血病(T-cell large granular lymphocytic leukemia,T-LGLL)、侵袭型NK细胞白血病(aggressive NK cell leukemia)、成人T细胞白血病/淋巴瘤(adult T-cell leukemia/lymphoma,ATLL)归入成熟T细胞和NK细胞肿瘤;将慢性粒细胞白血病(CML)、慢性中性粒细胞白血病(CNL)、慢性嗜酸性粒细胞白血病(chronic eosinophilic leukemia,CEL)归入骨髓增殖性肿瘤(MPN);将慢性粒-单核细胞白血病(CMML)归入骨髓增生异常/骨髓增殖性肿瘤(myelodysplastic/myeloproliferative neoplasms,MDS/MPN)。
表2 WHO(2008)有关AML分类

表3 WHO(2008)有关ALL分类

表4 WHO(2008)有关系列不明急性白血病分类














