英文名称 :iron deficiency anemia
缺铁性贫血(iron deficiency anemia,IDA)是体内贮存铁缺乏影响血红素合成所引起的贫血,其特点是骨髓、肝、脾等器官组织中贮存铁减少,血清铁、转铁蛋白饱和度和血清铁蛋白降低,典型的呈小细胞低色素性贫血。它是一种综合征,各种原因均会导致缺铁。
铁缺乏(iron deficiency,ID)是最常见的营养素缺乏症,最初导致贮存铁耗尽,继之发生红系细胞内缺铁(iron deficient erythropoiesis,IDE),最后发生IDA。ID至今仍是世界各国普遍而重要的健康问题,尤其是发展中国家,其高危人群为育龄期妇女、婴幼儿、儿童和妊娠期妇女。据全球187个国家1990年至2010年间疾病负担数据证实,铁缺乏影响了20亿人。ID的患病率约为IDA的2倍。我国的调查发现7个月~7岁儿童的ID和IDA患病率分别为32.5%和7.8%,育龄妇女为34.4%和15.1%,妊娠期妇女为42.6%和19.1%。
(一)营养因素
因饮食中缺乏足够量的铁或食物结构不合理,导致铁吸收和利用减低。国人膳食中供铁量并不少,但铁来源的食物构成不合理,仅20%的铁来源于动物食品。当生理性铁需要量增加时,如婴幼儿、青少年、妊娠期和哺乳期妇女,就容易发生营养性IDA。妇女一次月经平均失血量40~60ml,相当于20~30mg铁,因此需铁量比男性多,为 2mg/d;妊娠期为供应胎儿所需及分娩时失血所丢失的铁,估计一次正常妊娠要额外增加960mg铁,妊娠中、后期需铁量达4~6mg/d,单纯从饮食中难以获得。
(二)慢性失血
慢性失血是IDA最常见的病因之一。如按每毫升血含铁0.5mg计算,慢性长期失血即使每天失血量少至3~4ml,也足以引起缺铁。IDA常是胃肠道肿瘤的首发表现,成年男性发生IDA一定要进行胃镜和肠镜检查。妇女缺铁的常见原因是月经量过多。在农村,钩虫感染是慢性消化道失血的原因。血尿、咯血、反复鼻出血、血红蛋白尿(如PNH、心脏人工瓣膜和运动性血红蛋白尿症),也是慢性失血的原因。
(三)吸收障碍
常见于胃全切除和胃次全切除后数年发生缺铁。消化性溃疡长期服用H2受体拮抗药或质子泵抑制剂不致引起IDA,但萎缩性胃炎可影响铁的吸收。慢性腹泻、累及十二指肠和近端空肠的小肠疾病,不仅引起铁吸收不良,并且随着大量肠上皮细胞脱落而失铁。幽门螺杆菌(Hp)感染可能与宿主竞争可利用铁,减少铁的吸收。口服铁制剂常失效,Hp根治后,口服铁剂疗效恢复。
(四)遗传性
遗传性IDA甚为罕见,近年有一种常染色体隐性遗传的铁难治性缺铁性贫血(iron-refractory iron deficiency anemia,IRIDA)被认识。由于TMPRSS6(一种Ⅱ型跨膜丝氨酸蛋白酶,可抑制激活铁调素的信号通路)突变,导致铁调素高表达,阻断肠道铁吸收和铁再循环障碍,引起铁剂治疗无效的IDA。
(一)铁稳态和铁分布
铁是人体最丰富的必需微量元素之一,所有具有功能的细胞均含有铁,它广泛参与机体内的代谢过程。缺铁可引起血红素合成障碍导致IDA,也会影响含铁酶包括线粒体中细胞色素酶系统的活力以及肌红蛋白的合成。同时,机体还必须防止游离铁的毒害作用,后者可促发产生大量自由基。因此,人体存在严格的铁代谢调节机制,可以确保体内铁始终处于正常生理水平,称机体的铁稳态(iron homeostasis)。人体铁代谢是在“封闭”系统内反复循环,铁重复被利用,衰老红细胞被巨噬细胞吞噬后,所释放的铁约80%以上被重新利用(图1)。除月经及上皮细胞脱落丢失铁外,人体无明显的生理性排泄铁,因此正常成年男性和绝经后妇女一般不会发生缺铁。
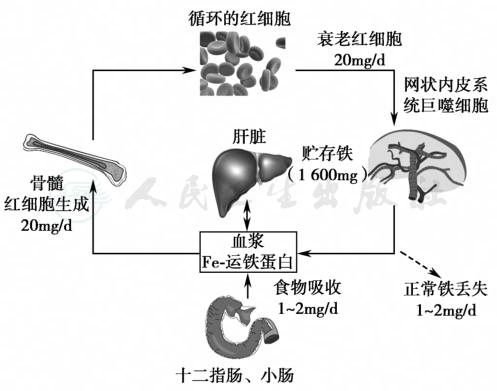
图1 正常人体铁稳态
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
正常成人含铁总量男性为50mg/kg体重,女性为40mg/kg。铁的62%组成血红蛋白,4%在肌红蛋白,31%以铁蛋白和含铁血黄素的形式储存,0.3%存在于参加细胞代谢的血红素酶类,0.1%为血液中的转运铁,2.5%为短暂结合于细胞膜或细胞间蛋白的易变池铁。成年女性的储存铁较男性显著减少,容易发生IDA。
(二)铁的吸收和转运
国人每日普通饮食中所供给的铁量为15~30mg,其中5%~10%被吸收,吸收量约1~2mg/d,主要吸收部位在十二指肠和空肠上段。铁的吸收形式有两种:①血红素铁,来自血红蛋白及动物食物的其他血红素蛋白,为二价铁,吸收率高。②非血红素铁,来自植物性食物中的高铁化合物等,为三价铁,必须转变为可溶性二价铁才易被吸收。胃酸可增加非血红素铁的溶解度,维生素C作为还原剂利于铁吸收。植物性食物中的磷酸盐、植酸盐、茶叶中的鞣酸及咖啡中的一些多酚类化合物等,都可与铁形成难以溶解的盐类而抑制非血红素铁的吸收,蛋黄中的磷蛋白和卵黄高磷蛋白和铁结合后可溶性差而不易吸收。因此铁的吸收率因食物种类而异,动物性食物约为20%~25%(蛋仅3%),植物性食物的吸收率小于5%(但大豆为7%),人乳铁吸收率为50%,牛乳仅10%。
食物中三价铁还原为二价铁后,在二价金属离子转运体1(DMT1)介导下进入肠上皮隐窝细胞,穿过上皮细胞的基底膜进入血流,转变为三价铁后与转铁蛋白结合,转运到肝和各组织。转铁蛋白主要由肝合成,分子量为79 500的糖蛋白,1分子转铁蛋白有2个结合三价铁的位点。正常人转铁蛋白血浆浓度为2.65~4.30g/L,应用间接法测定,即为总铁结合力(total iron binding capacity,TIBC),即血浆中能与铁结合的球蛋白的总量。正常情况下仅以其总量的1/3与铁结合,这部分称血清铁,2/3未与铁结合的转铁蛋白称为未饱和的转铁蛋白(图2)。转铁蛋白饱和度=血清铁/总铁结合力×100%。

图2 各种疾病血清铁和总铁结合力的比较
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
肝细胞膜上有两种转铁蛋白受体(transferrin receptor,TfR):TfR1和TfR2。幼红细胞摄取转铁蛋白铁也需TfR,中幼红细胞TfR最多,受体可随细胞成熟而丢失。TfR是一种跨膜糖蛋白,铁被受体运送到幼红细胞内后,转铁蛋白和受体重新被运送到细胞表面,转铁蛋白被释放而重新被利用,铁被幼红细胞所摄取。进入幼红细胞的铁在线粒体上与原卟啉结合形成血红素,多余的铁以铁蛋白形式贮存于幼红细胞中。
铁的储存形式有铁蛋白和含铁血黄素两种。铁粒幼细胞中的铁颗粒即为聚合的铁蛋白。含铁血黄素是变性或部分去蛋白质的铁蛋白聚合形成的不溶性含铁复合物,骨髓中可染铁即分布于骨髓小粒的含铁血黄素。
(三)铁代谢的调节
铁调素(hepcidin)是调节体内铁稳态的重要的铁调节激素,是由肝脏产生的含25个氨基酸的多肽,可调节小肠铁吸收、巨噬细胞铁再循环及肝铁的动用。铁调素是一种小肠铁吸收和巨噬细胞、肝细胞铁释放的负调控因子。在高铁状态、感染、炎症时产生增加,缺铁、组织释放缺氧信号时产生减少。铁缺乏时,铁调素转录受抑,促进肠道铁吸收和体内贮存铁释放。贫血缺氧时,低氧诱导因子2α(HIF-2α)增加,肾脏产生红细胞生成素(EPO)增多,从而刺激红系造血。HIF-2α增加了肠上皮细胞顶端DMT1的表达,以增加膳食铁从肠道吸收入肠上皮细胞。铁调素水平下降,转铁蛋白不再分解,肠上皮细胞基底膜铁转运增加,铁调素可与巨噬细胞表面的膜铁转运蛋白(ferroportin,FPN)结合,即通过铁调素-FPN轴使巨噬细胞贮存铁转运至血液循环增多。肝细胞对铁的释放较巨噬细胞为慢。总之,在缺铁状态下,铁调素通过增加肠道铁吸收、增加巨噬细胞贮存铁和肝铁的释放和转运来调节铁代谢。
(一)血常规检查
铁缺乏症早期无贫血。IDA阶段呈典型的低色素小细胞性贫血。成熟红细胞大小不一,中心淡染区扩大。红细胞分布宽度(RDW)>0.14。网织红细胞计数大多正常,亦可减低或轻度升高。白细胞计数正常,血小板正常或增多。
(二)骨髓象检查
幼红细胞轻度或中度增生,中幼红细胞比例增多。幼红细胞体积偏小,胞质减少,边缘不整齐,有血红蛋白形成不良的表现。骨髓铁染色显示骨髓小粒可染铁消失,铁粒幼红细胞低于15%。富含骨髓小粒的涂片铁染色缺乏可染铁,是诊断缺铁的“金标准”。
(三)血清铁和总铁结合力测定
在IDA时,血清铁<8.95μmol/L(50μg/dl),总铁结合力(TIBC)>64.44μmol/L(360μg/dl),转铁蛋白饱和度(transferrin saturation,TS)<0.15。血清铁并非缺铁的灵敏指标,且有昼夜变化,早晨高而夜间低,炎症性疾病、结缔组织病和恶性肿瘤都可使血清铁降低,肝细胞坏死可使血清铁升高。TIBC测定值较稳定。
(四)血清铁蛋白测定
血清铁蛋白(serum ferritin,SF)和体内贮铁相关性极好,1μg/L的SF相当于8~21mg贮铁,可作为贮铁缺乏的指标。一般认为SF<30μg/L表示贮铁减少,<12μg/L为贮铁耗尽。SF系反映缺铁较敏感的指标,可用于早期诊断和人群的筛检,诊断IDA的敏感度为92%,特异度为83%。但SF易受感染、炎症、结缔组织病、肿瘤和肝疾病的影响而升高,而红细胞内碱性铁蛋白则较少受上述因素的影响,更能正确地反映贮铁状态,但是要先分离纯化红细胞,操作困难,临床很少开展。
(五)红细胞游离原卟啉和血液锌原卟啉测定
缺铁时锌原卟啉(ZPP)和红细胞游离原卟啉(FEP)均可升高。FEP和ZPP升高尚见于铅中毒、慢性感染、炎症、恶性肿瘤和铁粒幼细胞贫血等。
(六)血清转铁蛋白受体(sTfR)测定
sTfR水平不受炎症、肝病和妊娠等因素的影响,可以较准确地反映缺铁,因此可用于妊娠期缺铁和慢性病贫血合并缺铁的诊断,其灵敏度和特异度均优于 SF。 一般 sTfR 浓度>26.5nmol/L(2.25μg/ml)可诊断缺铁。sTfR的水平也可反映贫血患者骨髓幼红细胞的生成情况。有认为采用复合参数如sTfR/SF和sTfR/logSF,尤其是后者更有助于慢性病贫血伴缺铁的诊断。
(七)网织红细胞血红蛋白量测定
诊断缺铁的标准为网织红细胞血红蛋白量(reticulocyte hemoglobin content,CHr)<28pg。
(一)病因治疗
非常重要。IDA是一种综合征,不能只顾补铁治疗而忽略其基础疾病的治疗,例如延误了胃肠道肿瘤的诊断和治疗,其后果不堪设想。
(二)口服铁剂
是治疗IDA的首选方法。口服铁剂的种类很多(表1),可分三类:无机铁、有机铁及血红素铁。至今仍认为硫酸亚铁是口服铁剂中的标准制剂,但它是无机铁剂,故胃肠反应大,主要和含有的游离铁离子有关。有机铁剂反应小,其中以多糖铁复合物最小;琥珀酸亚铁不仅含铁量高且吸收好,生物利用度高,不良反应又小,较常用。成人治疗剂量以每天100~200mg元素铁为宜,预防剂量每天10~20mg元素铁。多年来推荐的口服方式为每天给药,近年来有证据表明隔日给药铁的吸收更好,不良反应更少。为减少胃部刺激反应,宜在餐后服用。较大剂量维生素C(每30mg铁剂至少口服200mg)或琥珀酸可增加铁剂的吸收,铁剂忌与茶同服,钙盐及镁盐亦可抑制铁吸收,应避免同时服用。
铁剂治疗有效者网织红细胞在4~5天后即开始上升,一周后血红蛋白上升,一般治疗1~2个月左右,血红蛋白恢复正常。贫血纠正后至少需要继续治疗3个月或使SF恢复到50μg/L以补足贮存铁,总疗程一般需要4~6个月,否则易复发。
口服铁剂的不良反应有恶心、上腹痛、便秘和腹泻。如治疗3周无治疗反应,应检查诊断是否准确、是否按医嘱服药、有无活动性出血、有无铁吸收障碍、有无胃Hp感染、有无干扰铁吸收和利用的因素存在。
表1 常用口服铁剂

引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(三)注射铁剂
常用右旋糖酐铁注射液、蔗糖铁注射液及葡萄糖酸铁钠注射液三种(表2)。注射铁剂推荐静脉注射。静脉注射过快(>100mg/min)可致局部静脉疼痛、发红及金属味,但时间很短,只要缓慢注射即可消失。全身反应包括即刻及延迟反应;即刻反应有低血压、头痛、恶心、荨麻疹,罕有过敏反应,但严重可致命;延迟反应包括淋巴结肿大、肌痛、关节痛、发热等。但严重过敏反应甚少见,主要见于右旋糖酐铁,发生率约0.6%,葡萄糖酸铁钠为0.04%,蔗糖铁则更低。长期过量应用会增加氧化应激和感染的风险。
表2 三种静脉铁剂的剂量

引自:实用内科学.第16版.ISBN:978-7-117-32482-3
注射铁剂应严格掌握指征:①不能耐受口服铁剂或口服无效者,如胃大部切除、小肠旁路手术、乳糜泻、萎缩性胃炎、炎症性肠病等消化道疾病,遗传性铁难治性IDA;②需要尽快补铁患者,如妊娠后期的缺铁,失血速率快于口服铁剂的补偿率,先天性凝血出血疾病;③长期血透不能维持铁平衡或有功能性缺铁患者(如慢性肾衰贫血)同时应用红细胞生成素治疗者。
注射铁剂总量可按下列公式计算:
铁剂总量(mg)= 体重(kg)×[150-患者血红蛋白(g/L)]×0.24+500mg
注射铁剂的具体用法如下:右旋糖酐铁注射液(100mg/支),可以肌内注射、静脉推注和静脉滴注。静脉滴注首次使用前先做过敏试验,25mg溶于50ml生理盐水中,静脉滴注5分钟以上,如60分钟后无不良反应,即可静脉滴注。右旋糖酐铁100mg(2ml)用0.9%氯化钠溶液稀释至100ml,30分钟内滴注完毕,开始要慢。1周2~3次,可根据补铁总量决定。如采用一次性滴注给药方法,右旋糖酐铁1 000mg(20ml)应稀释至250~500ml,静脉滴注1~2小时。也可不经稀释肌内注射,每次100mg。
蔗糖铁注射液(100mg/支),可以静脉滴注和静脉推注,不建议肌内注射。静脉滴注时只能用生理盐水稀释,100mg(5ml)稀释于100ml生理盐水中静脉滴注。也可以不经稀释直接静脉推注,100mg(5ml)至少推注5分钟,每次最大推注剂量为 200mg(10ml)。
葡萄糖酸铁钠(62.5mg/支),125mg(10ml)用 0.9%生理盐水稀释,静脉滴注1小时。
应加强妇幼保健,预防早产,做好喂养指导,提倡母乳喂养,及时添加含铁量及铁吸收率高的辅食品。重视置节育环月经过多的问题。防治寄生虫病,特别是钩虫病。积极治疗慢性出血病灶。对早产儿、妊娠期妇女、胃切除者及反复献血者,应预防性口服铁剂。在高危人群也可推行铁强化食品。













