英文名称 :aplastic anemia
中文别名 :再障
再生障碍性贫血(aplastic anemia,AA),是一组最常见的获得性骨髓造血功能衰竭症(bone marrow failure),导致骨髓造血干/祖细胞和三系血细胞产生减少,外周血呈全血细胞减少,但骨髓中无恶性细胞浸润,无广泛网硬蛋白纤维增生。据国内21个省、自治区、直辖市的调查,该病年发病率为0.74/10万。西方国家为0.20/10万。各年龄组均可发病,发病年龄有两个高峰:15~25岁和60~65岁。
(一)自身免疫性再生障碍性贫血
绝大多数临床诊断原发性的获得性再生障碍性贫血是属于自身免疫性疾病,其靶器官为骨髓,最终引起骨髓衰竭。获得性再生障碍性贫血应用抗淋巴细胞球蛋白和/或环孢素等免疫抑制剂治疗后,至少有50%~80%的患者获得缓解;患者骨髓祖细胞体外培养去除T淋巴细胞可使集落生长恢复;再生障碍性贫血骨髓寡克隆T淋巴细胞内及患者血清中均可检出含高浓度IFN-γ和TNF-α。由于骨髓中IFN-γ和TNF-α产生过多,诱导骨髓CD34+细胞大量凋亡,从而引起造血干/祖细胞减少。自身寡克隆抑制性T淋巴细胞产生的机制尚不清楚,可能和调节性T细胞(CD4+、CD25+和FoxP3+)功能丧失有关。近年来由于二代测序技术的应用,发现50%再生障碍性贫血存在克隆性造血,约有1/3的患者具有骨髓增生异常综合征相关的基因突变,出现阵发性睡眠性血红蛋白尿克隆是最常见的一种克隆性造血。AA的克隆性造血是造血干细胞免疫打击后筛选出来的,不等同于恶性克隆性疾病,但有克隆性演变为骨髓增生异常综合征的风险。此外AA可继发于胸腺瘤、系统性红斑狼疮、嗜酸性筋膜炎和类风湿关节炎等,患者血清中可找到抑制造血干细胞的抗体。药物的特异质反应及病毒性肝炎相关性再生障碍性贫血也是自身免疫性再生障碍性贫血。
(二)药物性再生障碍性贫血
有两种类型:
1.和剂量有关,系药物毒性作用,达到一定剂量就会引起骨髓抑制,如各种抗肿瘤药。其中细胞周期特异性药物主要作用于容易分裂的细胞,因此发生全血细胞减少时骨髓仍保留一定量的多能干细胞,停药后AA可以恢复;白消安和亚硝脲类不仅作用于进入增殖周期的细胞,而且也作用于非增殖周期的细胞,常导致长期骨髓抑制难以恢复。此外,无机砷、雌激素、苯妥英钠、吩噻嗪、硫尿嘧啶及氯霉素等也可以引起与剂量有关的骨髓抑制。
2.和剂量关系不大,仅个别患者发生造血障碍,多系药物的特异质反应,是自身免疫性的,常导致持续性AA。常见的有氯霉素、有机砷、米帕林、三甲双酮、保泰松、金制剂、氨基比林、吡罗昔康、磺胺、甲砜霉素、卡比马唑、甲巯咪唑、氯磺丙脲等。最常见是由氯霉素引起的,氯霉素的化学结构含有一个硝基苯环,其骨髓毒性作用与亚硝基-氯霉素有关,它可抑制骨髓细胞内线粒体DNA聚合酶,导致DNA及蛋白质合成减少,也可抑制血红素的合成,幼红细胞质内可出现空泡及铁粒幼细胞增多。
(三)病毒性肝炎相关性再生障碍性贫血
其简称肝炎相关性再生障碍性贫血(hepatitis associated aplastic anemia,HAAA),是病毒性肝炎最严重的并发症之一,发生率不到1.0%,占AA患者的3.2%。20%病例现已明确由乙型肝炎引起,而80%病例引起AA的病毒性肝炎亚型至今尚未明确(非甲、乙、丙、丁、戊)。临床上有两种类型:①急性型居多数,起病急,肝炎和AA发病间期平均10周左右,肝炎已处于恢复期,但AA病情重,生存期短,发病年龄轻,大多病毒性肝炎亚型不明确;②慢性型属少数,大多在慢性乙型肝炎基础上发病,病情轻,肝炎和AA发病间期长,生存期也长。肝炎病毒对造血干细胞有直接抑制作用,也可通过病毒介导的自身免疫异常,尚可破坏骨髓微循环。其他病毒(如人类微小病毒B19、EB病毒等)也有报道。
(四)苯中毒相关再生障碍性贫血
苯及其衍化物和AA的关系已为许多实验研究所肯定,苯进入人体易固定于富含脂肪的组织,慢性苯中毒时苯主要固定于骨髓,苯的骨髓毒性作用与其代谢产物(苯二酚、邻苯二酚)有关,酚类为原浆毒,可直接抑制细胞核分裂,所形成的半抗原可刺激免疫反应。
(五)造血干/祖细胞自身缺陷相关再生障碍性贫血
PNH和AA的关系相当密切,PNH系获得性造血干/祖细胞自身缺陷引起造血衰竭。约30%PNH患者有AA病史,AA患者采用流式细胞术检测PNH克隆阳性率可达25%~67%,甚至临床上有AA-PNH综合征,两者可先后或同时发生。AA患者出现PNH克隆的机制仍不清楚,可能和AA患者造血干/祖细胞“逃逸”免疫攻击而自身选择的结果。近年研究还发现某些获得性再生障碍性贫血患者白细胞染色体端粒长度缩短,这些患者常对免疫抑制剂无效。
(六)其他因素
包括:
1.电离辐射
X线、γ线或中子可直接损害造血干细胞和骨髓微环境。长期超允许量放射线照射(如放射源事故)可致AA。全身照射超过700~1 000cGy可致持久性AA,>4 000cGy骨髓微环境被破坏,骨髓不能支持造血。
2.妊娠
有极少数病例报道AA在妊娠期发病,分娩或人工流产后缓解,第二次妊娠时再发,可能与妊娠激活免疫反应有关。
(一)血常规检查
血常规检查呈全血细胞减少,贫血属正常细胞型,亦可呈轻度大红细胞型。外周血片手工分类十分重要,红细胞形态应基本正常,仅见轻度大小不一,但无明显畸形及多染现象,无幼红幼粒细胞出现。网织红细胞显著减少。
(二)骨髓象检查
应做多部位骨髓穿刺涂片检查并同时进行骨髓小粒分类计数。SAA呈多部位增生减低或重度减低,三系造血细胞明显减少,尤其是巨核细胞和幼红细胞;非造血细胞增多,尤为淋巴细胞增多。NSAA不同部位穿刺所得的骨髓象很不一致,可从增生不良到增生象,但至少要有一个部位增生不良;如增生良好,晚幼红细胞(炭核)比例常增多,其核为不规则分叶状,呈现脱核障碍,但巨核细胞明显减少。NSAA可有轻度红系病态造血,但绝对不会出现粒系和巨核细胞病态造血。骨髓涂片肉眼观察油滴增多,骨髓小粒镜检非造血细胞和脂肪细胞增多,一般在60%以上。
(三)骨髓活组织检查和放射性核素骨髓扫描
由于骨髓涂片易受周围血液稀释的影响,有时一两次涂片检查难以正确反映造血情况,而骨髓活组织检查(至少取2cm骨髓组织)估计增生情况优于涂片,可提高诊断的正确性,应作为诊断AA必备条件。
AA骨髓病变的特点是造血组织减少,造血组织与脂肪组织比例多在2∶3以上。造血灶中造血细胞(粒系、红系和巨系)减少,而非造血细胞(淋巴细胞、浆细胞、肥大细胞和网状细胞)增多。骨髓中有血浆渗出、出血及间质水肿。SAA骨髓病变发展迅速而广泛;CAA则呈渐进性向心性萎缩,先累及髂骨,然后是椎骨棘突与胸骨。CAA尚存在代偿性增生灶,后者主要是幼红细胞增生伴成熟障碍。99mTc硫化锝或111In氯化铟全身骨髓γ照相可反映功能性骨髓的分布,可以间接反映造血组织减少的程度和部位。
(四)其他检查
流式细胞仪检测骨髓CD34+细胞数对鉴别AA和MDS有重要意义,AA显著降低(<0.5%),低增生MDS则明显增高。造血祖细胞培养不仅有助于诊断,而且有助于检出有无抑制性淋巴细胞或血清中有无抑制因子。成熟中性粒细胞碱性磷酸酶活力增高,血清溶菌酶活力减低。抗碱血红蛋白量增多。染色体检查除Fanconi贫血染色体畸变较多外,一般AA属正常,如有核型异常须除外MDS,但也有12%AA患者可存在染色体核型异常,常见有+8、+6、13号染色体异常。
包括病因治疗、支持疗法和促进骨髓造血功能恢复的各种措施。以自身免疫性AA为例,非重型如不必依赖输血者治疗可以雄激素为主,辅以其他综合治疗,不少病例血红蛋白恢复正常,但血小板长期处于较低水平,临床无出血表现。输血依赖的非重型AA首选环孢素(CsA)+雄激素治疗,6个月治疗无效者亦可选用ATG/ALG+CsA治疗。SAA预后差,一旦确诊宜及早(3周内)选用骨髓移植或ATG/ALG+CsA治疗。治疗方案的选择可依据我国2017年版再生障碍性贫血诊断和治疗中国专家共识(图1)。
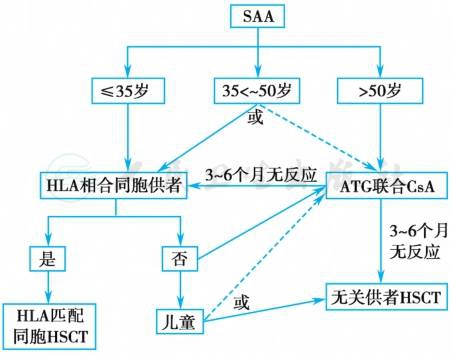
图1 重型再生障碍性贫血治疗选择
注:CsA.环孢素A;HSCT.造血干细胞移植。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(一)免疫抑制剂治疗
免疫抑制剂治疗(immunosuppresive therapy,IST)适用于年龄大于50岁或无HLA相配同胞供髓者的SAA。60岁以上患者慎用ATG。最常用的是抗胸腺球蛋白(ATG)和抗淋巴细胞球蛋白(ALG)。其机制主要通过去除抑制性T淋巴细胞对骨髓造血的抑制,其对B淋巴细胞无作用。剂量因来源不同而异,马源ALG/ATG 10~15mg/(kg•d),兔源 ALG/ATG 2.5~3.75mg/(kg•d),猪源 ATG 20~30mg/(kg•d),共5天;用生理盐水稀释后先做过敏试验(单支ATG/ALG的1/10量加入生理盐水100ml静脉滴注1小时),如无反应,缓慢从大静脉内滴注,每天分2次,每次6~8小时;同时静脉滴注氢化可的松4mg/(kg•d),经另一静脉通道与 ATG/ALG同步输注。患者应给予保护性隔离。为预防血清病,宜在第5天后口服泼尼松1mg/(kg•d),第15天后每5天剂量减半,第30天停用。起效时间一般在用药后6~9个月,无效确认后可进行第2次ALG/ATG治疗,须换用其他动物来源的制剂。单用治疗SAA的有效率可达40%~60%,有效者50%可获长期生存,但有30%复发率。不良反应有发热、寒战、皮疹等过敏反应,以及中性粒细胞和血小板减少引起的感染和出血,滴注静脉可发生静脉炎,血清病在治疗后7~10天出现。用药期间维持血小板>10×109/L。因ALG/ATG具有抗血小板活性作用,故不能在输注ALG/ATG的同时输注血小板悬液。
环孢素(CsA)的作用机制主要通过阻断IL-2受体表达来阻止细胞毒性T淋巴细胞的激活和增殖,抑制产生IL-2和γ干扰素。剂量为3~5mg/(kg•d),分两次口服。多数病例需要长期维持治疗,减量要缓慢,减量过快会增加复发风险。一般推荐疗效达平台期后持续服药至少12个月,以后逐渐减量,总疗程2~3年。对SAA的有效率也可达40%~60%,出现疗效的时间至少要3个月。不良反应有消化道症状、肝肾毒性作用、多毛、牙龈肿胀、肌肉震颤,因安全血药浓度范围较窄宜采用血药浓度监测,常采用测定全血CsA谷浓度来指导用药,安全有效谷浓度范围成人为150~200μg/L,儿童为100~150μg/L。
现代强烈免疫抑制治疗(指ALG/ATG和CsA联合治疗,CsA口服可与ALG/ATG同时应用或ALG/ATG开始后4周用)已成为SAA的标准治疗,有效率可达70%~80%,并且有效速度略快于单用ATG,强烈免疫抑制治疗的疗效已可和骨髓移植相近,但前者不能根治,且有远期并发症,如出现克隆性疾病,包括MDS、PNH和白血病等。伴有明显 PNH克隆(>50%)的AA患者慎用ALG/ATG治疗;妊娠期不推荐使用ALG/ATG,但可予CsA治疗;先天性AA对IST无效。
其他免疫抑制剂尚有单克隆抗T淋巴细胞抗体(如抗CD52单克隆抗体,alemtuzumab)及吗替麦考酚酯(麦考酚酸酯)等。大剂量静脉输注免疫球蛋白(HD-IVIg),可封闭单核巨噬细胞Fc受体,延长抗体包裹血小板的寿命,亦可封闭抑制性T淋巴细胞的作用,中和病毒和免疫调节效应,适用于SAA有致命出血表现伴血小板同种抗体阳性、血小板输注无效时,以及病毒相关性SAA的治疗。国外有应用大剂量环磷酰胺[CTX 45mg/(kg•d),连续 4天]治疗 SAA,但治疗相关病死率高而未被推荐。但上述免疫抑制剂的疗效均不及ALG/ATG和CsA。
(二)造血干细胞移植
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是治疗SAA和VSAA的最佳方法,且能达到根治目的。移植后长期无病存活率可达60%~80%,但移植需尽早进行,因初诊者常需输红细胞和血小板,这样易使受者对献血员的次要组织相容性抗原致敏,导致移植排斥的发生率升高。一旦确诊SAA或VSAA,具有HLA配型相合的同胞供者,年龄<35岁,应首选同胞供者造血干细胞移植(MCD-HSCT);年龄在35~50岁的患者,应于2个疗程标准免疫抑制剂治疗失败后才考虑移植治疗。HLA配型相合无关供者的HSCT适应证掌握必须严格,仅适用于无同胞供者,且免疫抑制治疗失败患者的二线治疗。近年来,国内临床研究发现随着HLA配型技术的发展,预处理方案的改进及移植后支持疗法的加强,亲缘半相合造血干细胞移植(Haplo-HSCT)、无关供者HSCT(UD-HSCT)和脐血 HSCT(UCB-HSCT)疗效与MSDHSCT无明显差异,UCB-HSCT虽然造血重建率明显低于其他移植方式,但总体预后亦无明显差异。
(三)雄激素治疗
雄激素是治疗NSAA不必依赖输血患者和先天性AA的首选药物。常用的雄激素有司坦唑醇(系17α-烷基雄激素类)、丙酸睾酮和十一酸睾酮系睾丸素酯类。两者对造血干细胞具有直接刺激作用,促使其增殖和分化。
因此雄激素必须在一定量残存的造血干细胞基础上才能发挥作用,SAA常无效,但有端粒缩短的AA患者有效。用法为:丙酸睾酮50~100mg/d肌内注射,司坦唑醇6~12mg/d口服,十一酸睾酮120~160mg/d口服,十一酸睾酮注射液0.25g肌内注射,每周1次,首次1.0g。疗程至少6个月以上。红系疗效较好,一般治疗后1个月网织红细胞开始上升,随后血红蛋白上升,2个月后白细胞开始上升,但血小板多难以恢复。部分患者对雄激素有依赖性,停药后复发率达25%~50%,复发后再用药仍可有效。丙酸睾酮的男性化副作用较大,肌内注射多次后局部常发生硬块,宜多处轮换注射。17α-烷基类雄激素的男性化副作用较丙酸睾酮轻,但其肝毒性反应显著大于丙酸睾酮,多数患者服药后出现谷丙转氨酶升高,严重者发生肝内胆汁淤积性黄疸,少数甚至出现肝血管肉瘤和肝癌,但停药后可消散。
(四)细胞因子
G-CSF可有效减轻SAA患者粒细胞缺乏的程度,缩短粒细胞缺乏的时间,减低感染率,因此在HSCT或IST基础上应尽早使用。TPO和TPO受体激动剂能促进巨核细胞增殖、分化和成熟,并对粒细胞和红细胞也有提升作用。近年有报道TPO受体激动剂艾曲波帕用于难治性SAA,有效率达40%~50%,如和IST合用可提高疗效,剂量可用固定剂量(150mg/d)或递增剂量(初始50mg/d,每两周每日剂量增加25mg,直到 150mg/d)。













