英文名称 :anemia
贫血(anemia)是指人体循环红细胞容量减少引起的一种病理状态。临床上常以外周血单位容积内血红蛋白(Hb)量、红细胞(RBC)数和/或血细胞比容(Hct)代替红细胞容量来反映贫血程度,一般都以Hb量低于正常参考值95%的下限作为贫血的诊断标准。血红蛋白浓度的降低一般都伴有相应红细胞数量或血细胞比容的减少,但也有不一致。个别轻型缺铁性贫血或珠蛋白生成障碍性贫血可仅有血红蛋白减少,而红细胞数量和血细胞比容都在正常范围内。单位容积血液中血红蛋白量因地区、年龄、性别以及生理性血浆容量的变化而异。婴儿和儿童的血红蛋白量约比成人低15%。男女之间的差异在青春期后才逐渐明显。妊娠时血容量增加,血红蛋白和红细胞可因被稀释而浓度相对降低。男性65岁以后Hb测定值较65岁以前为低,但女性无差异。
贫血诊断的标准,都以1972年WHO制订的诊断标准为依据。在海平面地区Hb低于以下水平可诊断为贫血:6个月到6岁儿童110g/L,6~14岁儿童120g/L,成年男性 130g/L,成年女性(非妊娠)120g/L,妊娠女性110g/L。Hb<110g/L作为65岁以后老年人贫血诊断标准,不分男女。选用某一血红蛋白值来划分有无贫血,要做到非常合理是相当困难的。因为正常人群血红蛋白分布曲线和贫血人群血红蛋白分布曲线之间互有重叠。事实上Hb正常值的个体差异较大,如患者一周前Hb 155g/L,现Hb降低为140g/L,虽然在正常范围,但应认为是有意义的。决定患者是否有贫血时还须注意Hb测定的标准化,以及采血的部位。对于指端血、耳垂血、静脉血,其测定值可略有不同。WHO规定的标准方法为静脉血氰化高铁血红蛋白法。此外,血浆容量的生理和病理变化,如妊娠后期3个月、全身水肿、充血性心力衰竭、低蛋白血症及某些细胞因子的作用,因血浆容量增加,血液被稀释,Hb浓度下降,可能被误诊为贫血,也称为稀释性假性贫血;血浆容量的丢失(如失水、腹泻、呕吐、重度烧伤或大量使用利尿剂后)血液浓缩,Hb浓度可上升,即使有贫血检测值也可正常。急性大量失血,红细胞和血浆同时丢失,虽然红细胞丢失过多,但贫血可不明显。贫血按严重程度可分为:极重度贫血,Hb≤30g/L;重度贫血,Hb为 31~60g/L;中度贫血,Hb为61~90g/L;轻度贫血,Hb>90g/L与低于正常参考值的下限之间。
贫血是一种症状,而不是具体的疾病。各种疾病都可伴有贫血。如果许多原因不同的贫血具有类似的临床表现和血液学特征,则可归纳为一种综合病征,如再生障碍性贫血、缺铁性贫血等。贫血在世界各地均属常见病,在发展中国家以及血红蛋白病或葡萄糖-6-磷酸脱氢酶变异高发的多民族及地区,贫血问题尤为突出。
(一)红细胞生成减少引起的贫血
1.临床上最常见的是造血原料缺乏引起的红细胞生成减少,包括缺铁性贫血和缺乏维生素B12或叶酸引起的巨幼细胞贫血。自红系祖细胞发育至中幼红细胞,细胞要经过多次分裂增殖,而DNA的合成倍增是细胞分裂期前所必需的。维生素B12和叶酸则是DNA合成的主要辅酶。无论是维生素B12或叶酸缺乏或由于其他因素影响DNA合成,都可导致核分裂延迟甚至停顿;形成核和胞质发育不平衡、核染色质疏松、形态巨大而畸形的巨幼红细胞。周围血液可见卵圆形的大红细胞,称为巨幼细胞贫血。在幼红细胞不断增殖的过程中,细胞质也逐渐发育成熟。早在早幼红细胞胞质内就开始合成微量血红蛋白,至中幼红细胞阶段血红蛋白合成达到高峰,一直持续到网织红细胞。血红蛋白的合成需要铁。铁通过血浆中的转铁蛋白运输到幼红细胞表面,和幼红细胞表面的转铁蛋白受体结合,通过胞饮方式进入质内,输送到线粒体,和原卟啉合成正铁血红素。珠蛋白是在幼红细胞内的核糖体上合成的。正铁血红素与珠蛋白合成血红蛋白分子。所以任何原因引起的血红蛋白合成障碍,不论是缺铁(缺铁性贫血)或铁代谢紊乱(慢性病贫血)、珠蛋白合成障碍(血红蛋白病)及血红素卟啉环合成障碍(铁粒幼细胞贫血)等,都可以导致Hb合成障碍,出现大量细胞质不足(小红细胞)及血红蛋白含量减少(低色素)的成熟红细胞,统称为低色素性贫血。
2.骨髓造血衰竭综合征系是多种不同原因引起骨髓造血干/祖细胞凋亡增加,或理化因素、生物因素对造血干细胞的损伤,或造血干细胞具有遗传性缺陷,或造血微环境有缺陷,导致骨髓造血衰竭,引起全血细胞生成减少的一组贫血。其中最常见的是自身免疫性再生障碍性贫血,属于自身免疫性疾病,其靶器官为骨髓。遗传性骨髓衰竭综合征包括Fanconi贫血、先天性角化不良及Shawachman-Diamond综合征。骨髓造血衰竭发生在单系,如单系红系造血衰竭,而其他系列如髓系、巨核系、淋系血细胞均正常,称纯红细胞再生障碍性贫血。
3.继发于慢性系统性疾病的贫血,其中最常见为炎症性贫血(anemia of inflammation),继发于慢性炎症、恶性肿瘤和自身免疫性疾病,其发病率仅次于缺铁性贫血,在住院贫血病例中居首位。炎症性贫血病理生理的特点是体内炎症性细胞因子分泌增多,包括 IL-1、TNF-α、IFN-γ、IL-6,导致 EPO 产生减少,EPO反应迟钝,IL-6通过肝脏上调铁调素(hepcidin)的产生,过量的铁调素导致炎症性贫血铁代谢的异常,TNF-α、IL-1和 IFN(IFN-α、IFN-β、IFN-γ)可抑制BFU-E 和CFU-E 的增殖和分化,最终导致红细胞生成减少,此外,炎症性贫血尚有红细胞寿命缩短。慢性肾病贫血(anemia of chronic kidney disease)也很常见,在透析患者中,贫血患病率高达51.5%,且贫血随肾功能恶化而加重,慢性肾脏病发生贫血的主要原因是EPO产生不足,同时具有炎症性贫血相同病理生理特点。许多内分泌激素参与红细胞生成的调节,包括甲状腺激素、糖皮质激素、睾酮和生长激素,因此甲状腺功能减退症、甲状腺功能亢进症、肾上腺皮质功能减退症、垂体功能减退症、甲状旁腺功能亢进症均可导致贫血。由于主要见于内分泌功能减退症,因此这类贫血统称为内分泌功能减退症贫血(anemia of endocrine hypofunction),一般为轻、中度贫血,激素替代治疗可纠正贫血。慢性肝病也引起轻、中度贫血,称慢性肝病性贫血(anemia of chronic liver disease)。
4.其他引起红细胞生成减少性贫血还包括骨髓发生纤维化或骨髓被异常细胞所侵犯,可导致骨髓结构和功能的破坏,同时伴有骨髓外造血灶的建立。临床上出现贫血,周围血液出现幼粒和幼红细胞,称为幼粒-幼红细胞贫血或骨髓病性贫血(myelophthisic anemia)。无效红细胞生成是指患者骨髓增生,幼红细胞增多,但由于幼红细胞本身有缺陷导致过早在骨髓凋亡,引起红细胞生成减少,网织红细胞减少,导致贫血。见于骨髓增生异常综合征——难治性贫血、巨幼细胞贫血及珠蛋白生成障碍性贫血等。
(二)红细胞破坏过多引起的贫血
正常红细胞的平均寿命约120天。衰老的红细胞被单核巨噬细胞吞噬、破坏,尤其是脾脏在破坏红细胞中占重要地位。红细胞的生存期和红细胞膜的结构、酶系的活力及血红蛋白分子等密切相关。任何原因导致红细胞有内在缺陷或外部原因,使红细胞在血管内破坏或被脾脏和肝脏过早清除,都可引起贫血。如骨髓造血功能正常,可以具有产生红细胞6~8倍的代偿能力,也可不出现贫血。如红细胞寿命缩短,破坏加速超过了骨髓代偿能力就会引起溶血性贫血(hemolytic anemia)。红细胞内在因素引起的溶血性贫血大多是遗传性的,红细胞外在因素所致溶血性贫血均系获得性的。
1.红细胞内在因素引起的溶血性贫血
红细胞内在缺陷包括红细胞膜缺陷、红细胞酶的缺陷和血红蛋白异常。红细胞膜缺陷多因基因突变致红细胞膜骨架蛋白异常,引起红细胞形态改变,这种形态异常红细胞容易在单核巨噬细胞系统内破坏,如遗传性球形红细胞增多症,也可因造血干细胞克隆性病变引起获得性红细胞膜缺陷,受累红细胞对补体介导的溶血敏感性增高,造成血管内溶血称阵发性睡眠性血红蛋白尿。参与红细胞代谢的酶(糖代谢酶)由于基因突变使酶活性改变,导致无氧糖酵解途径酶缺陷可造成红细胞能量来源不足,使细胞膜功能异常,产生溶血,如丙酮酸激酶缺乏症。磷酸戊糖旁路代谢酶缺陷的结果造成还原型谷胱甘肽的减少,细胞易受氧化损伤而发生溶血,如葡糖糖-6-磷酸脱氢酶缺乏。因基因突变,使珠蛋白肽链结构异常(异常血红蛋白病)或肽链合成异常(珠蛋白生成障碍性贫血),导致红细胞硬度增加。或异常血红蛋白在红细胞内形成聚合体、结晶体或包涵体,造成红细胞变形性降低,通过单核巨噬细胞系统(特别是脾)时,破坏增加。
2.红细胞外在因素引起的贫血
红细胞本身正常,但由于某些外在因素,包括化学、物理、机械、感染、毒素及免疫因素的影响,导致红细胞破坏过多,引起溶血性贫血。因此可分为有免疫性因素和非免疫性因素两种。免疫性溶血是抗原抗体介导的红细胞破坏。自身免疫性溶血性贫血患者产生抗红细胞抗体,温抗体型为不完全抗体,与红细胞结合后,致敏红细胞在单核巨噬细胞系统内被破坏或清除,是免疫性溶血性贫血中最常见的类型。冷抗体型多为完全抗体,可使红细胞直接在血管内破坏。血型不合输血亦可造成血管内溶血。新生儿溶血病是因为母婴血型不合,母亲产生的抗胎儿血型IgG型抗体通过胎盘进入胎儿血液循环,造成溶血,最常见的是ABO血型不合,其次是Rh血型不合。药物诱发的免疫性溶血性贫血,因药物分子量小,称“半抗原”和大分子载体蛋白(红细胞膜蛋白)结合,可诱发免疫反应产生抗体,20世纪80年代引起溶血药物主要为α-甲基多巴和大剂量青霉素,近年来随着上述药物应用的减少,80%病例由第二三代头孢菌素和β-内酰胺酶抑制剂引起,特别是头孢替坦、头孢曲松和哌拉西林。嘌呤类似物(氟达拉滨等)引起的也日益增多。
非免疫因素有:①感染因素,引起溶血的病原体种类繁多,有细菌(包括钩端螺旋体、支原体)、病毒、寄生虫等,但以疟疾为最常见,间日疟原虫仅侵犯网织红细胞,恶性疟原虫可侵犯各期红细胞,以后者导致的溶血更为严重。巴尔通体和巴贝虫感染也可引起溶血。梭状芽孢杆菌脓毒血症可致严重急性溶血。②物理因素,包括机械性损伤和热损伤。红细胞通过部分阻塞的血管或经过血管异常表面,会使细胞破裂导致溶血,患者外周血涂片见到红细胞碎片,可见于心脏瓣膜修复术(包括人工瓣膜、同种瓣膜、异种瓣膜和自身瓣膜成形术)、腱索断裂及心内补片修复术,瓣膜疾病(特别是主动脉瓣狭窄)和主动脉缩窄。也见于运动性血红蛋白尿症等。微血管病性溶血性贫血(microangiopathic hemolytic anemia),包括血栓性血小板减少性紫癜、溶血尿毒症综合征、弥散性血管内凝血及HELLP综合征等也属于红细胞的机械性损伤。严重烧伤后可出现急性血管内溶血。③化学因素,包括药物诱发(主要是氧化剂)可使血红蛋白氧化变性,形成高铁血红蛋白,变性血红蛋白,均可导致红细胞破坏,特别当红细胞内还原系统有缺陷或血红蛋白异常时更易发生。非氧化剂类化学物包括砷化氢、铜、铅,高浓度氧等也可以引起红细胞破坏。④生物毒素,包括毒蛇咬伤,有些蛇毒对红细胞膜具有直接毒性,有些可激活补体引起溶血。毒蜘蛛、毒蜂咬伤也可引起溶血。
(三)红细胞丢失过多引起的贫血
血液在短期内大量丢失,可导致急性失血后贫血(acute post-hemorrhagic anemia),其实急性大量失血主要病理生理改变是血容量急剧减少引起,其主要临床表现为血容量不足,2~3天后血容量的恢复主要依靠水、电解质和白蛋白从血管外被动员入血,使血浆容量扩增,血液被稀释,该时才会出现贫血。慢性失血性贫血实质上就是缺铁性贫血。
贫血的发病机制往往是多因素的。例如恶性肿瘤所致贫血的发生机制有失血(失血性贫血)、骨髓浸润(骨髓病性贫血)、肿瘤广泛转移在微血管形成瘤细胞栓(微血管病性溶血性贫血)、营养障碍致造血物质缺乏(营养性贫血)、红细胞生成素减少(慢性病贫血)、化疗和放疗的应用(治疗相关性贫血)。此外,某些肿瘤如胸腺瘤患者体内可产生抗幼红细胞或抗EPO抗体,致单纯红细胞再生障碍性贫血,淋巴瘤等可导致自身免疫性溶血性贫血,多发性骨髓瘤等因血浆球蛋白异常增多,大量细胞外液进入血管内可致稀释性贫血。药物也能通过不同机制引起多种类型的贫血,许多药物可抑制骨髓造血引起再生障碍性贫血(如抗肿瘤药物和氯霉素等),某些药物可影响红系细胞的DNA合成,引起巨幼细胞贫血(如抗代谢药、抗癫痫药等),阿司匹林可引起胃肠道出血致缺铁性贫血,抗结核药可引起铁粒幼细胞贫血,药物或其代谢产物可与红细胞膜发生作用,导致新抗原形成,引起药物免疫性溶血性贫血,如奎尼丁、非那西丁、磺胺类药物等,药物还能作用于有遗传性酶缺陷或异常血红蛋白的患者,引起溶血性贫血发作。同一类型的贫血也可有多种发病机制并存,如巨幼细胞贫血既有DNA合成障碍,又有红细胞破坏过多和幼红细胞在髓内过早凋亡等因素。
(一)贫血的形态学分类
贫血可按不同的发病机制和细胞形态学特征进行分类(表1)。按发病机制可分为红细胞生成减少、红细胞破坏过多及失血三类。按形态学,则可分为正常细胞性、大细胞性和小细胞低色素性三类。形态学分类不是固定不变的。例如再生障碍性贫血多数是正常细胞性贫血,但偶可表现为大细胞性贫血,溶血性贫血和急性失血后贫血也可呈正常细胞性贫血也可呈大细胞性贫血。贫血的形态学分类虽过于简单,但易于掌握,可提供诊断线索,如小细胞低色素性贫血多数是缺铁性贫血,大细胞性贫血很可能是由维生素B12或叶酸缺乏所引起。
表1 贫血的发病机制和形态学分类
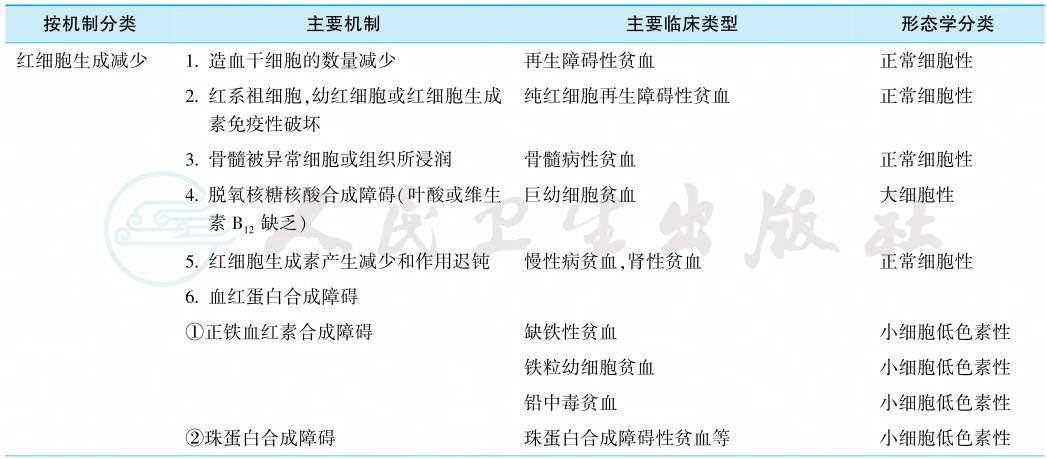
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
续表
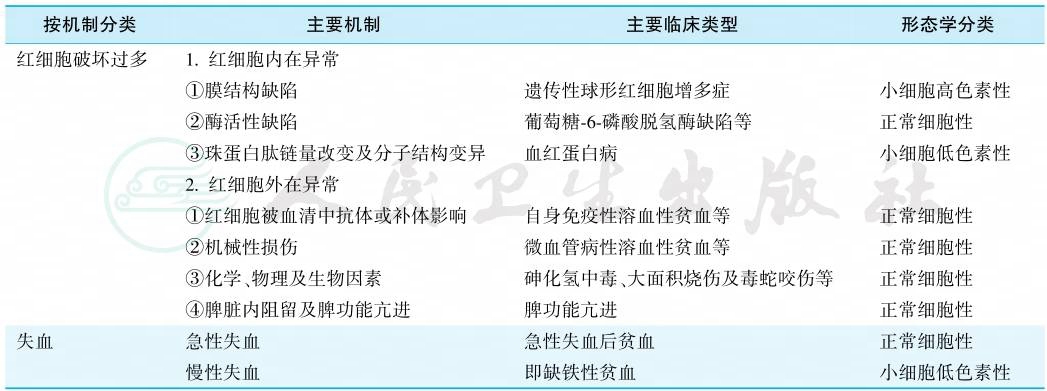
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(二)溶血性贫血的分类
按病情可分为急性和慢性溶血性贫血。按溶血的场所可分为血管内溶血和血管外溶血。按病因可分为遗传性和获得性溶血性贫血。按发病机制可分为红细胞内异常和红细胞外异常引起的溶血性贫血。
按临床表现分类:①急性溶血:急性溶血性贫血起病急骤,短期大量溶血引起寒战、高热、头痛、呕吐、四肢腰背疼痛,紧接着出现血红蛋白尿,其后出现黄疸。由于红细胞大量破坏,其分解的产物对机体产生毒性作用,严重者可发生周围循环衰竭。红细胞破坏的产物可引起肾小管坏死和管腔阻塞,导致急性肾衰竭。②慢性溶血:慢性溶血性贫血多为血管外溶血,发病缓慢,表现为贫血、黄疸和脾大三大特征。长期的高胆红素血症,可并发胆石症和肝功能损害。③血管内溶血:以急性溶血多见,多有腰背酸痛、高热并伴有血红蛋白血症、血红蛋白尿。也有慢性血管内溶血,可有含铁血黄素尿。见于阵发性睡眠性血红蛋白尿、红细胞破碎综合征、ABO血型不合所致输血反应、阵发性冷性血红蛋白尿、感染(如恶性疟疾、梭状芽孢杆菌败血症)、化学因素(砷、蛇毒、蜘蛛毒)引起的溶血性贫血、输注低渗溶液及热损伤引起的溶血性贫血。④血管外溶血:血管外溶血主要发生于脾,临床表现一般较轻,可有血清游离胆红素轻度升高,一般不出现血红蛋白尿,可有脾大。
贫血的病理生理学基础是血红蛋白减少,血液携氧能力减低,全身组织和器官发生缺氧变化等。首先体内相应的代偿机制发挥作用,例如脉搏变快、心搏排血量增加、呼吸加速、红细胞生成素分泌增多,以及血红蛋白与氧的亲和力降低等。有些脏器(如肾脏等)则发生血管收缩,使更多的血液流向缺氧较为敏感的器官如脑、心脏等。红细胞内合成更多的2,3-二磷酸甘油酸(2,3-DPG),后者与脱氧血红蛋白的β链相结合,以降低血红蛋白对氧的亲和力,使组织获得更多的氧。
实验室检查既是确立贫血的可靠方法,又是明确其类型的重要步骤。
(一)红细胞参数
根据自动血细胞分析仪获得的参数,有助于贫血的形态学分类(表2)。其中以MCV和RDW意义最大,MCV是反映红细胞大小的参数,RDW是反映红细胞大小不一程度的参数。
表2 贫血的细胞形态学分类
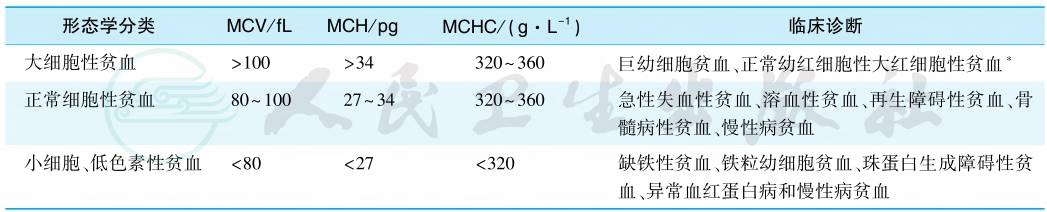
注:∗包括溶血性贫血、急性失血后贫血、肝病贫血、难治性贫血。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(二)周围血涂片
它不仅有助于贫血的形态学分类,而且又能从中发现异形红细胞。红细胞有大小不均、小型红细胞增多且中央苍白区扩大,见于低色素性贫血。球形红细胞增多见于遗传性球形红细胞增多症和自身免疫性溶血性贫血,椭圆形红细胞增多见于遗传性椭圆形红细胞增多症等,镰形红细胞见于镰状细胞贫血,口形红细胞见于遗传性口形红细胞增多症等,棘形红细胞见于先天性无β脂蛋白血症和肝衰竭,靶形红细胞常见于珠蛋白生成障碍性贫血。各种异形红细胞,如梨形、哑铃形、三角形甚至红细胞碎片,则提示有微血管病性溶血性贫血的可能。泪滴状红细胞可见于骨髓纤维化。出现幼粒幼红细胞是骨髓病性贫血的重要依据。溶血性贫血周围血液可出现幼红细胞,但数量不多,主要是晚幼红细胞,严重溶血时数量增多且可见豪-胶小体和幼粒细胞。
(三)网织红细胞计数
网织红细胞(reticulocyte,Ret)是晚幼红细胞脱核后尚未完全成熟的红细胞,因细胞质内残存核糖体RNA,经煌焦油蓝或新亚甲蓝活体染色后在显微镜下呈网状而得名。Ret在骨髓停留2~3天,外周血停留1天后变为成熟红细胞。显微镜下人工计数因影响因素较多,故当Ret数量较低时计数结果误差较大。血细胞自动分析仪计数的精确度比人工计数提高了10倍以上。新型的血细胞自动分析仪采用流式激光技术和荧光染色技术测量Ret胞质内的RNA含量,并根据荧光强度,将Ret分为高荧光强度Ret(HFR)、中荧光强度Ret(MFR)和低荧光强度 Ret(LFR),并计算未成熟 Ret分数(IRF)[IRF=(HFR+MFR)/Ret]。 IRF值与RNA含量和Ret幼稚程度呈正相关,能更好地反映骨髓红系的造血功能,因此IRF是评估Ret成熟度的参考指标,其正常参考值为5%~22%。
当外周血有幼红细胞出现时要影响分析仪计数的测定值,故此时应推荐人工计数。
Ret计数是反映骨髓红系增生情况的重要指标,是临床上鉴别红系增生不良性贫血和溶血性贫血最简单的方法。溶血性贫血及急性失血性贫血,其贫血原因系外周性,骨髓代偿性增生功能良好,故Ret数增高,溶血性贫血一般可高达5%~20%,但溶血性再障危象,Ret数可减少;再生障碍性贫血和纯红细胞再生障碍性贫血Ret常有显著减少,骨髓幼红细胞无效增生即髓内过早凋亡,Ret也减少,因此Ret减少常提示贫血原因是骨髓性的。
由于Ret的百分数受红细胞总数的影响,当外周血红细胞数减少时,可使Ret百分数增高,但实际上从骨髓释放的Ret并无增多,因此必须计算绝对值才能反映真实情况。有贫血时Ret绝对值<75×109/L表示贫血是低增生的或红系有成熟障碍;如Ret绝对值>100×109/L常提示贫血的性质为溶血性或出血性及营养性贫血补充治疗后红系的增生反应。
(四)骨髓象检查
根据骨髓增生与否,可将贫血分为增生性和增生不良性两大类。再生障碍性贫血属骨髓增生不良;缺铁性贫血、巨幼细胞贫血、溶血性贫血、急性失血性贫血骨髓增生良好,骨髓增生异常综合征贫血的骨髓增生多数也是良好的;单纯幼红细胞减少或缺如应疑及纯红细胞再生障碍性贫血或继发于肾脏及内分泌疾病的贫血。骨髓涂片检查是确定巨幼细胞贫血的重要方法,但出现幼红细胞巨幼样改变尚见于骨髓增生异常综合征贫血及红白血病等。骨髓涂片铁染色检查是诊断缺铁性贫血和铁粒幼细胞贫血的重要依据,慢性病贫血有铁利用障碍(骨髓小粒可染铁增多,但铁粒幼细胞减少)。骨髓“干抽”常是诊断骨髓纤维化贫血的线索之一。
(五)其他实验室检查
1.有关溶血性黄疸的检查
(1)血清非结合胆红素水平增加:大量溶血时,血清非结合胆红素增加,结合胆红素常少于总胆红素的15%。由于肝脏清除胆红素的能力很强,黄疸仅轻度或中度,即使大量溶血时,一般也不超过85.5μmol/L。血清胆红素浓度除了取决于血红蛋白分解的程度外,还与肝脏清除胆红素的能力密切相关。慢性溶血性贫血患者长期高胆红素血症,会引起肝功能损害,合并肝细胞性黄疸。
(2)尿胆原增加:正常人每天从尿中排出的尿胆原为0~5.9μmol/L。急性大量溶血时,尿胆原排出量明显增多。慢性溶血时,只有当肝功能减退时,尿胆原才会增加。
(3)粪胆原排出增加:正常人每天从粪便中排出的粪胆原为68~473μmol/L。当血红蛋白大量分解时,每日粪胆原排出量可多达680~1700μmol/L,甚至可高达 2 550μmol/L。
2.有关血管内溶血的检查
(1)血红蛋白血症:正常血浆只有微量的游离血红蛋白,含量1~10mg/L。当大量溶血时,主要是血管内溶血时可高达1 000mg/L以上。由于血液标本在体外储存时容易造成溶血,游离血红蛋白检测的实际意义不大。
(2)血红蛋白尿:血浆中的游离血红蛋白超过了结合珠蛋白所能结合的量时,多余的血红蛋白即可从肾小球滤出。血红蛋白尿需和肌红蛋白尿进行鉴别,肌红蛋白是小分子片段,极容易经肾过滤,不会在血浆中积蓄变成肉眼所见的红色,因此观察到血浆变成红色可有助于血红蛋白尿的确定。
(3)含铁血黄素尿:被肾小管重吸收的游离血红蛋白,在近曲小管上皮细胞内被分解为卟啉、铁和珠蛋白。铁以含铁血黄素形式沉积在上皮细胞内,当细胞脱落随尿排出,即成为含铁血黄素尿。含铁血黄素尿主要见于慢性血管内溶血,急性血管内溶血时,含铁血黄素尿要几天后才阳性,并可持续一段时间。
(4)血清结合珠蛋白降低:血清结合珠蛋白是血浆中的一组α2糖蛋白,是血红蛋白的转运蛋白,在肝内产生,正常血清含量为500~1 500mg/L。当血管内溶血后,1分子的结合珠蛋白可结合1分子的游离血红蛋白。此种结合体很快地从血中被肝细胞清除。血清结合珠蛋白的降低可见于血管内溶血,亦可见于血管外溶血,特别是在微血管病性溶血性贫血时是最敏感的溶血指标,可出现在贫血或血红蛋白血症之前。血清结合珠蛋白降低也见于巨幼细胞贫血、髓内溶血和肝病时,而在感染及恶性肿瘤中可升高。
3.血清乳酸脱氢酶(LDH)
溶血性贫血时红细胞内酶(LDH1、LDH2、LDH3)大量进入血浆所致。但很多原因可以引起LDH增高,因此缺乏特异性。
4.红细胞寿命缩短
红细胞寿命测定为诊断溶血的可靠指标。常用51Cr、32P-DFP或3H-DFP(二异丙基氟磷酸)标记红细胞。51Cr仅代表红细胞寿命指数,后两者测定比较接近红细胞的寿命且敏感。近年有应用一氧化碳呼气试验测定红细胞寿命。红细胞肌酸是红细胞寿命的定量指标,因为年轻红细胞肌酸水平高于年老的红细胞,因此可作为溶血的指标,特别是血管内溶血。
贫血性疾病的治疗分“对症”和“对因”两类。
1.对症治疗
目的是减轻重度血细胞减少对病人的致命影响,为对因治疗发挥作用赢得时间。具体内容包括:重度贫血病人、老年人或合并心肺功能不全的贫血病人应输红细胞,纠正贫血,改善体内缺氧状态;急性大量失血病人应及时输血或红细胞及血浆,迅速恢复血容量并纠正贫血;对贫血合并出血者,应根据出血机制的不同采取不同的止血治疗(如重度血小板减少应输注血小板);对贫血合并感染者,应酌情予抗感染治疗;对贫血合并其他脏器功能不全者,应根据脏器的不同及功能不全的程度而施予不同的支持治疗;先天性溶血性贫血多次输血并发血色病者应予祛铁治疗。
2.对因治疗
实乃针对贫血发病机制的治疗。如缺铁性贫血补铁及治疗导致缺铁的原发病;巨幼细胞贫血补充叶酸或维生素B12;溶血性贫血采用糖皮质激素或脾切除术;遗传性球形红细胞增多症脾切除有肯定疗效;造血干细胞质异常性贫血采用造血干细胞移植;AA采用抗淋巴/胸腺细胞球蛋白、环孢素及造血正调控因子(如雄激素、G-CSF、GM-CSF或EPO等);ACD及肾性贫血采用EPO;肿瘤性贫血采用化疗或放疗;免疫相关性贫血采用免疫抑制剂;各类继发性贫血治疗原发病等。













