英文名称 :lupus nephritis
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种病因未明的多系统累及自身免疫疾病,人群发病率为(30~50)/10万。我国约50%初发SLE患者就伴有肾脏累及,即狼疮性肾炎(lupus nephritis,LN)。LN是我国最常见的继发性肾小球肾炎,是SLE发病和死亡的主要原因。
SLE的病因仍不清楚,但明显涉及多种因素,其中包括遗传、激素、免疫和环境因素等具有研究证明。
免疫调节异常是SLE的主要问题,失去对细胞核自身抗原的免疫耐受是SLE的中心机制。CD8+效应性T淋巴细胞杀伤靶细胞,释放出核小体等自身抗原。树突细胞呈递自身抗原给T淋巴细胞。树突细胞表面的T淋巴细胞受体的异常可增加自身抗原的免疫原性。含DNA与RNA的自身抗原分别通过TLR9、TLR7激活树突细胞。抗原提呈细胞以自身抗原为第一信号,以共刺激分子如B7/CD28/CTLA-4为第二信号,活化T辅淋巴细胞。正常情况下,调节性T细胞可以抑制这个过程。但SLE患者CD4+CD25+调节性T细胞减少。而且,SLE患者2型T辅助淋巴细胞因子过度产生,导致B淋巴细胞持续活化、向浆细胞分化增多,自身抗体持续产生。
不同的临床表现是自身抗体形成及免疫复合物(immune complex,IC)产生的直接或间接结果。临床患者自身抗体包括抗核抗体(antinuclear antibody,ANA),其中高滴度的抗双链DNA(anti-double strand DNA,dsDNA)抗体、抗 Sm 抗体对诊断SLE有高特异性。自身抗体可以和肾小球抗原结合,引起免疫炎症。自身抗体也可以同肾小球上已种植的自身抗原结合,或形成自身抗原抗体复合物经循环沉积于肾小球内。在肾脏的IC可以固定补体,引起免疫炎症。此外,IC还能激活其他炎症反应,上调及激活内皮细胞上的黏附分子,从而募集白细胞及启动自身免疫损伤。被激活及损伤的肾小球细胞、浸润的巨噬细胞及细胞产生的炎性因子,使肾脏损害进一步扩大。
(一)肾小球病变
LN肾脏的组织病理变化多样,不同患者、不同肾小球,甚至在不同时间肾脏病理也会发生变化,既可是自发的改变,亦可与治疗相关。
肾小球内细胞增生及浸润是本病的基本病变,致肾小球呈分叶状,部分细胞出现核碎裂。肾小球内免疫复合物沉着是本病的第二基本病变,可沉积于上皮下、内皮下、基底膜及系膜区。免疫荧光可见 IgG、IgM、IgA、补体 C3、C1q阳性,常称为“满堂亮”表现。
2003年国际肾脏病学会/肾脏病理学会(International Society of Nephrology/Renal Pathology Society,ISN/RPS)LN 分型是目前公认的病理分类标准。分型如表1所示。
由于ISN/RPS分型标准主要依赖光镜,2018年国际肾脏病理工作小组对LN病理类型和肾组织活动性指数(activity index,AI)和慢性指数(chronic index,CI)评分标准提出建议,对Ⅳ型LN不再区分球性和节段性,同时建议所有类型使用AI/CI评分系统。
表1 2003年ISN/RPS狼疮性肾炎病理分型
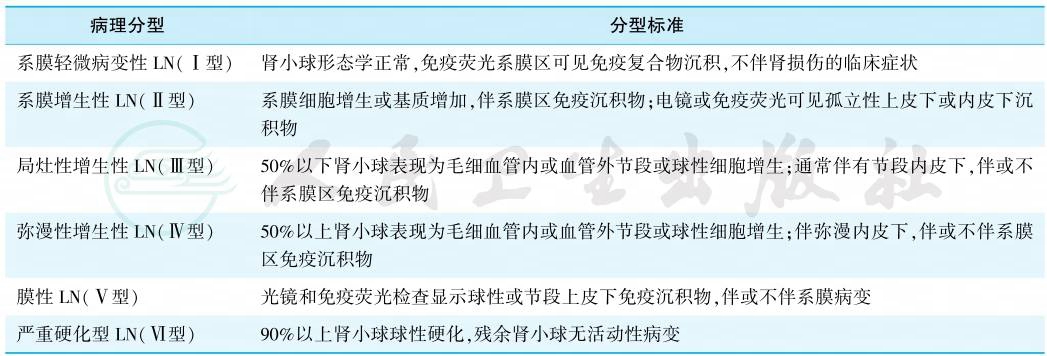
注:Ⅲ型或Ⅳ型LN如果光镜、免疫荧光或电镜提示肾小球上皮侧有广泛(>50%血管袢)免疫沉积物,通常提示同时存在Ⅲ+Ⅴ型,或Ⅳ+Ⅴ型。
(二)间质、血管病变
1.小管间质性肾炎
小管间质性肾炎(间质浸润、小管损害)伴或不伴小管基底膜IC沉积十分常见,常与其他肾小球病变同时存在。小管间质受累程度是判断预后的一个重要指标,它同高血压、血肌酐水平及临床病程进行性发展呈正相关。
2.血管病变
LN常见的肾血管受累,对肾脏预后造成不良影响。包括恶性小动脉性肾硬化、免疫复合物沉积、非炎症性坏死性血管病变、坏死性血管炎和血栓性微血管病。肾小球血栓性微血管病和LN并存时容易漏诊,需要光镜结合电镜加以鉴别。
3.肾小球足细胞病
SLE通过非免疫复合物沉积途径介导,多归入Ⅱ型LN。临床表现为肾病综合征,组织学特征为弥漫性足突融合,系膜区无或少量IC沉积,无内皮下或上皮侧电子致密物沉积。
LN治疗最终目标是提高人和肾脏长期存活率,实现尽可能低的疾病活动度,预防器官损伤,最大限度减少药物毒性,提高患者生活质量。由于不同治疗方案、疗程中可能发生的不良反应各有特点,因此临床医师须熟悉其特点并对患者进行个体化治疗。
(一)常用免疫抑制剂及其用法
1.羟氯喹
除有禁忌外,羟氯喹均应用于各型LN。研究表明,羟氯喹能降低LN的发生率及复发率,增加肾脏缓解率,同时延缓ESRD进展。最大剂量不超过6~6.5mg/(kg·d),缓解期可减量为0.2g/d。羟氯喹有潜在视网膜毒性,须定期接受眼底检查。
2.糖皮质激素
激素在LN疗法中普遍使用,剂量和用法取决于肾脏损伤的类型、活动性、严重程度及其他器官损伤的范围和程度。与无肾脏累及的患者相比,LN患者更容易发生激素相关器官损害。因此,在维持治疗期间应尽量减少剂量(目标维持剂量:泼尼松<7.5mg/d)。一般口服起始剂量为1mg/(kg·d),根据临床反应在6个月内逐渐减至维持量。对于活动增生性及伴血栓性微血管病(thrombotic microangiopathy,TMA)的LN,起始应予大剂量激素。目前正在研究激素快速渐减方案及无激素的方案。
3.环磷酰胺(cyclophosphamide,CYC)
既可影响增殖细胞,也可影响处于静止期的细胞,其免疫抑制程度与剂量及疗程呈正相关。有分析表明,加用CYC较单用激素可使ESRD发生率降低40%,是大多数LN患者诱导缓解的标准疗法。常用的治疗方案包括NIH(National Institutes Of Health)冲击方案(每月冲击治疗联合激素为重症LN的标准治疗方案。CYC 0.5~1g/m2,每月1次,共6个月;后续每3个月1次的同剂量治疗,持续2年,累积剂量为9~12g)和欧洲狼疮冲击方案(剂量小于NIH方案。CYC 0.5g,2周1次,共3个月)。初步报道,对增殖性LN欧洲方案疗效不差于NIH方案,但不良反应减轻。
4.吗替麦考酚酯(mycophenolate mofetil,MMF)
可用于诱导和维持治疗,是大多数LN诱导缓解的标准疗法。经典诱导剂量为2.0~3.0g/d,亚洲人群用量较少。在长期维持期间,剂量减少33%~50%。
5.硫唑嘌呤(azathioprine,AZA)
主要用于维持期帮助激素减量。研究显示,以AZA或MMF作为维持治疗的方案显著优于CYC方案,且不良反应较少。维持治疗剂量一般为1~2mg/(kg·d)。建议持续时间为24个月或更长。
6.钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)
主要用于膜性LN诱导治疗,也可用于维持治疗。需要监测药物浓度且有潜在的不良反应,影响治疗决策。常用剂量:环孢素A3~5mg/(kg·d),或他克莫司 0.05~0.1mg/(kg·d),分 2 次服用,一般6~8周可见效,病情稳定后逐渐减量。
7.来氟米特(leflunomide,LEF)
主要不良反应包括消化道症状、肝功能异常、感染等。起始先予50~100mg/d负荷量,连续3天,维持剂量为20~30mg/d。
(二)其他治疗方法
1.血浆置换
血浆置换可迅速清除致病自身抗体,但尚不能成为一线治疗。目前认为,血浆置换在狼疮相关性抗磷脂综合征及血栓性血小板减少性紫癜的治疗中可发挥一定的作用。
2.免疫球蛋白静脉注射
静脉注射人丙种球蛋白0.2~0.4g/(kg·d),每日或隔日1次,连用5~10天。通常用于治疗对激素及CYC禁忌或产生显著不良反应;有严重感染;狼疮伴血小板减少或难治性中枢神经系统病变。研究表明,此种疗法有免疫抑制的特性,可作为LN诱导缓解后的辅助维持用药。
3.生物制剂
由于激素和免疫抑制剂是非特异性治疗药物,会引起感染、代谢异常等不良反应。研发生物制剂以控制特定的分子靶点是优先考虑的。利妥昔单抗(rituximab,RTX)是一种特异性针对CD20分子的抗体,常用剂量为375mg/m2,每周1次,共4次;或固定剂量为1g/次,2周1次,共2次。一项单中心研究报道,LN患者早期使用RTX效果显著(90%的完全或部分缓解),在前6个月可以完全去激素,提示抗CD20可能在早期疾病中有价值。针对B细胞活化因子的抗体belimumab是首个被美国食品药品管理局批准作为狼疮治疗的药物,常用剂量为10mg/kg,4周1次。根据现有关安全性和有效性的临床试验观察到贝利尤单抗有获益,对于严重LN的研究正在进行。许多生物制剂,如靶向于B细胞的CD20抗体、小分子量的化合物等新型治疗药物都值得期待。
(三)并发症管理及协同治疗
由于并发症的存在,LN患者的死亡风险是一般人群的5倍。存在蛋白尿者应常规使用血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitior,ACEI)或血管紧张素Ⅱ受体拮抗剂(angiotensinⅡ receptor blocker,ARB),目标蛋白尿控制应小于0.5~1mg/d。目标血压控制在小于130/80mmHg,ACEI/ARB为首选。当肾病综合征持续时间超过2~3个月时,通常需开始用他汀降脂,目标LDL(low density lipoprotein)小于80~100mg/dl。建议患者注意防晒、戒烟、适当运动、免疫接种、均衡饮食。
(四)不同类型LN治疗方案的选择
免疫抑制剂治疗并非适用于每个患者,LN的治疗应按个体化分级进行,其中肾活检病理检查对LN的治疗起着重要的指导作用。
1.所有类型LN
除有禁忌,均建议使用羟氯喹,慢性肾脏病的剂量可减少。
2.Ⅰ或Ⅱ型LN
支持治疗为主。蛋白尿>3g/d接受激素联合免疫抑制治疗。Ⅱ型LN达到肾病范围蛋白尿者往往存在足细胞病变,推荐MMF或CNI治疗。
3.Ⅲ型和Ⅳ型LN
初始强化治疗目的在于诱导肾脏缓解及疾病静止,激素联合CYC或MMF为首选。对于重度活动的患者应采用甲泼尼龙静脉冲击疗法,诱导快速免疫抑制。对于非重度活动的病变,使用常规口服方案。ELNT试验表明,欧洲方案与NIH方案结局相当。前瞻性研究证实,作为增殖性LN患者的初始治疗,MMF不劣于CYC。由于增殖性LN患者在免疫抑制治疗减量或停药后复发多达50%,因此KDIGO建议,诱导治疗获得部分或完全缓解应继续维持治疗。EULAR/ACR指南建议,将AZA或MMF作为成功诱导后的最佳维持治疗药物。
4.Ⅴ型LN
一般认为Ⅴ型均需要进行治疗,当其合并Ⅲ型及Ⅳ型相关病变时,一般应采用强化治疗,方案可参照弥漫增殖性LN治疗方案。KDIGO建议,选择MMF联合激素作为初始治疗。对于有MMF禁忌或无法耐受该药的患者,建议CYC或CNI联合激素治疗,同时,不建议单用激素治疗。免疫抑制治疗起效较慢,因此不应过早改变免疫抑制治疗方案,建议观察3个月。若3个月内临床参数日益恶化或6个月治疗未显示任何改善,建议改变治疗方案。同时,必要时行肾活检以指导治疗。
5.Ⅵ型LN
支持治疗为主,有肾外表现者可适当行免疫抑制治疗。
6.难治性LN
对于初始免疫抑制治疗无效的患者,KDIGO和EULAR推荐用MMF治疗CYC耐药患者,反之相同,并且耐药LN患者诱导和维持治疗方案应一致。CYC、MMF是目前仅有已证实的对重度LN有效的药物,故建议使用短疗程CYC治疗MMF耐药患者。2010年相关研究表明,MMF联合他克莫司多靶点治疗可能对耐药LN有效。若MMF和CYC均无效,可以采用RTX治疗。
随着免疫抑制剂减停,很多增生性LN患者会复发。治疗方案取决于最初的免疫抑制方案、复发严重程度和时间。对于轻度复发患者建议最初使用CYC或MMF诱导治疗,AZA维持的患者,增加激素及AZA的剂量;若初始使用MMF进行诱导并减停,可以重新使用MMF;尚在维持期未停药的患者增加激素及免疫抑制剂量。中到重度复发的患者需要重建更积极的免疫抑制治疗。MMF是复发的优选初治方案;对于使用CYC诱导目前用AZA维持治疗的,多数会选择MMF以避免CYC累积毒性;若对MMF耐药,则选择进行第二轮 CYC治疗。若MMF诱导和维持治疗均结束,则MMF或CYC均可使用。若使用MMF维持治疗期间复发的,则优选CYC;若是MMF低剂量维持状态,则增加至诱导治疗的推荐剂量。若仍出现复发的患者,试用RTX可能获益。
7.对于肾功能急剧恶化、严重高血容量、顽固性心力衰竭病例
则应紧急采用肾脏替代治疗,为其他治疗创造条件。对于病情呈慢性过程,病理亦以慢性为主者,不宜盲目地长期使用激素及细胞毒性药物,以防产生致死性不良反应。
8.LN合并妊娠的治疗
建议达到完全缓解至少6个月可考虑妊娠。妊娠期应禁用 CYC、MMF和ACEI/ARB,可继续使用小剂量激素、AZA和羟氯喹。他克莫司可以用于希望保留生育功能的年轻患者。小剂量阿司匹林有助于减少流产的风险。妊娠期间应多学科团队定期密切评估狼疮活动性和妊娠合并症,调整治疗和决定是否继续妊娠。
(五)疗效监测
治疗期间定期随访尿蛋白很重要,治疗后尿蛋白快速下降是远期肾脏预后良好的标志。目前普遍接受的疗效评估标准:①完全缓解:血肌酐恢复至基值,同时尿蛋白/肌酐(urine protein/creatinine ratio,uPCR)<500mg/g。 ②部分缓解:血肌酐水平稳定(±25%),或下降但未恢复至正常,同时uPCR下降≥50%。如原有肾病范围的蛋白尿(uPCR≥3 000mg/g),则需要uPCR下降≥50%,同时uPCR<3 000mg/g。③未达到上述标准为无效。免疫抑制治疗的疗效通常与狼疮炎性病变特征减轻如肾外症状得到控制及补体、抗dsDNA滴度水平相关。蛋白尿的检测也是衡量治疗反应的一个重要指标。将来可能通过测定尿液中细胞因子、化学因子和/或血清抗C1q来评估疾病是否活动。













