英文名称 :membranous nephropathy
膜性肾病(membranous nephropathy,MN)是成人肾病综合征的主要病因,系抗体介导,特征性表现为肾小球上皮侧免疫复合物沉积,引起足细胞亚致死性损伤和肾小球滤过屏障破坏,最终导致蛋白尿和肾病综合征的其他表现。在发达国家,75%的MN为原发性膜性肾病(primary membranous nephropathy,PMN),系器官特异性的自身免疫疾病,其余则为继发性,如继发于恶性肿瘤、感染、系统性的自身免疫病和药物等。
目前认为PMN是一种自身免疫性肾小球疾病,即原位免疫复合物沉积于肾小球基底膜的上皮侧,导致免疫损伤和炎症。相反,继发性MN是循环免疫复合物沉积于肾小球基底膜所致。补体与原位免疫复合物中的抗体结合,通过形成膜攻击复合物导致足细胞亚急性损伤、复杂的细胞骨架破坏和足细胞裂孔膜丢失等,最终导致显性的非选择性蛋白尿。损伤的足细胞也可分泌细胞外基质包绕在免疫复合物周围,病理学上表现为基底膜增厚和钉突形成。
近10年来,得益于分子生物学技术的进步,PMN两个自身抗原足细胞抗原M型磷脂酶A2受体(M-type phospholipase A2 receptor,PLA2R)和1型血小板反应蛋白7A域(thrombospondin type-1 domain-containing 7A,THSD7A)被发现,使得人们对于PMN的认识和研究进入了一个崭新的时代。约80%的PMN患者自身抗原为PLA2R和THSD7A,但目前仍有20%的PMN尚未确认对应的自身抗原。
(一)PLA2R
2009年Beck等采用肾小球微切割、代谢组学和高通量等技术,发现70%~75%成人PMN的自身抗原为PLA2R,这些患者的血清中存在抗PLA2R的自身抗体,且主要为IgG4亚型。PLA2R是甘露糖受体家族成员,主要表达于人的肾脏、甲状腺唾液腺的上皮细胞中。在人肾脏中PLA2R仅表达于足细胞,主要亚型为PLA2R1,主要作用包括对基底膜滤过的小分子物质的解毒作用、大分子物质的内吞作用及维持有丝分裂后足细胞结构等。
(二)THSD7A
2014年Tomas等在自身抗原非PLA2R的成人PMN患者中找到了PMN的第二种自身抗原THSD7A,3%~5%的成人PMN自身抗原为THSD7A。它在人肾小球内也仅表达于足细胞,与PLA2R有类似的分子结构,系跨膜的大分子糖蛋白,识别该抗原的自身抗体也主要是IgG4亚型。
(三)其他
1.megalin
人们对PMN发病机制的了解源于大鼠Heymann肾炎模型,20世纪70年代后期研究者就在该模型中发现足细胞表面分子megalin为肾小球基底膜上的自身抗原。但这一结论现已被否定,缘于megalin在人类足细胞并不表达,且Heymann肾炎肾小球中沉积的IgG抗体很容易激活补体经典途径,但人类PMN中沉积的IgG主要为IgG4亚型,它不能激活补体经典途径。
2.NEP
2002年Debiec发现新生儿PMN的自身抗原为足细胞中性内肽酶(neutra lendopeptidase,NEP)。该基因在母体内发生筛除突变,在前一胎受孕流产后母体血清中产生了抗NEP自身抗体,在第二胎妊娠后该抗体通过胎盘作用于新生儿肾小球基底膜的NEP,形成原位免疫复合物导致新生儿PMN。
早期肾脏肿大、苍白,慢性肾衰竭晚期肾脏大小仍正常或略小。光镜和电镜下病理特点为上皮下免疫复合物沉积及基底膜增厚与变形。PMN的免疫复合物只分布在毛细血管袢而不分布在系膜区,一般无内皮或系膜细胞增生;而继发性MN由循环免疫复合物引起,免疫复合物除分布于毛细血管袢外,还可在系膜区沉积。免疫荧光检查可见IgG、C3呈细颗粒状弥漫性沉积于肾小球毛细血管袢。为鉴别原发和继发性MN,需常规进行PLA2R抗原和IgG亚型染色,其中PLA2R和IgG4阳性提示PMN可能,而继发性MN主要是IgG1和IgG2阳性,PLA2R阴性。有报道MN合并结节病和丙型肝炎的患者肾穿刺标本中仍可见PLA2R阳性染色,认为这仍是PLA2R相关的PMN同时合并了肝炎病毒血清学阳性或肿瘤。但SLE所致的MN一般PLA2R阴性,如出现C1q阳性,也提示继发可能,特别是与SLE有关。肾间质可见以淋巴细胞为主的细胞浸润,其程度与肾病综合征和肾功能减退程度明显相关。
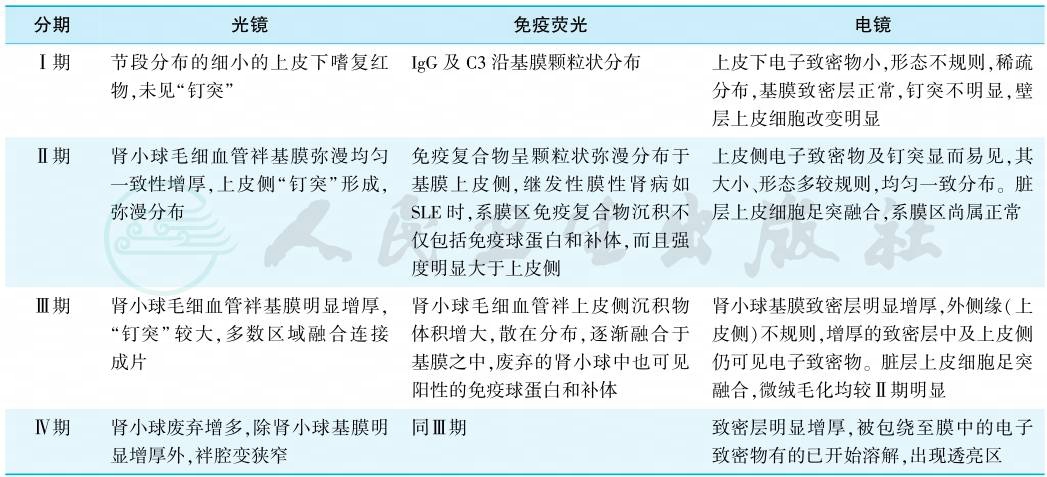
根据光镜、免疫荧光和电镜所见,本病可分为四期(表1)。研究发现,上皮下免疫复合物颗粒小、基底膜无明显增厚,多提示临床症状明显、免疫活动;而在基底膜明显增厚的MN后期,免疫活动多已静止。因此,免疫荧光和电镜在MN的价值尤为重要。
表1 膜性肾病的病理分期
(一)常规检查
蛋白尿是膜性肾病最显著的特点,80%以上的患者尿蛋白大于3g/d,部分患者甚至可大于20g/d。血脂蛋白升高,常见LDL和VLDL升高。部分患者有镜下血尿。发病时肾功能正常或仅轻度减退。补体C3和C4水平常正常,在一些活动性膜性肾病患者,尿中可检测出膜攻击复合物C5b-9,病变静止时其排出减少而检测不出。膜性肾病患者有高凝倾向,血纤维蛋白原升高,循环中前凝血因子升高,抗凝因子如抗凝血酶Ⅲ降低。静脉血栓形成时,静脉造影、Doppler超声和磁共振检查可发现栓子。
继发性膜性肾病,行乙型肝炎病毒标志物、丙型肝炎病毒(hepatitis C virus,HCV)抗体、抗核抗体(ANA)、抗双链DNA(SLE标志)、补体C3和C4及冷球蛋白等检查可能有阳性发现。部分患者抗肾小球基底膜抗体和抗中性粒细胞胞质抗体可阳性,肿瘤相关性者检查胸部X线片、结肠镜、大便隐血、女性乳房X线照相等,肿瘤标志物如癌胚抗原(carcinoembryonic antigen,CEA)和前列腺特异性抗原(prostate specific antigen,PSA)等可能有阳性发现。
(二)血清抗PLA2R抗体
血清抗PLA2R自身抗体目前已成为成人PMN诊断、原发和继发的鉴别诊断、疾病活动度监测和指导药物治疗有前景的标志物。在诊断方面,血清抗PLA2R抗体阳性对PMN诊断的特异性大于99%,敏感性为75%~80%,即使血清抗PLA2R抗体阴性的患者,依然有20%~25%的可能为PMN。在鉴别诊断方面,对于肾活检提示为MN,且没有临床和实验室证据支持继发性MN,如血清抗PLA2R抗体阳性,则肿瘤相关性MN的危险将减少92%;相反,对于抗体阴性的患者,约37%的患者将在肾活检后被诊断为肿瘤和肿瘤相关性膜性肾病;如肾组织和血清学PLA2R双阴性的患者,则更加提示肿瘤继发MN的可能。在疾病活动度监测方面,对于肾活检标本PLA2R阳性的患者,低水平甚至阴性的血清抗PLA2R高度提示MN自发缓解的可能。但界定血清抗PLA2R滴度高低没有绝对数值,而随访同一患者抗体滴度的动态改变对监测病情活动度更有意义,如抗体滴度下降甚至消失,即为“免疫缓解”,平均3~6个月后将出现临床缓解。在指导药物治疗方面,有研究认为如抗体滴度较前明显升高,提示需免疫抑制治疗;如滴度稳定,则可考虑调整免疫抑制剂的剂量;对于滴度下降90%以上的患者,则可停用免疫抑制治疗。
(一)保守治疗
1.一般治疗
严重肾病综合征患者需要休息,限水限钠。对无明显肾功能损害者蛋白质摄入以1~1.5g/(kg•d)为宜,必要时适当静脉输入白蛋白增进利尿。同时,保证足够的热量摄入。
2.ACEI/ARB
控制血压在125/75mmHg,定期随访肾功能和电解质。
3.抗凝
对于血清白蛋白<25g/L的患者,若出血风险低,建议使用华法林抗凝;若出血风险高,则使用阿司匹林治疗。新型口服抗凝药物利伐沙班出血风险小,也不需监测凝血功能,可考虑试用于PMN的预防性抗凝治疗。对于血清白蛋白25~32g/L的患者,若血栓风险较高,也可使用阿司匹林抗凝。
4.降脂
对于高脂血症的患者,建议使用他汀类药物降脂治疗。
(二)免疫抑制治疗
1.时机
对于表现为肾病综合征的患者,糖皮质激素及免疫抑制剂的使用时机仍存争议。2012年KDIGO发布的PMN治疗指南指出,对于表现为肾病综合征并至少具备以下条件之一的患者,才考虑使用免疫抑制:①经过至少6个月的降压和降蛋白(ACEI/ARB治疗)观察期内,尿蛋白持续超过4g/d,且维持在基线水平50%以上,无下降趋势(1B);②存在与肾病综合征相关的严重、致残或威胁生命的临床症状(1C);③在确诊后6~12个月内血清肌酐(SCr)升高≥30%,但eGFR不低于25~30ml/(min•1.73m2),且上述改变非肾病综合征并发症所致(2C);④对SCr持续>309.4μmol/L[eGFR<30ml/(min•1.73m2]及肾脏体积明显缩小(长径<8cm)者,或同时存在严重或潜在的威胁生命的感染患者,建议避免使用免疫抑制治疗(未分级)。2012年KDIGO指南PMN治疗流程见图1。
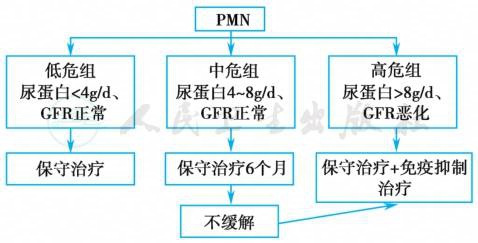
图1 2012年KDIGO指南PMN治疗流程
近年来,以血清抗PLA2R/THSD7A抗体滴度水平界定PMN免疫活动程度从而指导免疫抑制治疗被逐渐接受。图2为Couser 2017年提出以血清抗PLA2R/THSD7A抗体滴度指导MN临床诊治的流程。
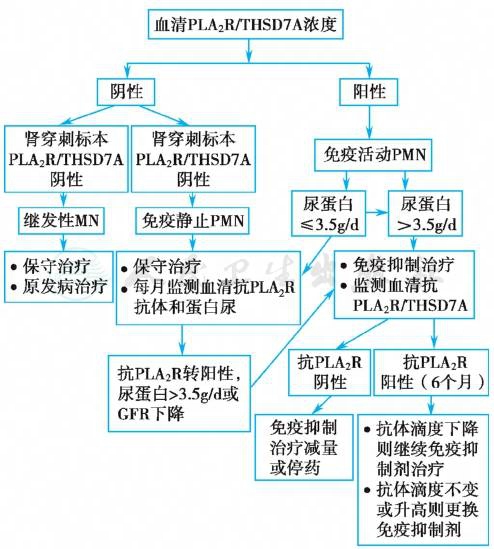
图2 以血清抗PLA2R/THSD7A抗体滴度指导PMN临床治疗
2.药物选择
(1)细胞毒性药物:
2012年KDIGO指南推荐的PMN初始治疗方案是细胞毒性药物。推荐使用改良的Ponticelli方案:第1、3、5个月的第1~3天,甲泼尼松龙每天静脉滴注1g,连续3天,继以泼尼松0.5mg/(kg•d)晨顿服,连用27天;第2、4、6个月每天口服CTX 2.0~2.5mg/kg。该方案的复发率为20%~30%。如复发,最多可再重复使用1次上述初始治疗方案。但在2020年KDIGO指南(草稿)推荐中,考虑到CTX致癌性等严重不良反应,CTX不再作为PMN的初始治疗方案,仅在有严重肾衰竭高危患者中考虑使用CTX。
(2)钙调磷酸酶抑制剂(CNI):
包括环孢素A(CsA)和他克莫司(FK506)两类。该方案是2012年KDIGO指南推荐的PMN次选治疗方案,而在2020年KDIGO指南(草稿)中被列为重度PMN的首选治疗方案。CNI可以联合小剂量泼尼松治疗,或者单独使用CNI治疗。该方案中CsA剂量为3.5~5mg/(kg•d),分2次口服,间隔12小时,目标血药浓度为120~200μg/L;FK506剂量为 0.05~0.075mg/(kg•d),分2次口服,间隔12小时,目标血药浓度为3~5μg/L;小剂量联合的泼尼松剂量为0.15mg/(kg•d)。若CNI治疗6个月无效,建议停止使用;若达到完全或部分缓解,且无CNI相关肾毒性发生,建议在4~8周内将CNI剂量减至初始剂量的50%,总疗程至少12个月。CNI治疗后PMN的复发概率为40%~50%。
(3)利妥昔单抗(rituximab):
采用抗CD19/20单克隆抗体利妥昔单抗可以通过去除B细胞,从而抑制PMN自身抗体的产生,实现免疫缓解。包括2019年MENTOR研究在内的多个RCT研究结果提示,利妥昔单抗对PMN的治疗效果与CTX或CNI相当,但药物不良反应明显减少。经典的治疗方案为每周静脉注射1次,375mg/m2,连续4次;部分研究也采用单次静脉注射1 000mg,间隔15天再注射1次,共2次。在2020年KDIGO指南(草稿)中,利妥昔单抗与CNI被并列推荐为重度PMN的首选治疗方案。
(4)其他:
MMF单药治疗PMN被证明是无效的,但对于难治性的PMN可尝试与其他免疫抑制剂联合用药。促肾上腺皮质激素(ACTH)治疗PMN的剂量为单次肌内注射1mg,每周2次,共1年。少数小样本RCT研究提示,ACTH单药治疗对PMN的疗效与CTX相当。但ACTH价格昂贵,且研究相对较少,目前它在PMN药物治疗中的作用尚未被肯定。













