英文名称 :liver failure
肝衰竭(liver failure)是多种因素引起的严重肝脏损害,导致其合成、解毒、排泄和生物转化等功能发生严重障碍或失代偿,出现以凝血功能障碍、黄疸、肝性脑病、腹水等为主要表现的一组临床症候群。我国2012年《肝衰竭诊疗指南》根据病理组织学特征和病情发展速度,将肝衰竭分为急性、亚急性、慢加急性、慢性四类。目前,我国以慢加急性肝衰竭为主,疾病进展快,病死率较高,应受到广泛关注。
在我国,引起肝衰竭的首要病因是肝炎病毒(主要是乙型肝炎病毒),其次是药物及肝毒性物质(如乙醇、化学制剂等)。在欧美国家,药物是引起急性、亚急性肝衰竭的主要原因;酒精性肝损伤常引起慢性或慢加急性肝衰竭。儿童肝衰竭还可见于遗传代谢性疾病(表1)。
表1 肝衰竭的病因
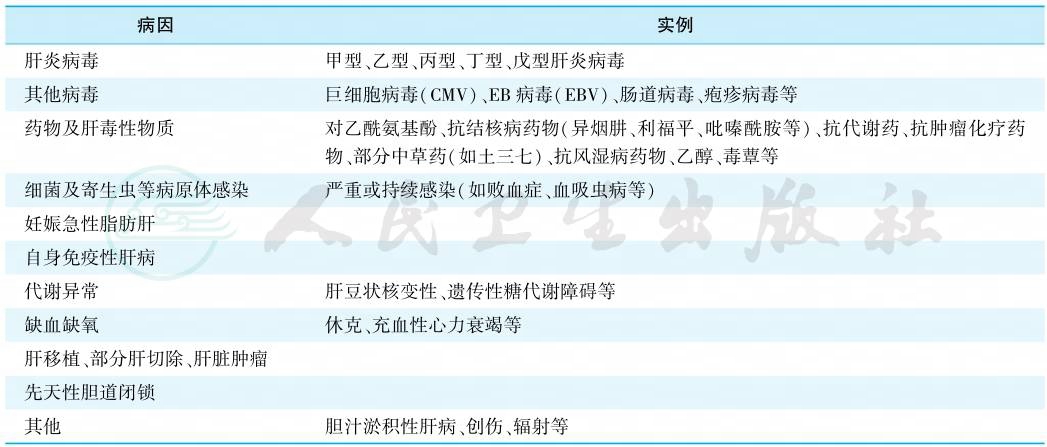
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
肝衰竭的发病机制十分复杂,受多种因素影响,具体机制目前尚未完全明确,主要包括以下两个方面。
1.各种因素对肝细胞的直接损伤
各型肝炎病毒都可引起肝衰竭,这些病毒的致病性与其数量、毒力及其变异有关。大量临床研究发现肝炎病毒感染,特别是肝炎病毒的重叠感染或混合感染和变异株的感染与肝衰竭的发生密切相关。
2.免疫损伤机制
促炎细胞因子促进组织破坏,在急性肝衰竭早期占主导地位。细胞因子参与肝衰竭的发生机制主要包括以下两种:参与肝衰竭、肝细胞坏死发生过程;参与构成抑制肝细胞再生的细胞外环境,导致肝衰竭时肝细胞再生障碍。
肝衰竭分为四类:急性肝衰竭(acute liver failure,ALF)、亚急性肝衰竭(subacute liver failure,SALF)、慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)和慢性肝衰竭(chronic liver failure,CLF)。
目前,肝衰竭的病因、分类和分期与肝组织学改变的关联性尚未取得共识。以HBV感染所致肝衰竭为例,各类肝衰竭典型病理表现为:急性肝衰竭肝细胞呈一次性坏死,坏死面积≥肝实质的2/3为大块坏死;或亚大块坏死(1/3~2/3肝实质),肝窦网状支架不塌陷或非完全塌陷。亚急性肝衰竭肝组织呈新旧不等的亚大块坏死或桥接坏死;较陈旧的坏死区网状纤维塌陷,或有胶原纤维沉积;残留肝细胞有程度不等的再生,并可见细、小胆管增生和胆汁淤积。慢加急性肝衰竭表现为在肝硬化/肝纤维化基础上沿中央静脉分布的亚大块肝实质坏死(坏死面积15%~90%),但酒精性慢加急性肝衰竭以严重的炎症和肝细胞变性为特征;此外严重的胆汁淤积、卵圆细胞来源的肝再生及病理上表现的脓毒血症均是所有慢加急性肝衰竭病理共有的特征。而慢性肝衰竭主要为弥漫性肝脏纤维化及异常结节形成,可伴有分布不均的肝细胞坏死。
1.血清胆红素测定
常呈进行性增高,多超过171μmol/L,可达800μmol/L以上。
2.血清转氨酶
血清谷丙转氨酶(ALT)及谷草转氨酶(AST)常明显升高,尤以后者升高更明显。AST/ALT比值对估计预后有意义,存活者比值介于0.31~0.63,死亡者多在1.20~2.26。肝衰竭时,由于肝细胞大量坏死,ALT及AST活性反而迅速下降。与此形成对比的是,血清胆红素显著升高,此现象称为“胆酶分离”现象,对肝衰竭的诊断及预后有重要意义。
3.血清胆固醇与胆固醇脂
胆固醇与胆固醇脂主要在肝细胞内合成,合成过程需多次酶促反应。正常血清胆固醇浓度为2.83~6.00mmol/L,如低于2.6mmol/L则提示预后不良,ALF时胆固醇脂也常明显下降。
4.血清胆碱酯酶活力
胆碱酯酶有两种,即乙酰胆碱酯酶和丁酰胆碱酯酶。后者在肝细胞内合成,肝衰竭时此酶活力常明显下降。
5.血清白蛋白
最初可在正常范围内,如白蛋白逐渐下降则预后不良。但这种变化的敏感度不高,主要因白蛋白的半衰期可达3周,其合成明显降低需2~3周才逐渐显现。
6.凝血功能检查
(1)凝血酶原时间(PT)
凝血因子Ⅰ、Ⅱ、Ⅴ、Ⅶ、Ⅹ中任何一种缺乏均可致PT延长。PT的表示方法有三种:①PT延长的秒数,比对照值延长3秒为异常;②INR,>1.2为异常;③PTA,由PT计算而来。PT测定是目前最常用的评估肝细胞功能指标之一,但需排除因维生素K缺乏所致的PT延长。
(2)活化部分凝血活酶时间(APTT)
参与内源性凝血系统的任何因子缺乏时均可致APTT延长。APTT延长首先提示因子Ⅷ、Ⅸ、Ⅺ、Ⅻ缺乏,但也提示Ⅰ、Ⅱ、Ⅴ、Ⅹ因子缺乏。肝衰竭时APTT延长较为常见。
(3)纤维蛋白原定量
由于肝细胞合成能力降低及并发DIC等原因,可出现血浆纤维蛋白原含量降低。
(4)凝血因子测定
Ⅱ、Ⅴ、Ⅶ、Ⅸ、Ⅹ等因子明显减少。
7.其他检查
肝炎病毒标志物包括甲、乙、丙、戊及其他病毒抗体的检查有助于病因的诊断。血氨、血浆氨基酸测定有助于肝性脑病的诊断及处理。细菌学检查及鲎试验有利于确定感染的存在。电解质检查对监测患者病情极为重要。
8.其他脏器功能衰竭指标
见表2。
表2 CLIF-OFs评分
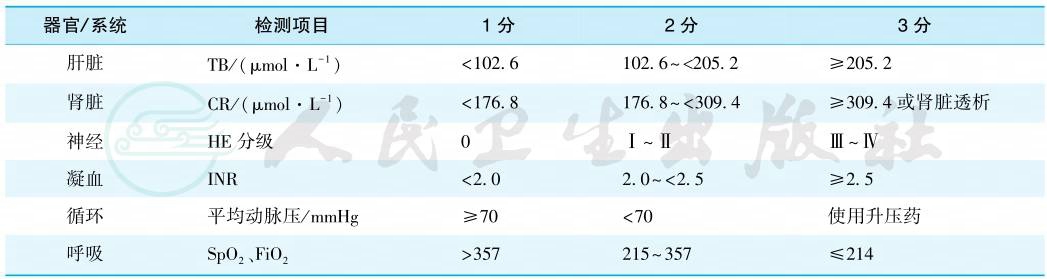
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(一)病因治疗
所有的肝衰竭患者应明确病因,并给予必要的病因特异性治疗,包括发病原因及诱因。针对单一病因ALF的特异治疗手段很少,例如以N-乙酰半胱氨酸(NAC)治疗对乙酰氨基酚(APAP)过量引起的ALF,立即分娩以治疗妊娠相关的ALF。对HBV DNA阳性的肝衰竭患者,不论其检测出的HBV DNA滴度高低,建议立即使用核苷(酸)类药物抗病毒治疗。
(二)内科综合治疗
1.支持治疗
(1)卧床休息。
(2)加强病情监测,应加强多学科协作综合治疗,并进行凝血功能、血氨及血液生物化学指标的监测,床边B超监测肝脏大小及腹水变化。
(3)推荐肠道内营养,供给足够热量,饮食以高碳水化合物、低动物蛋白、低脂肪为宜。每日总热量成人应在5~6.7kJ(1 200~1 600kcal)。进液量应控制在2 000ml左右,并补充足量的维生素B、C、K等。临床上多给予10%~20%葡萄糖,同时配给支链氨基酸。
(4)积极纠正低蛋白血症,补充白蛋白或新鲜血浆,并酌情补充凝血因子。
(5)纠正电解质、酸碱平衡:定期随访血气及电解质检查,及时发现,及时纠正。
(6)保持室内空气流动,注意消毒隔离,加强口腔护理及肠道管理,预防医院内感染发生。
2.其他治疗
(1)免疫调节治疗
目前对于肾上腺皮质激素在肝衰竭治疗中的应用尚存在不同意见。非病毒感染性肝衰竭,如自身免疫性肝病及急性乙醇中毒(严重酒精性肝炎)等是其适应证。其他原因所致的肝衰竭早期,若病情发展迅速且无严重感染、出血等并发症者,可酌情使用并及早停药。后期为调节肝衰竭患者机体的免疫功能、减少感染等并发症,可酌情使用胸腺素α1等免疫调节剂。
(2)促进肝细胞再生
疗效不肯定,但可试用以下一些药物。①肝细胞生长因子及肝细胞刺激物质,有促进DNA合成,促进肝细胞再生,抑制肿瘤坏死因子,增加库普弗细胞功能,增加肝细胞对氨基酸的摄取,增加ATP酶活性等作用;②前列腺E1,能改善组织灌流,但对已有出血的患者不能应用;③生长激素可增加肝细胞再生能力,提高巨噬细胞的吞噬功能,增加肠黏膜屏障功能,可考虑使用。
(3)微生态调节治疗
可应用肠道微生态调节剂、乳果糖等,减少肠道细菌易位或降低内毒素血症及肝性脑病发生。
3.并发症防治
(1)脑水肿治疗
25%~35%的Ⅲ期肝性脑病患者和约75%的Ⅳ期肝性脑病患者存在脑水肿,其后果包括颅内压增高、脑缺血和缺氧及脑干疝,这些是ALF患者死亡的最常见原因。肝移植是脑水肿唯一的确定性治疗,但未控制的颅内压升高是肝移植的禁忌证。
对于颅内压升高的患者,治疗目标是将颅内压降至20mmHg以下并将大脑灌注压维持在高于60mmHg的水平。降低颅内压的方法包括给予高渗药物(如甘露醇)和过度通气,但使用这些方法的获益通常短暂。静脉快速给予甘露醇(0.5~1.0g/kg)通常是颅内压升高患者的一线治疗。如果其他治疗重度颅内压升高的方法无效,则应采用戊巴比妥或硫喷妥诱导巴比妥昏迷。可单次静脉快速给予3~5mg/kg戊巴比妥。巴比妥类药物能降低颅内压,但也可能导致体循环低血压而降低脑灌注压,应予注意。由于ALF时巴比妥类药物的清除率明显降低,所以较长时间内将不可能进行神经系统评估。
试验性疗法包括诱导低体温及吲哚美辛(25mg静脉注射1分钟),可考虑在标准治疗无效的颅内压升高患者中使用。
肾上腺皮质激素不推荐用于控制ALF患者的颅内高压。
(2)肝性脑病的治疗
1)寻找并消除诱因:及时控制感染和上消化道出血并清除积血,避免快速和大量的排钾利尿和放腹水,注意纠正水、电解质和酸碱平衡失调,缓解便秘,并控制使用麻醉、止痛、安眠、镇静等药物。当患者狂躁不安或有抽搐时,禁用吗啡及其衍生物、水合氯醛、哌替啶及速效巴比妥类,必要时可减量使用(常量的1/2或1/3)地西泮(安定)、东莨菪碱,并减少给药次数。异丙嗪、氯苯那敏(扑尔敏)等抗组胺药有时可作为安定药代用。
2)乳果糖:乳果糖在结肠内被乳酸菌、厌氧菌等分解为乳酸和醋酸,降低结肠pH,使肠腔呈酸性,从而减少氨的形成与吸收;其轻泻作用有助于肠内含氮毒性物质的排出;肠道酸化后,促进乳酸杆菌等有益菌大量繁殖,抑制产氨细菌生长,氨生成减少。剂量为每次15~30ml,每天3~4次口服。从小剂量开始,根据每天2~3次软便,调整剂量。严重肝性脑病昏迷患者时,可用乳果糖经置入鼻胃管给药,一般为15~45ml,每8~12小时1次;或乳果糖300ml置于1L水中灌肠保留1小时,每2小时1次,直到症状改善。乳果糖还可以用于复发性肝性脑病的预防,我国多中心临床研究表明其可以改善轻微肝性脑病患者的认知和生活质量,用于轻微肝性脑病的治疗。
3)抑制肠道细菌生长:利福昔明是一种口服后肠道吸收极少的广谱抗生素,其对肝性脑病有良好的疗效,具有耐受性好、起效快等优点。可作为Ⅰ~Ⅲ级肝性脑病的治疗和预防复发性肝性脑病发作,推荐剂量是800~1200mg/d,分次口服或与乳果糖合用。
含有双歧杆菌、乳酸杆菌等的微生态制剂可起到维护肠道正常菌群、抑制有害菌群、减少毒素吸收的作用。
4)促进氨的转化和代谢:L-鸟氨酸-L-天冬氨酸(L-ornithine-L-aspartate,OA)中的鸟氨酸能增加氨基甲酰磷酸合成酶和鸟氨酸氨基甲酰转移酶活性,其本身也是鸟氨酸循环的重要物质,可促进尿素合成。天冬氨酸可促进谷氨酰胺合成酶的活性,促进脑、肝、肾利用和消耗氨以合成谷氨酸和谷氨酰胺而降低血氨,减轻脑水肿。每天静脉滴注20g,用于显性肝性脑病,能显著降低肝性脑病患者血氨,改善临床症状,安全性好。
(3)抗感染治疗
应行定期监测培养,以早期发现潜在的细菌或真菌感染,以便根据培养结果尽早采取适当治疗措施。
(4)肾功能不全处理
密切注意肝衰竭患者的液体复苏及血管内血容量的维持。伴急性肾衰竭患者如需要透析支持,建议采用持续性而不是间歇性血液透析。
(5)出血的防治
只有在出血和进行侵入性操作前才推荐对血小板减少症和凝血时间延长者进行补充治疗。ALF患者应接受H2受体拮抗剂或质子泵抑制剂治疗,以预防因为应激性溃疡导致的酸相关性胃肠道出血。
(三)人工肝支持系统
人工肝是指通过体外的机械、物理化学或生物装置,清除各种有害物质,补充必需物质,改善内环境,暂时替代衰竭肝脏部分功能的治疗方法,能为肝细胞再生及肝功能恢复创造条件或等待机会进行肝移植。人工肝支持系统分为非生物型、生物型和组合型三种。非生物型人工肝已在临床广泛应用并被证明确有一定疗效。生物型及组合型人工肝不仅具有解毒功能,还具备部分合成和代谢功能,是人工肝发展的方向,现正处于临床研究阶段。
(四)肝细胞和干细胞移植
利用动物或人肝细胞经微载体、球形体、微囊凝胶滴等植入系统植入人的腹腔或脾脏,以取代人的肝脏功能,目前尚未广泛应用于临床。近期已有报道脐带间充质干细胞治疗能够显著提高早中期肝衰竭患者的生存率,自体骨髓间充质干细胞移植能够显著提高ACLF患者的近期生存率。
(五)原位肝移植
肝移植是目前治疗肝衰竭的有效手段,中长期(5年)生存率可达到70%。应掌握时机。













