英文名称 :Liver tumor
中文别名 :原发性肝癌;肝癌
原发性肝癌(primary carcinoma of the liver,以下简称肝癌)是原发于肝脏的上皮性恶性肿瘤,其中超过80%的肝癌为肝细胞肝癌,其余为胆管细胞癌和混合型肝癌。
(一)病毒性肝炎
乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)和肝癌发生有关。在亚洲(日本除外)HBV感染是肝癌的主要发病因素。在原发性肝癌的患者中,有乙型肝炎感染背景者占80%以上。前瞻性的队列研究结果显示,有HBV感染的人群,发生肝癌的危险性较普通人群高5~100倍。其中,乙型肝炎表面抗原(HBsAg)阳性者较阴性者危险性更高;病毒载荷量和患肝癌的危险性呈正比。在欧洲、北美,以及日本,HCV感染是肝癌的主要发病因素。HCV在日本肝癌患者中的阳性率为80%~90%,意大利为44%~66%,美国为30%~50%。结果显示,HCV抗体阳性的人群较阴性的人群,患肝癌的危险性高15~20倍。其中伴有肝纤维化或肝硬化者发生肝癌的风险要显著高于无肝纤维化或肝硬化者。
(二)黄曲霉毒素
在流行病学上,黄曲霉毒素B1(aflatoxin B1,AFB1)与肝癌有密切的关系。在我国的东南沿海,气候温暖、潮湿,适宜黄曲霉的生长,在谷物中黄曲霉毒素的污染较为普遍,这些地区也是肝癌的高发地区。研究表明,AFB1的摄入量与肝癌的死亡率呈正相关。迄今为止,AFB1是已知最强的致癌物,可使多种动物发生肝癌,但尚缺乏导致人肝癌的直接证据,一般认为,黄曲霉毒素污染进一步增加了感染HBV人群患肝癌的危险性。
(三)代谢因素
随着生活方式的改变,代谢因素与肝癌的关系受到关注。糖尿病患者较对照人群患肝癌的风险高2.5倍;西方的研究提示,肥胖和非酒精性脂肪肝成为西方发达国家肝癌的重要发病因素,并认为是美国肝癌发病率提高的重要原因。
(四)长期饮酒和抽烟
可增加患肝癌的危险性,特别是增加HBsAg阳性患者患肝癌的危险性。在中国台湾一项前瞻性的研究中,HBsAg阳性患者发生肝癌的相对危险性为13.1~19.2,而HBsAg阳性患者有长期饮酒和抽烟习惯的患者患肝癌的相对危险性为17.9~26.9。在我国的肝癌高发区,有肝癌的家族聚集现象,提示肝癌具有遗传的倾向,尚待进一步研究证实。
肝细胞肝癌(hepatocellular carcinoma,HCC)的发病率在全世界恶性肿瘤中男性居第六位,死亡率居第三位。全球每年新发病例约84.1万,高发病率国家主要位于西非、北非、东亚及东南亚。我国是肝癌的高发地区,据2015年国家癌症中心的统计数据表明,肝癌年新发病例为46.6万。比较2000年至2011年发病率的变化,我国肝癌发病呈现下降趋势。由于在20世纪90年代开始实行了新生儿乙肝疫苗的接种,预计在10~20后肝癌的发病率会有明显的下降。但由于我国人口基数大及老龄化进程加快,肝癌粗发病率仍然呈上升趋势,目前仍然是我国最常见的恶性肿瘤之一。
上述各种病因均可引起肝脏的持续损伤。致病因素作用于肝脏,首先由库普弗(Kupffer)细胞和肝免疫细胞产生的细胞因子激活位于肝窦的肝星形细胞(hepatic stellate cell,HSC),后者转化为肌成纤维细胞,产生大量胶原和炎症因子。细胞外基质(extracellular matrix,ECM)成分合成增加、降解减少,总胶原量增加为正常时的3~10倍,同时其成分发生变化、分布改变。在血管内皮生长因子(vascular endothelial growth factor,VEGF)等的调控下,胶原在肝窦沉积,导致肝窦内皮细胞上窗孔直径变小、数量减少,细胞间隙变窄、消失,基质蛋白沉积,最终形成肝窦内皮细胞下基底膜,称为肝窦毛细血管化(sinusoid capillarization)。肝细胞表面绒毛变平及屏障形成,肝窦内物质穿过肝窦壁到肝细胞的转运受阻,直接扰乱肝细胞功能,导致肝细胞的合成功能障碍。肝窦变狭窄、肝窦血流受阻、肝内阻力增加影响门静脉血流动力学,造成肝细胞缺氧和养料供给障碍,加重肝细胞坏死,使始动因子得以持续起作用。肝细胞广泛坏死、坏死后的再生及肝内纤维组织弥漫增生,导致正常肝小叶结构的破坏。正常门管区消失,代之以增生的肝细胞结节,被增生的纤维组织重新分割,形成假小叶。肝实质结构的破坏还引起了肝内血管分流,例如从门静脉分支到肝静脉的短路,肝硬化时约1/3的肝血流分流,加重了肝细胞的营养障碍。缺氧引起VEGF增加,导致的新生血管形成也增加了分流。纤维隔血管交通吻合支的产生和再生结节压迫及增生的结缔组织牵拉门静脉、肝静脉分支,造成血管扭曲、闭塞,使肝内血液循环进一步障碍,假小叶的肝细胞没有正常的血流供应系统,可再发生坏死和纤维组织增生。如此病变不断进展,肝脏逐渐变形、变硬,功能进一步减退,形成肝硬化。以上病变也是出现硬化的肝脏进一步发生肝功能不全和门静脉高压的基础(图1)。
近年来研究提示肝纤维化是ECM合成和降解失平衡的动态过程,通过治疗,特别是去除病因,可以逆转肝纤维化和早期肝硬化。
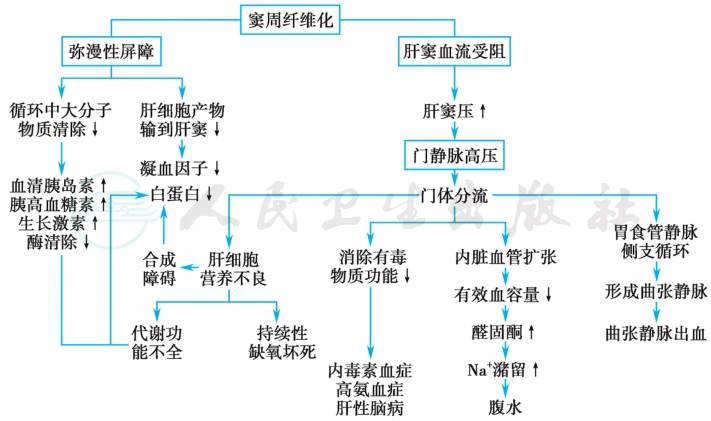
图1 结缔组织在窦周隙沉积(窦周纤维化)的后果
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(一)组织学分型
原发性肝癌主要有三种类型:肝细胞肝癌、胆管细胞癌和混合型肝癌。约4/5为肝细胞肝癌,1/5为胆管细胞癌和混合型肝癌。
1.肝细胞型
大多伴有肝硬化。癌细胞呈多角形,核大,核仁明显,胞质丰富。癌细胞排列成巢状或索状,癌巢之间有丰富的血窦。癌细胞有向血窦内生长的趋势。肿瘤分化程度按Edmondson标准分四级,Ⅰ级分化最好,癌细胞形态和正常肝细胞相似;Ⅳ级分化最差,癌细胞核大,形态变异大。肝细胞癌中以Ⅱ、Ⅲ级为多见,同一病例的癌组织可呈现不同的分化程度。透明细胞癌属肝细胞癌,在肝细胞癌中约占10%,属分化较好的肝细胞性肝癌。纤维板层肝癌是肝细胞癌的一种特殊类型,以癌细胞巢间出现大量平行排列的板层状纤维组织为特点,多见于年轻人,常不伴有HBV感染和肝硬化,甲胎蛋白多为低浓度阳性,但预后较好。
2.胆管细胞型
癌细胞呈柱状或立方状,胞质嗜碱性,无胆汁小滴,偶有黏液分泌;排列成腺泡、囊或乳头状;间质组织多。
3.混合型
癌组织中部分似肝细胞,部分似胆管细胞,或细胞形态介于二者之间。
(二)转移
肝癌是高转移潜能的恶性肿瘤。研究显示,即使直径小于2cm的小肝癌,有20%肝癌结节发现有微血管的侵犯。肝癌的转移包括了肝内转移和肝外的远处转移。
1.肝内转移
肝内血行转移发生最早,也最常见,是肝癌切除术后早期复发的主要原因。肝癌容易侵犯门静脉而形成癌栓。肝静脉发生癌栓后,也可进一步侵犯下腔静脉,甚至达右心房。
2.远处转移
①血行转移:以肺转移最常见,其他常见的转移部位有骨、肾上腺、肾、脑和软组织;②淋巴转移:肝门淋巴结转移最常见(占12.6%),也可转移至主动脉旁、胰周、锁骨上淋巴结;③种植或直接浸润:腹腔种植可形成腹腔肿块,种植于腹膜可形成血性腹水。肝癌也可直接浸润邻近的器官如膈肌、胃、十二指肠和结肠等。
早期发现和早期治疗是改善肝癌预后的最主要因素,而规范化的治疗是获得最佳治疗效果的保证。对于肝癌的规范化治疗,国际上有BCLC指南、AASLD指南、欧洲肝病研究会(EASL)指南、欧洲肿瘤内科学会(ESMO)指南、日本的J-HCC指南、亚洲肝癌诊治共识等。我国在2011年制定了肝癌诊治规范,并在2017年和2019年进行了更新。
依据BCLC指南,对于极早期(A0期)的肝癌首选消融治疗和手术切除;早期肝癌(A期)首选手术切除、消融治疗及肝移植;中期肝癌(B期)首选治疗方案是肝动脉栓塞化疗;晚期肝癌(C期)由于存在大血管侵犯(如门静脉癌栓)或远处的转移,主要的治疗方案是系统性治疗,如分子靶向药物治疗、系统性化疗或免疫治疗等;对于终末期(D期)的肝癌,则主要以支持治疗为主。
我国肝癌的主要病因是乙型肝炎病毒感染,与西方肝癌患者主要是丙型肝炎及非肝炎病因引起有显著的差别,同样在肝癌的临床特征、治疗反应及预后方面也有显著的差别。因此,在中国肝癌的临床实践过程中,治疗方案的选择也与BCLC指南有所差别。例如,在中国的肝癌诊治规范中,中期肝癌(Ⅱa期及Ⅱb期)的部分患者也推荐采用手术切除或消融治疗,甚至局部晚期的肝癌如合并门静脉分支癌栓的Ⅲa期患者,也可采用手术切除为主的联合治疗方案。
总体而言,根据肿瘤的分期确定治疗方案。早期肝癌首选采用根治性的治疗方法,如手术切除、局部消融等;中期的肝癌多采用局部区域性治疗——肝动脉栓塞化疗,部分中期的肝癌除了推荐肝动脉栓塞化疗外,也可采用根治性治疗方法可能获得更好的效果。对于晚期肝癌则以系统性治疗为主,如分子靶向治疗、系统性化疗、免疫治疗等,对于终末期的肝癌,则只能给予支持和对症治疗为主。
(一)治疗前评估
1.肿瘤情况
依据上腹部增强CT/增强MRI、胸部CT、放射性核素骨扫描、头颅CT、PET/CT,根据肿瘤大小、数目、门静脉(肝静脉)侵犯、有无远处转移等情况,给予肿瘤分期。
2.肝功能状态(Child-Pugh评分)
依据血清总胆红素、白蛋白(A)、凝血酶原时间、有无肝性脑病及腹水评估肝功能状态。
3.全身情况
依据ECOG评分评估肝癌患者全身情况。
4.有无系统性合并症
如心、肺功能,糖尿病等;血、尿、粪常规,肾功能,糖化血红蛋白,心电图、超声心动图,肺功能等。
(二)治疗方案
根据肝癌治疗指南和共识决定治疗方案。
1.外科手术治疗
肝癌的外科治疗包括肝切除术和肝移植。
肝切除是传统的根治性治疗方法,根治性切除后5年生存率在50%以上,是肝癌的首选治疗。手术切除的指征主要根据:①肿瘤的累及范围;②肝功能状态;③全身状况。在我国,肝癌切除术主要适用于肿瘤局限于一个肝叶或虽然位于多个肝叶,但可以完整切除者。一般认为,若肿瘤单个,或肿瘤多发,数目不超过3个,即我国肝癌规范的Ⅰa、Ⅰb和Ⅱa期,外科切除为首选的治疗方案;若肝癌为多发,如肿瘤数目超过3个,即我国肝癌规范的Ⅱb期,多选择肝动脉栓塞化疗;但部分Ⅱb期的肝癌,如肝功能允许,可能行根治性切除者,也可以选择手术切除,或者联合局部消融治疗,可获得优于肝动脉栓塞化疗的效果。Ⅲa期患者主要选择系统性治疗,但部分合并分支癌栓的患者,如果可能将肿瘤全部切除,也可选择手术切除的方案。
肝功能状态是决定患者能否接受手术切除的重要因素,一般为Child-Pugh A级或B级的肝癌患者。吲哚菁绿(ICG)试验对于判断肝脏的储备功能,确定手术指征很有帮助。
肝移植治疗肝癌除了可完全切除肝癌之外,还可治疗肝癌合并的肝硬化,特别适用于合并严重肝硬化的早期肝癌,治疗小肝癌可获得较好的效果。但是,由于肝癌容易发生肝内和远处转移,移植术后应用免疫抑制剂,如适应证选择不严格,术后容易复发。因此,肝移植治疗肝癌应该严格掌握适应证。西方国家多采用Milan标准或UCSF标准(单个肿瘤直径≤6.5cm,或多发肿瘤数目≤3个且每个肿瘤直径均≤4.5cm、所有肿瘤直径总和≤8cm)。由于我国肝癌的临床特征与西方的肝癌有所不同,根据我国肝癌的临床实践,制定了适合我国国情的肝癌肝移植标准,如“杭州标准”“复旦标准”“华西标准”等,适应证较Milan标准和UCSF标准有所扩大,但仍然能获得较好的远期生存。
肝癌切除术后,复发率较高,术后5年累积复发率可达61.5%~79.9%。故应该密切随访肿瘤标志物、超声、CT或MRI等,以便能够早期发现复发,及时治疗。肝癌术后复发超过80%发生在肝内,如能及时发现,再手术切除后5年生存率仍可达38.7%。射频毁损治疗或瘤内无水乙醇注射治疗术后复发的小肝癌也可获得较好的效果。
2.肝动脉栓塞化疗
AASLD指南认为经导管动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)是无血管侵犯和肝外转移的多发肿瘤(BCLC B期)的有效治疗。对于TACE是否能使BCLC C期患者获益,目前仍有争议,缺乏有效循证医学证据。传统的方法是在局部应用化疗药物的基础上,给予碘化油(lipoidol)或明胶海绵(gelfoam)进行肝动脉栓塞。近年来,有采用药物缓释微球或放射性铱-90微球进行肝动脉栓塞化(放)疗。随机对照研究和荟萃分析结果显示,对于Child-Pugh A级或B级的患者,与支持治疗或全身化疗做对照,肝动脉栓塞化疗均能显著地延长肝癌患者的生存期,从而肯定了肝动脉栓塞化疗的疗效。TACE最主要的并发症是肝衰竭,故应强调术中超选择肿瘤血管,以利肿瘤控制和肝功能保护。其他严重并发症包括上消化道出血、溶瘤综合征、异位栓塞、胆汁瘤继发胆道感染、血管损伤假性动脉瘤形成等。TACE禁忌证为:Child-Pugh C级、门静脉主干完全栓塞且侧支形成少、严重凝血功能障碍、急性感染期、ECOG>2分、全身广泛转移预计治疗不能改善生存期等。
3.局部消融治疗
包括射频消融(radiofrequency ablation)、微波消融(microwave ablation)、激光消融(laser ablation)及经皮无水酒精注射(percutaneous ethanol injection)。超过90%的患者可以在超声(或CT)引导下经皮穿刺消融,少数影像学显示不清楚或突出肝包膜的肝癌可在开腹和腹腔镜下消融。射频和微波的适应证为肿瘤直径≤5cm的单发肿瘤或直径≤3cm的3个以内多发结节,无血管、胆管侵犯或远处转移的患者,即我国肝癌诊治规范的Ⅰa、Ⅰb期。单发肿瘤直径≤3cm可获得根治性消融。超出以上标准的部分中期肝癌,联合TACE做消融治疗,可获得优于单纯TACE的疗效。无水酒精对于单发肿瘤直径≤2cm可取得类似于射频消融的疗效。禁忌证为Child-Pugh C级、近期有食管胃底静脉曲张破裂出血、ECOG>2分、活动性感染尤其胆系感染,严重凝血功能障碍或血液病等。严重并发症主要包括出血、周围脏器损伤和继发感染。
4.放射治疗
放射治疗主要适用于合并有远处转移病灶的姑息性治疗。近年来采用立体定向放射治疗技术的进步,有临床研究显示对小肝癌有良好的局部控制效果,但尚需充分的循证医学证据推荐为早期肝癌的首选治疗。对于部分不适合手术切除或局部消融的小肝癌,可选择立体定向放射治疗的方案。更有采用计算机断层技术与放射治疗结合的断层放射治疗(TOMO)治疗肝癌,使放射治疗应用更为广泛。适应证为肿瘤局限但位于重要解剖部位无法进行手术者,肿瘤压迫致胆道梗阻,胆道、门静脉或下腔癌栓,远处转移灶(淋巴结、肺、肾上腺、骨)。急性不良反应包括胃肠道反应、严重肝功能损害、骨髓抑制、放射性胃肠炎和肺炎,严重的放射后期损伤为放射诱导肝病(radiation induced liver disease,RILD)。 严重肝功能失代偿(Child-Pugh C级)或全身情况差(KPS评分<50分)不宜行放射治疗。放射治疗过程中应定期随访肝肾功能及血常规。
5.分子靶向治疗
分子靶向药物主要针对肿瘤发生和发展中的驱动基因,特异性地抑制肿瘤的生长。但迄今为止,尚未能明确肝癌增殖的驱动基因。目前主要应用针对肝癌新生血管形成、抑制肝癌增殖的分子靶向药物。一线选择的药物有索拉非尼、仑伐替尼。二线药物有瑞戈非尼。肝癌的分子靶向药物是有充分循证医学证据证实能够延长肝癌生存的药物,主要用于有远期转移,或合并门静脉癌栓的晚期肝癌患者,也可联合TACE用于中期肝癌的治疗。
6.免疫治疗
免疫检查点抑制剂近年来应用于临床的免疫治疗,包括PD-1/PD-L1抗体、CTLA-4抗体在各种实体瘤的临床试验中获得良好的效果,其特点是持续缓解时间长。纳武单抗(nivolumab)及帕博利珠单抗(pembrolizumab)根据 Checkmate040试验及Keynote224试验结果被美国食品药品监督管理局(FDA)批准为肝癌的二线治疗。进一步的临床研究显示,单一的免疫检查点抑制剂治疗肝癌的临床缓解率不超过20%,联合抗肿瘤血管生成抑制剂如仑伐替尼或贝伐单抗的治疗方案可提高缓解率。近期IMbrave150的研究证实,PD-L1抗体联合贝伐单抗在总体生存期和无疾病进展生存期方面,均显著优于索拉非尼,国家药品监督管理局批准了该方案为晚期肝癌的一线治疗方案。
7.其他治疗
肝癌多发生在乙型肝炎的基础上,在手术切除或抗肿瘤治疗同时应该注意监测乙肝病毒DNA载量的变化。如果治疗前或治疗过程发现有乙肝病毒复制,应及时给予核苷类抗乙肝病毒药物治疗。随机对照研究结果显示,如在肝癌切除术后大剂量应用α干扰素有降低术后复发率的作用。对于中晚期的肝癌患者,中药可以缓解症状、延长生存。此外,淋巴因子诱导的杀伤细胞——细胞因子诱导杀伤(cytokine-induced killer,CIK)细胞、肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)等过继细胞免疫治疗在肝癌切除术后应用,可降低术后的复发率。应掌握适应证应用。
(三)治疗后评估
1.肿瘤情况
①肝癌切除术后,通常需要在1个月行肿瘤标志物、超声等检查。对于复发高危的患者,如有大肝癌、有子灶或病理发现有血管侵犯,可在术后1~2个月给予辅助性的肝动脉栓塞化疗,能有效发现残留微小病灶并给予早期治疗。②TACE后1个月复查CT平扫评估碘油沉积情况,或增强MRI或超声造影可评估肿瘤存活情况,决定后续治疗方案。③消融治疗后1个月复查增强CT或增强MRI,评估消融彻底性,消融不全,或符合适应证的新发灶可重复消融。对于消融彻底的患者,应定期随访超声或MRI,以便早期发现复发,及时治疗。④随访肿瘤标志物如甲胎蛋白或异常凝血酶原,如术后未降至正常,则提示有残留癌的可能。
2.肝功能状态(Child-Pugh评分)及其他
治疗后再次Child-Pugh评分,评估肝功能状态。TACE及放疗后应随访血常规,观察骨髓抑制情况。随访HBV DNA和HCV RNA,观察有无免疫抑制引起的病毒复制。
3.全身情况和并发症评估
重新ECOG评分。
预防HBV和HCV感染是防治肝癌最有效的措施。乙肝疫苗的计划免疫将会显著降低HBV相关的肝癌发病率。预防HCV的主要措施是切断传染途径,包括血源的管理、使用一次性注射器具、外科器械的彻底消毒等。有效的抗病毒治疗如干扰素及核苷类抗HBV药物可减少肝炎后肝硬化的发生,以及降低肝癌的发生率。













