英文名称 :drug induced liver disease
中文别名 :药物性肝损伤
药物性肝病(drug induced liver disease,DILD)是指药物和/或其代谢产物引起的不同程度和类型的肝脏病变,又称为药物性肝损伤(drug-induced liver injury,DILI),是引起肝损伤的常见病因。目前已发现有1 200种以上药物有潜在的肝毒性(见LiverTox和HepaTox网站),包括医学处方药物及人们因治疗、营养等目的使用的非处方药物、中草药、保健品以及膳食补充剂。DILI约占所有药物不良反应的6%,急性肝炎的5%,非病毒性慢性肝炎的20%~50%,是引起暴发性肝衰竭的重要病因之一(50%以上)。
DILI中只有少部分由剂量依赖的毒性药物引起,而绝大多数是在推荐剂量下发生的个体对药物或其代谢产物的特异质性反应,难以预测,无特异性诊断标志物,发病与遗传易感因素、药物的理化和毒理性质及环境因素有关。
肝是药物清除、生物转化和分泌的主要场所,常能通过多种机制适应低水平的肝毒性。当药物代谢过程中毒反应性产物的产生超过能安全排泄的速率时就会引起肝损伤。
(一)非免疫机制
某些药物(如对乙酰氨基酚)在肝内细胞色素P450酶作用下可转化为毒性代谢产物,产生亲电子基和氧自由基,引起肝内谷胱甘肽耗竭,并与蛋白质、核酸和脂质等大分子物质共价结合,引起脂质过氧化,破坏线粒体、细胞骨架、微管、内质网及细胞核功能,结果导致肝细胞变性、坏死、凋亡和对炎症介质的敏感性增高。如果药物及其代谢产物引起肝窦底侧膜的摄取障碍、肝细胞分泌胆汁功能破坏和毛细胆管膜上转运器的功能障碍,则可导致药物性胆汁淤积。
(二)免疫机制
1.免疫过敏机制
药物反应性代谢产物可通过改变肝细胞的蛋白质形成新抗原、以半抗原复合物形式获得抗原性、诱导自身抗体的产生等启动细胞免疫和/或体液免疫反应,引起免疫介导的肝损伤。
2.免疫脱靶效应
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)通过阻断CTLA4、PD-1及 PD-L1或其他控制淋巴细胞抗肿瘤活性的分子而促进T细胞介导的肿瘤细胞监视和杀伤。这些分子也在对自身抗原有特异性的T细胞群体表达,因此定向这些分子的单克隆抗体可通过直接作用于自身反应性T杀伤细胞或作用于正常时抑制自身免疫反应性细胞的调节性T细胞(T-regs)而引起免疫性肝损伤。
(三)易感因素
①年龄(老龄);②性别(女性);③慢性酒精摄入;④药物的化学性质、剂量、疗程及药物间协同作用;⑤基础疾病(肝脏疾病和代谢紊乱);⑥肥胖;⑦宿主遗传因素:一些与药物生物转化、解毒及免疫反应过程相关基因(如细胞色素P450、跨膜转运蛋白、溶质转运蛋白、解毒酶、免疫因子、HLA等)的单核苷酸多态性与特异质性药物性肝损伤相关。
1.发病机制分型
①直接肝毒性(固有型):可预测,与药物剂量密切相关,个体差异不显著。②特异质性:临床上较为常见和多样化,不可预测,个体差异显著。又分免疫特异质性和遗传特异质性。前者有免疫反应特征,通常起病较快。③间接肝毒性:比特异质性肝毒性更常见。由药物的作用(而不是本身的毒性或特异质性)诱导了一个新的肝脏病变或加重了原有病情,如诱导免疫介导的肝炎,或加重乙肝、丙肝或脂肪肝。表型是那些潜在的疾病或易患病,如引起体重增加(利哌立酮、氟哌啶醇)或改变甘油三酯沉积(洛美他派)或胰岛素敏感性(糖皮质激素)的药物间接促进脂肪肝病;抗肿瘤化疗药物以及各种免疫调节药物、激酶和靶向酶抑制剂、单克隆抗体类药物可引起乙肝再激活;抗反转录病毒药物引起免疫重建和丙肝加重;因各种免疫调节药物、特别是肿瘤坏死因子拮抗剂以及抗肿瘤免疫检查点抑制剂引起的免疫介导的肝损伤,越来越多见。
2.病程分型
①急性:占绝大多数;②慢性:定义为发生6个月后血清ALT、AST、ALP及TBil仍持续异常,或存在门静脉高压或慢性肝损伤的影像学和组织学证据。
3.受损靶细胞类型分类
由国际科学组织理事会(The Council for International Organizations of Medical Sciences,CIOMS)初步建立后经修订,通过计算R值进行临床分型和观测演变。 R=(ALT实测值/ALT ULN)/(ALP实测值/ALP ULN)。可分为四型。①肝细胞损伤型:ALT≥3×ULN,且R≥5;②胆汁淤积型:ALP≥2×ULN,且 R≤2;③混合型:ALT≥3 ×ULN,ALP≥2×ULN,且2<R<5;④肝血管损伤型:相对少见,靶细胞可为肝窦、肝小静脉和肝静脉主干及门静脉等的内皮细胞。表现为HSOS/VOD,紫癜性肝病(peliosis hepatis,PH)、Budd-Chiari综合征、可引起特发性门静脉高压症(IPH)的肝汇管区硬化和门静脉栓塞、肝脏结节性再生性增生(NRH)等。
DILI可引起所有类型的肝损伤病理变化,包括坏死性肝炎、胆汁淤积、脂肪变、血管损伤和肝肿瘤(表1)。而肝内所有细胞均会受到药物的影响,不同药物可导致相同类型肝损伤,同种药物也可导致不同类型的肝损伤。有些药物甚至可能出现多种损伤表现。临床较多见的是类似急性黄疸性肝炎和胆汁淤积性肝病的症状和实验室检查异常。
表1 药物性肝病的临床病理表现

引自:实用内科学.第16版.ISBN:978-7-117-32482-3
续表
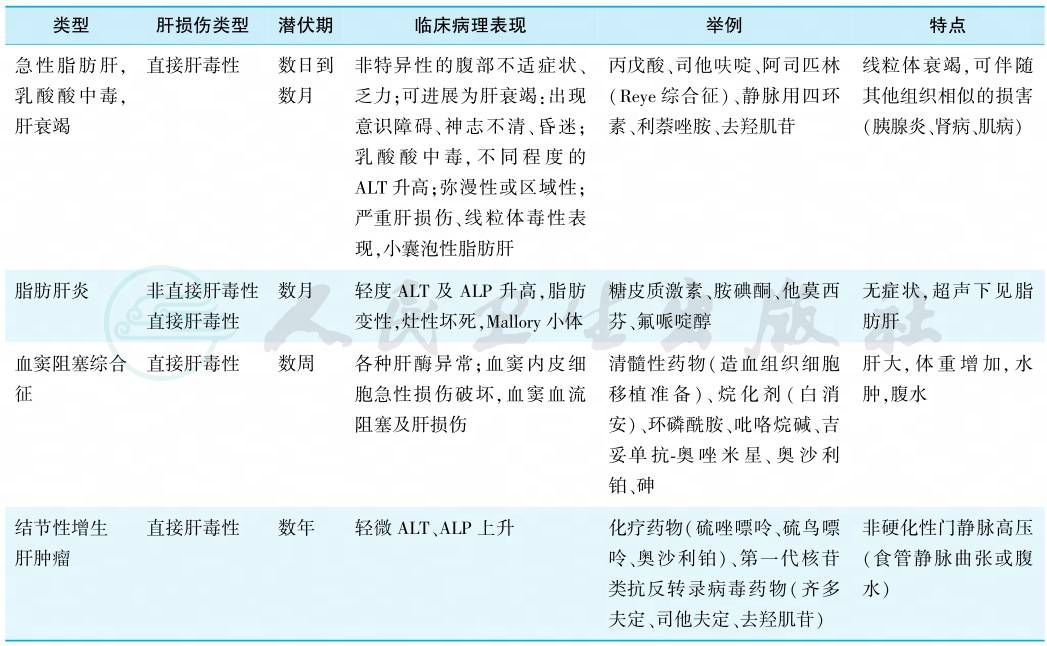
注:ALP.碱性磷酸酶;ALT.谷丙转氨酶。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
可分为0~5级。
0级:无肝损伤,患者对暴露药物可耐受,无肝毒性反应。
1级:轻度肝损伤,血清ALT和/或ALP呈可恢复性升高,总胆红素(TBil)<2.5mg/dl,且国际标准化比值(INR)<1.5。多数患者可适应。可有或无乏力、虚弱、恶心、厌食、右上腹痛、黄疸、瘙痒、皮疹或体重减轻等症状。
2级:中度肝损伤,血清 ALT和/或 ALP升高,TBil≥2.5mg/dl,且INR≥1.5。上述症状可有加重。
3级:中至重度肝损伤,血清 ALT、ALP、TBil和/或 INR 增高。患者症状进一步加重,需要住院治疗,或住院时间延长。
4级:重度肝损伤,血清 ALT和/或 ALP升高,TBil≥2.5mg/dl并至少出现以下一项:①肝衰竭(INR≥1.5,腹水或肝性脑病);②与DILI相关的其他器官功能衰竭。
5级:致死性,因DILI死亡,或需接受肝移植才能存活。
(一)停用和防止重新给予引起肝损伤的药物
包括属于同一生化家族的药物(以防止有相关化学结构的药物之间的交叉毒性反应)。免疫检查点抑制剂相关的肝损伤的处理和停药建议见表3。
表3 免疫检查点抑制剂相关的肝损伤的处理

注:∗常见不良反应事件评价标准,根据以下一般准则对每个不良事件的严重程度(1级至5级)作了特定的临床描述:
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(二)早期清除和排泄体内药物
服药6小时内可通过洗胃、导泻(硫酸镁)、吸附(活性炭)等清除胃肠残留的药物。血液透析(血浆药物浓度高,分布容积低的情况下)、血液超滤(摄取过量在14~24小时以内的患者)、渗透性利尿(血浆药物浓度低,分布容积高,采用血液超滤无效的情况下)可促进药物的排泄。
(三)药物治疗
包括抗氧化剂(促进反应性代谢产物的清除)、保护性物质的前体、阻止损伤发生的干预剂或膜损伤的修复剂。常用药物有:①N-乙酰半胱氨酸,对乙酰氨基酚过量的患者有特殊疗效,可作为谷胱甘肽的前体或通过增加硫酸盐结合解毒已形成的反应性代谢物,此外还有促进肝内微循环的作用。治疗应尽早,10小时内给药可获最大保护效果。用法:初次口服(或灌胃)140mg/kg,以后每 4小时口服 70mg/kg,共72小时;或首次静脉滴注150mg/kg(加入5%葡萄糖液200ml内静脉滴注15分钟),以后静脉滴注50mg/kg(500ml/4h),最后 100mg/kg(1 000ml/16h)。 ②还原型谷胱甘肽。③S-腺苷甲硫氨酸。④多烯磷脂酰胆碱。⑤熊脱氧胆酸(UDCA)。⑥甘草酸制剂。⑦皮质激素,可诱导多元耐药相关蛋白2(MRP2),从而加速胆红素排泄,可用于胆汁淤积和有免疫高敏感性证据的患者,可采用甲泼尼松龙30~40mg/d,有效后减量。
对发生DILI的患者应加强支持治疗。卧床休息,密切检测肝功能等指标,特别是监测急性肝衰竭和进展为慢性肝衰竭的征象。药物引起急性肝衰竭的治疗原则基本同急性重型肝炎。
皮质激素治疗通常对抗肿瘤免疫检查点抑制剂引起的免疫性肝炎有效,但激素减量后常常复发。激素难治性患者可使用麦考酚酯和他克莫司、抗胸腺细胞球蛋白治疗。
(四)支持治疗
重症DILI可选择人工肝支持治疗。
(五)肝移植
重症DILI导致肝衰竭、重度胆汁淤积和慢性肝损伤进展到肝硬化时,可考虑肝移植治疗。
药物性肝损伤重在预防,应严格掌握药物的适应证。避免同时使用多种药物,特别是应谨慎使用那些在代谢中有相互作用的药物;避免不必要的用药;避免服药时饮酒(酒精与多种药物合用)。













