英文名称 :inflammatory bowel disease
中文别名 :溃疡性结肠炎;克罗恩病
炎症性肠病(inflammatory bowel disease,IBD)是一种免疫介导的慢性肠道炎症性疾病,主要包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),好发于年轻人,以慢性复发性为其特征,病因不明。UC以黏膜炎症为特征,始于直肠,向近端蔓延累及部分结肠或全结肠,呈连续弥漫性分布;CD为非连续性全层炎症,可累及全消化道,最常累及末端回肠或回盲部。
IBD在西方国家较为常见,欧洲和北美UC年发病率最高分别为24.3/10万和19.2/10万,CD年 发病率分别为12.7/10万和20.2/10万,欧洲UC和CD的患病率分别为505/10万和322/10万。我国IBD年标化发病率为(1.77~3.14)/10万,但近20年呈快速上升趋势。我国IBD协作组根据住院患者粗略推算CD的年发病率为1.09/10万;大部分地区UC较CD常见,男性略高于女性。IBD主要的发病年龄在20~40岁。
疾病机制尚未完全明确,是近年来研究非常活跃的领域。
(一)环境因素
在经济发达地区发病率持续增高,如北美、北欧等。南亚裔发病率低,但移居至英国后IBD发病率增高,表明环境因素起着重要作用。母乳喂养可降低IBD的发病。在白种人中,吸烟对UC有保护作用,而使CD疾病恶化。
(二)遗传因素
5%~10%的IBD患者有家族史,同卵双胞胎、兄弟姐妹和一级亲属发病率明显升高。白种人和犹太人发病率较高。IL-10和IL-10受体缺陷与严重的早发IBD相关。已发现IBD有超过163个基因易感性位点,其中一些基因可能与疾病发病、严重程度及并发症有关。
(三)微生物因素
微生物可能在IBD发生发展中起作用。当IBD动物模型处于无菌状态时,不能诱发肠道炎症,导入正常菌群后,则出现肠道炎症。CD和UC分别好发于患者肠道细菌浓度最高的回肠末端和结肠(1012/g),使用广谱抗生素有助于缓解CD。临床上也发现粪便转流能防止CD复发。
(四)免疫因素
近来认为IBD是固有免疫系统(触发T细胞反应)失调的产物。正常肠道组织免疫细胞适度激活,对肠道正常菌群和口服食物抗原等肠内容物耐受,而感染时肠道相关淋巴组织完全激活并适时消停。遗传易感者对肠道微生态环境敏感,肠道细菌触发了免疫反应,由抗原提呈细胞产生IL-23等炎症介质,激活Th17淋巴细胞,并募集淋巴细胞经血流回巢进入肠黏膜进一步促进炎症,最终导致组织损伤。
目前认为IBD不仅是多基因病,也是一种遗传异质性疾病,遗传易感者在一定的环境因素作用下,其肠道正常菌群、肠上皮细胞和免疫细胞之间的稳态被打破,宿主对正常肠道菌群产生异常免疫应答而不受控制,导致肠道黏膜的慢性炎症。
一、临床表现
(一)症状
起病缓慢,少数急骤。病情轻重不一,常迁延不愈,反复发作。临床症状多样化,以右下腹痛多见,腹泻、便血、乏力、营养不良、生长发育迟缓为常见症状。严重者可有发热、突发性剧烈腹痛伴腹胀、恶心、呕吐等症状。可伴有肛门处疼痛和脓液分泌。
(二)体征
腹部常扪及腹部包块伴压痛。有急性或慢性胃肠道梗阻、肠穿孔和消化道出血体征,以及肛周脓肿和肛瘘等。
(三)肠外表现
可伴皮肤结节红斑、坏疽性脓皮病、口腔溃疡、关节炎、关节痛、虹膜炎、胆管炎等肠外表现。
二、实验室及辅助检查
(一)实验室检查
贫血常见,血小板常明显升高,C反应蛋白升高,与疾病活动有关。钙卫蛋白主要存在于中性粒细胞和巨噬细胞内,肠道炎症时,粪钙卫蛋白增高,与疾病活动度相关,可用于监测疾病活动。部分CD患者抗酿酒酵母抗体(anti-Saccharomyces cerevisiae antibody,ASCA)阳性。抗大肠埃希菌外膜孔道蛋白C抗体(抗OmpC抗体)、抗荧光假单胞菌抗体(抗I2抗体)和抗鞭毛蛋白抗体(抗Cbir1抗体)阳性可提供诊断线索,与长期病程中临床表现相关。
(二)内镜
内镜是诊断和疗效评估的重要手段。CD早期黏膜可见阿弗他溃疡,随着疾病发展,溃疡变深变大,成为纵向和匍匐形溃疡,呈节段性非对称性分布,周围卵石样增生,肠腔增厚狭窄,偶见瘘口。回结肠部位病变累及最多见,肠镜需进入末段回肠观察。小肠检查应列为CD诊断的常规项目。胶囊内镜观察小肠黏膜病变敏感性高,但若合并狭窄,有发生滞留危险,检查前可先行影像学评估。小肠镜能更好地观察病灶,亦可进行活体组织检查。
(三)影像学检查
结肠钡剂灌肠已被结肠镜检查所代替,当CD患者肠腔狭窄内镜无法检查时结肠钡剂灌肠仍有诊断价值。小肠钡餐造影敏感性低,已被CT或MR肠道显像代替。活动期CT可见肠壁明显增厚(>4mm),黏膜明显强化伴有分层改变,呈“双晕征”,提示黏膜下层水肿;早期肠壁增厚以系膜侧为重,称偏心性增厚;后期肠壁纤维性狭窄,近端肠腔呈不规则扩张。可见腹腔脓肿、蜂窝织炎、瘘管和节段性病变等;肠系膜血管呈“木梳征”;MR肠道显像是诊断CD复杂性瘘管和脓肿的重要手段,评价肛门内外括约肌的完整性。由于MR肠道显像无电离辐射,特别是对年轻及儿童IBD患者,更适合作为长期随访手段。腹部超声能观察病变部位、肠壁厚度、瘘管、脓肿等。
(四)病理组织学
黏膜活检建议多段多点活检(包括病变部位和非病变部位),活检病理可见局灶性慢性炎症、局灶性隐窝结构异常和非干酪样肉芽肿。外科标本应沿肠管纵轴切开(肠系膜对侧缘),可见肠系膜脂肪包绕病灶、节段性病变、纵行溃疡、卵石样增生、肠壁增厚伴肠腔狭窄、瘘管形成等。显微镜下表现为透壁性炎症;聚集性炎症分布,透壁性淋巴细胞增生;黏膜下层增厚;裂隙状溃疡;非干酪样肉芽肿(包括淋巴结);肠道神经系统异常。相比手术切除标本,内镜活检标本受取材深度的限制,其诊断价值有限。
三、诊断与鉴别诊断
(一)诊断
包括病史采集、体格检查、内镜、影像学、实验室及组织细胞学检查,并进行综合分析得出,WHO提出6个诊断要点(表1)。对初诊不典型患者,应6~12个月密切随访。
表1 WHO推荐的克罗恩病诊断标准
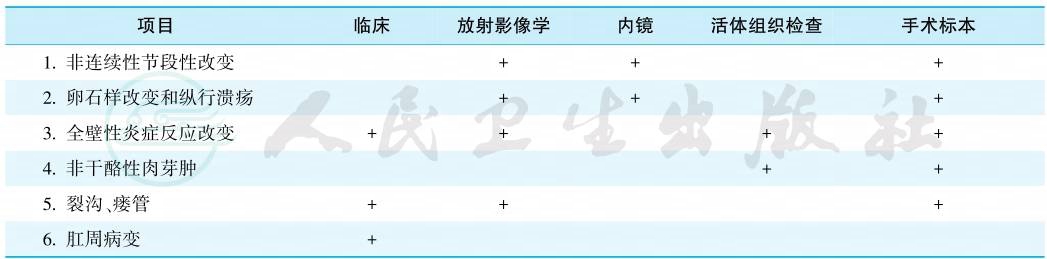
注:具有1、2、3者为疑诊;再加上4、5、6三者之一可确诊;具备第 4项者,只要加上1、2、3三者之二亦可确诊,“+”代表有此项表现。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(二)鉴别诊断
CD诊断需要建立在排除诊断的基础上,与IBD鉴别的疾病详见扩展阅读15-6-10-1。

扩展阅读15-6-10-1 需与IBD鉴别的疾病
1.肠结核
若鉴别困难且倾向于肠结核者,可按肠结核诊断性治疗8~12周。
2.白塞病
以反复发作口腔溃疡、生殖器溃疡、眼部病变和多形性的皮疹为主要特征,也可以末端回肠和回盲部溃疡为主要症状。肠道溃疡单发或多发,深浅不一,边界清楚,溃疡间不融合,无纵行溃疡,卵石样表现,可致肠壁穿孔、肠腔狭窄及瘘管形成等表现。
3.UC
当肠道病变不典型时,可暂诊断为未定型结肠炎(indeterminate colitis),长期随访后最终诊断。UC与CD的鉴别诊断要点见表2。
表2 溃疡性结肠炎和克罗恩病的鉴别
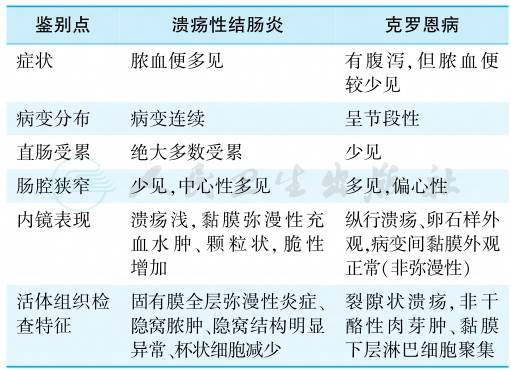
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(三)疾病评估
1.临床类型
CD分型见表3。
表3 克罗恩病的蒙特利尔分型
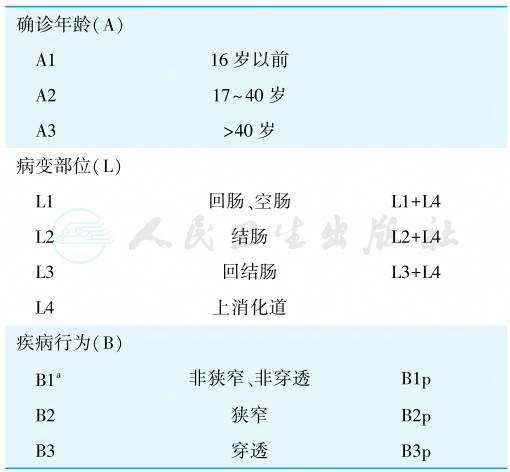
注:a随着时间推移,B1可发展为B2或B3;L4可与 Ll、L2、L3同时存在;p为肛周病变,可与 Bl、B2、B3同时存在。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
2.疾病活动性
分为缓解期和活动期,常选用简化Harvey和Brashow标准判定疾病活动指数(表4)。
表4 Harvey简化疾病活动指数计算法
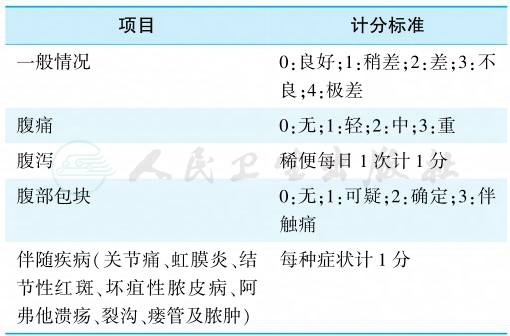
注:≤4分为缓解期;5~8分为中度活动期;>9分为重度活动期。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
3.并发症
40%以上病例有程度不等的肠梗阻,且可反复发生。急性肠穿孔占10%~40%。还可有肛门区和直肠病变,以及瘘管、脓肿、出血和癌变等。
四、治疗
(一)一般治疗
慢性疾病常伴有营养不良,主张高蛋白低脂饮食;少渣饮食能减少排便次数;适当补充叶酸、维生素和微量元素。全肠外营养适用于重症患者、肠瘘、短肠综合征等并发症者。戒烟有益于疾病控制。因疾病多反复发作,迁延终生,患者常见抑郁和焦虑情绪,需予心理疏导和支持。
(二)药物治疗
1.氨基水杨酸
适用于结肠型、回肠型和回结肠型,疗效有限,需及时评估(详见UC部分)。
2.糖皮质激素
最常用的治疗药物,快速诱导部分患者缓解症状,但不能作为维持缓解的药物(详见UC部分)。布地奈德是一种局部作用强而系统生物利用度较低(10%)的药物,特别是病变局限于回盲部者,可减少治疗的副作用,但疗效弱于全身作用的激素。
3.免疫调节剂
适用于激素依赖或无效者,以及激素诱导缓解后的维持治疗。
(1)硫嘌呤类药物:
包括硫唑嘌呤(azathioprine,AT)和巯嘌呤(mercaptopurine,6-MP),是最常用的免疫抑制剂,起效慢(3~4个月达到最大血药浓度)。部分AT不良反应者换用6-MP仍能耐受。欧洲共识推荐的目标剂量为1.5~2.5mg/(kg•d),我国患者耐受剂量较欧洲国家患者低,有报道为1~1.5mg/(kg•d),但尚未达成共识。AT存在量效关系,剂量不足会影响疗效,增加剂量会增加不良反应的风险。有条件的单位建议行药物浓度6-硫代鸟嘌呤核苷酸(6-thioguanine nucleotides,6-TGN)检测。密切随访不良反应,包括血常规、肝功能等。骨髓抑制可发生在1周~1个月内,也可发生于1年后,与基因变异有关,用药前可检测NUDT15基因。
(2)甲氨蝶呤(methotrexate,MTX):
适合不耐受巯嘌呤者。诱导缓解期常推荐MTX25mg/周肌内或皮下注射,缓解后改为15mg/周肌内或皮下注射,口服疗效降低。胃肠道反应常见,叶酸可减轻不良反应。
(3)沙利度胺(thalidomide):
对难治性CD有效,用于无条件使用抗肿瘤坏死因子(tumor necrosis factor,TNF)单抗者。起始剂量建议75mg/d或以上,值得注意的是该药治疗疗效及毒副反应与剂量相关。他克莫司(tacrolimus,TAC)对激素依赖和难治性CD伴瘘管有效。
4.生物制剂
英夫利西单抗(infliximab,IFX)是TNF-α 抑制剂,目前是治疗IBD应用时间最长的生物制剂,对大部分IBD患者疗效肯定。IFX使用方法为5mg/kg静脉滴注,可作为诱导期和维持期治疗的药物。维持治疗复发者,应查找原因,检测药物谷浓度及抗药抗体浓度。浓度不足者可增加IFX剂量或缩短给药间隔时间;联合免疫抑制剂可减少抗药物的抗体形成。目前尚无足够资料提出何时可以停用IFX,对停用IFX后复发者,再次使用IFX可能仍然有效。IFX可激活潜在结核分枝杆菌及肝炎病毒携带者病毒复制的危险,特别是联合免疫调节剂,并有诱发淋巴瘤的报道。其他不良反应包括过敏、多发性硬化、脱髓鞘病变和视神经炎等。
其他生物制剂包括全人源化抗TNF-α单体阿达木单抗(adalimumab,ADA)、阻断IL-12/IL-23介导信号转导的乌司奴单抗(ustekinumab)、抗肠道整合素 α4β7维得利珠单抗(vedolizumab),以及抑制细胞内的非受体酪酸蛋白激酶小分子物质托法替尼(tofacitinib)等。
5.抗生素类
用于并发症的治疗,即肛周病变、瘘管、炎性包块、预防术后复发等。甲硝唑、环丙沙星和利福昔明等为常用抗生素。
6.营养制剂
当慢性疾病持续性活动,特别是小肠广泛累及、肠瘘时,可导致严重营养不良,肠内、肠外营养为重要的辅助手段。特别是肠内营养,应遵循尽量选择肠内营养的原则促进肠道吸收功能。整蛋白配方、低聚(短肽)配方或氨基酸单体(要素膳)配方,疗效并无明显差异。
7.肠道菌群
尚无确切证据支持益生菌疗效,粪菌移植和干细胞移植在CD治疗中需进一步观察和研究。
(三)治疗方案
应制订个性化方案,综合考虑病变累及范围、部位、病程长短、全身情况、既往药物治疗疗效,以迅速控制疾病症状、维持缓解、促进黏膜愈合、防治并发症和掌握手术治疗时机。
轻度回结肠型和结肠型可予美沙拉嗪治疗,中重度首选激素或生物制剂诱导疾病缓解,随后继用免疫调节剂或生物制剂维持缓解。目前认为合并肛周病变、广泛性病变(病变累及肠段累计>100cm)、食管胃十二指肠病变、发病年龄小、首次发病即需要激素治疗而复发频繁者为“病情难以控制”高危因素,应考虑早期给予更积极治疗,包括激素联合免疫抑制剂、直接生物制剂,有助于提高疾病缓解率及减少缓解后的复发率。
疾病需长程治疗,缓解后仍需维持治疗。缓解期应撤离激素,免疫抑制剂是最常用的药物,抗TNF-α单抗诱导缓解后应以抗TNF-α单体维持治疗。对于维持缓解期间的复发,首先寻找病因,了解治疗的依从性、药物剂量是否足够、合并感染等因素,然后调整或更换药物。
(四)手术治疗
部分患者需要接受手术治疗,由于手术不能治愈疾病,接受多次手术的概率相当大。内科医师应慎重评估手术的价值和风险,短节段狭窄者可先行内镜下扩张。围手术期应调整营养不良,减少激素用量,减少手术并发症;另外,应避免盲目无效治疗而贻误手术最佳时机。手术指征包括纤维狭窄所致的梗阻,肠皮瘘、各种内瘘,腹腔脓肿,急性穿孔和大出血,癌变等。
肛瘘者,通过肠镜、肛检、影像学评估瘘管的解剖结构(单纯性和复杂性两大类),无症状单纯性肛瘘不需处理;脓肿者,先行外科引流,予抗菌药物;对不同肛瘘行个体化术式治疗,如单纯瘘管切除术、挂线疗法、肠道转流术等;外科治疗联合抗TNF-α单抗对复杂性肛瘘疗效较好。
CD术后复发率高,应定期随访,尤其是术后1年内的内镜复查,以利于制订预防复发的方案。早期复发的高危因素包括吸烟、肛周病变、穿透性疾病、有肠切除术史等。5-氨基水杨酸(5-aminosalicylic acid,5-ASA)制剂、硫嘌呤类药物、咪唑类抗菌药物对预防复发有一定疗效,嘌呤类药物疗效略优于5-ASA。若发现术后半年内镜下复发,可转换为生物制剂。
(五)肿瘤检测
小肠CD炎症部位癌变可增加检测的困难。
(六)妊娠
疾病本身,特别是活动期及治疗药物对妊娠期女性患者及胎儿均有潜在风险。甲氨蝶呤和沙利度胺存在明确的致畸作用,用药期间严格避孕。氨基水杨酸制剂、硫嘌呤类药物和抗TNF-α单抗不增加先天畸形风险;硫嘌呤类药物可能增加早产风险;抗TNF-α单抗妊娠中晚期可通过胎盘,对于婴儿活疫苗接种存在风险,6个月内婴儿不宜接种。
五、预后
本病经治疗可好转,部分可自行缓解,但多数患者迁延不愈、反复发作。在疾病漫长的病程中,将面临各种复杂临床变化,需要内外科、放射科、病理科及营养科的医师密切协作。总之,CD需长期治疗,以避免肠道功能的进展性不可逆损伤。
一、临床表现
起病缓慢,少数急骤。易反复发作,发作的诱因有饮食失调、过度劳累、精神紧张和感染等。
(一)症状
腹泻、黏液脓血便、下腹痛,以及里急后重、排便紧迫感等直肠刺激症状。直肠炎患者常排新鲜血便或黏液血便,可混于大便或涂抹于成形便表面,少数可表现为便秘。重度和广泛结肠炎患者常排黏液脓血稀便,伴腹部隐痛或绞痛,以及乏力、恶心、呕吐、发热和体重下降。
(二)体征
轻型者或疾病缓解期可无阳性体征。直肠指检可见黏血,广泛结肠炎可有结肠压痛,中毒性巨结肠还可见腹部膨隆、肝区呈鼓音,若伴发穿孔则出现腹膜炎体征。
此外,UC可伴各种肠外表现(见CD部分)。
二、辅助检查
(一)实验室检查
1.血常规和生化检查
广泛或严重病变患者可见贫血、白细胞升高、血小板增多,血沉增快,C反应蛋白升高。急性重症患者可出现低钾血症、低白蛋白血症和一过性转氨酶异常,持续性碱性磷酸酶升高需警惕合并原发性硬化性胆管炎。
2.粪便检查
活动期镜检可见红细胞、白细胞,隐血试验阳性。粪乳铁蛋白或钙卫蛋白增高,可作为疾病监测的指标。
3.免疫学检查
UC患者抗中性粒细胞核周抗体(anti-antineutrophilic perinuclear antibody,pANCA)阳性率为 55%~70%,CD患者pANCA阳性率为5%~10%,特异性差,目前尚不支持血清抗体作为诊断或预后的依据。
(二)内镜检查
对便血、腹泻、腹痛等临床疑诊患者,内镜检查对本病诊断最有价值,急性重型者应暂缓进行或酌情检查至乙状结肠,以防穿孔。严重程度可参考Mayo内镜评分。
(三)影像学检查
钡剂灌肠已很少应用,可表现为黏膜粗糙呈细颗粒样改变,肠壁充盈缺损可为炎性息肉或肿瘤性息肉及癌变。慢性病变者呈铅管样。重型患者应暂缓检查。CT和MRI可辅助了解整个结肠情况,多表现为轻度非特异性肠壁增厚,呈连续性。
三、病理
病变往往局限于黏膜和黏膜下层,重症者可累及全层。活动期可见固有层充血水肿,伴急性炎症细胞浸润、隐窝炎、隐窝脓肿、杯状细胞黏液耗竭、上皮细胞坏死和溃疡形成。慢性期隐窝结构变形呈分枝状伴隐窝减少,隐窝基底和黏膜肌层间隙增宽,伴基底部浆细胞浸润和多发淋巴样聚集、帕内特细胞化生。
四、诊断与鉴别诊断
(一)诊断
诊断缺乏“金标准”,主要结合病史和临床表现、内镜和活检组织病理学表现进行综合分析,同时应排除肠道感染性和其他非感染性结肠炎。若诊断存疑应在4~6个月后复查内镜和病理检查。
诊断步骤:有典型临床表现者疑诊UC,同时符合上述结肠镜和/或影像学特征者,可为拟诊;若活检和/或手术标本具有上述病理学特征者,可以确诊。初发病例如临床表现和结肠镜改变均不典型,应列为疑诊定期复查以明确诊断。除了病灶,对病灶近端和远端外观正常的黏膜包括直肠黏膜进行活检有助于病理诊断和界定病变范围。诊断UC同时需排除其他原因引起的肠炎。
(二)鉴别诊断
1.感染性结肠炎
包括细菌、病毒、真菌、寄生虫感染,临床表现与UC相似,内镜下亦可见黏膜充血水肿、糜烂,以及大小不一、形态多变的溃疡,与UC较难鉴别,但组织学无慢性炎症表现,如隐窝结构改变等;UC合并感染则病理无法鉴别感染或UC复发。常见沙门菌、志贺菌、空肠弯曲菌和致病性大肠埃希菌等细菌感染,起病急,血培养或粪便细菌培养可阳性,通常在4周内恢复正常。艰难梭菌引起的假膜性肠炎常见于院内感染,多有广谱抗生素应用史,镜下可见特征性的假膜形成,粪便毒素检测有助于诊断。直肠炎还应鉴别性传播疾病。巨细胞病毒感染多见于免疫抑制患者,肠镜下可见深溃疡;UC合并巨细胞病毒感染与UC病情加重难以鉴别,活检组织学检查见到细胞核内包涵体可确诊。HIV感染亦可出现腹泻发热伴结肠炎症,需鉴别。阿米巴感染有腹痛、里急后重和果酱样大便,镜下可见潜行溃疡,大便或活检找到阿米巴病原体或血清阿米巴抗体阳性有助于诊断。憩室炎部位局限,以乙状结肠好发。
2.克罗恩病
详见表2。
3.非感染性结肠炎
需鉴别的疾病有:系统性疾病如IgA血管炎、系统性红斑狼疮、结节性多动脉炎、淀粉样变等;药物性/毒素性肠炎如非甾体抗炎药、泻剂、化疗药、免疫相关药物等;炎症性疾病如放射性肠炎、缺血性肠炎、嗜酸性粒细胞性胃肠炎、直肠孤立性溃疡、显微镜下结肠炎、转流性结肠炎;子宫内膜异位症等;肿瘤性如淋巴瘤、原发性或转移性癌等。缺血性结肠炎多见于老年人,常急性起病并快速缓解,少数可呈慢性过程。孤立性直肠溃疡综合征排黏液血便伴便秘、排便费力堵塞感和肛周疼痛,镜下可见直肠前壁大溃疡,与括约肌过度活动、排便时直肠内压力过高或手抠大便有关,活检病理可确诊。显微镜下结肠炎多表现为水样泻,肠镜下黏膜正常,活检可发现上皮内淋巴细胞增多或胶原带。转流性结肠炎可见于回结肠造瘘术后,肛门排少量脓血便;镜下可见远端无粪便通过的结肠出现充血、颗粒样改变、质脆甚至溃疡,病理可见隐窝炎、隐窝脓肿,但隐窝结构正常,可与UC鉴别。
(三)疾病评估
包括疾病类型、病变范围、病期、疾病活动严重程度、并发症和肠外表现,以便选择治疗方案和用药途径,评估预后。
1.疾病类型
分为初发型、慢性复发型。
2.病变范围
分为直肠炎、左半结肠炎和广泛性结肠炎。
3.疾病分期
分为活动期和缓解期。
4.疾病活动严重程度
评价疾病活动度的改良的Truelove和Witts严重程度分型标准见表5。临床科研常用Mayo评分或部分Mayo评分以定量评价疾病活动度(表6)。
表5 改良Truelove和Witts疾病严重程度分型

注:中度为介于轻、重度之间。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
表6 溃疡性结肠炎的Mayo评分
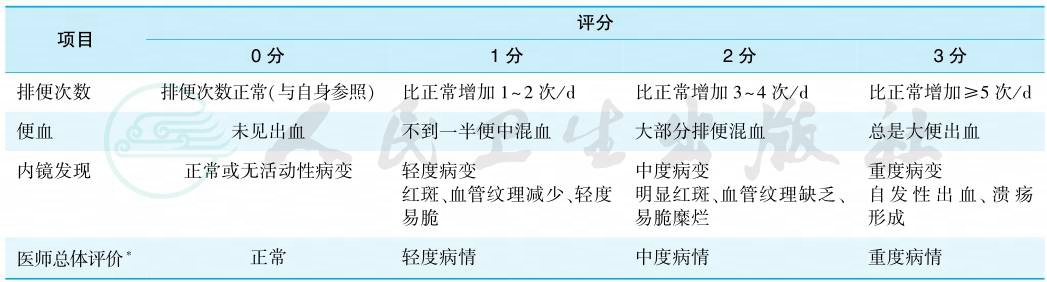
注:∗医师总体评价包括3项标准,即患者对腹部不适的回顾、患者总体感觉、对患者全身状态的评价。
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
5.并发症
包括中毒性巨结肠、肠穿孔、消化道大出血、上皮内瘤变和癌变。狭窄需排除并发肿瘤。
五、治疗
(一)一般治疗
活动期少渣饮食能减少排便次数。全肠外营养适用于重症患者及中毒性巨结肠等并发症者。严重结肠炎时禁用止泻剂与解痉剂。低钾血症和解痉剂可诱发巨结肠。
(二)治疗常用药物
1. 5-氨基水杨酸制剂(5-aminosalicylic acid,5-ASA)
包括传统的柳氮磺吡啶(sulfasalazine,SASP)和不同制剂的美沙拉嗪,是治疗UC的主要药物。活动期予3~4g/d,维持期2g/d。SASP在结肠内被细菌分解为5-ASA和磺胺,长期服用SASP者需补充叶酸,并关注磺胺类药物相关副作用。5-ASA具有肠黏膜局部抗炎作用,常用制剂有前体药奥沙拉嗪(偶氮二聚体)和巴柳氮(偶氮异二聚体),在结肠内分解为5-ASA起效;pH依赖包衣制剂在回肠末端pH 5~7时溶解释放,大部分在结肠释放;时间依赖型制剂起效范围从远端空肠至结肠。5-ASA肛栓剂和灌肠剂治疗局部黏膜内药物浓度高,尤其适用于溃疡性直肠和左半结肠炎,不良反应少。复旦大学附属中山医院几十年来沿用混合配方(曲安奈德40mg,柳氮磺吡啶2g,锡类散1支,利多卡因0.1g,生理盐水100ml)保留灌肠,起效快,便血常在1~3天内消失。
2.糖皮质激素
适用于中至重度UC及5-ASA无效的轻至中度病变,无维持缓解作用且长期应用不良反应多。常用泼尼松0.75~1mg/(kg•d),起始需足量,起效后逐渐减量;病情重者可予静脉甲基泼尼松龙。
3.免疫调节剂
适用于激素依赖和激素诱导缓解后5-ASA维持疗效不佳的患者,具体用法及不良反应见前。目前,甲氨蝶呤用于UC无足够证据。环孢素(cyclosporin,CsA)适于重症UC且激素无效者,2~4mg/(kg•d),1周内快速起效。临床症状缓解后可改口服[4~6mg/(kg•d)]并逐渐转为硫唑嘌呤维持。用药期间需监测血药浓度和不良反应(包括白细胞下降、肝肾功能损害和神经毒性等)。他克莫司与CsA同为钙磷酸酶抑制剂,可有效诱导激素依赖的UC缓解和维持缓解。
4.生物制剂
主要适用于经激素及免疫调节剂治疗无效或不能耐受者。抗TNF抗体是目前应用最多的生物制剂,用法同前。维得利珠单抗特异性作用于肠道黏膜,感染不良反应较低,能有效诱导缓解激素无效或抗TNF无效的患者;研究发现维得利珠单抗治疗中至重度活动性UC的临床和内镜下缓解率均显著高于阿达木单抗。
5.益生菌
为肠道防御系统构建正常肠道菌群,一些研究提示双歧杆菌等益生菌对维持UC缓解有效。仍需多中心RCT来证实其在UC治疗中的作用。
其他尚有白细胞吸附术、粪菌移植和造血干细胞移植治疗重度或难治性UC的报道,仍需严密谨慎的研究。
(三)治疗原则和方案选择
尽早控制疾病的症状,维持缓解,促进黏膜愈合,防治并发症和掌握手术治疗时机。
直肠炎选择5-ASA栓剂治疗,联合口服5-ASA疗效优于单用口服者,局部激素适用于局部5-ASA治疗无效者。局部泡沫剂和灌肠剂用于治疗左半结肠炎。广泛性结肠炎口服5-ASA联合栓剂或灌肠剂治疗可提高疗效。急性重度UC首选激素,若甲基泼尼松龙40~60mg/d静脉滴注3~5天症状无好转时,排除继发感染后,改为CsA或生物制剂治疗,同时加强对症支持治疗和病情监测,必要时手术切除。
(四)手术治疗
内科积极治疗下无效的重度UC,特别是大出血、中毒性巨结肠需急诊手术治疗。合并穿孔者死亡率达15%,需急诊手术切除全结肠并行回肠造瘘,以后再行回肠储袋肛管吻合术(ileal pouch-anal anastomosis,IPAA)。 内科医师应对手术有充分的认识,与外科医师保持密切联系,掌握手术时机。
(五)肿瘤检测
广泛性UC发生肠癌的概率比一般人群增高5%~10%。建议起病8~10年开始每1~2年1次结肠镜检查,伴发原发性硬化性胆管炎患者需每年行结肠镜检查。随机取样活检如发现高度异型增生,建议手术切除全结肠;平坦黏膜上的低度异型增生可行全结肠切除或3~6个月随访,仍有异型增生则行全结肠切除。













