英文名称 :chronic gastritis
慢性胃炎(chronic gastritis)是指多种病因引起的胃黏膜慢性炎症,病理上以淋巴细胞浸润为主要特点,部分患者在后期可出现胃黏膜固有腺体萎缩和化生,继而出现上皮内瘤变,与胃癌发生密切相关。
(一)生物因素
幽门螺杆菌(Helicobacter pylori,Hp)感染是慢性胃炎最主要的病因,70%~90%的慢性胃炎有Hp感染。Hp为革兰氏阴性微需氧菌,长2.5~4.0μm,宽 0.5~1.0μm,呈弯曲螺旋状,一端带有2~6根鞭毛,寄居于胃上皮细胞表面,在胃小凹上部的上皮表面和黏液层中最易找到,亦可侵入细胞间隙中。Hp胃炎是一种感染性疾病,其致病机制与以下因素有关:①Hp产生多种酶如尿素酶及其代谢产物氨、过氧化氢酶、蛋白溶解酶、磷脂酶A等,对黏膜有破坏作用;②Hp分泌的细胞毒素(cytotoxin)如含有细胞毒素相关基因(cagA)和空泡毒素基因(vagA)的菌株,可导致胃黏膜细胞的空泡样变性及坏死;③Hp抗体可造成自身免疫损伤。
(二)免疫因素
胃体萎缩为主的慢性胃炎发生在自身免疫的基础上,又称为自身免疫性胃炎或A型萎缩性胃炎。患者血清中能检测到壁细胞抗体(parietal cell antibody,PCA),伴有恶性贫血者还能检出内因子抗体(intrinsic factor antibody,IFA)。壁细胞抗原和PCA形成的免疫复合体在补体参与下,破坏壁细胞。IFA与内因子结合后阻断维生素B12与内因子结合,导致恶性贫血。
(三)物理因素
长期饮浓茶、烈酒、浓咖啡、过热、过冷或过于粗糙的食物,可导致胃黏膜屏障的反复损伤。
(四)化学因素
长期大量服用非甾体抗炎药如阿司匹林等药物可抑制胃黏膜前列腺素的合成,破坏黏膜屏障;烟草中的尼古丁不仅可影响胃黏膜的血液循环,还可导致幽门括约肌功能紊乱,造成胆汁反流;各种原因的胆汁、胰液和肠液反流均可破坏黏膜屏障,造成胃黏膜慢性炎症改变。
(五)其他
萎缩性胃炎的发生率随年龄而增加,老年人是萎缩性胃炎的高发人群。除Hp感染外,同属螺杆菌的海尔曼螺杆菌也可引起慢性胃炎。其他感染性胃炎(包括其他细菌、病毒、寄生虫、霉菌)更少见。嗜酸性粒细胞性、淋巴细胞性、肉芽肿性胃炎和Ménétrier病相对少见。对于克罗恩病累及胃所导致的胃黏膜肉芽肿改变也需要提高认识。
悉尼胃炎新分类系统根据部位、形态学和病因学三者而定(表1)。结合我国的实际情况将慢性胃炎分成非萎缩性(浅表性)胃炎、萎缩性胃炎和特殊类型胃炎三大类。
表1 悉尼胃炎新分类系统
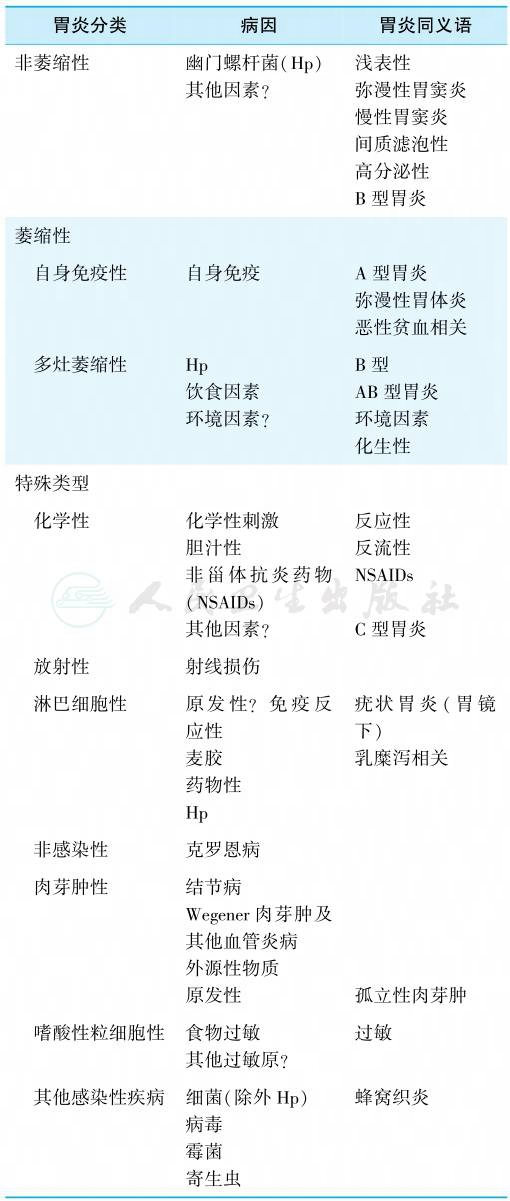
引自:实用内科学.第16版.ISBN:978-7-117-32482-3
(一)黏膜慢性炎症
固有膜内以炎症细胞浸润为特征,炎症细胞以淋巴细胞为主,可见灶性出血。根据慢性炎症细胞密集程度和浸润深度对慢性炎症进行分级(以前者为主)。正常:单个核细胞每高倍视野不超过5个,如数量略超正常而内镜无明显异常时,病理可诊断为无明显异常;轻度:慢性炎症较少并局限于黏膜浅层,不超过黏膜层的1/3;中度:慢性炎症细胞较密集,超过黏膜层1/3,达到2/3;重度:慢性炎症细胞密集,占黏膜全层。活动性炎症表现为在慢性炎症基础上有中性粒细胞浸润。
(二)腺体萎缩
胃黏膜萎缩是指胃固有腺体(幽门腺或泌酸腺)减少,组织学上有两种类型。化生性萎缩:胃固有腺体被肠化或假幽门化生腺体替代;非化生性萎缩:胃黏膜层固有腺体被纤维组织或纤维肌性组织替代,或炎症细胞浸润引起固有腺体数量减少。萎缩程度以固有腺体减少量来计算。
(三)化生
慢性胃炎胃黏膜萎缩性病变中常见有肠化生(intestinal metaplasia)和假幽门腺化生(pesudopyloric metaplasia)。前者指肠腺样腺体替代了胃固有腺体;后者指胃体泌酸腺的颈黏液细胞增生,形成幽门腺样腺体,它与幽门腺在组织学上一般难以区别,病理检查时应注意所取黏膜确实来自胃体部而非幽门部。一般的胃黏膜化生指肠化生,根据细胞形态及分泌的黏液类型,用组织化学和酶学方法将其分小肠型完全肠化生、小肠型不完全肠化生、大肠型完全肠化生、大肠型不完全肠化生。肠化生范围和肠化生亚型对预测胃癌发生危险性有一定的价值,其中不完全型/大肠型肠化生与胃癌关系更密切。
(四)上皮内瘤变(intraepithelial neoplasia)
与异型增生(dysplasia)、不典型增生同义,系指腺管及表面上皮在增生中偏离正常分化所产生的形态和功能异常。细胞核多形性,核染色过深,核质比例增大,胞质嗜碱性,细胞极性消失。黏液细胞、主细胞和壁细胞之间差别消失。胃上皮分泌产物改变或消失,腺管结构不规则。上皮内瘤变可见于炎症、糜烂、溃疡、胃息肉或胃癌边缘黏膜上,本身尚不是癌,但可能恶变,也可能长期保持原状,甚至自然地或在某些药物作用下退变恢复。上皮内瘤变是世界卫生组织(WHO)国际癌症研究协会推荐使用的术语,更强调肿瘤演进的过程,分为低级别(low grade neoplasia)和高级别(high grade neoplasia)。WHO于2002年修订了胃黏膜上皮病变分类及处理原则,即Vienna分类(扩展阅读15-5-1-1)。

扩展阅读15-5-1-1 消化道上皮病变新国际分类(Vienna分类,2002年修订)
(一)血清学检测
包括胃泌素水平、壁细胞抗体、内因子抗体、胃泌素抗体、血清维生素B12浓度等。血清胃蛋白酶原(pepsinogen,PG)Ⅰ、PGⅡ及胃泌素-17的检测可能有助于判断有无胃黏膜萎缩及程度。
(二)胃镜和活体组织检查
是诊断慢性胃炎的主要方法。内镜表现为黏膜充血水肿,或伴有糜烂、隆起、出血、粗大皱襞、胆汁反流等征象。必须进行多部位活检诊断黏膜萎缩和化生,并依据悉尼系统分类标准对胃黏膜行组织形态学评估。疑为上皮内瘤变者应取多块活检。疑为自身免疫性胃炎者,应在胃体、胃底或内镜发现病变处做多部位活检。新型内镜诊断技术对慢性胃炎的诊断和鉴别诊断有一定的价值。电子染色放大内镜对慢性胃炎和胃癌前病变具有较高的敏感度和特异度,但其具体表现特征和分型尚无完全统一的标准。共聚焦激光显微内镜光学活检技术对胃黏膜的观察可达到细胞水平,能实时辨别胃小凹、上皮细胞、杯状细胞等细微结构变化,对慢性胃炎的诊断和组织学变化分级(慢性炎症反应、活动性、萎缩和肠化生)具有一定的参考价值。同时,光学活检可选择性对可疑部位进行靶向活检,有助于提高活检取材的准确性。慢性胃炎有五种组织学变化分级,即Hp感染、活动性、炎症反应、萎缩和肠化生,分成无、轻度、中度和重度四级(0、+、++、+++)。 研究显示:萎缩、肠化生、鸡皮样胃炎、皱襞肿大增加胃癌风险。
(三)Hp检查
包括有创检查和无创检查。有创检查主要指通过胃镜检查获得胃黏膜标本的相关检查,包括快速尿素酶试验、病理Hp检查(HE或Warthin-Starry或Giemsa染色)、组织细菌培养、组织PCR技术。前两种检查常应用于临床,后两种作为科研项目只对特殊患者采用。用于Hp检测的标本应在胃窦小弯侧距幽门5cm(邻近胃角处)或胃窦大弯侧正对胃角处活检取材1~2块。近期接受抗生素或PPI治疗的患者易呈现假阴性结果,取材范围应包括胃体上部。
无创检查指不需要通过胃镜检查获得标本,包括血清抗体检测、13C或14C尿素呼气试验、粪Hp抗原检测(多用于儿童)等方法。前者通常应用于流行病学调查,后两种方法应用于临床,并作为Hp根除治疗后评价疗效的主要方法。需要注意的是,抗生素及抑酸药物影响Hp检查,复查时需要停用抑酸药物2周或者抗生素4周。
慢性胃炎的治疗目的是去除病因、缓解症状、改善胃黏膜组织学,治疗遵循个体化原则。无症状、Hp阴性的慢性非萎缩性胃炎不需特殊治疗。
(一)饮食和生活方式调整
宜进食易消化无刺激性的食物,少吃过酸、过甜的食物及饮用碳酸饮料,避免长期大量吸烟、饮酒,避免过多饮用浓茶、咖啡,进食应细嚼慢咽等。尽量避免长期大量服用损伤胃黏膜的药物。
(二)根除Hp治疗
对慢性胃炎伴萎缩、糜烂或消化不良症状,长期服用PPI,计划长期使用非甾体抗炎药,有胃癌家族史者推荐Hp检测和根除治疗。根除Hp治疗能使部分患者的消化不良症状消失,同时减轻炎症程度、延缓或阻止胃黏膜萎缩和/或肠化生的发生和发展,降低胃癌发生风险。PPI对Hp有较强的抑制作用,提高胃内pH水平,从而抑制Hp尿素酶活性,能明显加强抗菌药物的杀菌活性。
标准三联疗法的根除率已显著下降。2016年《第五次全国幽门螺杆菌感染处理共识报告》推荐PPI+铋剂+两种抗菌药物组成的四联疗法为一线治疗方案,疗程为14天。
1.标准剂量PPI
埃索美拉唑 20mg、雷贝拉唑 10mg(Maastricht共识推荐20mg)、奥美拉唑 20mg、兰索拉唑 30mg、泮托拉唑40mg、艾普拉唑5mg,2次/d。
2.标准剂量铋剂
枸橼酸铋钾220mg,2次/d。
3.有效抗生素
甲硝唑400mg或替硝唑500mg(国内大部分地区耐药),克拉霉素250~500mg,呋喃唑酮100mg;四环素750mg,阿莫西林1 000mg,左氧氟沙星 200mg;2次/d。
抗生素的选择需要考虑耐药率,甲硝唑、克拉霉素、左氧氟沙星的耐药率超过15%,选择时应避免联用。无过敏的情况下优先选择阿莫西林,甲硝唑高耐药地区避免使用,克拉霉素耐药超过20%的地区避免使用,老年患者合并冠心病时应用低剂量克拉霉素。
任何一种方案初次治疗失败后,可通过调整抗生素进行补救治疗。治疗无效的患者可结合抗生素敏感试验选择药物。根除Hp时已有胃黏膜萎缩/肠化生,根除Hp后仍属于胃癌高风险患者,需要定期内镜检查随访。胃癌切除术后,或早期胃癌、胃上皮内瘤变内镜下切除术后,一定要评估并根除Hp,根除后也需要密切随访。
(三)对症治疗
无症状可以随访;反酸、腹痛,内镜可见糜烂灶者可给予抑酸治疗。上腹饱胀、恶心或呕吐可选用促动力药物;与进食相关的腹胀、胃纳减退可应用消化酶。存在胆汁反流可给予结合胆酸作用的胃黏膜保护剂如吉法酯、替普瑞酮、铝碳酸镁、瑞巴派特等。萎缩性胃炎伴恶性贫血者可给予维生素B12和叶酸;存在明显精神心理因素者可以考虑采取心理干预、抗抑郁药物或抗焦虑药物治疗。
(四)癌前病变的干预
内镜下治疗是胃癌前病变治疗的重要手段之一,其中包括黏膜切除术、黏膜下剥离术,高频电切、氩气刀、激光、微波等治疗。中药及维生素类药物对癌前病变可能有益,中药如胃复春可作为上皮内瘤变的辅助用药,长期口服叶酸(5mg/次,3次/d)可能对预防癌前病变的进展有一定控制作用。













