英文名称 :gastroesophageal reflux disease
胃食管反流病(gastroesophageal reflux disease,GERD)是指胃内容物反流入食管所致的症状和/或并发症。GERD可分为非糜烂性反流病[(non-erosive reflux disease,NERD),亦称内镜阴性反流病(endoscopy-negative reflux disease,ENRD)]、糜烂性食管炎(erosive esophagitis,EE)和巴雷特食管(Barrett’s esophagus,BE)三种类型。其中以 NERD最为常见,约占 GERD的70%;EE可合并食管狭窄、溃疡和消化道出血;BE有可能发展为食管腺癌。
(一)食管下括约肌的抗反流屏障功能减弱
食管下括约肌(lower esophageal sphincter,LES)是食管胃连接处抗反流的第一道屏障,起着防止胃内容物反流入食管的作用。GERD患者的LES静息压明显低于正常,一般在10mmHg以下。LES的舒缩受神经、体液控制,也受胃肠激素的影响。胆碱能和β肾上腺素能拟似物、α肾上腺素能拮抗剂、多巴胺、地西泮、钙离子拮抗剂、吗啡等药物,脂肪、咖啡等食物,抽烟、酗酒等不良嗜好,应激等精神刺激均可引起LES的压力异常。当举重、弯腰或做Valsava动作致腹压明显升高时,亦可引起胃食管反流。
(二)食管对胃反流物的廓清能力障碍
胃反流物中的胃酸和胃蛋白酶是食管黏膜的主要损害因子,尤以胃酸更为重要。当胃内pH<4.0时,胃蛋白酶原被激活,引起黏膜上皮的损害。此外,反流液中还常有含胆汁、胰酶及溶血卵磷脂的十二指肠液,由此类物质引起的食管黏膜损害又称为碱反流性食管炎。胃酸和胆酸在食管黏膜的损害中具有协同作用:胆酸通过其亲脂性溶解食管黏膜的紧密连接,胃酸和胃蛋白酶可反渗至食管黏膜下造成深部的严重损伤;胆汁也可单独引起食管炎症。正常食管对反流物的廓清能力包括食管排空和唾液中和两部分。进入食管下段的反流物可刺激食管继发性蠕动,从而排空反流物。此外,唾液对食管的冲刷作用、唾液内的碳酸氢盐(pH=6~7)对反流物中酸的中和作用、坐立位时的重力影响,都参与胃食管反流物的清除。当某些疾病(如硬皮病等)导致食管肌肉、神经受损时,则可因蠕动障碍而导致食管廓清能力下降。
(三)食管黏膜屏障功能的损害
食管黏膜屏障由前上皮屏障、上皮屏障和后上皮屏障三部分组成。前上皮屏障主要包括食管黏膜表面的黏液层及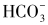 复合物和黏膜表面活性物质。上皮屏障由上皮细胞间的紧密连接、细胞内和细胞间的缓冲系统组成。后上皮屏障主要包括食管黏膜下血流及食管上皮损伤后的修复机制。当上述屏障功能受损时,即使在生理反流情况下也可引起食管炎症。
复合物和黏膜表面活性物质。上皮屏障由上皮细胞间的紧密连接、细胞内和细胞间的缓冲系统组成。后上皮屏障主要包括食管黏膜下血流及食管上皮损伤后的修复机制。当上述屏障功能受损时,即使在生理反流情况下也可引起食管炎症。
(四)GERD的其他发病因素
1.食管裂孔疝
食管裂孔疝合并GERD的机制可能是LES张力低下和/或出现频繁的LES瞬时松弛(transient lower esophageal sphincter relaxation,TLESR)有关。食管裂孔疝可能影响LES关闭或增强感觉刺激以致发生LES松弛。此外,卧位时疝囊的存液作用也易促使反流发生。
2.食管胃角
也称His角,是指食管腹内段与胃底所形成的夹角,正常情况下应为一锐角。如果His角变钝或胃底容受性舒张障碍会容易发生反流。
3.心理社会因素
心理社会因素可以通过神经-内分泌途径影响食管和胃的动力。有资料提示:催眠疗法、行为认知疗法、抗抑郁或抗焦虑治疗可能对反流性食管炎的治疗有益。
GERD的流行率有明显的地理差异。西方国家较为常见,但亚洲的发病率正在逐年上升。美国约有45%的成人有胃灼热症状。男性的发病率约为女性的2~3倍,白人多于黑人。
GERD涉及的病理生理因素包括滑动型食管裂孔疝、LES压力下降、TLESR、酸袋、肥胖、食管胃连接处扩张性增高、食管酸廓清时间延长、胃排空延迟等。影响GERD症状的因素包括反流液的酸度、反流位置、反流物中存在气体、胃十二指肠反流、纵行肌收缩、黏膜完整性、外周及中枢的致敏机制等。
EE可分为早期、中期和晚期,其中早期病变最具有特异性,而中、晚期则与其他类型的食管炎难以鉴别。目前很多学者以Ismail-Beigi的早期反流性食管炎病理诊断标准来确定EE的诊断。
BE是指食管远段的复层鳞状上皮被单层柱状上皮所取代,并伴有肠上皮化生。内镜下可见灰白的食管黏膜中出现橘红色的异位胃黏膜,呈环形、舌形或岛状分布(数字资源15-4-1-1)。BE见于10%~15%的GERD患者。当长度≥3cm时为长段BE,当长度<3cm时为短段BE。内镜与病理诊断相结合有助于对BE进行精确诊断。

数字资源15-4-1-1 巴雷特食管的内镜表现
目前尚无统一的NERD病理学诊断标准,但光镜下仍可有一定的病理改变,如表层细胞肿胀,灶状基底细胞增生,炎症细胞浸润,上皮乳头内血管扩张、充血等表现。NERD的诊断有赖于典型的症状及食管测压和24小时食管pH监测。
(一)X线检查
食管钡餐对GERD无诊断作用,但可显示有无黏膜病变、狭窄、食管裂孔疝及排除贲门失弛缓症等。
(二)内镜检查
对症状发生频繁、程度严重、伴有报警征象或有肿瘤家族史的患者应先行内镜检查。内镜检查有助于确定有无反流性食管炎及有无合并症和并发症,如食管裂孔疝、食管炎性狭窄、食管癌等,同时有助于诊断及评估本病的严重度。目前,GERD的内镜下分级标准多用1994年制定的洛杉矶(Los Angeles)分级标准,即LA分级标准。①A级:1个或1个以上食管黏膜破损,长径<5mm;②B级:1个或1个以上黏膜破损,长径≥5mm,但没有融合性病变;③C级:黏膜破损有融合,但小于75%的食管周径;④D级:黏膜破损有融合,至少达到75%的食管周径。
(三)高分辨率食管测压(high resolution manometry,HRM)
在GERD的诊断中,HRM除帮助食管pH电极定位、术前评估食管功能和指导手术术式外,还能预测抗反流治疗的疗效和是否需要行长期维持治疗。因此,食管测压能帮助评估食管功能,尤其是对治疗困难者。GERD患者HRM的主要异常包括:①LES压力下降、TLESR发生频繁、合并食管裂孔疝;②食管体部动力障碍等。
(四)食管多导腔内电阻抗(multichannel intraluminal impedance,MII)联合pH监测
MII-pH监测的优点主要是能够明确所有反流(液体、气体或混合性反流)、所有酸度(酸、弱酸、非酸)、确定反流方向,以及症状与反流的关系。它是诊断GERD的“金标准”。对于未服用质子泵抑制剂(proton pump inhibitor,PPI)的患者可行单纯24小时食管pH监测,明确有无GERD;对于正在使用PPI的患者需行MII-pH监测,判断酸、弱酸和非酸反流与症状的关系,明确PPI疗效差的原因。MII-pH监测指标见扩展阅读15-4-1-1。

扩展阅读15-4-1-1 MII-pH监测指标
(五)无线pH监测技术
无线pH监测(如Brava胶囊)可以分析48~96小时的食管pH变化,提高患者检测时的舒适度及依从性,尤其适用于无法耐受鼻导管、高度怀疑GERD但导管pH监测阴性的患者。
(六)唾液胃蛋白酶测定
唾液胃蛋白酶测定是一种用于快速诊断的侧向层析检测方法,将胃蛋白酶作为反流在唾液中的标记物,采用两种特定的抗人胃蛋白酶单克隆抗体,定性、定量地检测样本中的胃蛋白酶,可作为GERD新的筛查手段。
治疗目的:①愈合食管炎症,消除症状;②防治并发症;③提高生活质量,预防复发。具体措施包括抑酸以提高胃内pH;增加食管对酸、碱反流物的清除;促进胃排空;增加LES张力。
(一)调整生活方式
体位是减少反流的有效方法,如餐后保持直立,避免过度负重,不穿紧身衣,抬高床头,左侧卧位等。肥胖者应减肥。睡前3小时勿进食以减少食物诱发的胃酸分泌。饮食宜少量、高蛋白、低脂肪、高纤维素。提倡戒烟酒,限制咖啡因、巧克力、酸辣食品。许多药物能降低LES的压力,在应用时应加以注意。
(二)内科药物治疗
目的在于加强抗反流屏障功能,提高食管廓清能力,改善胃排空与幽门括约肌功能,以防止胃、十二指肠内容物反流,保护食管组织。
1.抑酸剂
抑酸剂包括H2受体拮抗剂和PPI。PPI能持久抑制基础与刺激后胃酸分泌,是治疗GERD最有效的药物。有奥美拉唑、兰索拉唑、潘托拉唑、雷贝拉唑、埃索美拉唑等,剂量分别为每次 20mg、30mg、40mg、10mg、20mg,每日 1~2 次口服。PPI常规或双倍剂量治疗8周后,多数患者症状完全缓解,EE得到愈合。停药后约80%的患者在6个月内复发,故在愈合治疗后应继续维持治疗1个月。若停药后仍有复发,建议再次取得缓解后给予按需维持治疗,即在PPI中任选一种,当有症状出现时及时用药以控制症状。为防止夜间酸突破的发生,可以在早晨口服1次PPI的基础上,临睡前加用H2受体拮抗剂(H2RA)1次,二者有协同作用。此外,有研究结果显示,合并食管裂孔疝的GERD治疗需要更高剂量的PPI;EE洛杉矶分级为C级或D级的患者经PPI治疗8周后,其愈合率显著低于洛杉矶分级A级或B级的患者,故推荐对洛杉矶分级为C级或D级患者PPI剂量应加倍。
2.制酸剂和黏膜保护剂
制酸剂常用的有铝碳酸镁,常用方法为1g/次,每日3次,饭后1~2小时嚼碎服下。铝碳酸镁对黏膜也有保护作用,同时可逆性吸附胆酸等碱性物质,使黏膜免受损伤,尤其适用于非酸反流相关的GERD患者。黏膜保护剂种类繁多,包括硫糖铝、铋剂、替普瑞酮、瑞巴派特等。此类药能在受损黏膜表面形成保护膜以隔绝有害物质的侵蚀,从而有利于受损黏膜的愈合。硫糖铝的常用剂量为每次1g,每日4次,饭前1小时和睡前服用。
3.促动力药
①多潘立酮为选择性多巴胺受体拮抗剂,对食管和胃平滑肌有显著促动力作用;②莫沙必利是5-羟色胺受体4激动剂,对全胃肠平滑肌均有促动力作用;③伊托必利具有独特的双重作用机制,既可阻断多巴胺D2受体,也可抑制乙酰胆碱酯酶活性,同时还能提高LES的张力,对心脏几乎无不良影响。治疗用量为每次50mg,每日3次,饭前30分钟服用。
4.联合用药
抑酸剂与促动力药物的联合应用是目前治疗反流性食管炎最常用的方法。PPI与促动力药物联用通过抑制反流和改善食管廓清及胃排空能力起到协同作用。巴氯芬是一种γ-氨基丁酸B型受体激动剂,每次20mg,每日3次,可以明显抑制TLESR的发生;MII-pH监测显示巴氯芬可以明显减少非酸反流,但嗜睡、头晕、肢体颤动等中枢副作用限制了其临床应用。巴氯芬停药前要逐渐减量,以防症状反跳。对于非酸反流(胆汁)引起相关症状的患者,可以联用铝碳酸镁。海藻酸盐可在食管胃连接处形成中性pH缓冲区,防止餐后酸袋形成,从而减少胃食管反流,但对非酸反流影响不大。
5.GERD的维持治疗
①按需治疗:指治疗成功后停药观察,一旦出现烧心、反流症状,随即再用药;②间歇治疗:指PPI剂量不变,延长用药间期,最常应用的是隔日疗法;③长期治疗:指症状缓解后维持原剂量或半量PPI,每日1次,长期使用。
6.用药个体化
可根据临床分级个体化用药。轻度GERD及EE可单独选用PPI、促动力药或 H2RA;中度 GERD及EE宜采用PPI或H2RA和促动力药联用;重度GERD宜加大PPI口服剂量或PPI与促动力药、制酸剂联用。对久治不愈或反复发作伴有明显焦虑或抑郁的患者,可加用抗抑郁或抗焦虑治疗。
(三)GERD的内镜下治疗
1.抗反流治疗
①Stretta射频法:射频消融是将Stretta射频治疗针经活检孔道送达齿状线附近,刺入食管下端的肌层,利用射频电流造成食管胃连接处及贲门肌层局部的热损伤,达到肌层纤维化的目的,从而增加食管下端张力,起到抗反流作用。②经口不切开胃底折叠术(transoral incissionless fundoplication,TIF):应用特殊的腔内装置进行治疗,不经外科切口,模仿抗反流的外科手术进行胃食管折叠,重建食管胃角,形成单向食管胃连接处屏障,可减少TLESR的发生率、降低食管胃连接处的扩张程度,有效控制反流症状。手术指征同外科,但其有效性及持久性尚待进一步研究证实。
2.BE的内镜下治疗
包括氩等离子体凝固术(APC)、消融术、内镜黏膜下剥离术等。内镜定期随访及治疗的目的是尽量减少BE患者罹患食管癌的风险。
(四)GERD的外科治疗
GERD抗反流手术的主要适应证是:①年龄较轻,手术条件好,可作为药物维持疗法的替代选项;②控制反流及其伴随的哮喘、吸入性肺炎。药物治疗失败不是手术治疗的指征,因为这表明症状未必是反流引起的,往往与内脏高敏感或焦虑、抑郁有关。手术治疗的方法见扩展阅读15-4-1-3。自2018年起国内已开展磁珠疗法(Linx环)治疗GERD的临床研究,即通过腹腔镜将磁力环置入患者食管胃连接处,增强LES压力来提高食管胃连接处反流的能力。

扩展阅读15-4-1-3 GERD的手术治疗
(五)难治性GERD的诊疗
双倍剂量的PPI治疗8~12周后烧心、反流症状无明显改善的GERD患者称为难治性GERD。PPI治疗无效的原因很多,首先需检查患者的依从性,并优化PPI使用。在药物的选择方面,抑酸强度高、代谢速率个体差异小的PPI(如埃索美拉唑、雷贝拉唑)是优选。难治性GERD患者需进行MII-pH监测及内镜检查等评估。有报道服用PPI同时行MII-pH监测的患者,弱酸(pH=4~7)反流是最常见的反流形式,这是PPI疗效差的重要原因;临睡前加用H2RA是针对GERD患者夜间酸突破的主要对策。若反流监测提示存在症状相关酸反流,可增加PPI剂量或换一种PPI,或在权衡利弊后行抗反流手术治疗。GERD伴食管外症状的患者若PPI治疗无效,需进一步评估以寻找相关原因。PPI治疗无效的食管外症状患者不建议行外科手术治疗。













