英文名称 :aortic dissection
急性主动脉综合征(AAS)包括主动脉夹层(aortic dissection,AD),主动脉壁内血肿(intramural aortic hematoma,IMH)和穿透性主动脉溃疡(penetrating ulcer,PAU)三种威胁生命的主动脉疾病。当主动脉内膜撕裂或者自身滋养血管(vasa vasorum)出血,血液聚集在中膜层时,形成IMH。而AD是指主动脉中膜纵向破裂,主动脉壁层分离形成假腔并连通真腔。大多数始于内膜破裂,血流在中膜形成夹层。这一过程中可伴随主动脉破裂。夹层可以顺行或者逆行。夹层也可累及侧支,其他并发症包括心脏压塞、主动脉瓣反流及近端或远端的缺血综合征。中膜血栓导致的炎症反应可能引起血管平滑肌的坏死或凋亡及弹力纤维的变性,这可能是中膜破裂的潜在因素。
基于人口学的流行病学资料较少,而且就诊前部分患者即死亡或因误诊,本病真实发病率不详。据估计,欧美国家AD的年发病率在2.6~6.0人次/10万人,春冬季较高,夏季最低。我国AD的发病率近年有上升趋势。我国台湾地区报道的年发病率约为4.3人次/10万人,与欧美国家相近。我国大陆尚无相关流行病学调查结果。急性主动脉夹层国际注册研究(IRAD)显示,AD患者的平均年龄为 63岁,Stanford A型占60%~70%,男性约占65%。中国主动脉夹层注册研究(Sino-RAD)中,AD患者平均年龄为51岁,Stanford A型约占40%,男性占76%。我国AD患者年龄较欧美国家年轻10岁以上。
病因未明。最常见的危险因素是高血压,尤其是血压未能控制的患者。临床与动物实验发现血压波动的幅度与AD相关。正常成年人主动脉壁耐受压力的能力较强,内壁裂开需500mmHg以上。因此,造成夹层分离的先决条件是动脉壁有缺陷,尤其是中膜层。AD的高血压患者不少伴有囊性中层坏死。高血压并非引起囊性中层坏死的原因,但可促进其发展。一般而言,在年长者以中膜肌层退行性变为主,年轻者则以弹性纤维缺少为主。Marfan综合征患者中主动脉囊性中膜变性坏死很常见,年轻时期即可发生AD。转录因子FOXE3的突变也易于发生胸主动脉瘤和急性AD,这显然与主动脉承受血液生物力学脉压的能力降低有关。妊娠期发生夹层的原因不明,推测可能内分泌变化使主动脉结构发生了改变。
AD的主要易患因素包括:①主动脉壁张力的增加,如高血压、主动脉缩窄、胸部钝挫伤等;②主动脉壁结构异常,如动脉粥样硬化、遗传性结缔组织疾病(如Marfan综合征、Loeys-Dietz综合征、Ehlers-Danlos综合征等)、家族性遗传性AD或主动脉瘤、大动脉炎等;③其他因素如妊娠、烟酒、冠脉介入操作中医源性夹层等。我国多中心研究表明,高血压、Marfan综合征、烟酒、先天性二叶式主动脉瓣、动脉粥样硬化等是国人发生夹层的主要独立危险因素。
少数AD无动脉内膜裂口者,则可能由于中层退行性变,病灶内滋养血管破裂出血所致主动脉壁内血肿。
(一)病理特点
基本病变为囊性中层坏死。动脉中层弹性纤维有局部断裂或坏死,基质有黏液样变和囊肿形成。夹层常发生于升主动脉,此处经受血流冲击力最大,而主动脉弓的远端则病变少而渐轻。主动脉壁分离为两层,其间积血,该处主动脉明显扩大呈梭形或囊状。病变如涉及主动脉瓣环,则环扩大而引起关闭不全。病变可从主动脉根部向远处扩延,可达髂动脉及股动脉,亦可累及主动脉各分支,如无名动脉、颈总动脉、锁骨下动脉、肾动脉等。冠状动脉一般不受影响,但主动脉根部夹层血肿对冠脉口可有压迫作用。多数夹层有内膜横行裂口。常位于主动脉瓣上方,裂口也可有两处,夹层与主动脉腔相通。少数夹层内膜完整无裂口。部分病例外膜破裂而引起大出血,破裂处在升主动脉,出血易进入心包腔内,破裂部位较低者亦可进入纵隔、胸腔或腹膜后间隙。慢性夹层可形成一双腔主动脉。一个管道套于另一个管道之中,此种情况见于胸主动脉或主动脉弓的降支。
(二)病理分型
可以指导临床治疗方案制定和预后的评估。根据内膜撕裂部位和AD动脉瘤扩展范围(图1),国际上最常应用DeBakey分型(DeBakey,1965)和Stanford分型(Daily,1970)。
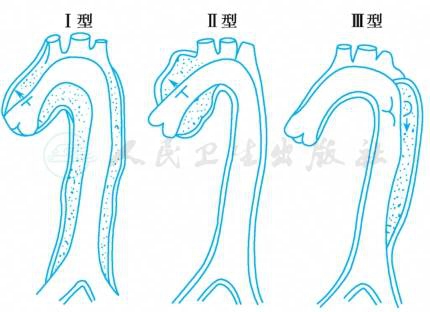
图1 主动脉夹层的分型
1.DeBakey分型
根据原发夹层破口的位置和累及范围分为Ⅰ型、Ⅱ型、Ⅲ型。Ⅰ型:原发破口位于升主动脉或主动脉弓,夹层累及大部或全部胸升主动脉、主动脉弓、胸降主动脉、腹主动脉;Ⅱ型:原发破口位于升主动脉,夹层累及升主动脉,少数可累及主动脉弓;Ⅲ型:原发破口位于左锁骨下动脉以远,夹层范围局限于胸降主动脉为Ⅲa型,向下同时累及腹主动脉为Ⅲb型。
2.Stanford分型
根据夹层的累及范围分为A、B两型。凡是夹层累及升主动脉者为Stanford A型,相当于DeBakeyⅠ型和Ⅱ型。内膜撕裂可位于升主动脉、主动脉弓或近段降主动脉,扩展可累及升主动脉、弓部,也可延及降主动脉、腹主动脉。约占AD的2/3;另外1/3夹层仅累及胸降主动脉及其远端,为Stanford B型,相当于DeBakeyⅢ型。内膜撕裂口常位于主动脉峡部,扩展仅累及降主动脉或延伸至腹主动脉,不累及升主动脉。
(三)分期
根据发病时间将AD进行分期。传统分期为急性期和慢性期。两周以内为急性期,超过两周为慢性期。虽然在进入慢性期后病情趋于稳定,其并发症发生率特别是主动脉破裂概率远低于急性期,但发病两周以上的并发症仍较高,使得传统分期对病情评估不足。因此,近年提出了诸多新的分期方法。2010 AHA指南推荐:发病时间≤2周为急性期,发病时间2~6周为亚急性期,发病时间>6周为慢性期;2014 ESC指南推荐:发病时间≤14天为急性期,发病时间15~90天为亚急性期,发病时间>90天为慢性期。目前,公认的急性期AD为发病时间在2周以内者。
(一)实验室检查
血常规及血型、尿常规、肝肾功能、血气分析、血脂血糖、心肌标志物、凝血指标(包括D-二聚体)、传染病筛查等,有助于鉴别诊断及评估脏器功能及手术风险,减少术前准备的时间。其中血浆D-二聚体水平对夹层的诊断和鉴别诊断至关重要。快速升高且达峰值时,拟患AD的可能性增大,其他疾病则是逐渐增加。在发病第一小时诊断价值最高,24小时内,当D-二聚体达到临界值500ng/ml时,其诊断急性AD的敏感性为100%,特异性为67%。该检查的重要意义在于鉴别诊断,如果D-二聚体水平低于500ng/ml,则不太可能是急性,故可作为诊断的排除指标。D-二聚体阴性不能排除主动脉壁内血肿和穿透性溃疡。其他生物标志物有:反映内皮或平滑肌细胞受损的特异性标记蛋白,如平滑肌肌球蛋白重链和弹性蛋白降解产物;反映血管间质受损的钙调蛋白和基质金属蛋白酶-9;反映炎症活动的C反应蛋白等。血浆C反应蛋白>15mg/dl是AD患者低氧及预后不良的指标。心电图检查无特殊发现。如果病变累及冠状动脉时,可出现急性心肌缺血甚至急性心肌梗死改变。1/3冠脉受累患者的心电图可正常。心包积血时可出现急性心包炎的心电图改变。
(二)影像学检查
其目的是要对主动脉进行整体综合评价,包括夹层受累的范围、形态、不同部位主动脉的直径、主动脉瓣及主动脉各分支受累情况、与周围组织的关系,以及夹层的其他相关表现如心包积液、胸腔积液及脏器缺血情况等。特别需要关注:①明确内膜片;②明确内膜破口的位置;③识别真腔与假腔;④明确夹层的累及范围;⑤明确主动脉窦、主动脉瓣累及情况;⑥主动脉一级分支受累情况及血流状态;⑦识别主要脏器的缺血情况;⑧识别心包积液、胸腔积液及程度;⑨识别主动脉周围出血与否;⑩识别扫描野内其他脏器的病变及性质。
1.计算机断层扫描(CT)
是目前最常用于诊断AD的影像工具之一。由于其快速性及极高的敏感性和特异性而广泛应用于临床,已作为可疑AD患者的首选术前检查手段。我国专家共识推荐使用多排螺旋CT进行全主动脉及其一级分支血管的CTA检查(从胸廓入口上方至耻骨联合水平),既可评价头臂血管走行及受累情况,又可对某些需要介入治疗患者选择股动脉穿刺或切开入路提供详细信息。应采用心电门控CTA扫描以减少心脏及主动脉根部搏动所产生的伪影对主动脉根部及升主动脉的影响;同时对冠状动脉近段、主动脉窦及主动脉瓣进行评价,为Stanford A型夹层术前细化分型提供支持。对于AD术后存在可疑内漏的患者可进行延迟扫描,明确内漏的位置及程度。另外,多角度多平面三维重建可明确夹层各部位形态学改变。
2.超声心动图
对AD的诊断准确性较CT、MRI略低,但便携性强,可用于各种状态围手术期患者的评价。经胸超声心动图(TTE)诊断Stanford A型夹层的敏感性88%~98%,特异度90%~95%,且可快捷识别并发症,评价主动脉瓣膜功能及主动脉窦受累情况,为制订手术方案提供帮助;Stanford B型夹层的诊断灵敏度较低。但经食管超声心动图(TEE)结合实时彩色血流显像技术观察升主动脉夹层分离较可靠,对降主动脉夹层也有较高的特异性及敏感性。其检测AD的敏感性97%~100%,内膜撕裂的敏感性61%~73%,假腔内血栓68%,主动脉瓣关闭不全和心包积液为100%。当受患者体型、胸壁、肺部疾病等因素影响时,TEE可提高诊断的准确性,由于是一种侵入性操作,对急性AD患者具有一定的风险,非全麻状态下不建议常规实施。有食管静脉曲张,肿瘤和食管狭窄为禁忌证,并发症有心动过缓,低血压,支气管痉挛等。
3.磁共振成像(MRI)
对AD的诊断效率与CTA相似,敏感性,特异性均近乎100%。除了形态学,还能对瓣膜功能、内膜片的摆动及通过破口的血流、真假腔内血流进行全面评价。目前被认为是诊断AD存在与否的“金标准”。但MRI扫描耗时较长,对于循环不稳定的患者难以耐受、配合。对于体内安装起搏器和植入人工关节、钢针等金属物属禁忌证。对于碘过敏、肾功能损害、妊娠及甲状腺功能亢进或其他CTA检查相对或绝对禁忌的患者,MRI可作为首选的替代检查手段。
4.主动脉造影术(aortography)
曾是诊断AD的“金标准”,但对于内膜片、内膜破口及主动脉双腔的显示并不优于CTA,而且作为一种有创性操作,对Stanford A型夹层的诊断存在巨大潜在风险。因此,目前血管造影不作为AD的常规检查手段,仅作为Stanford B型夹层行覆膜支架植入手术中的辅助检查。血管内超声可用来补充血管造影的不足。
对于任何可疑或确诊主动脉壁内血肿或AD患者,应立即入住ICU进行监护治疗,而不是等待影像学检查确诊。治疗目的是减弱心肌收缩力、减慢左心室收缩速度(dV/dt)和减低外周动脉压。治疗目标是阻止其进一步进展,降低破裂的风险。尽管缺乏随机试验的结果,目前指南建议紧急药物治疗直接降低血压,通常使收缩压控制在100~120mmHg,心率低于60次/min,同时保持大脑,心肾和其他器官的灌注。这样能有效地稳定或终止AD的继续分离,使症状缓解,疼痛消失。治疗分为紧急治疗与巩固治疗两个阶段。
(一)内科治疗
1.紧急治疗
(1)缓解疼痛:剧烈疼痛可给予吗啡类药物止痛,并镇静、制动,患者应ICU内密切监护,注意神经系统、肢体脉搏、心音等变化,监测生命体征、心电图、尿量等,采用鼻导管吸氧,避免输入过多液体以免升高血压及引起肺水肿等。
(2)降压治疗:治疗的关键是控制血压和降低心率,对急性Stanford A型夹层患者,在发病24小时的超急性期积极降压治疗,可提高生存率。联合应用血管扩张剂和β受体阻滞剂,以降低血管阻力、血管壁张力和心室收缩力,控制收缩压于100~120mmHg之间以防扩展。可静脉给予β受体阻滞剂艾司洛尔先在2~5分钟内给负荷剂量0.5mg/kg,然后以0.10~0.20mg/(kg•min)静脉滴注。艾司洛尔的最大浓度为10mg/ml,输注最大剂量为0.3mg/(kg•min)。也可静脉应用美托洛尔及阻滞α和β受体的拉贝洛尔。维拉帕米、地尔硫䓬、硝苯地平等钙通道阻断剂尤其在支气管哮喘患者更为有利。如果β受体阻滞剂单独不能控制,可联合应用血管扩张剂。通常联合硝普钠,初始剂量为25~50μg/min,调节滴速,使收缩压降低至100~120mmHg或足以维持尿量25~30ml/h的最低血压水平。正常血压或血压偏低患者,还应注意排除血液进入胸腔、心包腔或假腔中的可能。血压下降后疼痛明显减轻或消失是夹层分离停止扩展的临床指征。需要注意合并有主动脉大分支阻塞的高血压患者,因降压能使缺血加重,不可采用降压治疗。
(3)严重血流动力学不稳定患者应马上插管通气,补充血容量。破入心包、胸腔或主动脉破裂者输血。右桡动脉进行有创血压监测。如累及头臂干(极少见),则改为左侧。排除由于主动脉弓分支阻塞导致的假性低血压非常重要,应监测双侧血压。TEE可在ICU或手术间内进行。超声心动图一旦发现心脏压塞时,不需再进一步影像检查而施行胸骨切开外科探查术。在手术前行心包穿刺放液术可能有害(除非患者发生急性心脏压塞),因为降低了心包内压力而引起再出血,甚至导致血流动力学崩溃和死亡。
2.巩固治疗
病情稳定后可改用口服降压药控制血压,及时检查评估,决定下一步治疗方案。若内科治疗不能控制高血压和疼痛,或出现病变扩展、破裂、脏器缺血征象时应积极手术治疗。对近端,已破裂或濒临破裂夹层,伴主动脉瓣关闭不全者应手术治疗。对缓慢发展的及远端AD,可继续内科治疗。为了达到收缩压低于120mmHg,强调β受体阻滞剂作为首选药物,如疗效不满意,通常需要加用二种或三种降压药物。冠脉介入操作时发生的医源性AD,开口支架植入保守治疗的短期和长期预后均良好。
(二)手术治疗
是AD最为有效并具有一定远期疗效的补救治疗,是彻底去除病灶,防止病变发展,抢救破裂、脏器缺血等并发症的根本方法。
对于急性Stanford A型夹层,虽经有效抗高血压治疗,其发生主动脉破裂或心脏压塞等致命并发症的危险性仍然很高(约90%)。故目前一经确诊,建议紧急外科手术修复。
降主动脉手术的死亡率很高,主动脉钳夹所致的急性缺血可造成截瘫、急性肾衰竭等严重并发症。近年微创血管腔内介入技术日趋优于外科手术,已广泛应用于AD的治疗。1994年Dake实施了世界上首例胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)。 由于其创伤小、恢复快、死亡率低等优点,TEVAR已逐渐取代传统开胸手术,成为胸主动脉瘤和胸主动脉夹层的首选治疗方案。由于急性B型夹层发生危及生命的并发症的风险较低,通常药物治疗为主,因为在B型夹层的小型随机试验中,药物治疗加常规血管内修复术并未提高存活率。但如果B型夹层伴有主动脉破裂、远端器官灌注不良缺血等严重并发症,经药物治疗后夹层仍扩展蔓延、无法控制的高血压及疼痛剧烈者,则具有介入指证。
对孤立性壁内血肿,尤其是血肿很小和主动脉内径正常,进展为夹层或其他并发症的可能性低于初始夹层的患者。在一组东亚患者中,大多数壁内血肿可以消退,一般不必手术。在西方系列研究中,估计10%的血肿可自发消退,25%至50%在后期随访中有进展。升主动脉的壁内血肿风险最高,通常建议手术。对于远端的壁内血肿,与远端夹层的处理相同,进展患者手术治疗。













