英文名称 :dilated cardiomyopathy
扩张型心肌病(dilated cardiomyopathy,DCM)是一类以左心室或双心室扩大伴收缩功能障碍为特征的心肌病。该病较为常见,我国发病率为(13~84)/10万。病因多样,约半数病因不详。临床表现为心脏扩大、心力衰竭、心律失常、血栓栓塞及猝死。本病预后差,确诊后5年生存率约50%,10年生存率约25%。
多数DCM病例的原因不清,部分病人有家族遗传性。可能的病因包括感染、非感染的炎症、中毒(包括酒精等)、内分泌和代谢紊乱、遗传、精神创伤。
1.感染
病原体直接侵袭和由此引发的慢性炎症和免疫反应是造成心肌损害的机制。以病毒最常见,通过心内膜活检技术,在心内膜探及的常见病毒基因,包括柯萨奇病毒B、ECHO病毒、细小病毒B-19,人疱疹病毒6型,脊髓灰质炎病毒、流感病毒、腺病毒等,其他较为少见的病毒还包括巨细胞病毒、单纯疱疹病毒、EB病毒、人类免疫缺陷病毒等。
部分细菌、真菌、立克次体和寄生虫等也可引起心肌炎并发展为DCM,如Chagas病(南美锥虫病),病原为克氏锥虫,通常经猎蝽虫叮咬传播。
2.炎症
肉芽肿性心肌炎(granulomatous myocarditis):见于结节病和巨细胞性心肌炎,也可见于过敏性心肌炎。心肌活检有淋巴细胞、单核细胞和大量嗜酸性粒细胞浸润。此外,多发性肌炎和皮肌炎亦可以伴发心肌炎;其他多种结缔组织病如系统性血管炎、系统性红斑狼疮等均可直接或间接地累及心肌,引起获得性扩张型心肌病。
3.中毒、内分泌和代谢异常
嗜酒是我国DCM的常见病因。化疗药物和某些心肌毒性药物和化学品,如多柔比星等蒽环类抗癌药物、锂制剂、依米丁。某些维生素和微量元素如硒的缺乏(克山病,为我国特有的地方性疾病)也能导致DCM。嗜铬细胞瘤、甲状腺疾病等内分泌疾病也是DCM的常见病因。
4.遗传
25%~50%的DCM病例有基因突变或家族遗传背景,遗传方式主要为常染色体显性遗传,X染色体连锁隐性遗传及线粒体遗传较为少见。目前已发现超过60个基因的相关突变与家族遗传性或散发的DCM有关。有的为常染色体显性遗传,有的为X连锁遗传,这些致病基因编码多种蛋白,包括心肌细胞肌节蛋白、肌纤维膜蛋白、细胞骨架蛋白,闰盘蛋白、核蛋白、线粒体蛋白及多种离子通道。
5.其他
围生期心肌病是较常见的临床心肌病。神经肌肉疾病如Duchenne型肌营养不良、Backer型肌营养不良等也可以伴发DCM。有些DCM和限制型心肌病存在重叠,如轻微扩张型心肌病、血色病、心肌淀粉样变、肥厚型心肌病(终末期)。
2002年中国分层整群抽样调查19个地区8 080例正常人群DCM患病率约为19/10万;1990年欧洲报道DCM的5年病死率为15%~50%;2014年中国一项报道显示767例DCM随访52个月病死率为42.24%。
以心腔扩大为主,肉眼可见心室扩张,室壁多变薄,纤维瘢痕形成,且常伴有附壁血栓。瓣膜、冠状动脉多无改变。组织学为非特异性心肌细胞肥大、变性,特别是程度不同的纤维化等病变混合存在,如有炎症过程参与可见多种炎症细胞浸润。
病变的心肌收缩力减弱将触发神经-体液机制,产生水钠潴留、加快心率、收缩血管以维持有效循环。但是这一代偿机制将使病变的心肌雪上加霜,造成更多心肌损害,最终进入失代偿阶段。
1.胸部X线检查
心影通常增大,心胸比>50%。可出现肺淤血、肺水肿及肺动脉压力增高的X线表现。有时可见胸腔积液。
2.心电图
缺乏诊断特异性。可为R波递增不良、室内传导阻滞及左束支传导阻滞。QRS波增宽常提示预后不良。严重的左心室纤维化还可出现病理性Q波,需除外心肌梗死。常见ST段压低和T波倒置。可见各类期前收缩、非持续性室速、房颤、传导阻滞等多种心律失常同时存在。
3.超声心动图
超声心动图是诊断及评估DCM最常用的重要检查手段。疾病早期可仅表现为左心室轻度扩大,后期各心腔均扩大,以左心室扩大为著(图1)。室壁运动普遍减弱,心肌收缩功能下降,左心室射血分数显著降低。二尖瓣、三尖瓣本身虽无病变,但由于心腔明显扩大,导致瓣膜在收缩期不能退至瓣环水平而关闭不全。
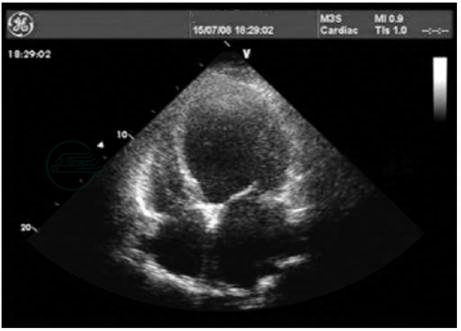
图1 扩张性心肌病超声心动图表现
引自:主编:.内科学.第9版.ISBN:978-7-117-26541-6.图3-6-1
4.心脏磁共振(CMR)
CMR对于心肌病诊断、鉴别诊断及预后评估均有很高价值。有助于鉴别浸润性心肌病、致心律失常型右心室心肌病、心肌致密化不全、心肌炎、结节病等疾病。CMR钆延迟增强显像与DCM的全因死亡率、心衰住院率和心脏性猝死增高相关。
5.心肌核素显像
运动或药物负荷心肌显像可用于除外冠状动脉疾病引起的缺血性心肌病。核素血池扫描可见舒张末期和收缩末期左心室容积增大,左心室射血分数降低,但一般不用于心功能评价。
6.冠状动脉CT检查(CTA)
CTA可以发现明显的冠状动脉狭窄等病变,有助于除外因冠状动脉狭窄造成心肌缺血、坏死的缺血性心肌病。
7.血液和血清学检查
DCM可出现脑钠肽(BNP)或N末端脑钠肽前体(NT-proBNP)升高,此有助于鉴别呼吸困难的原因。部分病人也可出现心肌肌钙蛋白I轻度升高,但缺乏诊断特异性。
血常规、电解质、肝肾功能等常规检查有助于明确有无贫血、电解质失衡、肝硬化及肾功能不全等疾病,这些检查虽然对扩张型心肌病的诊断无特异性,但有助于对病人总体情况的评价和判断预后。临床尚需要根据病人的合并情况,选择性进行如内分泌功能、炎症及免疫指标、病原学等相关检查。
8.冠状动脉造影和心导管检查
冠状动脉造影无明显狭窄有助于除外冠状动脉性心脏病。心导管检查不是DCM诊断的常用和关键检查。在疾病早期大致正常,在出现心力衰竭时可见左、右心室舒张末期压,左心房压和肺毛细血管楔压增高,心搏量及心脏指数减低。
9.心内膜心肌活检(endomyocardial biopsy, EMB)
主要适应证包括:近期出现的原因不明的突发严重心力衰竭、可伴有严重心律失常,对药物治疗反应差。尤其对怀疑暴发性淋巴细胞心肌炎的病例,这些病人通过血流动力学支持后预后很好,通过EMB尽快明确诊断对治疗有指导作用。心内膜心肌活检还可以确诊巨噬细胞心肌炎,有助于及时启动免疫抑制治疗。此检查也有助于决定病人应该尽早心脏移植还是先用心室辅助泵。
治疗旨在阻止基础病因介导的心肌损害,阻断造成心力衰竭加重的神经体液机制,去除心力衰竭加重的诱因,控制心律失常和预防猝死,预防各种并发症的发生如血栓栓塞,提高临床心功能、生活质量和延长生存。
(一)病因及加重诱因的治疗
应积极寻找病因,给予相应的治疗,如控制感染、严格限酒或戒酒、治疗相应的内分泌疾病或自身免疫病,纠正液体负荷过重及电解质紊乱,改善营养失衡等。
(二)针对心力衰竭的药物治疗
在疾病早期,虽然已出现心脏扩大、收缩功能损害,但尚无心力衰竭的临床表现。此阶段应积极地进行早期药物干预治疗,包括β受体拮抗剂、ACEI或ARB,可减缓心室重构及心肌进一步损伤,延缓病变发展。随病程进展,心室收缩功能进一步减低,并出现心力衰竭的临床表现。此阶段应按慢性心力衰竭治疗指南进行治疗:
1.ACEI或ARB的应用
所有LVEF<40%的心力衰竭病人若无禁忌证均应使用ACEI,从小剂量开始,逐渐递增,直至达到目标剂量,滴定剂量和过程需个体化。对于部分ACEI不能耐受(如咳嗽)的病人可以考虑使用ARB。
2.β受体拮抗剂
所有LVEF<40%的病人若无禁忌都应使用β受体拮抗剂,包括卡维地洛、琥珀酸美托洛尔和比索洛尔。应在ACEI和利尿剂的基础上加用,需从小剂量开始,逐步加量,以达到目标剂量或最大耐受剂量。
3.盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonist, MRA)
包括依普利酮和螺内酯,为保钾利尿剂。对于在ACEI和β受体拮抗剂基础上仍有症状且无肾功能严重受损的病人应该使用,但应密切监测电解质水平,后者可引起少数男性病人乳房发育。
4.肼屈嗪和二硝酸异山梨酯
此两种药物合用作为ACEI和ARB不能耐受病人的替代。对于非洲裔病人,这种药物组合可用于那些使用ACEI、β受体拮抗剂和MRA后临床心功能仍为Ⅲ~Ⅳ级的病人,以降低死亡率和心衰再住院率。
5.伊伐布雷定
窦房结If通道阻滞剂,它能减慢心率同时不影响心肌收缩力,但对房颤时的心室率控制无作用。经过目标剂量或最大耐受量的β受体拮抗剂、ACEI或ARB和醛固酮拮抗剂后仍有症状,射血分数≤35%且窦性心率仍≥70次/分的病人,应考虑使用伊伐布雷定以降低心衰住院与心血管死亡风险。对于LVEF≤35%的症状性慢性心衰病人,如不能耐受β受体拮抗剂或有使用禁忌,且静息窦性心率≥70次/分,应该使用伊伐布雷定。
6.血管紧张素受体脑啡肽酶抑制剂(ARNI)
是脑啡肽酶(neprilysin)抑制剂sacubitril和血管紧张素Ⅱ受体拮抗剂缬沙坦组成的一种复方制剂。若射血分数减低的心衰病人经过ACEI、β受体拮抗剂和醛固酮拮抗剂充分治疗后病人仍有症状,应使用ARNI替代ACEI,以进一步降低心衰住院与死亡风险。
7.利尿剂的应用
能有效改善胸闷、气短和水肿等症状。通常从小剂量开始,如呋塞米每日20mg或氢氯噻嗪每日25mg,根据尿量及体重变化调整剂量。
8.洋地黄
主要用于ACEI(ARB)、β受体拮抗剂、MRA治疗后仍有症状,或者不能耐受β受体拮抗剂的病人,能有效改善症状,尤其用于减慢心力衰竭伴房颤病人的心室率。
上述药物中ACEI、β受体拮抗剂和MRA对改善预后有明确的疗效,近年问世的新药伊伐布雷定和ARNI改善收缩性心衰的预后作用也逐渐被临床试验所证实。而其他药物对远期生存的影响尚缺乏充分证据,但能有效改善症状。值得指出的是,临床上一般不宜将ACEI、ARB、MRA三者合用。噻唑烷二酮(thiazolidinediones)如格列酮类(glitazones)可能加重心力衰竭,应该避免使用;NSAIDs或COX-2抑制剂可能造成水、钠潴留,也应该避免使用。地尔硫䓬及维拉帕米有负性肌力作用,应避免使用。
(三)心力衰竭的心脏再同步化治疗(CRT)
CRT是通过植入带有左心室电极的起搏器,同步起搏左、右心室而使心室的收缩同步化。这一治疗对部分心力衰竭病人有显著疗效。病人需要在药物治疗的基础上选用。
(四)心力衰竭其他治疗
严重心力衰竭内科治疗无效的病例可考虑心脏移植。在等待期如有条件可行左心机械辅助循环,以改善循环。也有试行左心室成形术者,通过切除部分扩大的左心室同时置换二尖瓣,以减轻反流、改善心功能,但疗效尚不确定。
(五)抗凝治疗
血栓栓塞是常见的并发症,对于有房颤或已经有附壁血栓形成或有血栓栓塞病史的病人,须长期服用华法林或新型口服抗凝药物等抗凝治疗。
(六)心律失常和心脏性猝死的防治
对于房颤的治疗可参考心律失常相关章节。植入型心律转复除颤器(ICD)预防心脏猝死的适应证包括:①有持续性室速史;②有室速、室颤导致的心跳骤停史;③LVEF≤35%,NYHA心功能分级为Ⅱ~Ⅲ级,预期生存时间>1年,且有一定生活质量。
由于病因未明,预防较困难。部分病例由病毒性心肌炎演变而来,因此预防病毒感染有实际意义。本病常伴有心力衰竭,呼吸道感染常为其诱发或加重的因素,应预防和及时治疗。
治疗以针对临床表现为主:
1.注意休息及避免劳累,有心脏扩大或心功能减退者更应注意长期休息,防止病情恶化。
2.治疗心力衰竭者原则与治疗一般心力衰竭相同,急性心衰或慢性心衰急性发作时采用正性肌力、利尿和扩血管药,由于心肌损坏较广泛,洋地黄类应用要谨慎。非洋地黄类正性肌力兴奋剂,如肾上腺素能受体兴奋剂和磷酸二酯酶抑制剂能短期静脉应用。利尿药有益,但在低肾小球滤过时,氢氯噻嗪可能失效,此时需用袢利尿药呋塞米等。螺内酯可以阻断醛固酮效应,对抑制心肌重构,改善预后有很好的作用。扩血管药,包括ACEI/ARB/ARNI都可用,须从小剂量开始,注意低血压。DCM慢性心衰时用β受体阻滞剂有效,其机制可能是慢性心衰时肾上腺素能神经过度兴奋,β受体密度下调,除了临床常用的高选择性β1受体阻断药,如美托洛尔、比索洛尔外,卡维地洛作为一种新型的非选择性肾上腺素受体阻断药无内在拟交感活性,避免了反射性交感神经兴奋所引起的周围血管收缩及外周阻力增加;此外,它有极强的抗氧自由基、调节细胞因子、抗心肌重构等多种作用。因此,已有许多学者将卡维地洛(10~25mg,口服,每日2次)用于治疗扩张型心肌病。此外,脑钠肽(BNP)类药物奈西立肽(nesiritide)可以均衡地扩张动脉和静脉,增加心排血量和尿量,可用于治疗急性心力衰竭。
3.治疗心律失常,尤其有症状者需用抗心律失常药或电学方法治疗,对快速室性心律与高度房室传导阻滞而有猝死危险者治疗应更积极。
4.有心腔明显扩大伴低射血分数、NYHA心功能Ⅳ级、长期卧床,尤其是有血管栓塞史或深静脉血栓形成的患者可使用华法林或新型口服抗凝药。
5.改善心肌代谢的药物,如维生素C、三磷酸腺苷、辅酶A、环化腺苷酸、辅酶Q10、曲美他嗪等,抗病毒的干扰素都可作为辅助治疗。
6.国内在中医药调节免疫、抗病毒、改善心肌代谢的基础上采用中西医结合治疗DCM方面取得了明显有益的效果。研究发现,黄芪、牛磺酸、生脉制剂等既能抗病毒,又能调节机体免疫,改善心脏功能的作用。
7.心脏再同步化治疗主要适用于药物效果不佳、QRS波群时限延长>150毫秒、LVEF值≤35%、QRS波呈完全性左束支传导阻滞或心室内传导阻滞的DCM患者,可考虑安装左右心室同步起搏的双腔、三腔或四腔心腔起搏治疗DCM难治性心力衰竭,通过调整左右心室收缩顺序,改善心功能,缓解症状。对LVEF≤35%或伴顽固性持续快速室性心律失常的患者可考虑安置植入型心律转复除颤器(ICD)。
8.左心机械辅助循环是将左心的血液通过机械装置引入主动脉,以减轻左心室做功。为晚期DCM患者维持全身循环、等待心脏供体及不能进行心脏移植患者的一种有效治疗方法。
9.DCM患者出现难治性心衰时,可考虑心脏移植。













