英文名称 :infective endocarditis
感染性心内膜炎(infective endocarditis,IE)指因细菌、真菌和其他病原微生物(如病毒、立克次体、衣原体、支原体、螺旋体等)直接感染而产生心瓣膜或心室壁内膜的炎症,有别于由于风湿热、类风湿、系统性红斑狼疮等所致的非感染性心内膜炎。
近年来随着抗生素广泛应用和病原微生物的变化,本病临床表现变得不典型。由于人口老龄化,风湿热减少,感染性心内膜炎的平均发病年龄有所增加,大于40岁的患者明显增加,且发病率随年龄增长而增长,在70~80岁时达最高,男女的比例约为2∶1,女性患者预后较差。
本病多见于器质性心脏病的患者。近年来大量研究证实了血流动力学因素、机械因素造成心内膜的原始损伤、非细菌性血栓性心内膜炎、暂时性菌血症及血液中致病微生物的数量、毒力、侵袭性和黏附于黏膜的能力均与IE的发病有关。
各种先天性心脏病中,动脉导管未闭、室间隔缺损、法洛四联症最常发生。在单个瓣膜病变中,二叶式主动脉瓣狭窄最易发生,瓣膜脱垂(主动脉瓣、二尖瓣)也易患本病。另外接受长时间经静脉治疗、静脉注射麻醉药成瘾、由药物或疾病引起免疫功能抑制的患者、人工瓣膜置换术后的IE和心血管植入型电子装置(cardiovascular implanted electronic device,CIED)性 IE也有增多。在发达国家,二尖瓣脱垂是IE最常见的原因。肥厚型心肌病、冠心病罹患本病者也有报道。
近年来,由于广谱抗生素的普遍和过度使用,致病菌种也发生改变,过去罕见的耐药微生物病例增加。尽管目前甲型溶血性链球菌(草绿色链球菌)心内膜炎的比例有所下降,但链球菌包括各种不同类型的变异体及葡萄球菌仍是最常见、毒性最强的致病菌。葡萄球菌感染是医源性和静脉内药物滥用者的IE最主要的原因。CIEDs性IE多为表皮葡菌和金黄色葡萄球菌感染。真菌尤多见于心脏手术和静脉注射麻醉药物成瘾者中,长期应用抗生素或激素、免疫抑制剂、静脉导管输给高营养液等均可增加真菌感染的机会,其中以念珠菌属、曲霉菌属和组织胞浆菌属较多见。
在心瓣膜病损、先天性心血管畸形或后天性动静脉瘘的病变处,存在异常的血液压力阶差,引起局部心内膜的内皮受损,可形成非细菌性血栓性心内膜炎,涡流可使细菌沉淀于低压腔室的近端、血液异常流出处受损的心内膜上,引起IE。正常人可有少数细菌自口腔、鼻咽部、牙龈、检查操作或手术等伤口侵入引起菌血症,大多为暂时的,很快被机体清除,临床意义不大。但反复的暂时性菌血症使机体产生循环抗体,尤其是凝集素,它可促使少量的病原体聚集成团,易黏附在血小板-纤维素血栓上面引起感染。也有人认为由于某些革兰氏阳性致病菌,如肠球菌、金黄色葡萄球菌,表皮葡菌等,均有一种表面成分与心内膜细胞表面的受体起反应而引起内膜的炎症。血小板、血浆蛋白及血管内皮细胞与病原体间通过复杂的相互作用共同导致IE的发生。
2015年欧洲心脏病学会(ESC)公布了新版IE预防、诊断与治疗指南,提出IE分类方法:
(一)根据感染的部位和是否存在心内异物将IE分为四类
1.左心自体瓣膜IE(native valve endocarditis,NVE)。
2.左心人工瓣膜 IE(prosthetic valve endocarditis,PVE)早期人工瓣膜IE:瓣膜置换术后<1年发生,晚期人工瓣膜IE:瓣膜置换术后>1年发生。
3.右心IE。
4.器械相关性IE 发生在起搏器或除颤器导线上的IE,伴或不伴有瓣膜受累。
(二)根据感染来源分类
1.医疗相关性IE
(1)院内感染:
患者在入院48小时以后出现IE相关的症状和体征。
(2)非院内感染:
患者在入院48小时以内出现IE相关的症状和体征:IE发病前30天内接受家庭护理或静脉治疗,血透或静脉化疗;IE发病前90天内入住急诊监护室,或护理院或长期住监护室。
2.社区获得性IE
患者入院48小时内出现IE相关症状和体征但不符合医疗相关性标准。
3.经静脉吸毒者的IE
没有其他感染来源的静脉吸毒者。
有以下情况者可认为属于活动性IE:①患者持续性发热且血培养多次阳性;②手术时发现活动性炎症病变;③患者仍在接受抗生素治疗;④有活动性IE的组织病理学证据。
IE的再发有两种情况:①复发:首次发病后<6个月由同一微生物引起IE再次发作;②再感染:不同微生物引起的感染或首次发病后>6个月由同一微生物引起IE再次发作。
基本病理变化为在心瓣膜表面附着由血小板、纤维蛋白、红细胞、白细胞和感染病原体沉着而组成的赘生物。后者可延伸至腱索、乳头肌和室壁内膜。赘生物下的心内膜有炎症反应和灶性坏死。以后感染病原体被巨噬细胞吞噬,赘生物被纤维组织包绕,发生机化、玻璃样变或钙化,最后被内皮上皮化。但部分的赘生物愈合程度不一,有些愈合后还可复发,重新形成病灶。病变严重者,心瓣膜可形成深度溃疡,甚至发生穿孔。偶见乳头肌和腱索断裂。本病的赘生物较风湿性心内膜炎所产生者大而脆,容易碎落成感染栓子,随循环血流播散到身体各部产生栓塞,以脑、脾、肾和肢体动脉为多,引起相应脏器的梗死或脓肿。栓塞阻碍血流,或破坏血管壁,引起囊性扩张形成细菌性动脉瘤,常为致命的并发症。如脑部的动脉滋养血管栓塞而产生动脉瘤,往往可突然破裂而引起脑室内或蛛网膜下腔出血导致死亡。
本病常有微栓或免疫机制引起的小血管炎,如皮肤黏膜瘀点,指甲下出血,Osler结和Janeway损害等。感染病原体和体内产生相应的抗体结合成免疫复合物,沉着于肾小球的基底膜上,引起局灶性、弥漫性或膜型增殖性肾小球肾炎,后者可致肾衰竭。
(一)血培养
约75%~85%患者血培养阳性。阳性血培养是诊断本病的最直接的证据,而且还可以随访菌血症是否持续。急性患者宜在应用抗生素前1~2小时内抽取2~3个血标本,亚急性者在应用抗生素前24小时采集3~4个血标本。先前应用过抗生素的患者应至少每天抽取血培养共3天,以期提高阳性率。取血时间以寒战或体温骤升时为佳,每次取血10~15ml并更换静脉穿刺的部位,皮肤严格消毒。应用抗生素治疗的患者,取血量不宜过多,避免血液中过多的抗生素不能被培养基稀释,影响细菌的生长。要求常规做需氧和厌氧菌培养。在人工瓣膜置换,较长时间留置静脉插管、导尿管,有药物依赖者,应加做真菌培养。如血培养阴性患者,更应加强对真菌的培养。观察时间至少2周,当培养结果阴性时应保持到3周,确诊必须2次以上血培养阳性。动脉血培养阳性率并不高于静脉血。罕见情况下,血培养阴性患者,骨髓培养可阳性。阳性者应做各种抗生素单独或联合的药物敏感试验,以便指导治疗。血培养阴性,IE的发生率为2.5%~31%,最常见原因是血培养前应用过抗生素,另一常见原因是病原体为苛养微生物,易见于人工瓣膜、留置静脉导管、植入起搏器、肾衰竭或免疫抑制状态的患者。
(二)常规临床检验
红细胞和血红蛋白降低。偶可有溶血现象。白细胞计数在无并发症的患者可正常或轻度增高,有时可见到核左移。红细胞沉降率大多增快。半数以上患者可出现蛋白尿和镜下血尿。在并发急性肾小球肾炎、间质性肾炎或大的肾梗死时,可出现肉眼血尿、脓尿及血尿素氮和肌酐增高。肠球菌性和金黄色葡萄球菌性心内膜炎常可导致菌尿症,因此做尿培养也有助于诊断。
(三)心电图检查
一般无特异性。在并发栓塞性心肌梗死、心包炎时可显示特征性改变。在伴有室间隔脓肿或瓣环脓肿时可出现不全性或完全性房室传导阻滞、束支传导阻滞或室性期前收缩。颅内菌性动脉瘤破裂,可出现“神经源性”的T波改变。
(四)放射影像学检查
胸部X线检查仅对并发症如心力衰竭、肺梗死的诊断有帮助。计算机化X线断层显像(CT)或螺旋CT对怀疑肺栓塞或有较大的主动脉瓣周脓肿患者有助于诊断。磁共振成像(MRI)的诊断作用可能更大。
(五)超声心动图检查
能探测到赘生物所在部位、大小、数目和形态,对血培养阴性患者的检查很有诊断价值。经食管超声心动图(transesophageal echocardiography,TEE)检查显著优于经胸壁超声心动图检查(transthoracic echocardiography,TTE),检出率达90%,能检出直径在2mm以上的赘生物。超声心动图还有助于诊断原来的心脏和瓣膜病变,能探测瓣膜破坏的情况,了解人工机械瓣膜或生物瓣的状况,各种心内并发症,以及瓣膜反流的严重程度和左室功能,可作为判断预后和确定是否需要手术的参考。超声心动图检查适应证:①一旦怀疑患者有IE可能,首选TTE,应尽早检查(1类推荐,B级证据);②高度怀疑IE而TTE正常时,推荐TEE(1类推荐,B级证据);③TTE/TEE阴性但临床仍高度怀疑IE者,应在7~10天后再行TTE/TEE检查(1类推荐,B级证据);④IE治疗中一旦怀疑出现新并发症(新杂音、栓塞、持续发热、心力衰竭、脓肿、房室传导阻滞),应立即重复TTE/TEE检查(1类推荐,B级证据);⑤抗生素治疗结束时,推荐TTE检查以评价心脏和瓣膜的形态学及功能(1类推荐,C级证据)。诊断IE的超声心动图主要标准是:赘生物、脓肿、人工瓣膜裂开(瓣周漏伴或不伴瓣膜的摇摆运动)。
(六)心导管检查和心血管造影
对诊断原有的心脏病变、估计瓣膜的病变程度、了解有无冠心病有帮助。它们可能使赘生物脱落引起栓塞,加重心力衰竭,须慎重考虑,严格掌握适应证。
(七)血清免疫学检查
常显示免疫功能的应激和炎症反应。本病亚急性病例病程长达6周者,50%类风湿因子呈阳性,经抗生素治疗后,其效价可迅速下降。有时可出现高球蛋白血症或低补体血症,常见于并发肾小球肾炎的患者,其下降水平常与肾功能不良保持一致。约有90%患者的循环免疫复合物(CIC)阳性,且常在100μg/ml以上,比无IE的败血症患者高,具有鉴别诊断的价值。其他检查尚有真菌感染时的沉淀抗体测定、凝集素反应和补体结合试验。金黄色葡萄球菌的胞壁酸抗体测定等。
及早治疗可以提高治愈率,但在应用抗生素治疗前应抽取足够的血培养,根据病情的轻重,推迟抗生素治疗几小时乃至1~2天。明确病原体,采用最有效的抗生素是治愈本病最关键的因素。
本病的治疗经历了两次大的进展。一是抗生素的应用,二是外科手术的治疗。
(一)药物治疗
IE治愈的关键在于清除赘生物中的病原微生物。抗感染治疗基本要求是:①应用杀菌剂;②联合应用2种具有协同作用的抗菌药物;③大剂量,需高于一般常用量,使感染部位达到有效浓度;④静脉给药;⑤长疗程,一般为4~6周,人工瓣膜IE需6~8周或更长,以降低复发率。抗菌药物应根据药代动力学给药,大剂量应用青霉素等药物时,宜分次静脉滴注,避免高剂量给药后可能引起的中枢神经系统毒性反应,如青霉素脑病等。部分患者需外科手术,移除已感染材料或脓肿引流,以清除感染灶。
1.经验治疗方案
在血培养获得阳性结果之前采用,适用于疑似IE、病情较重且不稳定的患者。经验治疗方案应根据感染严重程度,受累心瓣膜的类型、有无少见或耐药菌感染危险因素等制定,分为自体瓣膜IE(NVE)及人工瓣膜IE(PVE)。治疗应覆盖IE最常见的病原体。经验治疗推荐的治疗方案见表2。
表2 IE的经验性治疗(等待血培养结果)
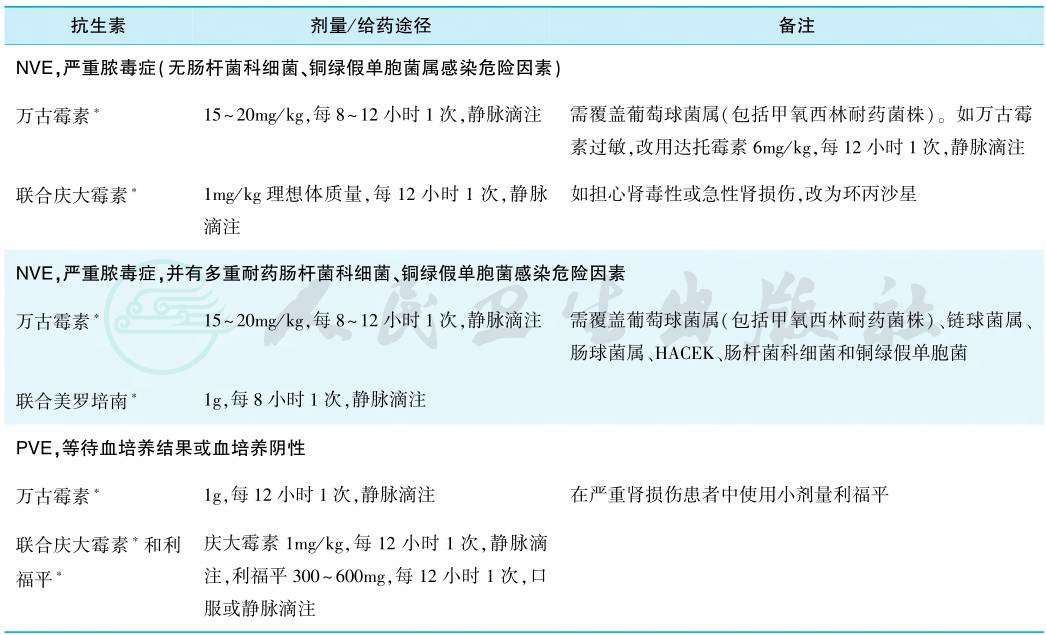
注:∗根据肾功能调整剂量;IE:感染性心内膜炎;NVE.自体瓣膜感染性心内膜炎;PVE.人工瓣膜感染性心内膜炎。
2.葡萄球菌心内膜炎
治疗方案根据病原菌是否属甲氧西林耐药株而定(表3)。由于青霉素耐药葡萄球菌已达90%以上,故在获知细菌药敏前经验治疗宜首选耐酶青霉素类,如苯唑西林、氯唑西林等联合氨基糖苷类。
表3 葡萄球菌心内膜炎的治疗
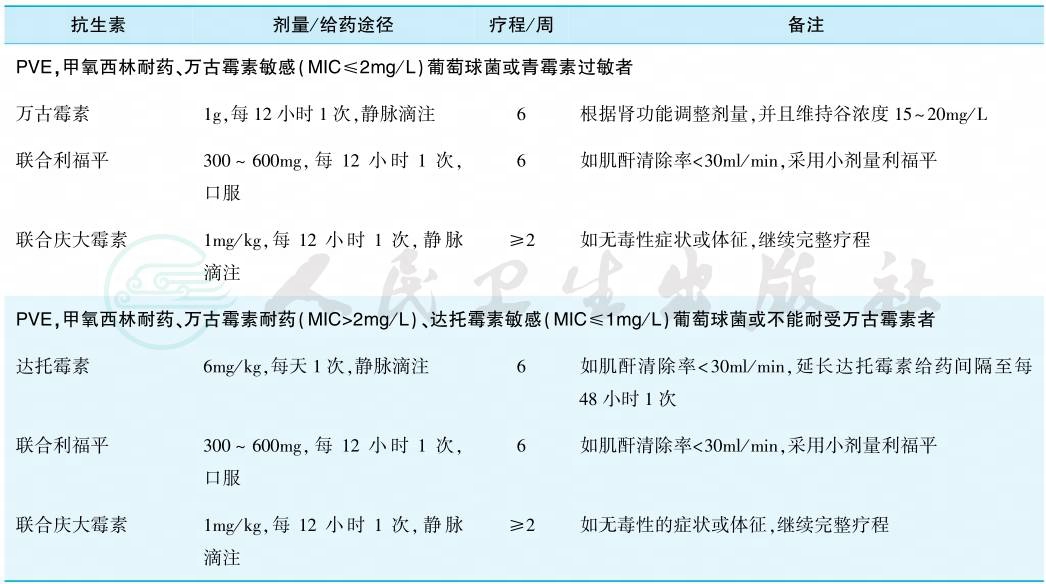
注:MIC.最低抑菌浓度;PVE.人工瓣膜感染性心内膜炎。
3.链球菌心内膜炎
按照草绿色链球菌对青霉素的敏感程度,治疗方案略有差异(表4)。青霉素对草绿色链球菌最低抑菌浓度(MIC)<0.125mg/L者为敏感株,MIC>0.125mg/L而<0.5mg/L者系相对耐药株,MIC>0.5mg/L为耐药株。耐药株所致IE,无论NVE或PVE均按肠球菌心内膜炎治疗方案,予以万古霉素或替考拉宁联合庆大霉素。
表4 链球菌心内膜炎的治疗
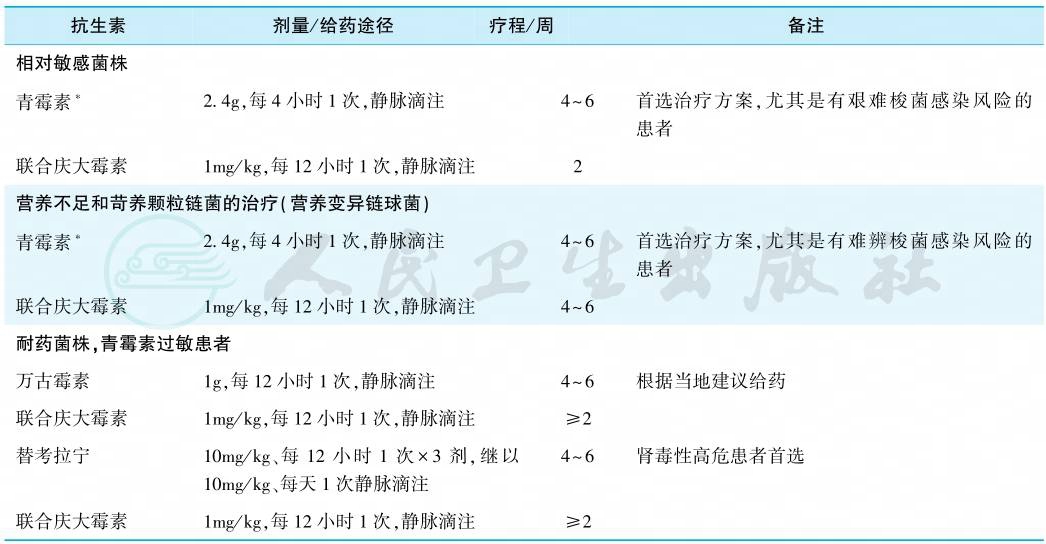
注:所有药物剂量根据肾损伤调整;应监测庆大霉素、万古霉素和替考拉宁血药浓度;∗阿莫西林2g、每4~6小时1次给药可用于替代青霉素1.2~2.4g、每4小时1次给药。
4.肠球菌心内膜炎
肠球菌属对多种抗菌药物呈现固有耐药,一些有效药物单用仅具抑菌作用,须联合用药达到杀菌作用并减少复发机会。粪肠球菌可对氨苄西林和青霉素呈现敏感,但其敏感性较草绿色链球菌差,屎肠球菌敏感性更低(表5)。
表5 肠球菌心内膜炎的治疗
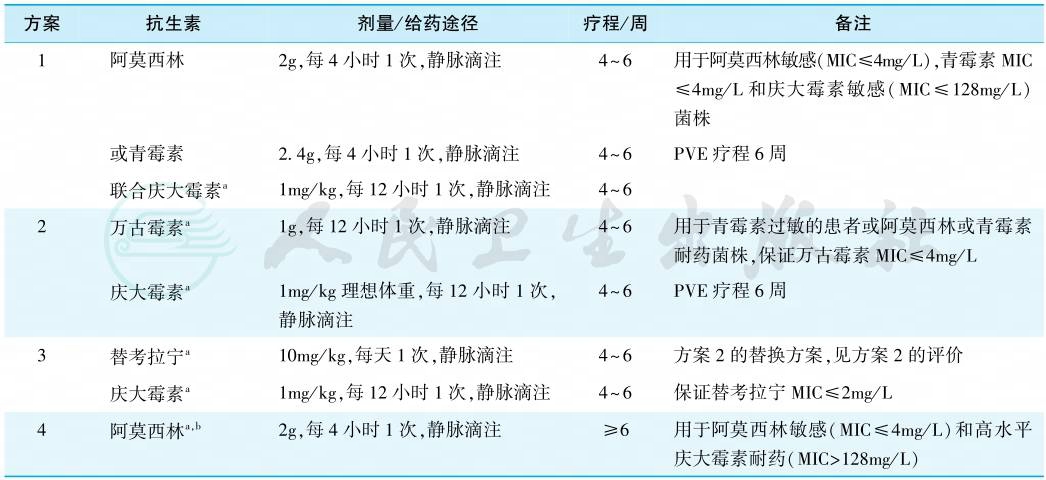
注:a根据肾功能调整剂量;b如菌株敏感,可增加链霉素7.5mg/kg、每12小时1次,肌内注射;MIC.最小抑菌浓度;PVE.人工瓣膜感染性心内膜炎。
5.革兰氏阴性需氧杆菌心内膜炎
应选用具抗假单胞菌活性的青霉素类或头孢菌素类联合抗假单胞菌氨基糖苷类,如哌拉西林联合庆大霉素或妥布霉素,或头孢他啶联合氨基糖苷类。革兰氏阴性杆菌对抗菌药的敏感性在菌株间差异甚大,宜根据细菌药敏结果选择用药。疗程至少6周,常需6~8周或更长。
心内膜炎也可由HACEK组细菌引起,早年此组细菌对氨苄西林敏感,近年来该细菌中产β内酰胺酶菌株渐增多,宜选用头孢曲松或头孢噻肟等第三代头孢菌素治疗。对非产酶株也可选用阿莫西林、氨苄西林联合氨基糖苷类抗生素,疗程应为4周,如为PVE者疗程至少6周,治疗初始联合庆大霉素2周。环丙沙星可考虑作为替换药物。
6.其他病原体所致IE
(1)真菌性心内膜炎:
相对少见(1%~6%),以念珠菌属、曲霉属多见,其他真菌包括组织胞浆菌、隐球菌、芽生菌等。真菌性心内膜炎的诊断相当困难,如临床疑为IE,但连续血培养阴性,应考虑真菌性心内膜炎可能。念珠菌心内膜炎血培养阳性率较高,其他如隐球菌、红酵母等酵母菌血培养阳性率也较高。真菌心内膜炎相对疗程长,预后差,易复发。
1)念珠菌心内膜炎:
初始治疗选用棘白霉素类药物,剂量适当增加可获得更好疗效,或选用两性霉素B脂质体,或两性霉素B去氧胆酸盐,还可联合氟胞嘧啶,每日4次,提高疗效。初始治疗疗程应6~10周左右,待病情稳定、血培养阴性后,敏感菌株给予氟康唑每天400~800mg(6~12mg/kg)降阶梯治疗,并建议尽早行瓣膜置换术,术后治疗至少6周,有瓣周脓肿或其他并发症者,疗程更长。
2)曲霉菌心内膜炎:
初始治疗首选伏立康唑,疗程4周以上。治疗中需监测血药浓度,保证达到足够血药浓度;不能耐受或伏立康唑耐药者,可选用两性霉素B脂质体。病情稳定后应长期口服伏立康唑维持治疗,疗程至少2年。瓣膜置换术对于曲霉菌心内膜炎的成功治疗至关重要。
3)其他真菌性心内膜炎:
药物选择可参照上述治疗方案及体外药物敏感试验。
(2)Q热(query fever):
Q 热是由贝纳柯克斯体(Coxiella burnetii)感染所致的一种人兽共患的自然疫源性疾病,又称Q热柯克斯体。以急性发热、头痛、肌痛、间质性肺炎等为主要表现,少数呈慢性经过,IE是慢性Q热最主要的临床表现形式。患者多存在细胞免疫缺陷或基础心瓣膜损害及人工瓣膜等。Q热心内膜炎血培养常为阴性,可有瓣膜赘生物形成。
治疗建议:①抗生素应用:多西环素100mg、每 12小时1次,联合氯喹200mg、每12小时1次口服,至少18个月,能够有效杀菌并预防复发,有学者推荐治疗≥3年。或多西环素100mg、每12小时1次和环丙沙星200mg、每12小时1次口服至少3年;②贝纳柯克斯体抗体滴度监测:治疗期间应该每6个月1次,治疗停止后每3个月1次,至少2年;③治愈标准:贝纳柯克斯体的Ⅰ相IgG抗体滴度<1∶800和Ⅰ相IgM和IgA抗体滴度<1∶50,提示治愈。
(3)巴尔通体心内膜炎(Bartonella endocarditis):
巴尔通体是一种兼性细胞内G-短小杆菌,是引起血培养阴性IE的另一种常见病原体。最常见的巴尔通体心内膜炎是由五日热巴尔通体引起,其次是汉塞巴尔通体。前者可引起战壕热和IE,通过体虱传播。感染的高危因素包括缺乏家庭关怀、免疫力低下、吸毒、嗜酒等。后者较少引起IE。IE是慢性巴尔通体感染的一种常见表现。
治疗建议:联合庆大霉素和一种β内酰胺类抗生素或多西环素治疗至少4周,通常6周以上。庆大霉素1mg/kg、每8小时1次×4周,联合阿莫西林2g、每4小时1次×6周或头孢曲松2g、每天1次×6周,均静脉滴注。若青霉素过敏则可使用多西环素100mg、每12小时1次,口服6周。注意监测庆大霉素浓度。
(二)感染性心内膜炎的外科手术
外科手术主要适用于左心瓣膜IE。
1.适应证与手术时机
左心瓣膜IE累及二尖瓣约占50%~56%,累及主动脉瓣约占35%~49%,同时累及以上2个瓣膜的约占15%。大约一半的IE患者由于存在严重并发症需手术治疗。活跃期(即患者仍在接受抗生素治疗期间)早期手术指征是心力衰竭、感染无法控制及预防栓塞事件(表6)。活跃期接受手术治疗存在显著的风险。年龄本身不是禁忌证。
表6 左心瓣膜心内膜炎的手术适应证与时机
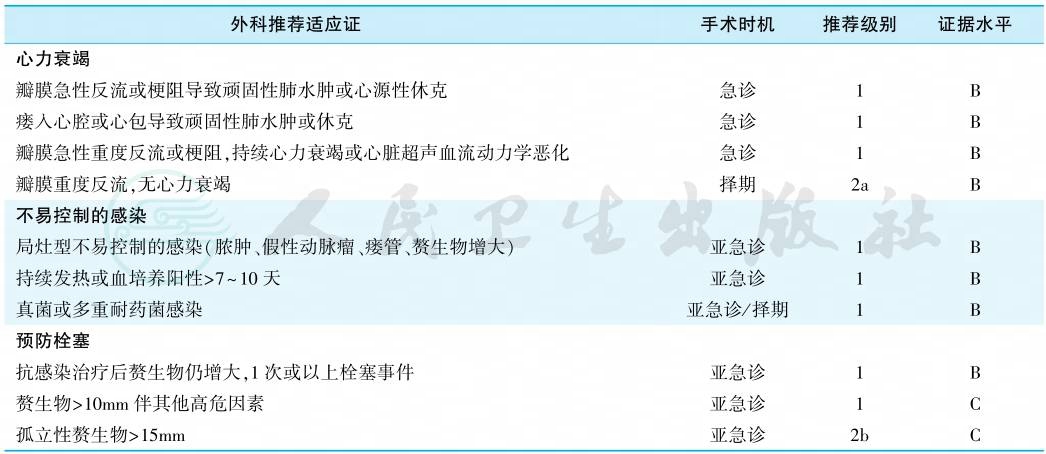
注:急诊手术,指24小时内的外科手术;亚急诊手术,指数天之内的外科手术;择期手术,指至少1~2周抗生素治疗后的外科手术。
(1)心力衰竭:
心力衰竭是多数IE患者的手术适应证,并且是亚急诊手术的首要适应证。严重的主动脉瓣或二尖瓣关闭不全、心内瘘管或赘生物造成瓣膜梗阻,严重急性主动脉瓣或二尖瓣关闭不全虽然无临床心力衰竭表现,但超声心动图提示左心室舒张末期压力升高、左心房压力升高或中到重度肺动脉高压,均有手术适应证。
(2)感染无法控制:
包括持续性感染(>7天)、耐药菌株所致感染及局部感染失控是第二类常见的手术原因。
(3)体循环栓塞的预防:
大部分栓塞发生在入院前,很难避免。抗生素治疗的第1周是栓塞发生风险的最高时期,行外科手术治疗来预防栓塞的发生获益最大。虽然证据表明赘生物体积与栓塞的风险直接相关,但在决定是否尽早手术时需全面考虑如下因素:是否存在陈旧栓塞、IE的其他并发症、赘生物大小及活动度、保守外科治疗的可能性、抗生素治疗的持续时间。应权衡外科手术治疗的获益与风险,并且个体化评价患者的一般状况及并发症。
2.手术病死率、致残率及术后并发症
IE的手术病死率在5%~15%,国内报道为4.1%。抗生素治疗1周以内行手术治疗的患者,院内病死率为15%,再发感染的发生率为12%,术后瓣膜功能障碍发生率为7%。病变仅局限于瓣膜结构,术中可完整清除感染组织的患者,手术病死率与常规瓣膜手术接近。导致死亡的原因主要是多器官功能衰竭、心力衰竭、难治性败血症、凝血障碍、卒中。
术后急性并发症常见的有:需应用补充凝血因子治疗的凝血障碍、因出血或心脏压塞导致的二次开胸、需要血液透析的急性肾衰竭、卒中、低心排综合征、肺炎、因切除主动脉根部脓肿导致房室传导阻滞需行起搏器植入。术前心电图显示左束支传导阻滞者,术后常需要植入埋藏式起搏器。
(一)入院后的预后评估
IE院内死亡率在9.6%~26%,尽快确认高危患者有助于更加密切监测和更积极治疗。影响预后的主要因素:患者的临床基础状态、是否存在并发症及感染的微生物种类。
1.临床基础状态
既往存在心脏病、瓣膜置换术后、心腔存在植入性装置、胰岛素依赖型糖尿病、肾脏疾病和肺部疾病、老年、自身免疫性疾病(系统性红斑性狼疮等)、肿瘤(结肠癌等),常规抗生素治疗后仍持续发热及血培养阳性持续10天以上者预后差。
2.并发症
伴心力衰竭、心脏局部结构毁损、肾衰竭、卒中、多器官栓塞、动脉瘤、菌血症性休克、局部无法控制的感染(心肌或瓣周脓肿,假性动脉瘤)及巨大的赘生物(>10mm)等,预后不良。
3.微生物类型
金黄色葡萄球菌、真菌、革兰氏阴性杆菌、血培养不易发现的某些少见微生物(尿气球菌)、人类免疫缺陷病毒(HIV)合并感染等往往病情严重,预后差。
如果在上述3个方面各有1个以上危险因子,死亡或致残的风险高达70%以上。例如IE合并心力衰竭、瓣周脓肿,致病菌是金黄色葡萄球菌,死亡风险最高,即使在感染已控制的情况下也需要手术挽救生命。
(二)出院后的转归随访
患者出院后转归与是否出现晚期并发症有关,主要并发症包括感染再发、心力衰竭、需外科换瓣手术及死亡。
1.感染再发
概率为2.7%~22.5%,分为复发和再感染。“复发”是指导致IE的病原体和上次IE相同,而“再感染”是指IE的病原体和上次感染的病原体不同。再发患者在检测到病原体和上次IE相同时,常难确定是上次IE的复发还是病原体的再感染,菌株分型技术有助于区分。当两次感染病原体无法确定或分子技术不可行时,可以根据第2次发病时间来做区分,一般而言,复发间隔时间要短于再感染,初次感染后6个月内再发的多为复发,6个月后再发的多为再感染,建议IE菌株保存至少1年。
增加复发的相关因素包括:①抗感染治疗不恰当(类型、剂量、疗程);②耐药菌,如布鲁氏菌、军团菌、衣原体、支原体、结核分枝杆菌、巴尔通体、贝纳柯克斯体、真菌;③静脉吸毒者多重微生物感染;④培养阴性行经验性抗感染治疗;⑤感染沿瓣周进展;⑥PVE;⑦持续出现感染转移灶(脓肿);⑧常规抗感染方案抵抗;⑨瓣膜培养阳性。
如复发是由疗程不足或抗生素选择不佳所致,应根据致病菌和药敏试验选择抗生素,并需额外延长抗感染时间4~6周。再感染多见于静脉吸毒者(尤在初次感染后1年内)、PVE、持续血液透析患者及有多个危险因素者。再感染患者死亡率较高,常需要心瓣膜置换术。
2.心力衰竭及需要心瓣膜手术
感染得到控制的患者,如果因心瓣膜破坏导致心力衰竭进行性加重,手术指征和传统瓣膜病相同。
3.长期死亡率
出院后长期死亡率的主要影响因素包括年龄、并发症和心力衰竭,尤其在未手术患者,以上因素对死亡率的影响甚于感染本身。晚期死亡患者中仅6.5%是由于感染再发。
4.定期随访
应教育患者了解IE的相关症状和体征。如出现发热、寒战及其他感染征象时,要考虑到IE复发可能,需及时就诊。抗感染前行血培养。对高危患者需采取预防措施。为了监测心力衰竭的发生,需要在抗感染完成后进行临床心功能评估和经胸超声心动图检查,并定期随访,尤其在第1年随访期内。一般建议抗感染结束后第1、3、6、12个月进行临床评估、血液检查(白细胞计数、C反应蛋白)及经胸超声心动图检查。
预防措施主要针对菌血症和基础心脏病两个环节。菌血症是IE发生的必要条件,器质性心脏病患者为IE高危易感人群。
1.预防和减少菌血症发生
一般措施是强调口腔、牙齿和皮肤的卫生,防止皮肤黏膜损伤后的继发性感染。尽可能避免有创医疗检查和操作,如必须进行,要严格遵循无菌操作规范。
2.预防性应用抗生素
对高危人群如各种心脏瓣膜病、先天性心脏病、梗阻性肥厚型心肌病,以及风湿免疫性疾病而长期服用糖皮质激素治疗者及注射毒品的吸毒者,在做有创医疗检查和操作时需预防性应用抗生素。
(1)适用的人群和手术:
①有人工瓣膜或人工材料进行瓣膜修复的患者;②曾患过IE的患者;③发绀型先天性心脏病未经手术修补者或虽经手术修补但仍有残余缺损、分流或瘘管、先天性心脏病经人工修补或人工材料修补6个月以内者,以及经外科手术和介入方法植入材料或器械后仍有残余缺损者。
(2)适用的检查和操作:
口腔科操作菌血症的发生率为10%~100%,故操作前30分钟需预防性应用抗生素。呼吸道的气管镜、喉镜、经鼻内镜;消化系统的胃镜、经食管心脏超声检查、结肠镜;泌尿生殖系统的膀胱镜、阴道镜等检查,目前没有相关证据表明可引起IE,不推荐预防性使用抗生素。













