英文名称 :pulmonary arterial hypertension
肺动脉高压(pulmonary arterial hypertension,PAH)是以肺小动脉重构为特征,肺血管阻力(pulmonary vascular resistance,PVR)进行性升高并最终导致右心衰竭而死亡的一类恶性心脏血管性疾病,其发病率、致残率及病死率高。
PAH的发生发展过程与肺血管重构密切相关,但其发病机制尚未完全阐明。目前认为肺血管重构是遗传因素(基因突变)、表观遗传因素(DNA甲基化、组蛋白乙酰化、微小RNA等)、环境因素(低氧、氧化应激、机械剪切力、炎症、药物或毒物等)多种因素共同作用的结果。
多种血管活性因子如内皮素(ET)、血管紧张素Ⅱ、前列环素、一氧化氮(NO)等,多个信号通路如MAPK通路、Rho/ROCK通路、PI3K/AKT通路、骨形态发生蛋白(BMP)/转化生长因子β(TGF-β)通路等及离子通道(钾离子通道、钙离子通道)被认为在肺血管重构中发挥重要调节作用。经典三大途径见图1。
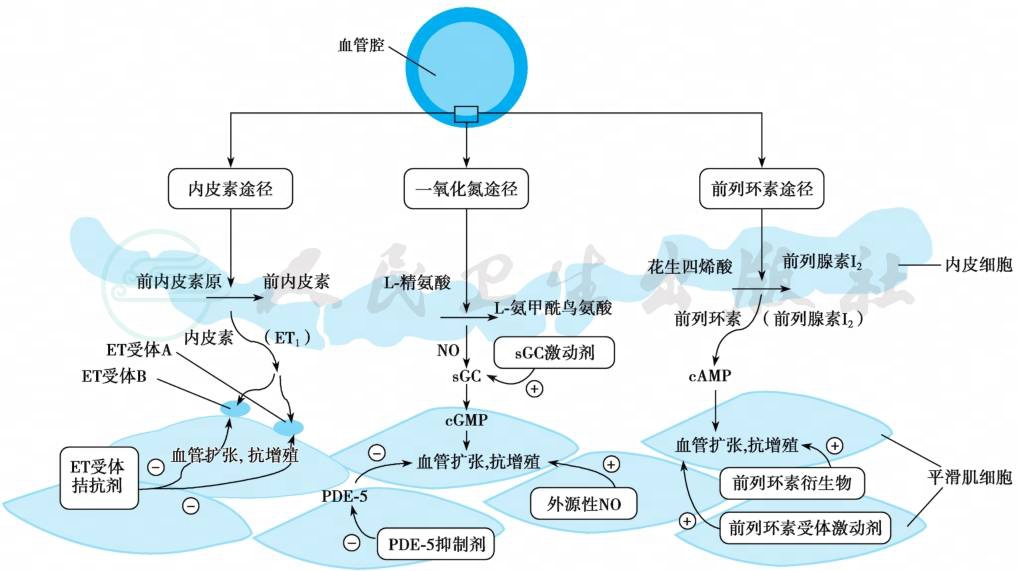
图1 肺动脉高压发病机制经典三大途径
ET.内皮素;NO.一氧化氮;sGC.可溶性鸟苷酸环化酶;cGMP.环磷酸鸟苷;PDE-5.5型磷酸二酯酶;cAMP.环磷酸腺苷。
(一)内皮衍生的血管活性因子
1.一氧化氮(nitricoxide,NO)
NO是短效亲脂自由基气体,正常生理条件下NO合酶(nitricoxidesynthase,NOS)催化左旋精氨酸转变为瓜氨酸产生NO。NO合成的关键酶有三种异构体:内皮型一氧化氮合酶(eNOS)、神经型一氧化氮合酶(nNOS)、诱导型一氧化氮合酶(iNOS)。eNOS主要存在于内皮细胞中,是血管壁上NO的主要来源。NO激活鸟苷酸环化酶(sGC),增加平滑肌的环磷酸鸟苷(cGMP),调控胞外钙离子浓度,进而引起平滑肌舒张导致血管扩张。由低氧和剪切力增加诱导的eNOS降低,导致NO减少,进而增加肺动脉平滑肌张力和增加无效收缩,表现为内皮依赖性血管舒张功能障碍。
2.前列环素
花生四烯酸的环氧化酶代谢产物,包括前列腺素E、地诺前列酮、前列环素[主要是前列腺素I2(PGI2)]和血栓素A2等。其中,地诺前列酮和血栓素A2等可使血管收缩,前列腺素E和前列腺素I2可使血管舒张。前列环素通过环磷酸腺苷(CAMP)依赖途径,发挥扩张血管、抑制平滑肌细胞增殖和抑制血小板聚集的作用。在IPAH患者前列环素降低,而血栓素A2升高,中小肺动脉前列环素合成酶表达减少。
3.内皮素(endothelin,ET)
ET是由21种氨基酸组成的肽类,其家族分为 ET-1、ET-2和ET-3等,在肺血管中主要是ET-1发挥作用。血管内皮细胞受到某种刺激后可合成并释放ET,ET经内皮素转换酶作用后激活,激活后与其受体结合而发挥其生物学效应,包括血管的收缩、舒张、内皮细胞增生、血管壁增厚、纤维化等。ET-1受体分为ETA和ETB受体,ETB受体有二种亚型:ETB1及ETB2,ET-1是至今发现的最强的缩血管因子,其缩血管效应是通过ETA和ETB2发挥作用,ETB1则使血管产生舒张效应。Chanruck研究表明,ET-1在PAH发病中起重要作用,PAH患者,ET表达呈高水平,且其表达水平与病情呈正相关。
4.其他血管活性因子
内皮细胞的损害是血管炎症的关键,低氧或是持续高压剪切力活化内皮细胞表达一些特殊的蛋白质和标志物如表皮细胞黏附因子-1、VEGF受体、E选择素、组织因子等。内皮损伤后内皮屏障有所丢失,血管中的炎性介质和一些生长因子能直接作用于血管中、外膜,进一步加重PAH的形成。血浆血管性血友病因子(von Willebrand因子)抗原水平是血管内皮细胞功能紊乱的一个标志物,在IPAH患者中其水平明显高于继发性肺动脉高压患者。
(二)遗传学机制
基因突变是部分PAH患者最根本的病因,基因检测可从分子水平确诊PAH。IPAH和家族性肺动脉高压(FPAH)均为单基因常染色体显性遗传,目前已知9个致病基因——BMPR2、BMP9、ACVRL1、ENG、SMAD9、BMPR1B、TBX4、CAV1和 KCNK3,可解释 50%~80%的 FPAH 和 20%~50%的遗传性散发型IPAH患者的病因。
IPAH和HPAH在临床和组织病理学上不能加以区分,HPAH有女性高发(男女比例约1∶2),发病年龄多样性等特点。范德堡大学和哥伦比亚大学的队列研究证实了HPAH的不完全外显特点,HPAH家庭成员患病的估测风险为10%。(50%的机率遗传致病基因突变,20%机率外显)。PAH家系研究揭示HPAH中BMPR2突变不完全外显的特点。这表明杂合基因突变还不足以完全导致该病外显。不完全外显的机制尚未明确,提示疾病显现与其他基因或环境相互作用有关。
BMPR2突变是多数HPAH的病因。到目前为止已报道300多种BMPR2突变。西方人群中70%~80%的FPAH患者和20%~40%的IPAH患者携带BMPR2基因突变。中国人群中BMPR2突变比例在HPAH和IPAH分别为53%和15%。BMPR2突变导致PAH主要分子机制是单倍剂量不足。单倍剂量不足是基因杂合突变引起蛋白质产物不足,不能维持正常生理功能需要,导致疾病表型发生。另外一种机制是突变引起BMPR2分子信号通路受损。PAH患者的肺血管局部内皮细胞和局部、远端平滑肌细胞呈现出单克隆细胞增殖,BMPR2信号通路可能是影响肺动脉内皮细胞单克隆增殖的原因。
BMP9是最新发现的IPAH致病基因。BMP9基因突变使IPAH发病风险上升22倍,可解释6.7%中国IPAH患者的遗传病因。BMP9突变的强烈致病性使其成为仅次于BMPR2排名第2的IPAH致病基因。
遗传性肺静脉闭塞病(PVOD)/肺毛细血管瘤(PCH)被认为是常染色体隐性遗传,基因测序显示EIF2AK4等位基因性突变存在几乎所有的家族PVOD/PCH患者及9%~25%的散发患者中。对于临床疑似PVOD/PCH,推荐进行遗传学检测。
(三)血管壁平滑肌细胞钾离子通道
K+通道是高度选择性的、允许K+跨膜转运的一种蛋白通道,共有四种K+通道,研究证实IPAH患者肺动脉平滑肌细胞存在钾通道功能障碍。
(四)免疫学机制
一部分IPAH患者有雷诺现象,而且抗核抗体及抗Ku抗体阳性,提示IPAH患者免疫系统可能有问题,部分IPAH患者的HLAⅡ型自身抗体阳性也支持此假设。
上述各种机制和因素可能互相影响、共同参与了IPAH的发病。
2018年WSPH肺高压的临床分类继续延续2015年ESC肺高压诊治指南的5大类框架。WSPH对第1大类PH进行了调整,增加具有血管反应性的PAH作为单独的一组(1.2)。大会将2015年ESC指南中临床分类的“肺静脉阻塞性疾病(PVOD)和/或肺毛细血管瘤(PCH)”及“新生儿持续性PH”修正到第1大类,各作为单独的一组疾病(1.6和1.7,表1)。
《中国肺高血压诊断和治疗指南2018》的临床分类沿用了2018年WSPH临床分类的推荐,见表1。
表1 肺高压的临床分类(2018年WSPH/《中国肺高血压诊断和治疗指南2018》)

注:EF.射血分数;VSD.室间隔缺损;HIV.人类获得性免疫缺陷病毒。
(一)心电图
肺动脉高压特征性的心电图改变有:①电轴右偏;②Ⅰ导联出现s波;③右心室肥厚高电压,右胸导联可出现ST-T波低平或倒置。其发生机制是由于肺动脉高压造成右心室肥厚,心包心肌张力增加影响心肌供血。肺动脉阻力增加越高,增高的时间越短,心电图反映心肌缺血的敏感性越高。
(二)胸部X线片
肺总动脉及肺门动脉影扩张,伴外周肺血管稀疏(“截断现象”),右心房右心室影扩大。还可发现原发性肺部疾病,胸膜疾病,心包钙化,或者心内分流性畸形可能,因为后者可出现肺血增多。但胸部X线平片正常并不能排除肺高血压。
(三)超声心动图
是筛选肺高压最重要的无创检查,各大指南推荐超声心动图作为一线的无创性辅助诊断检查以排查可疑的肺高压(1C)。更新后的超声心动图诊断肺高压的参考标准见表3。2018年WSPH及《中国肺高血压诊断和治疗指南2018》继续沿用该标准。其他超声心动图迹象见表4。
表3 ESC 2015年推荐的超声心动图诊断肺动脉高压的参考标准

表4 肺高压的其他超声心动图迹象

(四)右心导管检查与急性血管反应试验
右心导管检查,是诊断和评价肺高压的“金标准”。可提供右心室和肺动脉的血流动力学情况,排除左-右心内分流和其他严重的左心疾病,以帮助查找PAH的原因,并且可行急性血管扩张试验。测定的项目包括:上下腔静脉压、右心房压、右心室压、肺动脉压、肺小动脉楔压(均为收缩压、舒张压、平均压)、心排血量、肺血管阻力(PVR)和体循环阻力、动脉及混合静脉血氧饱和度。平均右心房压力升高和心指数降低是PAH患者生存的重要预测指标。通常情况下,PAWP低估左室舒张末期压力,右心导管测量还需计算跨肺压(TPG)和PVR。PVR>3Wood单位是诊断PAH的标准条件之一。舒张压力梯度(DPG)相对TPG很少受血流和充盈压的影响。对无心内或无大动脉分流患者,建议采用热稀释法测量心排血量,因为即使在低心排血量状态和/或严重三尖瓣反流患者中,该方法也可准确反映患者的实际心排血量。一般至少测定3次取均值。而对分流性先天性心脏病应采用Fick法测定肺循环(Qp)和体循环血流量(Qs)。
急性血管扩张试验是选择出适合长期钙通道阻滞剂(CCB)治疗患者的必要手段,推荐在有经验的专科中心完成。最新指南推荐在IPAH,HPAH,药物相关PAH患者行急性血管反应试验来指导CCB的应用。目前指南仍推荐吸入NO、静脉依前列醇作为试验用药,腺苷或是吸入伊洛前列素可作为试验用药选择。我国专家学者通过中国人群的临床研究结果推荐吸入伊洛前列素作为首选试验用药,腺苷为第二选择试验用药。指南推荐试验用药见表5。
表5 推荐急性血管反应试验应用方案

注:∗1ppm=1cm3/m3。
终止急性血管反应试验的指征:①体循环收缩压下降超过30%或低于85mmHg;②心率增加超过40%或大于100次/min;③心率低于60次/min并出现体循环低血压症状;④发生不可耐受的不良反应;⑤肺动脉压下降达到目标值;⑥血管扩张剂已应用至最大剂量。
急性血管反应实验的阳性标准:ESC于2004年制定的标准是:①mPAP达到≤40mmHg;②mPAP至少下降 10mmHg;③同时心排出量增加或不变。近年来一直延用该标准。
钙通道阻滞剂不能作为急性血管反应试验的药物。它对体循环的扩张作用强于对肺血管的作用,如果患者肺血管阻力固定,心排血量不能增加,可导致严重的低血压甚至猝死。
(五)肺功能评价
呼吸功能检查有助于发现潜在的肺实质或气道疾病。所有肺动脉高压患者初始检查应行包括一氧化碳弥散量(DLCO)检查的肺功能检查,了解有无换气功能障碍。大部分的PAH患者DLCO降低,低于45%预测值预后相对差。
(六)肺通气/灌注(V/Q)显像
对于不明原因的肺动脉高压的患者,建议行V/Q扫描,以排查慢性血栓栓塞引起的肺动脉高压。对于CTEPH筛查V/Q显像比CT肺动脉造影(CTPA)敏感度更高,因此是筛查CTEPH的重要手段。V/Q扫描正常可以基本排除 CTEPH,其敏感度 90%~100%,特异性94%~100%。在肺动脉慢性血栓栓塞时呈某一区域的放射活性减弱,急性栓塞呈现完整的灌注缺损。部分PAH和PVOD/PCH也可出现小的外周肺野节段性灌注缺失。
(七)睡眠监测
约有15%阻塞性睡眠障碍的患者会合并肺动脉高压,必要时可对肺动脉高压患者进行睡眠监测。
(八)胸部CT
胸部CT可提供关于心脏、血管、肺实质及纵隔病变的详细信息,主要用于PH病因诊断、肺血管介入影像学评估及评价预后。CT平扫发现以下征象提示PH可能:肺动脉直径≥29mm;主肺动脉直径/升主动脉直径比值≥1.0;大于3~4个亚段的肺动脉直径/支气管直径比值>1。胸部高分辨率CT检查着重了解有无肺间质病变、PVOD/PC。对于可疑慢性血栓栓塞引起的肺动脉高压患者,建议行CT肺动脉造影检查(CTPA)。
(九)肺动脉造影
指征:①临床怀疑有CTEPH而无创检查不能提供充分证据;②临床考虑为中心型CTEPH而有手术指征,术前需完成肺动脉造影以指导手术;③临床诊断患者为肺血管炎,需要了解患者肺血管受累程度。
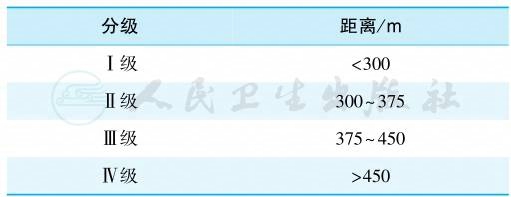
(十)6分钟步行距离试验(6-minute walk test)
是评价慢性心力衰竭患者心功能的重要指标之一。1993年Bittner根据病情将6分钟步行试验的结果分为4级(表6)。
表6 6分钟步行试验结果的分级
(十一)心脏MRI检查(CMR)
心脏磁共振是目前无创评价右心大小、形态和功能的“金标准”,具有较高的可重复性,可无创评估血流动力学状态、估测右心室每搏量、心排血量、肺动脉弹性和右心室质量。CMR也可用于评价肺高血压患者病情严重程度及治疗效果。并且对可疑的先天性心脏病也能协助提供更多的诊断信息。对于疑诊肺动脉阻塞性疾病患者,注射对比剂或无对比剂磁共振肺动脉造影都具有一定诊断价值,尤其适合一些临床特殊情况,如孕妇、肾功能不全或对含碘对比剂过敏患者。
以目标为导向的精准化治疗,尽早及尽可能地把所有PAH患者控制并维持在低危状态。第一步基本治疗,包括一般治疗,支持治疗,转诊肺高压专科中心,行急性血管反应试验明确是否有CCB治疗的适应证。第二步,对于血管反应试验阳性的患者给予高剂量的CCB治疗,急性血管反应试验阴性根据患者风险评估选择已经批准的PAH靶向药物,尽早启动靶向药物联合治疗。第三步,药物治疗无反应,考虑肺移植。
在2015年ESC肺高压指南,对于部分低危和所有中危患者,靶向药物序贯联合治疗和起始联合治疗是同等力度的推荐,WHO功能分级Ⅱ级即可启动联合治疗。2018年WSPH及《中国肺高血压诊断和治疗指南2018》基于循证医学依据进一步在中低危患者推进起始联合治疗:强调除了7类可以初始单药治疗的人群之外均推荐初始联合治疗。优化的治疗流程见图3。
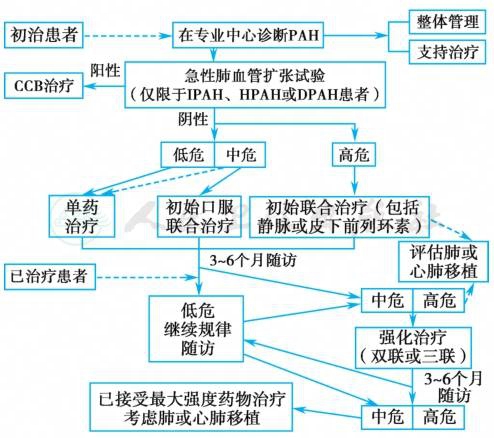
图3 肺动脉高压(PAH)优化的治疗疗程
CCB.钙离子拮抗剂;PAH.肺动脉高压;IPAH.特发性肺动脉高压;HPAH.遗传性肺动脉高压;DPAN.药物相关肺动脉高压。
七类推荐单药治疗的PAH患者:①急性血管扩张试验阳性的WHO功能分级Ⅰ/Ⅱ级IPAH/HPAH/DPAH且仅CCB治疗至少1年后持续血流动力学改善的患者。②长期(>5~10年)单药治疗,且稳定低危状态的患者。③>75岁的IPAH患者,存在多种心力衰竭风险因素(高血压、糖尿病、冠状动脉疾病、房颤、肥胖)且左室射血分数保持不变。④疑似或高度疑似肺静脉闭塞病或肺毛细血管瘤的PAH患者。⑤与HIV感染或门脉高压或未修复先天性心脏病相关的PAH患者。⑥极轻度PAH患者(如WHO功能分级Ⅰ级、PVR 3~4Wood单位、mPAP<30mmHg、超声心动图显示右心正常)。⑦联合治疗不适用或存在禁忌(如严重肝病)。
(一)基本治疗
基本治疗包括一般治疗和支持治疗。一般治疗包括体力活动及专业指导的康复锻炼,避免妊娠,计划生育,绝经后的激素治疗,择期外科手术的注意事项,预防感染,社会心理支持,治疗配合性,遗传咨询和旅行注意事项,对一般治疗的建议见表8。
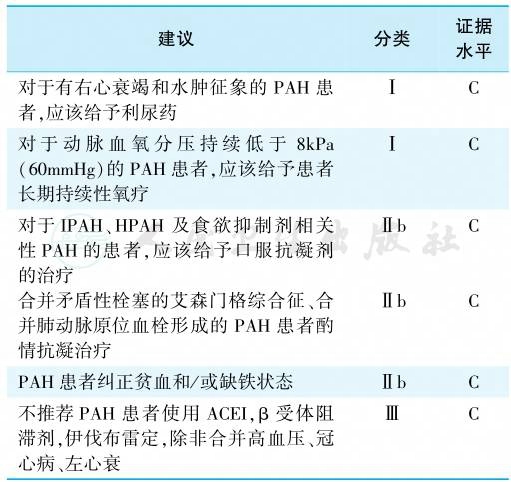
支持治疗主要包括吸氧、利尿药、地高辛和口服抗凝药物等。主要是针对右心功能不全和肺动脉原位血栓形成。对支持治疗建议见表9。外科和心内介入治疗则主要为先天性心脏病患者进行封堵、修补或矫治术。
1.氧疗
肺动脉高压患者吸氧治疗的指征是动脉血氧饱和度低于91%或动脉血氧分压<60mmHg,使得血氧饱和度>92%。先天性体-肺分流性心脏病相关肺动脉高压则无此限制,若艾森门格综合征患者吸氧后氧饱和度上升5%,则建议其吸氧。
表8 《中国肺高血压诊断和治疗指南2018》对一般治疗的建议
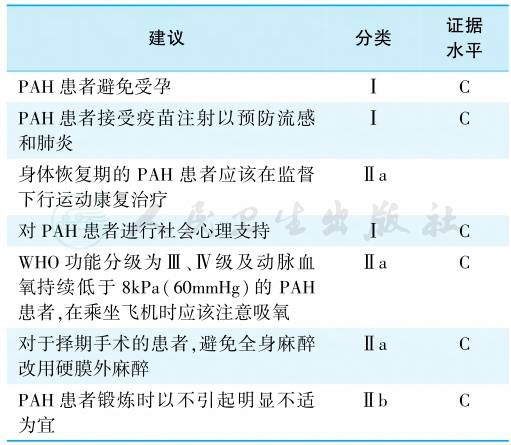
注:PAH.肺动脉高压。
表9 《中国肺高血压诊断和治疗指南2018》对支持治疗的建议
注:PAH.肺动脉高压;IPAH.特发性肺动脉高压;HAPH.遗传性肺动脉高压;ACEI.血管紧张素转化酶抑制剂。
2.利尿药
对于合并右心功能不全或是水肿有水钠储留的肺动脉高压患者,应给予利尿药。常用利尿剂包括襻利尿剂和醛固酮受体拮抗剂。运用期间应密切监测血钾,并注意患者血压及有效血容量情况。
3.地高辛及其他心血管药物
心排血量低于4L/min,或者心指数低于2.5L/(min•m2)是应用地高辛的绝对指征;另外,右心室明显扩张、基础心率大于100次/min、心室率偏快的心房颤动等均是应用地高辛的指征。地高辛可改善PAH患者心排血量,但长期疗效尚不清楚。除左心疾病所致肺高血压外,不建议对其他类型肺高血压患者应用血管紧张素转化酶抑制剂(ACEI)血管紧张素Ⅱ受体拮抗剂(ARB)、β受体阻滞剂、硝酸酯类药物和伊伐布雷定等药物。特殊情况需应用时应严密监测患者血压、心率和症状,避免PAH靶向药物和上述药物合用产生严重不良反应。
4.口服抗凝药
CTEPH患者终生抗凝。建议 IPAH、HPAH和减肥药相关PAH患者口服抗凝。对于存在肺动脉血栓或矛盾性栓塞的艾森门格综合征患者,在无明显咯血的情况下,可考虑口服抗凝剂。口服华法林,一般使国际标准化比值(INR)控制在2~3之间。新型口服抗凝药的治疗效果尚不明确。
5.铁剂
缺铁在PAH患者中较为普遍,其可使PAH患者运动耐量下降,病死率增加,并且这种铁缺乏与贫血无关。铁缺乏患者可考虑铁替代治疗,推荐静脉注射铁剂。
6.多巴酚丁胺
是重度右心衰竭(心功能Ⅳ级)和急性右心衰竭患者首选的正性肌力药物,主要作用于β1受体,对β2及α受体作用相对较小,直接激动心脏β1受体以增强心肌收缩和增加搏出量,使心排血量增加。一般起始剂量为2.5~10μg/(kg•min),可逐渐加量到 15μg/(kg•min)。 当>15μg/(kg•min)时,需注意过大剂量仍然有可能加速心率并产生心律失常。
(二)钙通道阻滞剂(CCB)
用于治疗轻度功能性PAH患者的一线用药,仅限于急性血管扩张试验阳性患者。急性血管扩张试验阳性PAH患者长期用CCB治疗5年生存率为97%。对于WHO分级Ⅰ级或是Ⅱ级的IPAH,HPAH和DPAH患者急性血管反应试验阳性的在用药后伴有明显的血流动力学改善或接近正常,建议持续应用高剂量的CCB(ⅠC)。在采用CCB治疗3个月后,应对患者进行密切随访再评估(包括右心导管)(ⅠC)。
CCB特别是选择性低的CCB具有显著的心脏负性肌力作用,可致显著的低血压。指南推荐高剂量使用CCB,鉴于PAH患者多数血压不高或是偏低,建议CCB的剂量逐渐滴定,防止低血压发生。常用的CCB有硝苯地平、地尔硫䓬、氨氯地平等,维拉帕米可能增加IPAH猝死率故禁用。
(三)PAH靶向药物
靶向药物联合治疗的推荐见图4。
(四)右心辅助装置
肺高血压合并严重右心衰竭且药物治疗效果不佳时可考虑使用体外膜肺氧合(ECMO)进行救治,但需提前明确下一步治疗方向,过渡到恢复或是过渡到肺移植或心肺联合移植。建议ECMO仅用于明确有恢复机会或等待移植的患者。
(五)心房间隔造口术
足够剂量使用上述靶向药物联合治疗之后,患者仍无明显好转,即可推荐患者进行房间隔造口术。房间隔造口术目前仍然是作为肺移植前的过渡治疗方法。禁忌证:右心房压力>20mmHg,静息状态动脉血氧饱和度<90%。
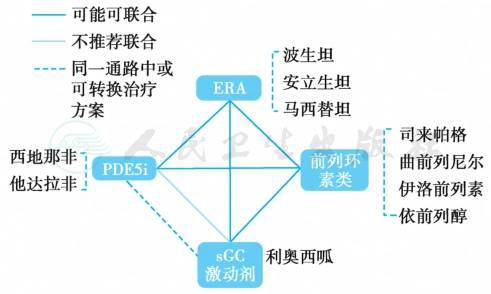
图4 靶向药物联合治疗的推荐
ERA.内皮素受体拮抗剂;PDE5i.磷酸二酯酶5抑制剂;sGC.可溶性鸟苷酸环化酶。
(六)肺或心肺联合移植
单侧肺移植、双肺移植、活体肺叶移植及心肺移植已在国外成熟应用于肺动脉高压患者的治疗,目前国内也在积极开展。主要指征:已充分内科治疗而无明显疗效的患者。肺移植技术明显延长了这些患者的寿命和生活质量。
(七)肺动脉去神经术
我国研究者开展了一系列经皮肺动脉去神经术治疗肺高压患者的临床试验,发现部分患者心功能和血流动力学参数有所改善。
(八)基因治疗
国外有成功报道,但是距离临床推广使用尚远。













