英文名称 :cardiac arrhythmia
心脏不断规律、协调地进行收缩和舒张交替活动是心脏实现泵血功能、推动血液循环的必要条件,而这些机械活动均由心脏的电活动所激发。心脏的电活动起源于窦房结,后者的冲动先扩布到右、左心房,然后到达房室结,再沿房室束及左右束支、浦肯野纤维网传导激动心室肌,使得心房和心室顺序收缩和舒张。凡由于心脏内冲动的发生与传播不正常而使整个心脏或其一部分的活动变为过快、过慢或不规则,或者各部分活动的顺序发生紊乱时,即形成心律失常(cardiac arrhythmia)。
可分为遗传性和后天获得性。
遗传性心律失常多为基因突变导致的离子通道病,使得离子流发生异常。目前已经明确的遗传性心律失常有长QT间期综合征、短QT间期综合征、Brugada综合征、儿茶酚胺敏感性室性心动过速、早期复极综合征等,另有一部分心房颤动、预激综合征患者也发现了基因突变位点。另外,进行性心脏传导疾病、肥厚型心肌病、致心律失常性心肌病和左室致密化不全等心肌病也被认为与遗传有关。2019年中国《单基因遗传心血管病基因诊断指南》指出对于临床上确定或者怀疑遗传性心律失常疾病为病因的SCD患者或幸存者及其直系亲属,应加强离子通道病和心肌病基因检测,并在专业临床中心接受评估。
后天获得性心律失常中,病因又可分为心脏本身、全身性和其他器官障碍的因素。心脏本身的因素主要为各种器质性心脏病,包括冠心病、高血压心脏病、风湿性心脏病、瓣膜病、心肌病、心肌炎等。全身性因素包括药物毒性作用、各种原因的酸碱失衡及电解质紊乱、神经与体液调节功能失调等。心脏以外的其他器官在发生功能性或结构性改变时亦可诱发心律失常,如甲状腺功能亢进等。此外,胸部手术、麻醉过程、心导管检查及各种心脏介入性治疗等均可诱发心律失常。在健康人群中的心律失常也不少见,部分心律失常病因不明。
心律失常按其发生原理可分为冲动起源异常和冲动传导异常两大类:
(一)冲动起源异常
1.冲动自窦房结发出
①窦性心动过速;②窦性心动过缓;③窦性心律不齐;④窦性停搏。
2.冲动自异位节律点发出
(1)被动性异位心律
①房性逸搏及心房自搏心律;②房室交界性逸搏及房室交界性自搏心律;③室性逸搏及心室自搏心律。
(2)主动性异位心律
①期前收缩(分为窦房结性、房性、房室交界性、室性);②阵发性心动过速(分为室上性和室性);③非阵发性心动过速(分为房性、房室交界性和室性);④扑动(分为心房扑动和心室扑动);⑤颤动(分为心房颤动和心室颤动)。
(二)冲动传导异常
1.干扰及干扰性房室分离
2.心脏传导阻滞
(1)窦房传导阻滞。
(2)房内及房间传导阻滞。
(3)房室传导阻滞:①一度房室传导阻滞(P-R间期延长);②二度房室传导阻滞(不完全性房室传导阻滞);③三度房室传导阻滞(完全性房室传导阻滞)。
(4)室内传导阻滞:①左束支阻滞(不完全性、完全性);②右束支阻滞(不完全性、完全性);③分支阻滞(左前分支阻滞、左后分支阻滞)。
3.各种异常旁路参与传导
如预激综合征。
(三)冲动起源异常与冲动传导异常并存
反复心律和并行心律等。
(四)人工心脏起搏参与的心律
包括DDD(R)和VVI(R)起搏器所具有的时间周期、起搏、感知与自身心律的相互影响等。
(一)心脏的传导系统解剖
心肌按其组织结构和功能特点可粗略地分为两大类型:一类是普通的心肌细胞,占心肌组织的大部分,具有兴奋性和传导性。另一类是特殊分化了的心肌细胞,组成心脏的特殊传导系统,它们除具有兴奋性和传导性之外,还具有自动产生节律性兴奋的能力,故又称为自律细胞。心脏特殊传导系统主要包括窦房结(sino-atrial node,SAN)、房室交界(又称房室结区,atrio-ventricular node,AVN)、房室束(又称希氏束,His bundle)、左右束支及其分支,以及浦肯野纤维网。窦房结位于右心房与上腔静脉交界处的前外侧,是控制心脏正常活动的起搏点;房室结区(房室交界)位于冠状静脉窦和三尖瓣环之间,Koch三角区内,向前上延续成房室束,其从房室结延伸出后,穿过中央纤维体(穿行部),越过房室环,走行于膜部室间隔的后缘,至肌部室间隔的顶部先分出左束支(left bundle branch,LBB)的后分支,再分出左束支的前分支(此段称为分叉部),本身延续成右束支。左束支后分支粗短,呈扇形分支,左束支前分支和右束支细长。两侧束支于心内膜下走向心尖方向并再分支,互相交织成网状,并垂直向心外膜侧延伸,称为浦肯野纤维网,深入心室肌内(图1)。
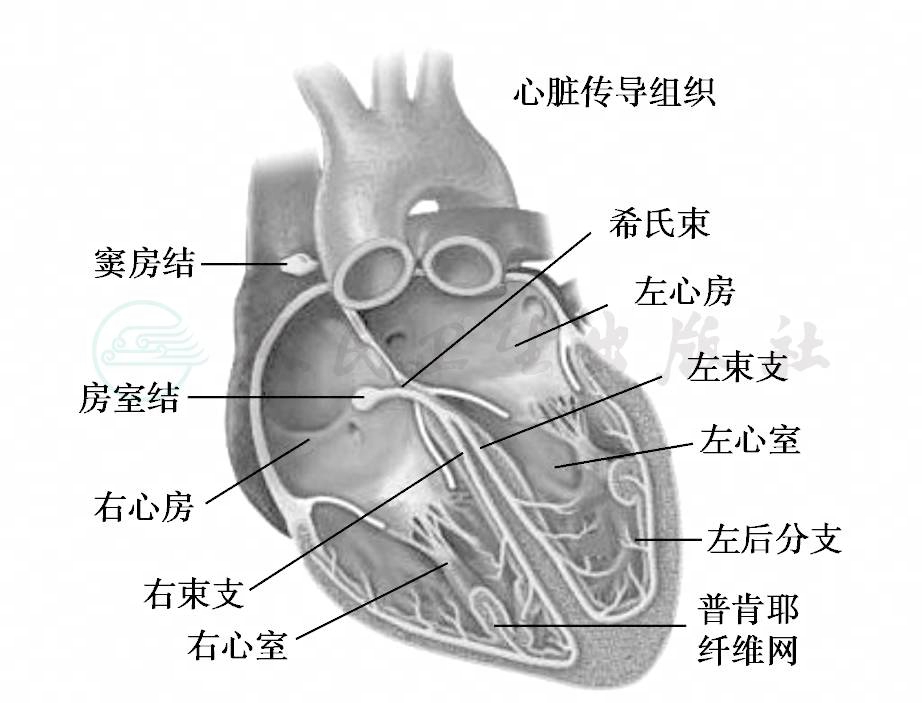
图1 心脏传导系统解剖示意
窦房结主要含有P细胞和过渡细胞。P细胞是自律细胞,位于窦房结中心部分;过渡细胞位于周边部分,不具有自律性。房室结区是心房和心室之间的特殊传导组织,是心房兴奋传入心室的通道,它主要包括以下三个功能区域:房结区、结区和结希区。房结区和结希区都具有传导性和自律性;而结区仅有传导性,无自律性,激动传导在结区延迟最明显。窦房结、房室结和房室束主干多由右冠状动脉供血。房室束分支部分、左前分支和右束支血供来自左冠状动脉前降支,而左后分支则由左冠状动脉回旋支和右冠状动脉供血。
(二)心肌细胞的电生理基础
心肌细胞电生理基础为经心肌细胞膜的跨膜离子流。
1.膜内外离子浓度差
心肌细胞膜上有离子通道,每一种通道只允许一种或数种离子通过,即所谓选择通透性。心肌细胞膜的选择通透性能使细胞膜内外各种离子浓度存在差别,如心肌细胞膜内钠、钙离子浓度远低于膜外,而钾离子浓度则远较膜外高,形成膜内外不同离子的浓度差,因而也使膜内外保持一定的电位差。离子的跨膜转运称为离子流(ion current)。外向电流导致膜内电位向负电性转化,促使膜复极;内向电流导致膜内电位向正电性转化,促使膜除极。离子是否能跨膜转运取决于相应的离子通道是否开放及其开放的程度。
2.离子通道
心肌细胞膜上的离子通道有两大类:由跨膜电位决定的电压门控通道(voltage-gated channel)及由各种化学物质(如各种受体的配体)决定的化学门控通道(chemicallygated channel)。在动作电位发生机制中,电压门控通道起主要作用,神经体液介质则可改变化学门控通道的通透性。
3.膜电位
心肌细胞膜的内外存在一定的电位差,称为跨膜电位(transmembrane potential)或膜电位。细胞膜内电位较膜外为负的现象,称为极化。非自律细胞处于静息状态时,外流和内流的离子所携带的总的电荷量是相等的,因此膜电位是稳定的;而自律细胞到达最大复极电位后,膜电位并不稳定于这一水平,随着自动除极的进行,膜电位逐渐衰减。
4.动作电位
心肌细胞兴奋过程中产生除极和复极的一系列电位变化称为动作电位。按照动作电位特征,可将心肌细胞分为快反应细胞和慢反应细胞。前者包括心房、心室肌(非自律细胞)和浦肯野细胞(自律细胞),后者包括窦房结和房室结的结区细胞。快反应细胞的动作电位振幅大、除极迅速,复极缓慢,传导兴奋的速度快;慢反应细胞动作电位振幅小,除极缓慢,传导兴奋的速度慢。
根据心肌细胞动作电位特征将其分为5期:0期(除极),1、2、3期(复极)和4期(静息或电舒张期)(图2)。

图2 心肌细胞的动作电位、不应期(左)和膜反应曲线(右)
(1)0期
又称除极相,心肌细胞受阈值刺激(阈电位,threshold potential,TP)兴奋时发生除极,膜内电位由静息电位迅速上升。对于心室肌等快反应细胞而言,0期去极化是由于细胞膜上的快钠通道开放、Na+快速内流引起;而窦房结P细胞则由于细胞膜上的慢钙通道开放,Ca2+的缓慢内流形成,故P细胞属于慢反应细胞。
(2)1期
又称快速复极初期,由钾外流形成,历时10毫秒,膜电位由+30mV迅速下降至0mV左右。
(3)2期
又称平台期(plateau),由慢钙内流和缓慢钾外流平衡形成,维持膜电位接近0mV。此期持续约100~150毫秒,是心肌动作电位持续时间长的主要原因。窦房结P细胞没有明显的1期和2期。
(4)3期
又称快速复极末期,随着复极化过程的进行,再生性外向钾流随时间递增,此时慢钙通道失活,内向离子流减弱至终止,膜内电位由0mV左右较快地下降至静息电位水平,完成复极化过程,占时约100~150毫秒。
自0期起始至3期结束所需时限称为动作电位时限(action potential duration,APD)。在复极化过程的大部分时间中,心肌细胞不能被新的刺激激活,这也是产生不应期(refractory period)的原因。
(5)4期
在心室肌细胞或其他非自律细胞,4期膜电位稳定在-90mV左右的静息电位水平,由外向背景钾流维持。自律细胞在4期开始缓慢自动除极(舒张期除极),达到阈电位水平时则诱发产生一个动作电位。钾外流随时间的进行性衰减是窦房结P细胞4期除极的最重要的离子基础。
慢反应细胞(窦房结和房室结的结区细胞)动作电位曲线与其他部位不同:0期除极缓慢、振幅低,1、2、3期分期不明显,4期自动除极斜率大,动作电位时限短(无明显平台期)(图3)。慢反应细胞自律性较高,传导性能差,易发生传导障碍;快反应细胞则传导性能可靠。
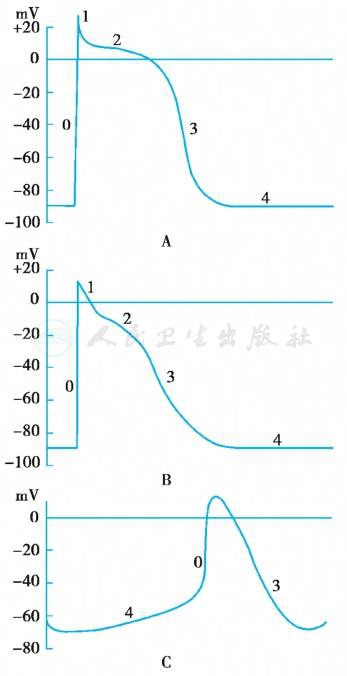
图3 不同心肌细胞动作电位曲线
A.心室肌细胞(快反应细胞)的动作电位曲线;B.心房肌细胞(快反应细胞)的动作电位曲线;C.窦房结细胞(慢反应细胞)的动作电位曲线。
随着心肌细胞电生理研究的深入,对心肌细胞膜的离子通道及其离子流的作用又提出一些新概念,分子生物学和遗传性疾病研究了解到了与离子通道相关的一些基因,如SCN5A(hH1)为编码INa的基因等。
(三)心肌细胞的电生理特性
心肌细胞有自律性、兴奋性、传导性和收缩性,前三者与心律失常关系密切。
1.自律性(automaticity)
具有自律性的心肌细胞包括窦房结、房室交界、希氏束和浦肯野系统的细胞。自动节律的频率(起搏频率)取决于最大舒张期膜电位水平、阈电位水平和4期自动除极速率三个因素,其中4期自动除极速率对其影响最大(图4)。窦房结细胞的起搏频率最高,约100次/min,房室交界细胞的起搏频率为40~50次/min,浦肯野细胞为30次/min。因此,窦房结是控制正常心脏活动的起搏点(最高起搏点),它所引起的心脏搏动节律称为窦性节律(sinus rhythm),其他部位的自律细胞称为潜在起搏点(latent pacemaker),所引起的心脏搏动节律称为异位节律(ectopic rhythm)。
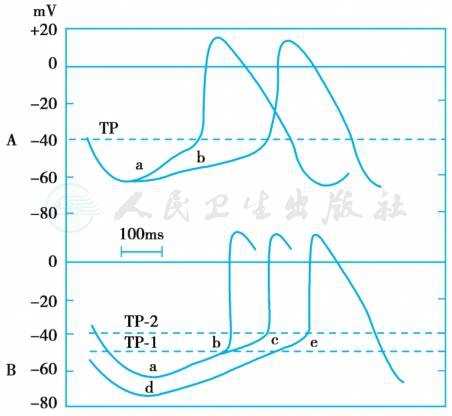
图4 影响自律性的因素
A.4期自动除极速率由a→b,自律性降低,起搏频率减慢;B.阈电位负值减小(由TP-1→TP-2)和/或舒张期最大复极电位负值增大(由a→d),自律性降低,起搏频率减慢。TP.阈电位水平。
2.兴奋性(excitability)
心肌的兴奋性是指心肌具有对刺激产生反应的能力,又称为应激性,能引起动作电位的最低强度的刺激称为阈值刺激。心肌细胞的兴奋性受下列因素影响:
(1)膜电位
在一个心电周期中,从0期除极到3期复极化至-60mV前,无论多强的刺激也不能产生新的动作电位,称为有效不应期(effective refractory period)。从有效不应期完毕(膜内电位约-60mV)至复极化基本完成(-80mV)这一时间,称为相对不应期(relative refractory period)。当膜内电位由-80mV恢复至-90mV这一时段内,低于阈值的刺激亦可引起细胞兴奋,即超常期,然后兴奋性恢复正常。此外,在相对不应期开始初有一个短暂的时间,在此期间应用较强的刺激容易诱发出心脏的纤维性颤动,称易损期(vulnerable period)。心率缓慢、低钾血症和Ⅲ类抗心律失常药物作用都可使动作电位时限延长,不应期也相应延长。
(2)膜反应性
不同膜电位时心肌细胞的除极反应,称为膜反应性,可用膜反应曲线表示(图2)。心肌细胞0期除极速度快且振幅高者,膜反应性强,兴奋性高;反之,则膜反应性弱,兴奋性低。
(3)静息电位和阈电位间差距
静息电位和阈电位之间差距越小,心肌的兴奋性就越高,反之亦反。
3.传导性(conductivity)
影响传导性能的主要因素:①动作电位0期除极的速度和幅度:速度越快或幅度越大,传导速度就越快。②邻近未兴奋细胞膜的兴奋性。③心肌纤维的物理性能:直径大的细胞、心肌纤维走向和结构一致者,传导速度快。浦肯野纤维传导速度最快(4 000mm/s);房室结区细胞传导速度最慢(20~200mm/s)。然而冲动在房室交界延搁一段时间(房室延搁)具有重要生理意义,即允许血液从心房进入心室,使心室有足够的时间充分接纳血液。
支配心脏的神经是交感神经和副交感神经。心交感神经节后纤维组成心脏神经丛,支配心脏各个部分,其节后纤维末梢释放去甲肾上腺素,可导致窦房结和异位起搏点自律性增高,冲动传导加快,心肌收缩力加强。支配心脏的副交感神经是迷走神经,节后神经纤维支配窦房结、心房肌、房室交界、房室束及其分支。迷走神经末梢释放乙酰胆碱,可降低窦房结自律性、延长房室交界不应期、缩短心房不应期等。自主神经在多种心律失常的发生中起着重要作用。
心律失常分类繁多。按其发生原理可分为冲动起源异常和冲动传导异常两大类;按起源部位则可分为窦性、房性、房室交界性和室性心律失常,常可归纳为室上性和室性心律失常。按心律失常时心率的快慢可分为快速型和缓慢型心律失常。有些学者还提出按心律失常时血流动力学是否稳定、循环障碍的严重程度和预后,将心律失常分为良性和恶性两大类,或分为致命性、潜在致命性和良性三类。以上分类方法分别或联合应用,有助于依据心律失常的不同发生原理、频率及其严重程度,指导医师选择适时而恰当的治疗。
(一)冲动起源异常
1.冲动自窦房结发出
①窦性心动过速;②窦性心动过缓;③窦性心律不齐;④窦性停搏。
2.冲动自异位节律点发出
(1)被动性异位心律
①房性逸搏及心房逸搏心律;②房室交界性逸搏及房室交界性逸搏心律;③室性逸搏及心室逸搏心律。
(2)主动性异位心律
①期前收缩(分为窦房结性、房性、房室交界性、室性);②阵发性心动过速(分为室上性和室性);③非阵发性心动过速(分为房性、房室交界性和室性);④扑动(分为心房扑动和心室扑动);⑤颤动(分为心房颤动和心室颤动)。
(二)冲动传导异常
1.干扰及干扰性房室分离
2.心脏传导阻滞
(1)窦房传导阻滞。
(2)房内及房间传导阻滞。
(3)房室传导阻滞:①一度房室传导阻滞(PR间期延长);②二度房室传导阻滞(不完全性房室传导阻滞);③三度房室传导阻滞(完全性房室传导阻滞)。
(4)室内传导阻滞:①左束支阻滞(不完全性、完全性);②右束支阻滞(不完全性、完全性);③分支阻滞(左前分支阻滞、左后分支阻滞)。
(5)各种异常旁路参与传导:如预激综合征。
(三)冲动起源异常与冲动传导异常并存
反复心律和并行心律等。
(四)人工心脏起搏参与的心律
为DDD(R)和VVI(R)起搏器所具有的算法与自身心律的相互影响所致。
心律失常是否需要治疗取决于患者有无相关症状及基础心脏疾病。其治疗包括病因治疗、发作时心律失常的控制与预防复发、去除病灶和改良基质等。
心律失常从无症状到立即致死,临床表现多样。针对危及生命的恶性室性心律失常,如心室颤动/扑动、影响血流动力学的持续室性心动过速/房颤伴旁道下传等,应立即采取电复律等紧急措施;而针对不影响血流动力学/无症状/无明确器质性心脏病的患者,应主要针对原发疾病而非心律失常本身治疗。
主要包括药物和非药物治疗方法,当然,对于常见的期前收缩等,解释期前收缩的良性预后,避免紧张及过度关注等也是非常重要的治疗方法。
(一)药物治疗
传统上,心律失常采用药物治疗。药物治疗缓慢性心律失常一般选用增强心肌自律性和/或加速传导的药物,如拟交感神经药(异丙肾上腺素等)和迷走神经抑制药(阿托品等),但存在副作用及疗效不肯定等弊端。终止和预防快速性心律失常发作可选用各种抗心律失常药物,其基本电生理作用是影响心肌细胞膜的离子通道,通过改变离子流而改变细胞的电生理特性。
目前抗心律失常药物广泛使用的仍然是20世纪60年代的Vaugham Williams分类法。
实际上,与其他心力衰竭、高血压等药物治疗的迅速发展不同,抗心律失常药物的发展明显滞后。国内目前可应用的抗心律失常药物屈指可数,有些曾经广泛使用的“老药”如Ⅰa类药物已基本淘汰或无药,因此可供医师选择的药物并不多。然而科学家们始终未停止过探索和开发新的抗心律失常药物。初见成效的药物有:①多通道阻滞剂,如胺碘酮的同类药决奈达隆(dronedarone)已被FDA批准用于房颤治疗;②心房选择性多通道阻滞剂,如维纳卡兰(vernakalant)被FDA批准用于房颤治疗;③晚钠电流(INaL)抑制剂,如雷诺嗪被FDA批准用于心绞痛治疗,同时具有抗房颤和抗室速作用;④选择性起搏电流(If)抑制剂,如伊伐布雷定(ivabradine)可用于减慢窦性心率;⑤单纯的钾离子通道阻滞剂,尼非卡兰(nifekalant)用于其他药物无效或不能使用情况下危及生命的室速、室颤。
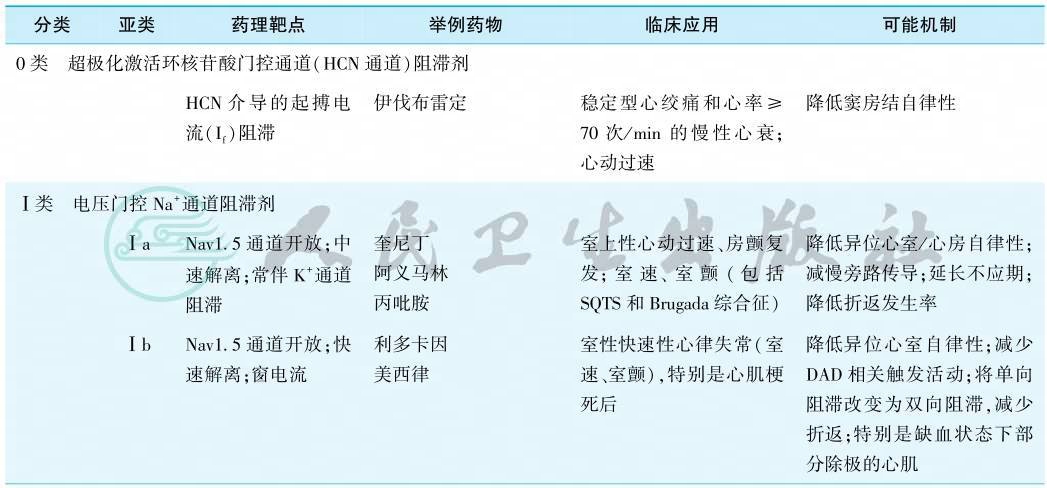
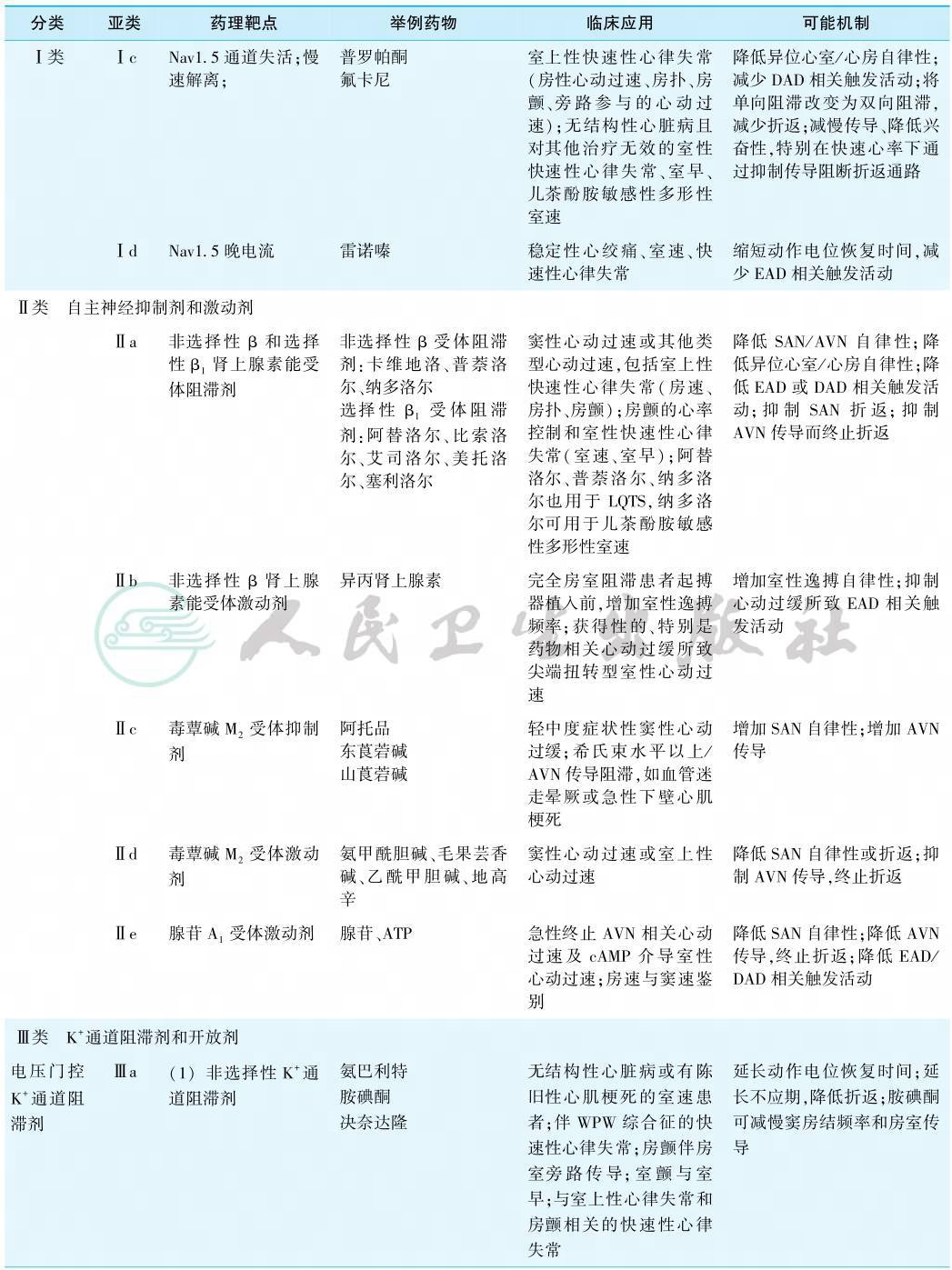
按照经典的Vaugham Williams分类法,很多抗心律失常药物已经不能被归类。有鉴于此,2018年中英科学家联合提出了抗心律失常药物的最新分类系统,总结了目前已知和潜在抗心律失常药物的最新、最全面的分类,充实并扩展了药物的范围,并且保留了广泛接受的经典Vaughan Williams分类的原有架构和简便易行的特征。首先,其增加了0类——HCN通道阻滞剂(伊伐布雷定)、Ⅴ类——机械敏感性通道阻滞剂、Ⅵ类——缝隙连接通道阻滞剂、Ⅶ类——上游靶点调节器等类别。同时新的分类系统对原有的四类药物进行了更新和细化:①在Ⅰ类原有的三个亚类的基础上,新增了Ⅰd类(晚钠电流阻滞剂——雷诺嗪);②将Ⅱ类重新定义为自主神经的抑制剂和激活剂,具体分为Ⅱa类(非选择性β和选择性β1肾上腺素能受体阻滞剂)、Ⅱb类(非选择性β肾上腺素能受体激动剂)、Ⅱc类(毒蕈碱M2受体抑制剂),Ⅱd类(毒蕈碱M2受体激动剂);③将Ⅲ类定义为钾通道抑制剂和开放剂,除了原有的非选择性钾通道阻滞剂(如胺碘酮),选择性IKr阻滞剂(如多非利特)外,还新增了IKs、IKur(维那卡兰)、Ito(替地沙米),IKATP(尼可地尔)、IKACh(BMS914392)等钾通道的相关药物;④Ⅳ类被界定为Ca2+稳态相关的分子靶点药。现将新的抗心律失常药物分类系统、作用靶点及临床应用归纳于表1。
表1 抗心律失常药物现代分类系统
续表
续表

续表
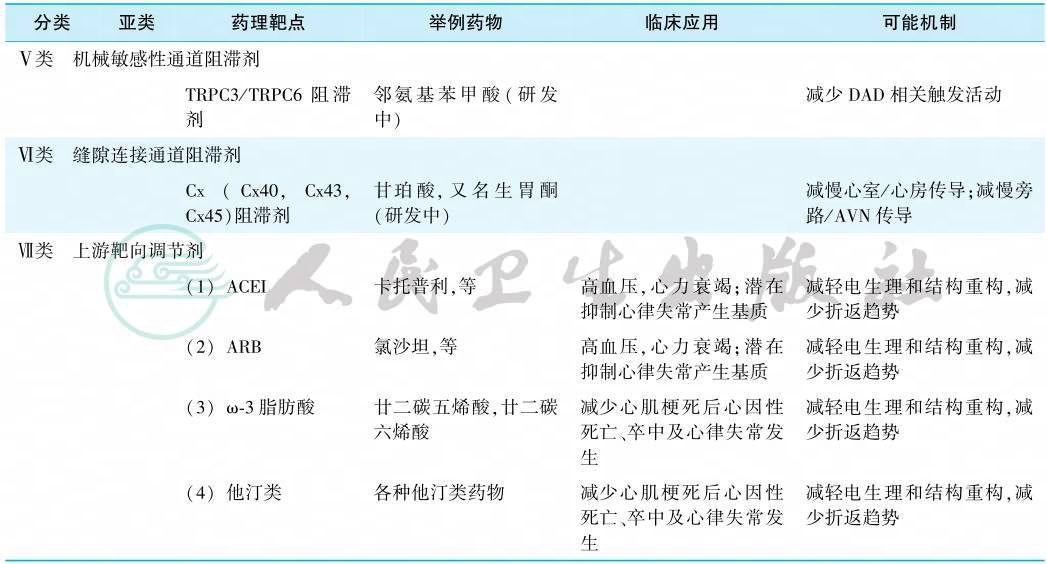
值得注意的是,严重心力衰竭、心源性休克,严重肝肾功能损害,严重窦房结功能障碍,二度或三度房室传导阻滞及双分支阻滞等均为上述抗心律失常药物的禁忌证(除了Ⅶ类上游靶点调节剂的应用不受缓慢型心律失常限制)。此外,某些药物尚有其特有的禁忌证,如β受体阻滞剂禁用于末梢循环灌注不良、严重的周围血管疾病、支气管哮喘及严重的慢性阻塞性肺疾病患者;胺碘酮则慎用于有甲状腺功能异常史或已有功能异常、碘过敏、QT间期延长者。另外,由于负性肌力等原因,心功能不全患者的抗心律失常药物通常只能选择Ⅱ类和胺碘酮,而急性心肌梗死患者禁用Ⅰc类药物。
循证医学证据表明,任何抗心律失常药物均可能存在致心律失常作用,对于多数快速性心律失常长期应用抗心律失常药物治疗虽然可改善患者的症状,但并未改善其预后。几乎所有的抗心律失常药物都不能增加患者生存率,有时甚至还可增加患者的死亡率。心肌受损范围愈大和/或心功能损害程度愈严重,抗心律失常药物成功预防心律失常复发的可能性愈小。因此,一般而言,无器质性心脏病基础,有无明显相关症状的“良性”心律失常,诸如期前收缩等,无须特殊治疗。只有对于症状严重者方可考虑应用抗心律失常药物。
对于房颤患者,尚需根据CHA2DS2-VASc评分进行栓塞风险评估,对于卒中高危患者给予抗凝治疗。新型口服抗凝药物(如达比加群、利伐沙班、阿哌沙班、艾多沙班)已被推荐替代华法林用于非瓣膜病房颤的抗凝治疗,且其适用范围正在逐步扩大。在一些合并特殊临床事件(如因ACS行冠状动脉支架置入术后),采用氯吡格雷联合低剂量利伐沙班(15mg,每日1次)或达比加群(150mg,每日2次)双联治疗可相对三联治疗减少出血风险。目前,新型口服抗凝药已具备了特异性拮抗剂。当存在致命性出血或需要行紧急操作时,可应用idarucizumab对达比加群逆转药效(Ⅰ类推荐),应用andexaneralfa对利伐沙班或阿哌沙班逆转药效(Ⅱa类推荐)。由于新型口服抗凝药主要经过肾脏代谢,需根据肾功能调整药物剂量。
(二)非药物治疗
反射性兴奋迷走神经方法(压迫眼球、按摩颈动脉窦、捏鼻用力呼气和屏气等)可用于终止多数阵发性室上性心动过速,可在药物治疗前或同时采用。
电复律及电除颤疗效迅速、安全可靠,对于血流动力学不稳定的各种快速室上性和室性心律失常,电复律应为首选治疗方式,但不能防止复发。
心脏起搏器是治疗缓慢型心律失常的唯一可靠方法,用于治疗症状性心动过缓。近年来随着起搏器技术的不断发展,其适应证亦在不断拓宽,包括双心室同步起搏治疗(CRT)心力衰竭、应用特殊起搏模式治疗血管迷走性晕厥、双腔起搏纠正梗阻性肥厚型心肌病的血流动力学障碍等。长使用寿命(13年左右)、MRI兼容和远程监测的起搏器都已在国内广泛应用,无导线起搏器也已在国内开展,后者避免了起搏导线及囊袋的潜在并发症。
植入型心律转复除颤器(ICD)可有效降低心脏性猝死(SCD)的死亡率,疗效显著优于抗心律失常药物,包括二级和一级预防。但国内ICD的应用,尤其是一级预防远远不足,今后应加强这方面的工作。目前全皮下ICD(S-ICD)也在国内开始应用,在保证除颤疗效的前提下避免了除颤导线可能产生的并发症,只是目前尚不能应用于需要心脏起搏或抗心动过速起搏治疗及双室同步起搏的患者。
对于恶性室性心律失常应重在管理。2015年ESC及2017年AHA/ACC/HRS版《室性心律失常管理和心源性猝死预防指南》重点关注内容为SCD的预防。建议所有的急性心肌梗死患者早期(出院前)评估左室射血分数(LVEF),在心肌梗死后6~12周再次评估LVEF,以评估是否有ICD一级预防的潜在必要;对左室射血分数保留的心肌梗死患者或其他原因不明的晕厥患者,可以考虑使用带程序性心室刺激的电生理检查;推荐新型计算方程用于肥厚型心肌病患者的风险分层。
经导管消融术所采用的能量包括射频、冷冻、激光、化学、微波和超声等,其中应用最广泛的为经导管射频消融术(radiofrequency catheter ablation,RFCA)。对预激综合征和/或房室折返性心动过速、房室结折返性心动过速、心房扑动和房性心动过速等,治疗成功率高、并发症低,已成为反复发作患者的首选治疗。RFCA对特发性左室或右室室性心动过速、束支折返性心动过速等均有较好的治疗效果,但对伴有器质性心脏病的室性心动过速,则必须在抗心律失常药物和植入ICD后应用以减少发作。
近年来,随着对房颤发生机制认识的深入和导管消融技术的不断完善和改进,导管消融术治疗心房颤动取得了良好的疗效。根据2020年ESC房颤管理指南,有症状的阵发性心房颤动患者经Ⅰ类或者Ⅲ类抗心律失常药物治疗不能很好地控制心房颤动症状时,推荐射频导管消融术(Ⅰ类推荐,A级证据);导管消融可以作为一线治疗预防心房颤动复发,改善症状,作为部分症状性阵发性心房颤动患者除药物治疗外的另一种选择(Ⅱa类推荐,B级证据)。房颤导管消融还需考虑各个电生理中心和术者的经验、房颤持续时间、左房大小、是否合并器质性心脏病等,以提高房颤导管消融治疗的成功率。
经皮/导管左心耳封堵术是近年来发展的通过微创导管术封堵左心耳,以达到预防房颤患者血栓栓塞的新技术,是一种一次性、局部的治疗。左心耳封堵术已被作为口服抗凝药有禁忌的高危卒中房颤患者或服用抗凝药物仍然发生卒中患者预防卒中的可选方案。
外科手术治疗心律失常包括切断异常房室旁路或房室交界区的折返环路来治疗阵发性室上速;迷宫手术治疗心房颤动;左侧心脏交感神经切除术(left cardiac sympathetic denervation,LCSD)治疗先天性长QT综合征;室壁瘤切除手术治疗相关的室性心动过速等。其中已有不少被介入治疗取代。
遗传性心律失常患者的治疗方案各不相同,从药物治疗和生活方式改善到植入ICD乃至LCSD。随着分子生物学的进展和基因工程技术的进步,基因治疗心律失常亦在探索之中,如通过基因工程的方法进行生物起搏,通过基因敲除技术去除致病基因,治疗遗传性心律失常如长QT综合征、短QT综合征、Brugada综合征等,期待更多研究和临床实践,使患者更多受益。













