英文名称 :hirsutism
女性多毛症是指女性与其同种族、同年龄的女性相比,毛发生长过多并呈男性化分布,主要表现为上唇、下颏、耳前、乳晕、胸部、上、下腹部、上背部等部位出现粗而长的终毛。发生率占育龄妇女的5%~10%。
女性体内的雄激素主要包括双氢睾酮(dihydrotestosterone,DHT)、睾酮(testosterone,T)、雄烯二酮(androstenedione)、脱氢表雄酮(dehydroepiandrosterone,DHEA)、硫酸脱氢表雄酮(dehydroepiandrosterone sulfate,DHEAS),其活性依次递减,对毛囊最具有生物活性的雄激素是DHT。在未孕妇女中,雄激素由卵巢、肾上腺和外周组织转化合成,大部分与血清白蛋白和性激素结合球蛋白(SHBG)相结合,仅1%以游离形式发挥生物效能。
毛囊皮脂腺单位是雄激素敏感靶组织,游离睾酮、雄烯二酮、DHEA与受体结合后进入靶细胞,在5α-还原酶作用下转换为活性更强的DHT,进而与胞质受体蛋白结合,进入细胞核与DNA结合后作用于毛囊,导致毛发生长。当体内雄激素升高时,DHT转化增强,导致多毛。
毛发对雄激素的反应性除了取决于DHT的活性外,还取决于5α-还原酶活性。5α-还原酶可将睾酮转变为DHT,是雄激素作用的关键酶。5α-还原酶有两个亚型,SRD5A1及SRD5A2,SRD5A1和多毛的程度有关。5α-还原酶活性增强为正常雄激素水平的多毛女性发病的主要机制,这部分女性多毛的程度与血雄激素水平并不平行。即使雄激素水平正常,由于5α-还原酶的活性增高,将体内正常水平雄激素转化为DHT的效率升高,亦会导致多毛。
多囊卵巢综合征合并血雄激素水平升高,性激素结合蛋白降低,产生更高的游离雄激素,另外部分PCOS患者的5α-还原酶活性也会增加,使DHT的水平增高,从而使患者表现为多毛。但并非所有高雄激素的患者均表现为多毛,许多高雄激素血症的女性而无多毛表现,可能是毛囊皮脂腺对雄激素的反应性有个体差异所致。
妇女多毛症本身并不是一种疾病,但提示机体可能存在雄激素生成过多的疾病。大多数妇女多毛症的发生是由于雄激素水平升高,有些患者是由于毛囊对雄激素的敏感性升高。引起多毛症的原因有多囊卵巢综合征(polycystic ovarian syndrome PCOS)、卵巢肿瘤、肾上腺过度增生、肾上腺肿瘤、Cushing综合征、催乳素腺瘤、接受雄激素治疗和特发性多毛症。而PCOS在诸多病因中占第一位,约78%的女性多毛症为PCOS患者,而约20%的女性多毛为特发性多毛症,即找不到导致多毛的病因,雄激素水平为正常。
临床上分以下三种类型:
(一)正常雄激素性多毛症
1.特发性多毛症
约占10%,有明显的家族倾向。多毛始于青春期,以后数十年持续发展。循环中雄性激素水平正常、月经正常且无其他内分泌异常。可能是毛囊和皮脂腺对雄激素敏感性增高或局部5α-还原酶活性升高使DHT增多所致。
2.其他内分泌疾病
肢端肥大症和高催乳素血症,甲亢合并胫前黏液性水肿的患者等可见多毛。
(二)高雄激素性多毛症
占75%~85%。女性体内循环中的雄激素50%由外周组织转化而来,25%来源于肾上腺,25%来源于卵巢。常见的疾病包括:
1.多囊卵巢综合征(polycystic ovary syndrome,PCOS)
是女性多毛的最主要病因,占70%~80%。雄性激素明显升高,且性激素结合球蛋白(SHBG)减少,使游离雄激素增多。多毛症状明显,常伴肥胖、代谢综合征、面部痤疮、月经减少乃至闭经、性欲减退和不育等。
2.卵巢肿瘤
小于1%,包括颗粒细胞瘤、泡膜细胞瘤、Leydig细胞瘤等。多毛发展迅速,并出现男性化。
3.胰岛素抵抗
体内高水平的胰岛素导致多毛症伴黑棘皮。
4.其他
非典型先天性肾上腺皮质增生症是一组常染色体隐性遗传病,约占1%,患者多毛且伴月经紊乱。皮质醇增多症可伴有雄激素分泌增多,导致多毛,其中以库欣病最常见,一般无男性化表现。肾上腺皮质癌可使多毛和男性化表现发展迅速。
(三)药物性多毛症
虽少见,但以下药物可致多毛,如睾酮、达那唑、糖皮质激素、蛋白质同化激素、乙酰唑胺、苯妥英钠、氨苯蝶啶、氢氯噻嗪、米诺地尔、二氮嗪、环孢菌素等。
(一)内分泌激素相关检查
1.血浆睾酮 目前测定的血浆睾酮99%是与SHBG等结合的总睾酮。建议女性测定性激素结合球蛋白及游离睾酮。
2.血浆雄烯二酮 卵巢和肾上腺来源约各占50%。
3.血浆硫酸脱氢表雄酮(DHEAS) 80%来自肾上腺皮质。
4.血浆17-羟孕酮21-羟化酶、11β-羟化酶缺陷的先天性肾上腺皮质增生症的患者,血浆17-羟孕酮的水平显著升高。
5.血清催乳素 如存在月经紊乱需测定血清催乳素。
6.皮质醇增多症的筛查 如存在库欣综合征表现应进行24小时尿游离皮质醇、血皮质醇昼夜节律、小剂量地塞米松抑制试验等进行筛查。
(二)卵巢功能测定
监测基础体温和测定黄体期孕酮水平以明确是否存在无排卵性月经。
(三)影像学检查
1.卵巢B超
应常规进行子宫及双附件超声检查,根据2003年鹿特丹诊断标准,如卵巢内存在12枚及以上、直径在2~9mm的小卵泡,和/或卵巢体积增大,大于10ml,即可诊断为多囊卵巢。
2.肾上腺CT
先天性肾上腺皮质增生或怀疑肾上腺肿瘤应行肾上腺薄层CT增强。
医源性多毛症应停用导致多毛症的药物,对其他疾病引起的多毛症应积极处理原发病。由于多毛症还给患者带来心理和社交压力,因此美容措施也应同时进行。特发性多毛症治疗流程参见图3。
(一)局部处理
对以局部小范围多毛为主的患者,可采用化学或物理方法(脱毛霜、剃毛、激光等)进行处理,其中以激光治疗最为安全、有效和持久。但可能出现皮肤刺激、毛囊炎、色素沉着,甚至瘢痕等副作用。
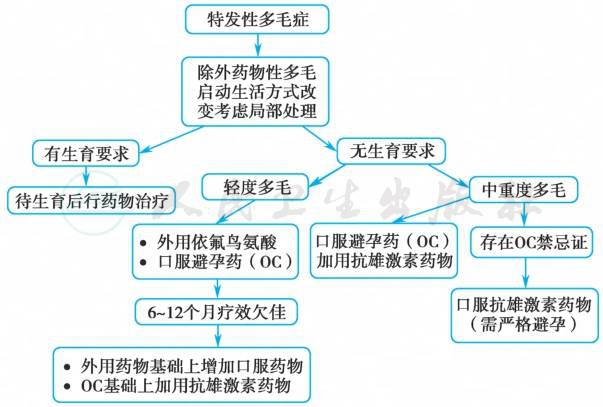
图3 特发性多毛症治疗流程
(二)减少雄激素产生
1.口服避孕药(oral contraceptive,OC)
主要的作用机制是抑制促性腺激素的分泌从而减少卵巢雄激素的合成和分泌。同时也有微弱的与糖皮质激素受体结合的作用,使肾上腺雄激素分泌减少。该类药物还可以导致SHBG增加,从而降低游离睾酮的水平。常作为睾酮水平增高的多毛症的一线用药。
2.GnRH类似物(GnRHa)
GnRHa通过抑制 LH和 FSH分泌,减少卵巢类固醇激素生成,常用于治疗PCOS和严重卵巢高雄激素血症。治疗4~6周后测定血睾酮和雄烯二酮水平可反映治疗效果。血睾酮正常或接近正常及肾上腺分泌雄激素过多的妇女对GnRHa治疗常无反应。单独使用GnRHa可显著抑制雌激素水平,因此,在治疗的同时通常给予雌激素/孕激素替代治疗。
(三)阻断雄激素在外周作用
1.螺内酯(spironolactone)
可以在靶组织的细胞内与睾酮及二氢睾酮竞争性地和受体结合,大剂量时还可减少睾酮的合成。常用较大剂量100~200mg/d。其不良反应与剂量相关,常见的有月经不规则、乳房触痛或胀痛、疲劳,用药时应检测血钾。
2.环丙孕酮(cyproterone acetate,CPA)
CPA 为 17α-羟孕酮的衍生物,能竞争性地与雄激素受体结合而抑制雄激素作用,并反馈抑制促性腺激素的释放,抑制卵巢雄激素的合成和分泌,另外还能增加睾酮清除。CPA多与雌激素合用。经典的周期性治疗为在月经周期1~15天服用CPA 50~100mg/d,在月经周期5~26天,加服炔雌醇35μg/d,持续服药4~9个月后显效。不良反应有乏力、体重增加、性欲减低、乳房胀痛、头痛。此外,CPA具有肝毒性,宜每3~6个月复查肝功能,本药不宜长期应用。
3.氟他胺(flutamide)
强效高特异性的非类固醇类抗雄激素药物,主要通过阻断雄激素受体而拮抗雄激素的外周作用。疗效优于螺内酯,治疗剂量为250~500mg/d,疗程6~24个月。不良反应有一过性恶性头痛,大剂量(500mg/d)可有皮肤干燥、性欲下降、胃肠反应和肝功能损害,甚至有肝衰竭报道,因此并不推荐使用。
4.非那雄胺(finasteride)
特异性的Ⅱ型5α-还原酶的抑制剂,通过抑制该酶活性进而抑制睾酮向DHT转化。常用剂量为5~7.5mg/d。该药的最大优点是不良反应小,偶见头痛、胃肠反应及性欲下降。
(四)其他药物
1.盐酸依氟鸟氨酸乳膏(eflornithine hydrochloride)
外用治疗面部轻度多毛症,该药通过抑制鸟氨酸脱羧酶从而抑制毛发生长。
2.胰岛素增敏剂
如二甲双胍、噻唑烷二酮类等药物可以提高胰岛素敏感性,使得PCOS患者获益。
(五)生活方式改变
尤其对于超重或肥胖的PCOS患者,饮食与运动治疗是基础。













