英文名称 :hypopituitarism
中文别名 :pituitary deficiency
腺垂体功能减退症(hypopituitarism)指各种病因导致的下丘脑、下丘脑-垂体柄通路、腺垂体本身病变而引起一种或多种腺垂体激素分泌不足的疾病。成人多因后天获得性疾病如鞍区肿瘤、创伤、炎症、手术或放射治疗引起,部分患者是先天性发育异常所致垂体功能减退,但至成年才能得以诊断。
腺垂体功能减退症病因见表1。
表1 成人腺垂体功能减退症常见病因

(一)鞍区占位性病变(肿瘤或囊肿)
常见的有垂体大腺瘤、颅咽管瘤、Rathke囊肿、鞍区脑膜瘤、生殖细胞瘤、室管膜瘤、鞍区胶质瘤、下丘脑神经节细胞瘤、垂体转移瘤(乳腺癌、肺癌、结肠癌)、淋巴瘤等。所有占位性病变可因严重压迫正常垂体组织而致腺垂体功能减退。部分病例阻断垂体柄和/或破坏下丘脑功能,使下丘脑释放激素作用减弱而致腺垂体功能减退,常伴尿崩症。
(二)损伤性
包括颅脑外伤(traumatic brain injury,TBI)、鞍区手术损伤、放射治疗损伤等。
TBI后腺垂体功能减退症率报道从5.4%至90%不等,与所报道人群颅脑损伤的严重程度、垂体功能评估的时间及功能评估的方法不同有关。Schneider等荟萃分析发现汇总患病率为27.5%。
垂体瘤术后腺垂体功能减退症的发生及严重程度与肿瘤的大小、侵袭程度、手术方式及手术医师的熟练度等因素有关。近年来,开展内镜经蝶手术和垂体瘤亚专业分工后,手术导致垂体功能减退的发生率明显减少。另外,垂体大腺瘤手术切除后由于占位效应解除,部分患者术后可有不同程度的恢复。
针对鞍区各种肿瘤和鼻咽癌进行放射治疗容易导致腺垂体功能减退的发生。功能减退的发生率及程度与垂体局部接受的放射治疗剂量、患者的年龄有关。剂量越大,功能减退发生得越早、程度越重;儿童、青春期患者对放射线更为敏感,更易发生功能减退。立体定向放射外科手术(即γ刀)后功能减退的发生率明显低于常规放射治疗。
(三)炎症/浸润性、感染性
包括各种原发性和继发性垂体炎,以淋巴细胞性垂体炎多见。淋巴细胞性垂体炎,女性较多见,好发于妊娠晚期或产后。病变可累及腺垂体、垂体柄、神经垂体,可合并自身免疫性甲状腺炎等自身免疫性疾病。患者常表现为突发性头痛、垂体功能减退和高催乳素血症,偶有视野视力改变,少数患者神经垂体受损出现尿崩症。影像学表现为垂体增大且均匀强化。感染性则以垂体脓肿多见。
(四)血管性
垂体卒中多因垂体大腺瘤瘤体内梗死或出血,瘤体突然增大,压迫正常垂体和邻近神经组织所致。可自发或因多巴胺受体激动剂、内分泌功能检查用药、抗凝药等诱发。表现为突发头痛呕吐、上睑下垂和复视、垂体功能减退,影像学可清楚识别。垂体卒中也可发生在正常垂体内,因冠脉手术、高/低血压波动、脑外伤、抗凝治疗等诱发。产后大出血所致者又称希恩综合征,近年来发病率已明显下降。
腺垂体功能的评估主要依据垂体及相应靶腺激素水平。外周靶腺激素水平降低而垂体促激素水平未相应升高提示腺垂体功能减退。部分需行激发(兴奋)试验,相应垂体/靶腺轴所用的功能试验名称、方法和正常结果汇总见表3。
表3 评估成人腺垂体功能的功能试验
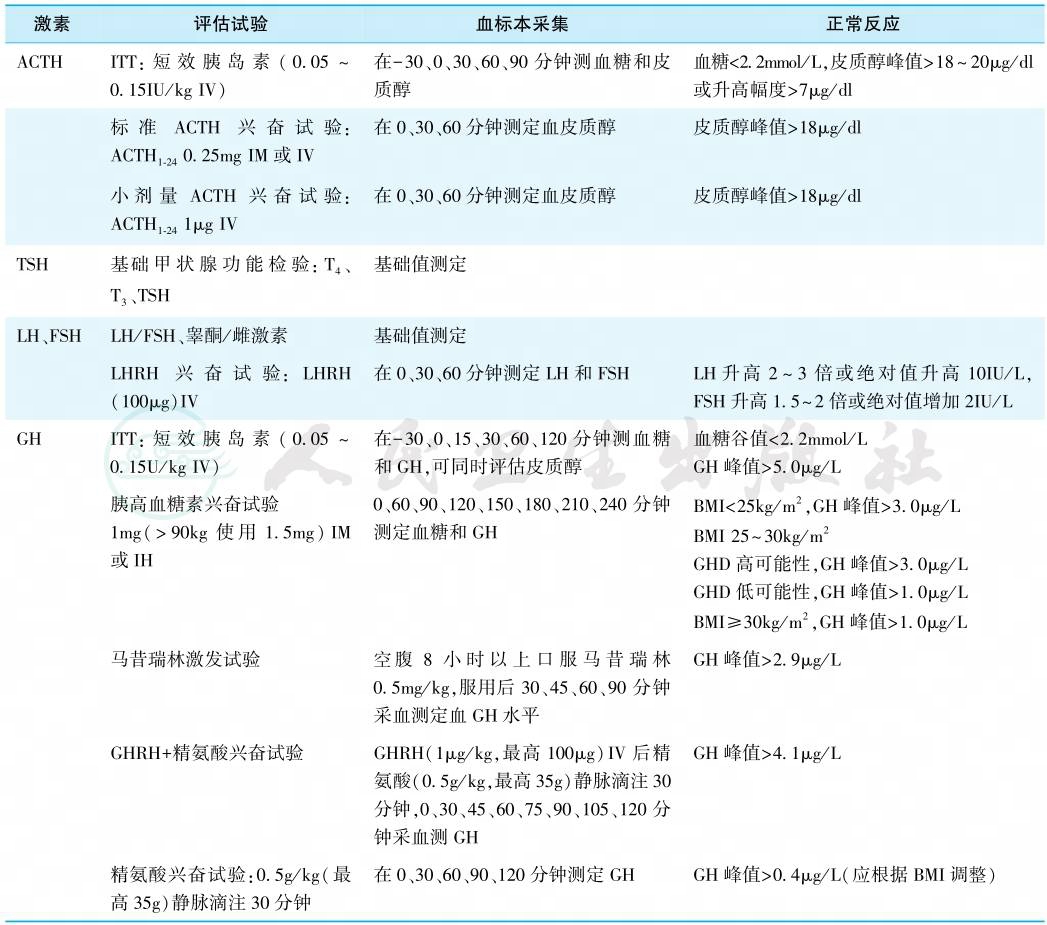
注:IM.肌内注射;IV.静脉注射;IH.皮下注射。
(一)ACTH
对于有肾上腺皮质功能不全临床表现的患者,先测定晨8时基础血皮质醇水平,<100nmol/L(3μg/dl)可诊断为肾上腺皮质功能减退,≥500nmol/L(18μg/dl)可排除。2016年美国内分泌学会指南建议基础晨血皮质醇>410nmol/L(15μg/dl)可排除。急重症应激情况下,血皮质醇<400nmol/L(14.5μg/dl)即提示肾上腺皮质储备功能不足。基础血皮质醇为100~410nmol/L(3~15μg/dl)者建议行低血糖兴奋试验(insulin tolerance test,ITT)或ACTH兴奋试验明确诊断。参见本篇第二章“内分泌功能试验”。
(二)TSH
中枢性甲状腺功能减退者FT4、TT4水平降低,严重者血清FT3和TT3均降低,但其幅度低于TT4和FT4,而TSH水平多数正常或偏低,也可轻微升高(<10mIU/L)。不能依据TSH水平判断是否存在TSH分泌缺乏。结合鞍区疾病史通常诊断不难,需与低T3综合征鉴别。
(三)LH/FSH(GnH)
绝经期女性雌激素水平低下而FSH和LH无相应升高;育龄期女性闭经或月经稀发,雌激素水平低下而FSH和LH无相应升高,或无黄体酮撤退性出血;男性晨空腹睾酮水平降低而FSH和LH无相应升高,可以诊断GnH缺乏。可行LHRH兴奋试验判断病变在垂体或下丘脑。
(四)GH
由于GH昼夜节律和脉冲式分泌特点,且成人水平较低,随机测定GH无法区分GH分泌正常者和GH缺乏(GHD)者。IGF-1主要来自肝脏,主要受GH调节,半衰期长,血清水平稳定,可作为GH的替代指标,但肝脏疾病、营养不良等干扰IGF-1诊断GHD的特异性,同时IGF-1正常也不能除外GHD。故需结合垂体基础疾病、垂体其他轴功能及IGF-1、GH激发试验综合判断GH储备功能。明确垂体基础疾病,同时有肾上腺轴、甲状腺轴和性腺轴功能减退,IGF-1低于正常参考值下限,无须激发试验即可诊断。其他情况需选其中的两项激发试验进行评估,均不能兴奋时方可诊断。GH激发试验中,ITT是“金标准”,国内可行但操作要求高,安全性低;胰高血糖素不易获得,尚无马昔瑞林和GHRH供应;精氨酸和左旋多巴刺激GH分泌的作用较弱,目前较少使用。临床合并其他腺垂体激素分泌不足时,在试验前须保证肾上腺皮质激素和甲状腺激素替代剂量合适。
(五)PRL
由于下丘脑对垂体分泌PRL的抑制作用减弱或垂体瘤分泌过多PRL,鞍区病变患者常表现为PRL升高;垂体损伤严重时也可表现为PRL降低。希恩综合征患者PRL多低于正常。
确定腺垂体功能减退症后,可通过详细询问病史和鞍区影像学检查查找可能病因,如希恩综合征、手术或放射治疗损伤,或鞍区肿瘤、垂体炎、空蝶鞍等。MRI分辨率高,能更好地显示软组织包括周围血管、视交叉、垂体柄,是垂体疾病首选的影像学检查。CT在分辨钙化上优于MRI,也是垂体卒中、颅脑外伤等急危症患者的首选检查。
包括垂体功能的激素替代治疗(hormone replacement therapy)和病因治疗。替代治疗原则:补充垂体分泌缺乏的促激素(GH、促性腺激素)或相应的靶腺激素(肾上腺糖皮质激素、甲状腺激素、性激素),尽可能模拟激素生理分泌曲线;多种激素缺乏时,先补充肾上腺糖皮质激素,后补充甲状腺激素、性激素/GH。各激素的使用与原发性靶腺功能减退相似,但随访指标有所不同。表4为腺垂体功能减退替代治疗一览表。
表4 成人腺垂体功能减退的替代治疗
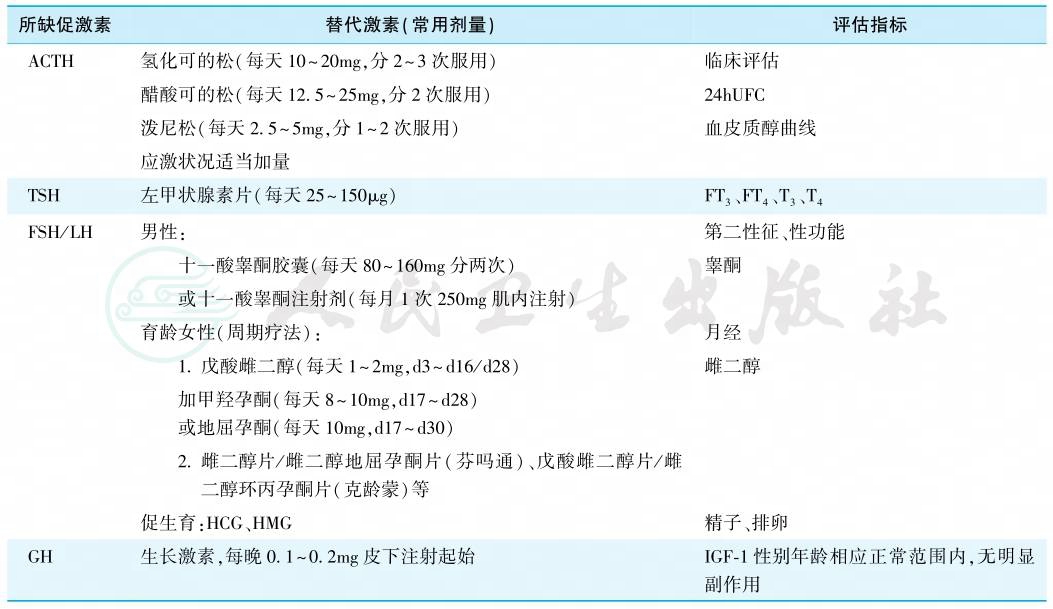
不同病因治疗方法各异,不在本章节详述。部分垂体炎、垂体脓肿、垂体瘤卒中等患者的垂体功能有恢复可能,替代治疗过程中需要随访评估,及时调整治疗方案。腺垂体功能减退患者在应激时有发生危象可能,宜加强患者健康教育,携带治疗卡。
1.肾上腺糖皮质激素
首选短效糖皮质激素如氢化可的松和醋酸可的松,次选中效激素如泼尼松或甲泼尼龙,不建议选地塞米松。正常成年人每天皮质醇分泌量为5~10mg/m2,故成人每天剂量通常为可的松20~25mg,或氢化可的松15~20mg,根据激素的昼夜节律宜在晨起给全天量的2/3,下午2—3时给余下1/3,或氢化可的松一天3次给药(如晨起10mg、中午5mg和傍晚5mg)。替代剂量应根据患者皮质醇缺乏程度、体重等进行适当调整。替代不足可使患者生活质量降低、易诱发危象,替代过量则会诱发骨质疏松、体重增加等。评估替代治疗是否合适缺乏客观指标,可根据患者自身感受、体重变化、血钠、24小时尿游离皮质醇(24hUFC)、服药后多点采血测定血皮质醇曲线来综合辅助判断替代剂量是否合适。建议以服药后24hUFC在正常范围内、日间多点采血测皮质醇水平在正常参考范围内且日间低值不低于3.6μg/dl为佳。切不可根据晨起服药前血皮质醇水平低而盲目加量。
感染、手术等应激状况下,应根据应激的严重程度和持续时间相应增加替代剂量以预防肾上腺危象。轻度应激如普通感冒口服替代剂量加倍即可;中等应激如严重肺部感染可静脉滴注琥珀酸氢化可的松或氢化可的松100~200mg/d;重度应激如严重创伤、大手术时,可分次静脉用琥珀酸氢化可的松或氢化可的松200~300mg/d,并根据病情随时调整剂量。应激缓解后减至原维持剂量。
如发生危象,立即氢化可的松50~100mg加入5%葡萄糖氯化钠注射液静脉滴注,需要时可重复给药;根据好转情况逐步减量。并监测血糖、电解质等,寻找和治疗诱因。
2.甲状腺激素
选用左甲状腺激素(LT4)替代,剂量因人而异。可从每天25~50μg开始,逐渐增加至最适当剂量,年老或有缺血性心脏病患者开始剂量宜小。开始用药或剂量改变后4~6周复查甲状腺功能,以T4、FT4维持在正常参考范围中上水平和T3、FT3维持正常范围内为目标。
3.性腺激素
育龄期女性有子宫者予雌孕激素周期疗法建立人工周期。第1~25天服用雌激素,可选用结合雌激素(0.625mg/d)或戊酸雌二醇(1~2mg/d),服药第16~25天加用孕激素(甲羟孕酮5~10mg/d),停药后可出现撤退性出血;出血第5天开始服用第二个周期。也可采用雌孕激素复合制剂如芬吗通、克龄蒙。周期疗法在治疗期间应定期进行妇科检查。育龄期但无子宫者可单纯使用雌激素治疗。有生育需求者,需在辅助生育专家指导下,用FSH、LH促排卵,超声监测卵泡发育情况。可选用人类绝经期促性腺激素(HMG,每支含FSH、LH各75IU)、基因重组人FSH促卵泡发育、大剂量人绒毛膜促性腺激素(HCG)促排卵。更年期后女性则无须替代治疗。
国内常用的男性雄激素替代制剂包括十一酸睾酮胶囊(80~160mg/d分次口服)或十一酸睾酮注射剂(250mg/m肌内注射)。老年男性可适当减少剂量以符合生理性的较低水平。睾酮补充治疗禁忌证包括前列腺癌、乳腺癌等。有生育需求者,停用雄激素改用HCG(1 000~2 000U/次,每周2次),治疗6个月仍无满意生精者加用HMG(75IU/次,每周3次)或人重组FSH。针对下丘脑病变引起的性腺轴功能减退如Kallmann综合征还可选用更符合生理替代的LHRH脉冲泵治疗。
4.生长激素
对非肿瘤性病因、无活动性肿瘤且明确GHD患者可行GH替代治疗;活动性恶性肿瘤患者禁忌使用。用法:<60岁者0.2~0.3mg/d起始,≥60岁者0.1~0.2mg/d起始。6周评估血清IGF-1水平调整GH剂量,监测临床反应包括体重、体脂、血压、腰围、血糖、血脂和骨密度,监测甲状腺功能和可能的副作用。GH治疗副作用包括:体液潴留最常见,表现为水肿、关节僵硬、麻木、腕管综合征、关节痛等,发生率5%~18%;其他包括血糖升高、视网膜病变、良性颅高压等。原有糖尿病患者血糖可能升高,注意监测并及时调整降糖药。治疗目标为:临床症状改善、无副作用和血清IGF-1位于性别年龄相应正常范围内。达标后每半年评估临床表现、可能的副作用和IGF-1水平。目前尚无证据显示GH替代治疗会增加垂体瘤等鞍区良性肿瘤的复发率,但是否增加其他部位肿瘤的发生率不详。病因为鞍区肿瘤性病变的患者仍应监测病灶变化。













