英文名称 :pituitary tumors
垂体瘤(pituitary tumors)是一组起源于腺垂体的肿瘤,是中枢神经系统和内分泌系统的常见肿瘤,占所有颅内肿瘤的15%,仅次于脑膜瘤。最新的流行病学数据显示垂体瘤人群患病率为130/10万~230/10万,而在尸解中,垂体微腺瘤检出率高达25%,影像学检查则可在10%的正常个体中检出小的垂体病变。垂体瘤可发生于任何年龄,40~60岁相对高发,女性略多于男性。垂体瘤绝大多数为良性肿瘤,垂体癌极为罕见(<0.5%)。95%的垂体瘤为散发,其余为家族性。
垂体瘤的发病机制仍不清楚。X染色体失活证实垂体瘤系单克隆起源,多种机制被认为与垂体瘤的发生相关,包括:细胞周期调控异常,涉及cyclin、CDK、CDK抑制因子、Rb和E2F的复杂调控;染色体稳定性异常,如垂体肿瘤转化基因(PTTG)的高表达;信号通路异常,如GNAS突变导致的Gsα持续激活、Akt、Wnt信号通路异常;旁分泌的生长因子和细胞因子异常,涉及FGF、EGF、VEGF、NGF等;抑癌转录因子失活或表达减少,如 MEG3、PLAGL1、GADD45-γ;促肿瘤转录因子增加,如HMGA2。在散发性垂体瘤中,基因突变少见,目前仅GNAS、PIK3AC、USP8和USP48分别在部分生长激素腺瘤、各类型垂体瘤和ACTH腺瘤中发现存在体细胞突变。表观遗传调控可能参与垂体瘤的发生,如MEG3、PLAGL1、GADD45-γ被发现启动子甲基化而沉默;组蛋白H3K9乙酰化增加,一定程度上与p53错误表达相关。大约5%的垂体瘤为家族性遗传综合征所导致,最常见的包括多发性内分泌腺瘤病1型(MEN-1)、4型(MEN-4),Carney综合征,家族性孤立性垂体腺瘤,分别由MEN-1、p27、PRKAR1A、AIP基因突变导致。 近年来,有研究发现垂体中存在干细胞,以保证垂体在特定情况下的可塑性需要。在垂体腺瘤中也发现了肿瘤干细胞的存在,包括产生激素的干细胞和间充质干细胞,可能与垂体腺瘤的发生相关。上皮-间充质转化(epithelial-mesenchymal transition,EMT)可能与肿瘤干细胞的存在和维持相关。垂体瘤虽可发生局部侵袭,但很少真正发生恶变和远处转移,可能是由于DNA损伤和过早增殖停滞(如细胞衰老)。
垂体腺瘤按不同的特征可有不同的分类方法。按腺瘤是否具有分泌激素的功能分为功能性腺瘤和无功能性腺瘤。按肿瘤大小可分为微腺瘤(直径<1cm)和大腺瘤(直径≥1cm),直径≥4cm的腺瘤称为巨腺瘤。按肿瘤与周围结构的关系,目前临床最常用Knosp五级分类法:采用测量海绵窦冠状位MRI上垂体腺瘤与颈内动脉海绵窦段(C4)及床突上段(C2)血管管径的连线,来判断垂体腺瘤与海绵窦的关系。按病理分类,目前普遍采用的是2017年WHO垂体瘤临床病理分类,其按激素免疫组化、细胞分化来源谱系进行分类(表1。该分类还根据肿瘤的生长特性将垂体瘤分为典型垂体腺瘤、高危型垂体腺瘤和垂体癌。高危型垂体腺瘤包括稀疏颗粒型生长激素腺瘤、男性催乳素腺瘤、沉默型促肾上腺皮质激素腺瘤、Crooke细胞腺瘤和PIT-1阳性多激素腺瘤。当肿瘤发生转移诊断为垂体癌。
表1 2017年WHO垂体瘤临床病理分类
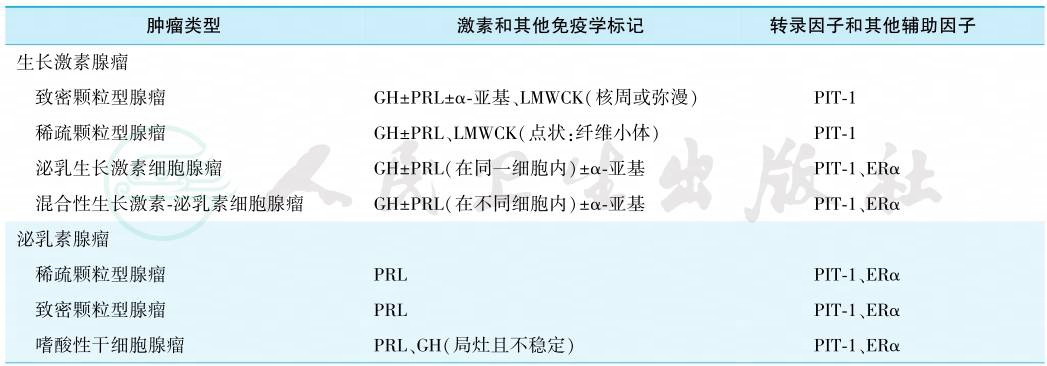
续表
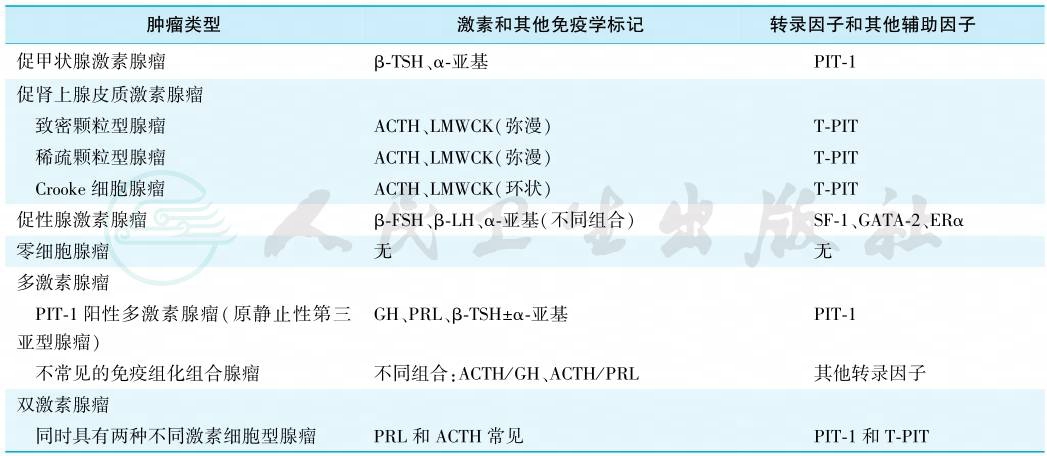
注:LMWCK.低分子量细胞角蛋白.PIT-1.垂体特异POU类同源结构域转录因子1;ERα.雌激素受体α;GATA-2.锌指转录调控蛋白的GATA家族成员;T-PIT.T-box家族成员TBX19;SF-1.类固醇生成因子1。
垂体瘤大多数为良性腺瘤,少数为增生,腺癌罕见。肿瘤的体积大小不一,嗜酸细胞性或嗜碱细胞性腺瘤体积往往较小,而嫌色细胞性腺瘤则常较大。小肿瘤生长在鞍内,大者往往向鞍外发展。小肿瘤常呈球形,表面有光滑的包膜,大者多数呈不规则的结节状,包膜完整,可压迫和侵蚀视交叉、下丘脑、第三脑室和附近的脑组织。第三脑室受压后可引起侧脑室扩大和积水。肿瘤偶尔也可侵蚀蝶骨并破坏骨质而长入鼻咽部。若为恶性肿瘤,则癌肿组织可浸润和破坏蝶鞍周围的结构。瘤内可出血、变性而形成囊肿。光镜下,嫌色细胞性腺瘤细胞呈多角形或梭形,呈片状或条索状排列,细胞核较小和轻度不规则,呈圆形或椭圆形,胞质染色淡,可含有细颗粒或不含颗粒而呈透亮状。间质为丰富的薄壁血窦,瘤细胞可沿血窦排列成假乳头状。常可见到出血、囊性和钙化等变化。嗜酸细胞性腺瘤的瘤细胞呈圆形或多角形,边界清楚,呈片状或丛状分布,细胞体积普遍较嫌色细胞者为大,核圆,有核仁,胞质丰富,内含许多较粗的颗粒,间质中血管较嫌色细胞者少。嗜碱细胞性腺瘤的瘤细胞为多角形或圆形,体积较大,细胞核圆形居中,胞质丰富,含有许多嗜碱性粗颗粒。间质中血管丰富,常呈玻璃样变性,部分腺瘤组织中可含一种以上的瘤细胞称为混合型腺瘤,常见的是嫌色细胞与嗜酸细胞的混合型。垂体腺癌或垂体瘤恶变时,常见瘤细胞较丰富、异形和核分裂,并见瘤细胞呈浸润性生长入蝶鞍周围组织,或有远处转移。
电镜下发现生长激素腺瘤及泌乳素腺瘤细胞内颗粒较大,可分两种,一种为颗粒致密型,以泌乳素细胞内颗粒最大,平均直径大约600nm,最大可达1200nm,伴错位胞溢,内质网明显,排列成同心轮(称nebenkem)状。生长激素细胞内颗粒次之,直径多数为350~450nm,两种细胞的粗面内质网与高尔基复合体均发达丰富。另一种为颗粒稀少型,颗粒小而稀,促肾上腺皮质激素腺瘤细胞呈球形或多角形,核圆形或卵圆形,胞质基质深,粗面内质网和核糖体皆丰富,高尔基复合体明显,内含致密型颗粒,圆形或不规则形,直径250~450nm。促甲状腺激素腺瘤及促性腺激素腺瘤极罕见。前者颗粒最小,直径约100~200nm,后者颗粒稀少,此两者以往均属嫌色细胞瘤。多形性腺瘤中以多种细胞同时存在为特征。用免疫组织化学法可识别不同细胞的分泌功能。
垂体瘤的治疗手段包括手术治疗、内科药物治疗、放射治疗。治疗的目的包括解除占位效应、纠正激素的过度分泌、尽可能保存正常的垂体功能。应根据垂体瘤的类型、各治疗手段的优缺点选择合适的治疗手段。建议由内分泌科、神经外科、影像医学科、神经放射外科等相关科室组成的多学科团队对患者进行个体化治疗。
1.手术治疗
可通过直接切除肿瘤以解除腺瘤对视交叉及鞍区周围组织的压迫及破坏,纠正激素的过度分泌,是目前除催乳素腺瘤外的其他类型垂体腺瘤的一线治疗手段。手术方式目前有经蝶窦及经颅两种途径。内镜下或显微镜下经蝶窦手术是目前首选的方式。手术疗效与外科医师的经验、肿瘤的大小、侵袭程度有关。手术并发症包括脑脊液鼻漏、尿崩症、SIADH、感染、垂体功能减退、视力损伤等,多为暂时性,永久性并发症不到10%,手术死亡率不到1%。经颅手术主要适用于肿瘤明显向鞍上及鞍外生长者,手术并发症及病死率较经蝶手术高,目前已很少使用。内镜、神经导航系统有助于提高肿瘤全切率和手术安全性。
2.内科药物治疗
分为两大类,一类为垂体功能减退的替代治疗,根据各靶腺受损的情况给予相应的激素替代;另一类为针对原发肿瘤的治疗。本节仅介绍针对原发肿瘤的药物。药物是催乳素腺瘤的一线治疗,对于其他类型的垂体腺瘤,药物主要用于手术未能全切、存在手术禁忌、不愿接受手术治疗,或放射治疗后等待起效的患者。
药物分为直接作用于肿瘤的药物,包括多巴胺受体激动剂、生长抑素类似物、赛庚啶等;作用于靶腺的药物,包括生长激素受体拮抗剂(培维索孟)、酮康唑、氨鲁米特、米托坦等;直接拮抗激素作用的药物,包括米非司酮等。多巴胺受体激动剂,常用的为溴隐亭(bromocriptine)和卡麦角林,可抑制PRL的合成,并抑制肿瘤细胞增殖、促进细胞凋亡,主要用于治疗催乳素腺瘤,对TSH腺瘤和生长激素腺瘤也有一定的疗效,也有文献报道卡麦角林对部分ACTH腺瘤有效。生长抑素类似物,通过与生长抑素受体结合,抑制生长激素的分泌和肿瘤细胞的增殖,主要用于生长激素腺瘤的治疗。生长抑素类似物也用于治疗TSH腺瘤和ACTH腺瘤。
3.放射治疗
主要作为手术和内科药物治疗的辅助手段,可分为外照射和内照射。外照射是国内常用的方法,包括高能射线治疗、重粒子放射治疗、立体定向放射治疗(γ刀)等。内照射即通过开颅手术(额路)或经鼻腔穿过蝶窦途径将放射性物质植入蝶鞍当中进行放射,其放射源包括放射性核素钇-90(90Y)、金-198(198Au)等。 近年来高能射线发展,已取代了常规X线治疗。放射治疗指征包括存在手术禁忌,手术无法完全切除,术后复发但病灶不大,且不宜再行手术者。目前国内使用最多的是立体定向放射治疗,其并发症主要包括腺垂体功能减退、继发脑瘤、脑血管病、视力损伤、脑坏死。
绝大多数垂体瘤经手术、药物和放射治疗能够取得良好的疗效。但侵袭性垂体瘤或垂体癌临床十分罕见,是垂体瘤治疗中的难点。替莫唑胺是目前侵袭性垂体瘤或垂体癌标准治疗手段失败后的一线治疗药物。对于替莫唑胺无效的患者,可考虑全身化疗,洛莫司汀联合5-FU在病例报告中最为常用,多柔比星、依托泊苷、卡铂、顺铂等多种药物也有报告。













