英文名称 :glucogen storage disease
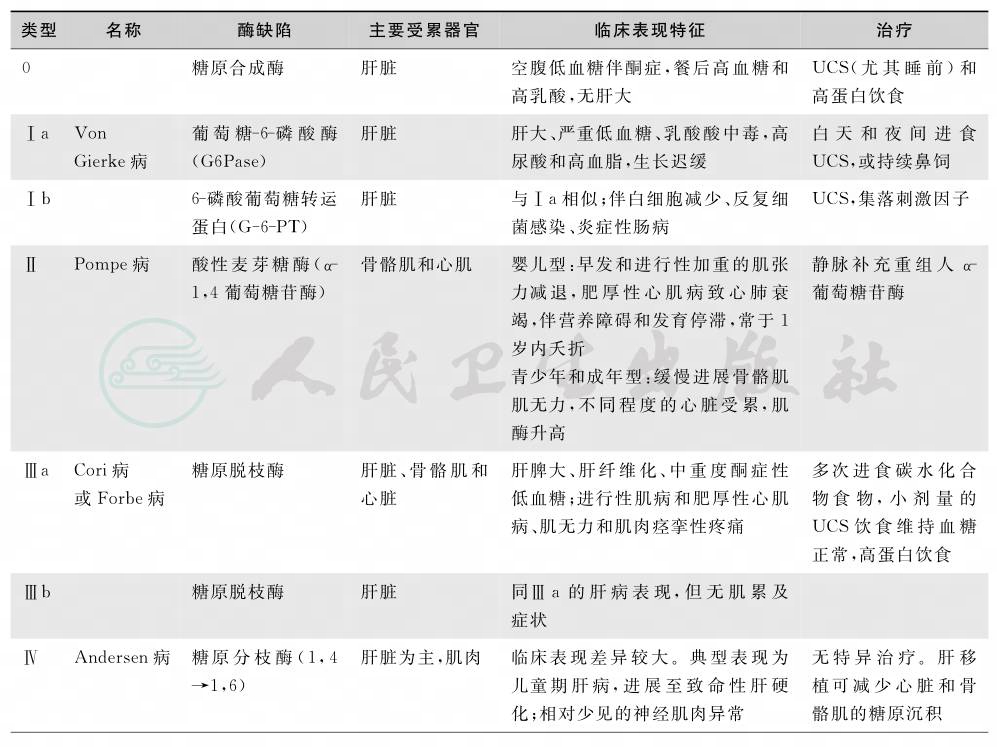
糖原累积病(glucogen storage disease,GSD)为一组罕见的影响糖原代谢的遗传性疾病,发病率为二万到三万分之一。本病为某一糖原分解或合成酶缺陷导致的糖中间代谢紊乱,可涉及肝脏、骨骼肌和肾脏,以糖原含量和/或结构异常为特点。一般根据疾病发现的顺序用罗马数字或明确的酶缺陷命名,目前已确认15型。除GSDⅨ为X染色体连锁遗传外,其余各型均为常染色体隐性遗传。前六型病例数占GSD总病例数的97%,其中GSDⅠ占25%,GSDⅡ占15%,GSDⅢ占24%,GSDⅣ占3%,GSDⅤ和Ⅵ占30%。根据基因测定可明确各型的诊断。表1概括了主要各型的特点。
表1 糖原累积病分型及特征
续表

一、糖原累积病0型(GSD0)
0型糖原累积病系糖原合成酶(基因位于12号染色体p12.2)缺乏所致。由于患者糖原降解、糖异生和脂肪酸氧化正常但糖原储存不足(因此并非是真的糖原累积病,无肝大)致糖原匮乏而易发生空腹低血糖和酮症。空腹时间过长则严重的酮症和高游离脂肪酸抑制骨骼肌释放丙氨酸而导致糖异生前体减少而加重低血糖。临床表现个体差异较大,重者在出生后几小时即发病,表现为呼吸暂停、抽搐、酮尿,如不及时处理,则婴儿死于低血糖和酮中毒;及时给予糖水,低血糖和酮中毒可迅速纠正;但由于葡萄糖不能被肝脏合成糖原而进食后易发生高血糖,喂养间歇延长又易发生低血糖。由于低血糖反复发作,患儿可有智能障碍,可伴有发育迟缓。轻者症状轻微,发育可正常。但个子矮小和骨量减少较常见。进食葡萄糖或半乳糖后血乳酸和血脂升高有助于该病的诊断。既往常行肝穿刺查肝脏中糖原含量来确诊,现可行基因测定来明确。进食富含蛋白质的食物和夜间进食未烹饪的玉米淀粉(uncooked cornstarch,UCS)可有效预防低血糖发作。
二、Ⅰ型糖原累积病(GSDⅠ)
1929年Von Gierke第一次描述本病,故又称Von Gierke病。GSDⅠ是由于肝肾等组织内葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6Pase)活力缺陷所致,G6Pase的作用是将通过糖异生和糖原分解产生的6-磷酸葡萄糖(glucose-6-phosphate,G6P)脱磷而分离葡萄糖,为饥饿状态下机体提供葡萄糖而维持血糖平衡。根据缺陷的具体部位不同,本病又可分为4型:位于内质网内侧的催化亚基(基因位于17号染色体q21)缺陷致G6Pase活性缺失为Ⅰa型;将底物G6P转运入内质网的G6P转运蛋白(G6PT,基因位于11号染色体q23)缺陷为Ⅰb型,此时G6Pase本身活性正常;Ⅰc为使磷酸盐通过内质网的转运蛋白(P-transporter)缺陷;Ⅰd为使葡萄糖释出内质网的转运蛋白GLUT7缺陷。GSDⅠ罕见,其中Ⅰa型约占GSDⅠ病例的80%,而Ⅰc、Ⅰd仅个例报告。
(一)临床表现
各型临床表现相近,有下列特征:①因糖异生障碍、肝糖输出减少,患儿出生后即可出现低血糖,表现为苍白、震颤、呼吸暂停、啼哭、烦躁不安、多汗、惊厥甚至昏迷等。稍大儿童可表现为木偶脸、不易叫醒、倦怠、易饥、生长迟缓、佝偻病和贫血、鼻出血;而胰高血糖素治疗低血糖无效。感染可加重低血糖。②出生时即肝大或出生后肝脏快速增大,致腹部隆起。③高脂血症:长期低血糖促使脂肪分解增多,脂肪酸在肝脏中形成甘油三酯增多,形成高甘油三酯血症和高脂肪酸血症,沉积于臀和四肢伸面形成黄瘤。④伴有酮症、乳酸性酸中毒、高尿酸血症:前者因脂肪酸分解加速而引起,后者由于G6P不能转化为葡萄糖,以致糖酵解旺盛,使乳酸生成过多;同时G6P通过戊糖磷酸通路致尿酸代偿性合成增多。⑤肾脏表现:随着年龄增加肾脏受累,早期表现为肾小球高滤过,可逐步进展为微量白蛋白尿、蛋白尿、高血压和终末期肾病。由于高尿钙和低柠檬酸钙可致肾钙质沉着症或尿石症。由于肾脏糖原积聚,肾脏增大。⑥Ib型患者可伴有中性粒细胞减少,易反复发生感染;伴炎症性肠病,表现为发热、腹泻和溃疡。⑦GSDI存活患者成人后多数身材矮小,代谢控制不佳者可出现晚期并发症:单发或多发的肝脏腺瘤,可能转为恶性;肾功能不全、尿石症、骨质疏松、痛风等,同时高血脂可诱发胰腺炎、胆石病等。
(二)诊断
根据:①参考上述临床症候群;②胰高血糖素治疗无效;③肝穿刺活检,病理学显示肝脏呈马赛克样苍白染色,细胞肿胀,脂肪变性,核内有大量糖原沉积;④基因诊断可以确诊:GSDⅠa(G6PC,17q21),GSDⅠb(G6PT,11q23)。
(三)治疗
目的在于纠正和预防低血糖,预防惊厥,防止神经系统永久性后遗症,改善代谢紊乱。
1.低血糖急性发作期
立即快速静脉输入25%葡萄糖(0.5~1.0g/kg)。症状控制后改用5%~10%葡萄糖液,并逐步减慢输入速度。此后根据血糖监测结果,调整给糖量,以使血糖维持在4~5mmol/L为宜。
2.长期维持治疗
为防治低血糖症,首要处理是多餐,每2~3小时进食一次,其中碳水化合物约占60%。夜间可持续点滴高糖类营养液。尽可能少含半乳糖和果糖的食物,进食玉米淀粉已成为重要的饮食疗法。
3.其他对症治疗
别嘌呤醇治疗高尿酸血症及痛风;碳酸氢盐或柠檬酸钾纠正酸中毒;血管紧张素转换酶抑制剂减少蛋白尿和延缓肾功能恶化;调脂治疗等。
4.Ⅰb患者需注意预防感染
可选用粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)治疗。
三、Ⅱ型糖原累积病(GSDⅡ)
此型亦称Pompe病,于1963年由Hers发现。为一种常染色体隐性遗传性疾病,位于17号染色体q25.2-25.3编码α-1,4葡萄糖苷酶(即酸性麦芽糖酶,acid alpha-glucosidase,GAA)的基因突变致酶活性降低或缺失,以致糖原及麦芽糖不能转化为葡萄糖被利用所致。全身组织均可有糖原沉着,主要沉积于骨骼肌、心肌和平滑肌。其基因突变具有高度的遗传异质性,可通过影响酶的合成、磷酸化修饰、转运和分泌等环节,其突变性质及突变片段的不同组合最终决定残留酶的活性水平。残留酶活性越低、发病年龄越早、临床表现越严重。本病不伴有低血糖、酮症、高脂血症或其他中间代谢异常。
GSDⅡ累及全身,但主要以肌病表现为主。依据发病年龄可分为婴儿型、青少年型和成年型,各型症状差异很大。婴儿型(1岁以内发病):该型GAA活性很低,症状比较严重,常为致死性。患者在出生后的几个月内即可出现心肌肥大、全身肌肉无力、肌张力减退、肝大和呼吸困难,伴有营养障碍和发育停滞,大多在1岁时死于心肺功能衰竭。青少年型(1~19岁发病):常以动作发育迟滞或步态不稳起病,表现为进行性近端对称性肌无力,可伴腓肠肌假性肥大,后期可出现呼吸肌麻痹,而肝大和心肌肥大少见,甚至不受累。成人型(20岁以后发病):因残留GAA活性较高,故症状比较轻微,仅表现骨骼肌无力,疾病进展速度缓慢,一般心脏不受累。肌肉组织或皮肤成纤维细胞中酶活性测定和基因检测可确诊。成人型有一定的效果。GAA酶替代治疗(enzyme replacement therapy,ERT)被公认为是目前最有效的治疗。目前多采用重组人GAA(rh GAA)的方法,重组酶加入了能够使GAA定向进入溶酶体的关键性转运载体甘露糖-6-磷酸残基。美国FDA于2006年4月批准上市了第一个重组GAA-Myozyme用于本病的治疗。重组GAA酶替代治疗的临床试验表明其可显著延长患者的寿命,并可最大限度地减轻骨骼肌损害。开展遗传咨询,检出突变基因携带者,并在此基础上进行产前诊断和采取有效措施预防患儿出生,是控制本病最根本的方法。
四、Ⅲ型糖原累积病(GSDⅢ)
本型亦称Forbe病、Cori病,属常染色体隐性遗传性疾病,为糖原累积病(GSD)较常见的类型之一,约占23%。其病因为糖原脱枝酶(glycogen debranching enzyme,基因位于1号染色体p21)活性缺乏。糖原脱枝酶有两种催化活性,即淀粉-1,6-葡萄糖苷酶(amylo-1,6-glucosidase,AGL)活性和低聚-(1,4→1,6)-葡聚糖转移酶活性。而其活性缺乏使糖原在糖链分支处分解葡萄糖时出现障碍,导致大量形态结构异常的短侧链糖原在肝脏蓄积和/或肌肉组织累积。本型根据脱枝酶活性缺失组织不同及该酶催化活性的不同,可分为Ⅲa(肝和肌肉受累,占80%)、Ⅲb(仅肝受累,占15%)、Ⅲc(仅糖苷酶活性缺失)、Ⅲd(仅转移酶活性缺失)。后两型极为罕见。
绝大多数患者肝脏受累,常有显著肝大、肝纤维化、脾大和低血糖(不如GSDⅠ严重)。肌肉受累者表现为进行性肌病和心肌病,表现为肌肉痉挛性疼痛、运动不耐受、易于疲劳和进行性肌无力。心肌受累者表现为心脏增大和心电图异常,但心力衰竭和心律失常少见。在学龄前期和学龄期GSDⅢ型患者的身材矮小、生长发育迟缓较为显著。肝病可随年龄增加而略有缓解,因而成人Ⅲa患者以肌病为主要表现。实验室检查可见新生儿的肝酶显著升高,随着肝病缓解肝脏体积缩小,肝酶可有降低;肌肉受累者多数肌酶升高。肝脏和(或)肌肉AGL活性测定或基因测定可明确诊断。
治疗上,饮食上治疗维持血糖正常(多次进食富含碳水化合物食物、玉米淀粉或胃管内滴入食物);高蛋白饮食对肌肉受累者有一定益处。肝脏移植可纠正肝脏相关症状,但对肌病远期效果不详。
五、Ⅳ型糖原累积病(GSDⅣ)
本型亦称Andersen病,由于糖原分枝酶(淀粉1,4-1,6转葡糖苷酶,基因位于3号染色体p12)活性缺乏所致,是一种罕见的常染色体遗传病。此酶缺乏引起支链淀粉累积于肝脏等组织,刺激肝脏发生肝硬化,但肝糖原沉积不多。由于存在组织特异性同工酶,临床表现变异较大。典型肝脏受累者,常于出生后2~3个月出现肝大,快速进展为肝硬化、脾大,常因肝衰竭于3~5岁夭折。约半数患者可同时有心肌、骨骼肌和中枢神经系统等多系统受累。患者肌肉和上皮角质细胞中有大量淀粉酶抵抗的酸性Schiff阳性物质堆积。相应酶活性和基因测定可明确诊断。此型无特效疗法,预后颇差。对病变仅限于肝脏患者可考虑肝移植。
六、Ⅴ型糖原累积病(GSDⅤ)
本型亦称McArdle病,于1951年由McArdle首次描述。由于肌肉中糖原磷酸化酶(基因位于11号染色体q13)缺陷所致。系常染色体隐性遗传性疾病,约半数患者有家族史。临床上仅有骨骼肌受累的症状,一般于青少年发病,以体力活动能力降低和肌肉疼痛性痉挛为特征,提重物、快跑、上楼等中、重度运动会诱发,休息可减轻症状。约半数患者运动后出现红葡萄酒样尿(为横纹肌溶解所致的肌红蛋白尿)。患者无肝、心或代谢紊乱的表现。
治疗上以避免疲劳及剧烈运动,减少肌红蛋白尿发作为主。高蛋白饮食,运动前进食葡萄糖或果糖可提高运动耐量,减轻症状。
七、Ⅵ型糖原累积病(GSDⅥ)
本型亦称Hers病,属常染色体隐性遗传病,由于肝糖原磷酸化酶(基因位于14号染色体q21-q22)缺乏所致。婴儿起病,临床表现以肝大和生长迟缓为特征,低血糖症较轻或无,无心脏和骨骼肌受累症状。可伴血清转氨酶、胆固醇和甘油三酯升高。随年龄增加,症状可有减轻。本症病情较轻,预后较好,可不予治疗。少食多餐可预防低血糖。
八、Ⅶ型糖原累积病(GSDⅦ)
本型属常染色体隐性遗传病,由于肌磷酸果糖激酶(基因位于12号染色体q13.3)活性缺失所致。本病症状似第Ⅴ型,临床表现为运动后肌肉酸痛、痉挛,伴肌红蛋白尿。可伴轻度溶血性贫血和胆红素升高。对活检肌组织进行酶学或组织学检测、用红细胞或成纤维细胞检测酶的活力可帮助确诊。治疗上以避免剧烈运动防止肌痉挛和肌红蛋白尿为主。
九、磷酸化酶激酶缺陷
磷酸化酶激酶有四个亚单位(α、β、γ、δ)组成,由位于不同染色体的不同基因编码,在各组织中表达各不相同。α和β亚单位具有调节功能,而α亚单位又分为肝和肌肉两种同工酶,由X染色体上的两个不同的基因编码;γ亚单位具有催化功能;而δ亚单位具有和钙离子结合的功能。因此磷酸化酶激酶缺陷所致的GSD非单一肌病,以前曾被称为Ⅵa型,Ⅷ型或Ⅸ型GSD。现在依据其病变累及的器官和遗传特征再分为四型:①X连锁遗传性肝磷酸化酶激酶缺陷:位于X染色体p22编码α亚单位基因突变所致,肝组织和红细胞、白细胞中酶活力缺陷,肌细胞正常。多数患者1~5岁出现生长迟缓和肝大,血胆固醇和转氨酶升高,乳酸、尿酸正常,低血糖不明显。随年龄增加,血生化和肝大逐步缓解。②常染色体隐性遗传性肝和肌磷酸化酶激酶缺陷:位于16号染色体q12-13编码β亚单位的基因突变所致肝脏和肌肉内糖原沉积。患者早期即出现肝大致腹部膨隆,运动后或空腹低血糖,生长迟缓,部分伴有肌张力低下。③特定性肌磷酸化酶激酶缺陷:肌组织中位于Xp12编码α亚单位基因突变所致,患者表现为运动后肌肉痛性痉挛和肌红蛋白尿,或进行性肌无力和肌萎缩,肝脏和心脏不受累。④心脏磷酸化酶激酶缺陷:酶缺陷仅限于心肌,婴儿早期即表现为心脏增大和心力衰竭,病情进展迅速,往往夭折。各型的确诊有赖于病变器官组织酶活力的检测。多数患者不需特殊治疗,预后良好。有低血糖者可少量多次进食和给予高糖类饮食。仅心脏累及可心脏移植。
十、Ⅹ型糖原累积病
本型由于肌肉特异性磷酸甘油变位酶基因突变引起,临床表现与GSDⅤ相似,临床罕见。
十一、Ⅺ型糖原累积病
第Ⅺ型糖原累积病又称Fanconi-Bickel综合征,由于位于3号染色体q26.1-q26.3编码GLUT-2的基因突变所致,使单糖不能通过细胞膜。临床表现为肝、肾因糖原堆积增大而致腹部隆起,空腹低血糖、餐后高血糖和高半乳糖血症、高脂血症;近端肾小管功能障碍表现为Fanconi肾病及严重身材矮小。治疗包括纠正糖代谢紊乱和补充经肾丢失的各种物质。此类患者果糖代谢不受影响,故可作为糖类替代品。













