英文名称 :acquired immunodeficiency syndrome
中文别名 :获得性免疫缺陷综合征
艾滋病,即获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS),是人类免疫缺陷病毒(human immunodeficiency virus,HIV)侵犯人体免疫系统后,导致机体免疫功能受损乃至缺陷,最终并发各种严重机会性感染(opportunistic infection,OI)和AIDS相关肿瘤的综合征。艾滋病在我国的持续流行,给我国公共卫生安全带来了严重威胁。
HIV属于反转录病毒科(Retroviridae)慢病毒属(Lentivirus),直径为100~120nm,病毒颗粒呈球形,由核心和包膜两部分组成。核心由病毒衣壳蛋白包裹,其内是两条单股正链RNA、核壳蛋白和病毒复制所必需酶类。病毒最外层为包膜,是来源于宿主细胞膜的膜质结构,其中嵌有外膜糖蛋白和跨膜糖蛋白,包膜结构之下是基质蛋白,构成一个病毒内壳。HIV基因组全长约9.7kb,含有3个结构基因、2个调节基因,和4个辅助基因。结构基因env变异率最高。
HIV是由猴免疫缺陷病毒(simian immunodeficiency virus,SIV)进化而来,推测可能于1920年至1940年由非人灵长类传至人。根据HIV基因差异,病毒可分为HIV-1型和HIV-2型,目前全球流行的主要是HIV-1。HIV-1可进一步分为M组(主要组)、O组和N组,其中M组有11个亚型,多个重组型。HIV-2生物学特性与HIV-1相似,但其传染性较低,引起艾滋病临床进展较慢,症状较轻。HIV-2型至少有7个亚型。我国以HIV-1为主要流行株,已发现有A、B(欧美B)、B′(泰国B)、C、D、F、G、H、J、K 10个亚型,还有不同流行重组型,主要流行的是AE重组型和BC重组型。1999年起在部分地区发现并证实我国有少数HIV-2型感染者。下文中,除非特别标注HIV均指HIV-1。
HIV需借助第一受体(CD4,主要受体)和第二受体(CCR5和CXCR4等辅助受体)侵入细胞。HIV可分为使用CCR5的R5型病毒和使用CXCR4的X4型病毒。还有同时使用这两种受体R5/X4型病毒。R5型病毒株出现在感染早期和无症状期,主要感染单核巨噬细胞,随着疾病进展,X4型病毒株逐渐增加,主要感染和破坏CD4+T淋巴细胞(简称CD4+T细胞)。
HIV在细胞内感染过程包括:①吸附、膜融合及穿入;②反转录、入核及整合;③转录及翻译;④成熟、装配及出芽。
HIV在外界环境中的生存能力较弱,对物理化学因素抵抗力较弱。一般消毒剂如:碘酊、过氧乙酸、次氯酸钠等对乙型肝炎病毒有效的消毒剂,对HIV也都有良好的灭活作用。75%酒精也可灭活HIV,但紫外线或γ射线不能灭活HIV。HIV对低温耐受性较强,对热敏感,56℃ 30分钟可使HIV在体外失去感染性,100℃ 20分钟可将HIV完全灭活。
(一)世界及中国的流行态势
世界卫生组织(WHO)报告显示,2018年全球现存活HIV感染者/艾滋病患者(HIV/AIDS)3 790万人,其中2017年新发病例约170万人,艾滋病相关死亡77万人。截至2018年底,我国估计存活HIV/AIDS人数约125万(110万~140万)人,超过10万例的有四川、云南和广西三省,四川凉山的部分县区,人群感染率超过1%。当前我国艾滋病流行有五大特点:①全国艾滋病总体呈低流行态势,部分地区疫情严重。②感染者和患者数量继续增加,但新发感染人数保持在较低水平。③由于既往感染者陆续进入发病期,艾滋病发病数和死亡人数较前增加。④性传播所占比例继续增高,由2007年的 42.3%上升到2019年1月至10月的96.7%,异性传播多于同性传播。⑤感染人群多样化,流行形势复杂化。近年来老年艾滋病病例数持续增加,老年HIV/AIDS患者占比从2010年的7.4%升至2018年的16.5%。
(二)传染源
艾滋病患者和HIV感染者是本病的传染源。HIV主要存在于感染者和患者的血液、精液、阴道分泌物、胸腹水、脑脊液、羊水和乳汁中。
(三)传播途径
HIV主要经以下三种途径传播:性接触(包括无保护的同性、异性和双性性接触)、经血液及血液制品(包括共用针具静脉注射毒品、不安全规范的介入性医疗操作、文身等)和母婴传播(包括宫内感染、分娩时和哺乳传播)。病原携带者的器官移植、人工授精等亦可导致HIV感染。医务工作者意外被HIV污染针头或其他物品刺伤或发生黏膜暴露,亦可感染。握手拥抱、礼节性亲吻、同吃同饮等日常生活接触不会传播HIV。蚊虫叮咬也不会传播HIV。
(四)易感人群
人群普遍易感。发病年龄主要为40岁以下青壮年,60岁以上老年发病人数有上升趋势。HIV感染高危人群有男男同性性行为者、静脉药瘾者、多性伴人群及接受可疑血及血液制品者等。
HIV主要侵犯免疫系统,包括CD4+T细胞、巨噬细胞和树突状细胞等,主要表现为CD4+T细胞数量不断减少,最终导致细胞免疫功能缺陷,引起各种机会性感染和肿瘤的发生。
HIV进入人体后,在24~48小时内到达局部淋巴结,约5天在外周血中可以检测到病毒成分,继而产生病毒血症,导致急性感染,以CD4+T细胞数量短期内一过性迅速减少为特点,多数感染者无需特殊治疗,CD4+T细胞数可自行恢复。由于机体的免疫系统不能完全清除病毒,因而进入慢性感染阶段,含无症状感染期和有症状感染期。无症状感染期持续时间各异,平均5~8年,表现为CD4+T细胞数量持续而缓慢减少(多为350/μl到800/μl之间)。需要注意的是,我国男男同性恋者感染HIV者疾病进展较快,多在4~5年进展到艾滋病期。进入有症状期后CD4+T细胞再次较快速地减少,多数感染者CD4+T细胞数在350/μl以下,部分晚期患者降至200/μl以下,甚至每微升外周血中仅有数十乃至数个CD4+T细胞。
除CD4+T细胞数量变化外,其功能也见异常,表现为识别功能障碍、淋巴因子减少、白细胞介素受体表达减少、对抗原的反应减低、对B细胞的辅助功能减弱等。此外,由于缺乏CD4+T细胞分泌的辅助因子,CD8+T淋巴细胞的杀伤作用也有降低。单核巨噬细胞及自然杀伤细胞的数量和功能也会受到影响。
人体通过适应性免疫和固有免疫反应对抗HIV感染,以适应性免疫反应为主。HIV入侵后2~12周,人体即产生针对HIV的各种特异性抗体,其中仅中和性抗体具有抗病毒作用。细胞免疫主要有特异性CD4+T细胞免疫反应和特异性细胞毒性T淋巴细胞反应(CTL)。
艾滋病期早期即可见HIV引起的淋巴结病变,表现为滤泡增生、融合,大量淋巴细胞浸润,继而发生纤维性病变。胸腺可有萎缩、退行性或炎症病变。HIV相关性脑病者可见脑的额颞部萎缩,组织学见弥漫性髓鞘苍白,且有空泡形成,部分可见脑组织有小胶质细胞、巨噬细胞、淋巴细胞及多核巨细胞浸润。HIV相关肾病表现为局部肾小球硬化及肾小管损害等。
HIV感染合并机会性感染和肿瘤多见。根据病种,各自有特殊的病理变化。
(一)血常规
常见红细胞、血红蛋白降低,呈轻度正细胞正色素性贫血。白细胞降至5×109/L以下,淋巴细胞多低于1.0×109/L,有浆细胞样淋巴细胞出现。血小板一般无变化,也可明显减少。
(二)HIV的实验室检测
主要包括HIV抗体、抗原检测、HIV核酸定性和定量检测、包括CD4+T细胞计数在内的细胞免疫功能检测、HIV耐药检测等。
1.HIV-1/2抗体检测
包括筛查试验(含初筛和复检)和补充试验。HIV-1/2抗体筛查方法包括酶联免疫吸附试验(ELISA)、化学发光或免疫荧光试验、快速检测(斑点ELISA和斑点免疫胶体金或胶体硒快速试验、明胶颗粒凝集试验、免疫层析试验)等。绝大多数HIV-1感染者在3个月内呈血清抗体阳性。补充试验包括抗体确证试验(免疫印迹法,条带/线性免疫试验和快速试验)和核酸试验(定性和定量)。常用的方法是免疫印迹法(WB)。该方法特异性强,假阳性极少。
筛查试验呈阴性反应可出具HIV-1/2抗体阴性报告,见于未被HIV感染的个体,但由于窗口期的存在,筛查者也可表现为阴性反应。若为阳性反应,用原有试剂双份(快速试验)/双孔(化学发光法或ELISA)或两种试剂进行重复检测,如均呈阴性反应,则报告为HIV抗体阴性,否则需进一步行补充试验。抗体确证试验无HIV特异性条带产生,报告HIV-1/2抗体阴性;出现条带但不满足诊断条件的报告不确定,可进行核酸试验或2~4周后随访,根据相应结果进行判断。补充试验HIV-1/2抗体阳性者,出具HIV-1/2抗体阳性确证报告。
2.抗原检测
在抗体出现前的窗口期即可检测到HIV的p24抗原。联合p24抗原及HIV-1/2抗体在内的检测有助于缩短检测窗口期,利于在感染早期发现感染。
3.病毒载量测定
病毒载量一般用每毫升血浆中HIV RNA的拷贝数(copies/ml)或国际单位(IU/ml)来表示。病毒载量测定常用方法有反转录PCR系统(RT-PCR)和实时荧光定量PCR扩增技术(real-time PCR)。病毒载量测定有助于疾病进程的预测、提供开始治疗的依据、评估疗效和指导治疗方案调整,也可作为HIV感染诊断的补充试验,用于急性期/窗口期诊断、晚期患者诊断及小于18月龄的婴幼儿的HIV感染诊断。
4.HIV基因型耐药检测
HIV耐药检测结果可为治疗方案的制订和调整提供重要参考。抗病毒治疗前或病毒载量下降不理想或治疗失败需要改变治疗方案时,建议行耐药检测。对于抗病毒治疗失败者,耐药检测在病毒载量>400拷贝/ml且未停用抗病毒药物时进行,如已停药需在停药4周内进行基因型耐药检测。HIV基因型检测出现HIV耐药,表示该感染者体内病毒可能耐药,也需充分考虑HIV感染者依从性,对药物耐受性及药物代谢吸收等因素进行综合评判。改变抗病毒治疗方案需要在有经验的医师指导下才能进行。HIV耐药结果阴性,表示该份样品通过基因型耐药检测未检出耐药性,但不能确定该感染者体内的病毒不存在耐药情况。
5.CD4+T细胞检测
目前常用流式细胞术,可以直接获得CD4+T细胞数绝对值,也可由CD4+T细胞的百分数再通过白细胞分类计数换算为CD4+T细胞绝对数。CD4+T细胞计数的临床意义在于判断机体的免疫状态和病程进展、确定疾病分期和治疗时机、评价治疗效果,也可根据CD4+T细胞的数值来决定是否进行特定机会性感染的预防。
(三)其他
尿蛋白、血肌酐、尿素氮可升高。X线、B超、CT和MRI等影像学检查可用于检查各种机会性感染和机会肿瘤,如PCP、结核病、CMV感染、淋巴瘤、卡波西肉瘤等。
(一)抗病毒治疗
1996年高效抗反转录病毒治疗(highly active anti-retrovirus therapy,HAART)的出现和应用是艾滋病抗病毒治疗史上具有里程碑意义的重大事件。HAART是把不同作用机制的抗HIV药物联合应用以达到最佳的抗病毒治疗效果,以期将感染者体内的病毒载量控制到最低水平,减缓临床进程,重建机体免疫功能,提高患者生存质量,降低传播风险。HAART的应用使AIDS从一种致死性疾病转变为可以治疗的慢性疾病。
1.治疗目标
①抑制病毒复制,使病毒载量降低至检测不到水平并减少病毒变异;②重建或者改善免疫功能;③减少异常免疫激活;④减少HIV相关疾病及非HIV相关疾病的发病率和死亡率,使患者获得正常期望寿命,改善生活质量;⑤减少HIV的传播,预防母婴传播。
2.治疗指征和开始时机
原则是对所有HIV感染者,只要患者同意,不论感染阶段及分期,均及时予以治疗,寓防于治。
(1)成人及青少年启动抗反转录病毒治疗的时机:确诊HIV感染,无论CD4+T细胞水平高低,均建议立即开始治疗。在开始HAART前,一定要取得患者的配合和同意,教育好患者服药依从性;如患者存在严重机会性感染和既往慢性疾病急性发作期,应控制病情稳定后开始治疗。启动HAART后,需终身治疗。
(2)儿童及青少年开始抗反转录病毒治疗启动时机见表1。
表1 儿童及青少年开始抗反转录病毒治疗的时机

3.国内现有抗反转录病毒(ARV)药物
目前国际上共有6大类30多种药物(包括复合制剂),分为核苷类反转录酶抑制剂(NRTIs)、非核苷类反转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶抑制剂(INSTIs)、融合抑制剂(FIs)及CCR5抑制剂等。国内主要抗反转录病毒药物详见表2。
表2 国内现有主要抗反转录病毒药物
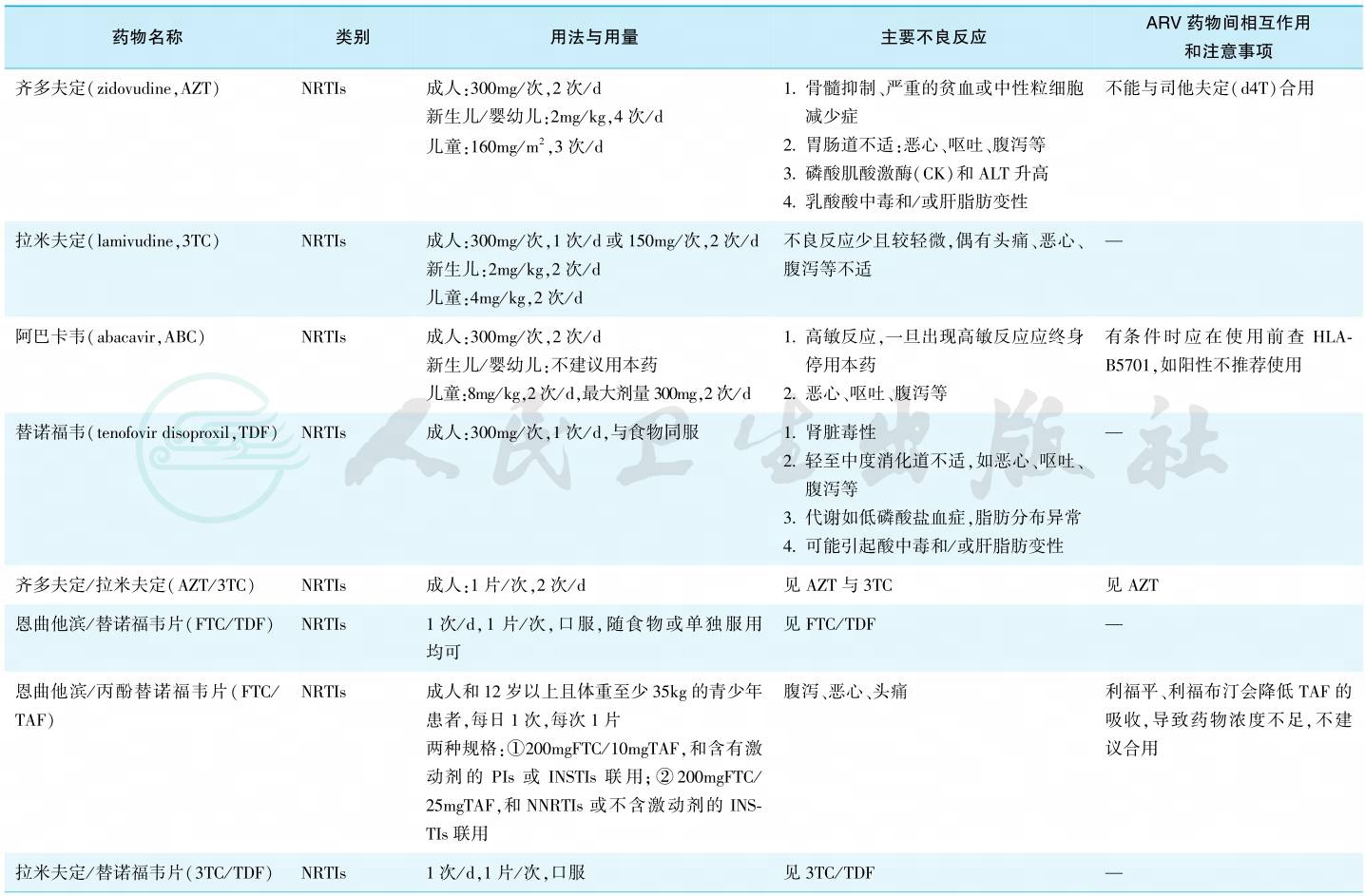
续表
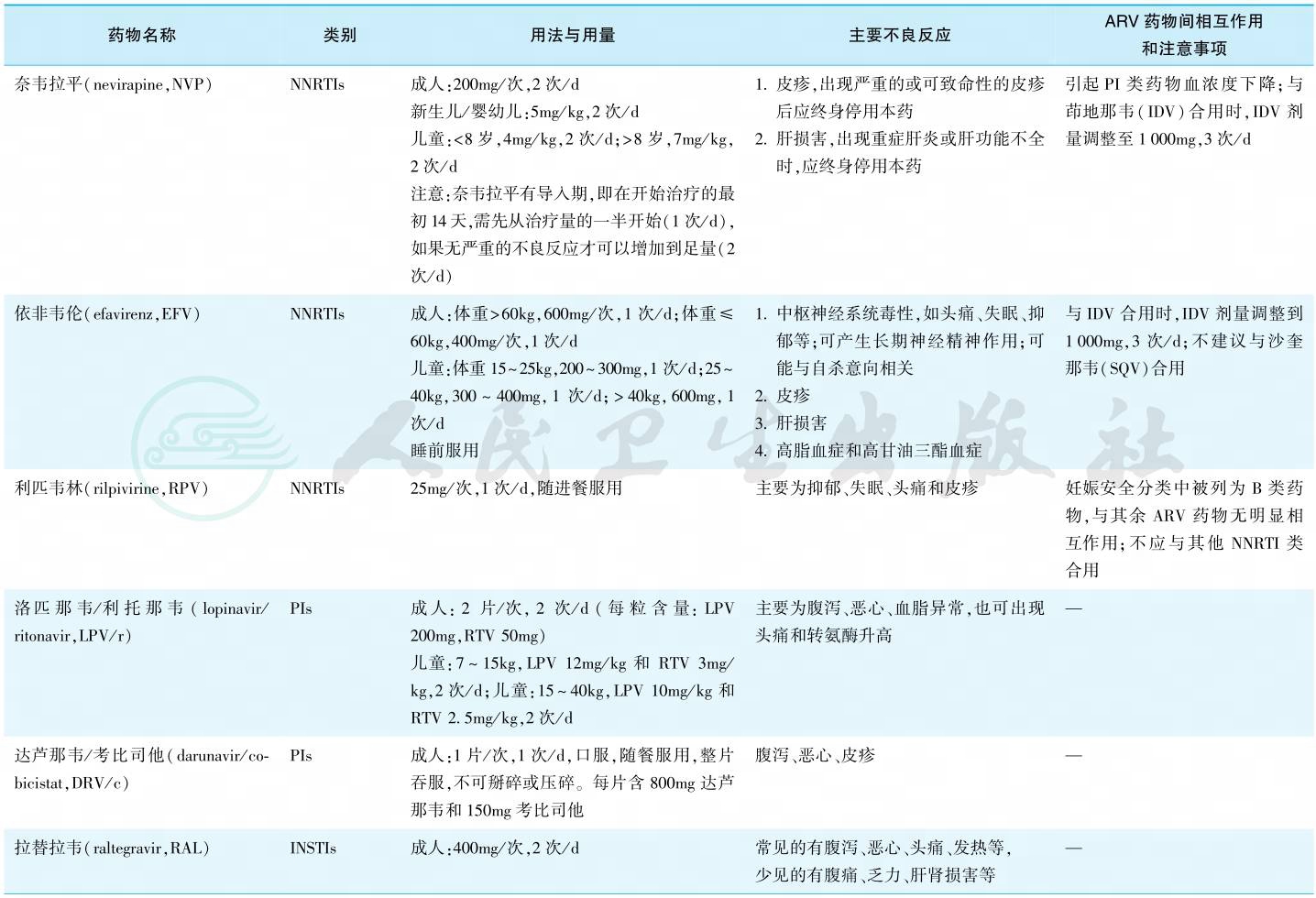
续表
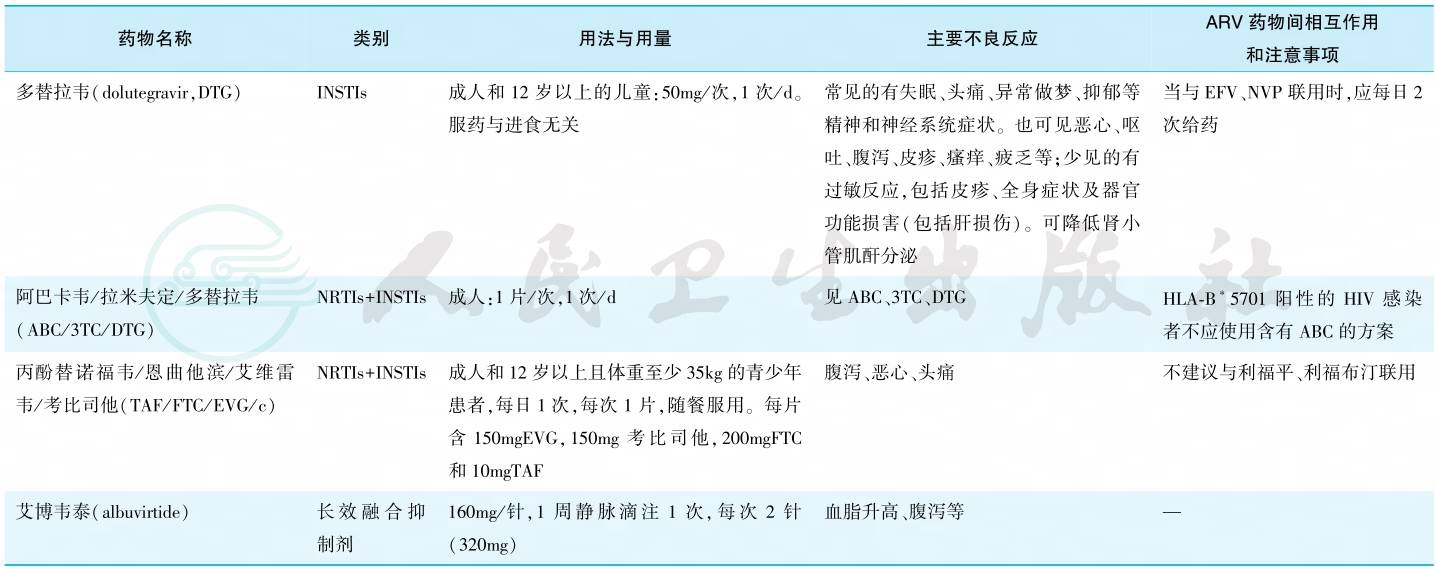
注:—无相关数据;NRTIs.核苷类反转录酶抑制剂;NNRTIs.非核苷类反转录酶抑制剂;PIs.蛋白酶抑制剂;服用方法中2次/d=每12小时服药1次,3次/d=每8小时服药1次。
4.治疗方案
推荐首选抗病毒治疗原则为一个基本药加上两个核苷类药,前者含NNRTIs、PIs或INSTIs,而双核苷则有许多可供选择。美国健康与人类服务部(DHHS)指南推荐的首选方案有5种:①多替拉韦/阿巴卡韦/拉米夫定(DTG/ABC/3TC);②多替拉韦/替诺福韦/恩曲他滨(DTG/TDF/FTC);③艾维雷韦/考比司他(cobicistat,增强剂)/替诺福韦/恩曲他滨(EVG/c/TDF/FTC);④拉替拉韦/替诺福韦/恩曲他滨(RAL/TDF/FTC);⑤达芦那韦/利托那韦+替诺福韦/恩曲他滨(DRV/r/TDF/FTC)。国际推荐方案还有“备选抗病毒方案”和“可以接受的抗病毒治疗方案”,此方案与我国的治疗用药情况相近。
我国成人及青少年初治者推荐治疗方案为:2种NRTIs类骨干药物联合第三类药物治疗。第三类药物可以为NNRTIs或增强型PIs或INSTIs。有条件患者可以选择复方单片制剂(STR)。根据我国药物可及现状,对于未接受过抗病毒治疗的患者推荐一线方案(见表2)。
近年越来越多研究支持,通过三药标准治疗达到病毒学抑制的患者,可以选择某些双药组合来维持治疗效果,以便减少药物不良反应、药物相互作用,提高长期服药患者的生活质量。①多替拉韦(DTG)+利匹韦林(RPV):两项三期临床试验共纳入了1024名经治HIV感染者,部分患者转换为DTG+RPV的双药维持治疗方案,48周时,双药组和三药组各有96%和95%保持病毒学抑制,两组间没有统计学差异。美国指南推荐,对于无须使用TDF、TAF、ABC等NRTIs的患者,DTG+RPV的方案可以作为维持治疗选择,以减少药物负担及药物不良反应。2017年,DTG+RPV双药合剂Juluca也成功上市。②含有增强剂的蛋白酶抑制剂(boosted PIs,bPIs)+拉米夫定(3TC)。患者更换bPIs+3TC双药方案维持治疗后,不会增加体内病毒对bPIs或3TC的耐药风险。可以选择的相应组合有:DRV/r(达芦那韦/利托那韦)+3TC;LPV/r(洛匹那韦/利托那韦)+3TC;ATV/r(阿扎那韦/利托那韦)+3TC。治疗方案中3TC可以用恩曲他滨(FTC)替换。③多替拉韦(DTG)+拉米夫定(3TC):TANGO研究48周的研究结果显示,DTG+3TC双药非劣于以TAF为基础的三药或四药治疗方案,但可减少药物暴露,同时不会增加病毒学失败和耐药风险。欧洲临床艾滋病学会(EACS)2019年指南已推荐DTG+3TC作为经治患者维持治疗的备选(表3)。
表3 我国推荐成人及青少年初治患者抗病毒治疗方案

注:TDF.替诺福韦;ABC.阿巴卡韦;3TC.拉米夫定;FTC.恩曲他滨;AZT.齐多夫定;NNRTI.非核苷类反转录酶抑制剂;EFV.依非韦伦;PI.蛋白酶抑制剂;LPV/r.洛匹那韦/利托那韦;INSTI.整合酶抑制剂;RAL.拉替拉韦;DTG.多替拉韦;NVP.奈韦拉平;RPV.利匹韦林;a用于HLA-B∗5701阴性者;b单片复方制剂;c对于基线CD4+T细胞>250/μl的患者要尽量避免使用含NVP的治疗方案,合并丙型肝炎病毒感染者避免使用含NVP的方案;dRPV仅用于病毒载量<105拷贝/ml和CD4+T细胞>200/μl的患者。
5.特殊人群抗病毒治疗
(1)儿童抗病毒治疗方案:
见表4。
表4 儿童抗病毒治疗方案
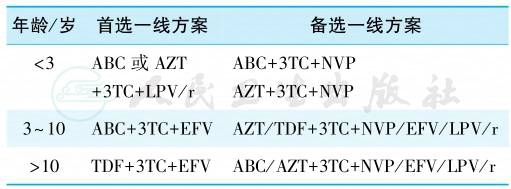
注:ABC.阿巴卡韦;AZT.齐多夫定;3TC.拉米夫定;LPV/r.洛匹那韦/利托那韦;EFV.依非韦伦;NVP.奈韦拉平;TDF.替诺福韦。
(2)孕妇:
参见“预防-阻断母婴传播”部分。
(3)哺乳期妇女:
母乳喂养具有传播HIV风险,感染HIV的母亲应避免母乳喂养。如果坚持要母乳喂养,则整个哺乳期都应继续抗病毒治疗。治疗方案与怀孕期间抗病毒方案一致,且新生儿在6月龄之后应立即停止母乳喂养。
(4)合并结核分枝杆菌感染者:
应避免抗病毒治疗和抗结核同时开始。合并结核病患者抗HIV治疗时机:对于CD4+T细胞计数<50/μl的严重免疫缺陷者,建议抗结核治疗2周内开始HAART。对于CD4+T细胞计数≥200/μl,建议在8周内尽快启动HAART。患有中枢神经系统结核感染者,早期启动抗病毒治疗,发生免疫重建炎症综合征(immune reconstitution inflammatory syndrome,IRIS)风险较高,需严密观察,最佳启动治疗时机尚不明确。HIV感染孕妇合并活动性结核病者,HAART应尽早进行。如合并耐药结核病,在确定结核分枝杆菌耐药使用二线抗结核药物后2~4周内开始HAART。
治疗过程中要注意药物毒副作用及抗病毒药物与抗结核药物间相互作用,必要时进行药物浓度监测。艾滋病合并结核病患者推荐的一线抗病毒方案是:AZT(TDF)+3TC(FTC)+EFV。也可选择含INSTIs的HAART方案,正在接受DTG或RAL治疗的HIV合并结核感染患者,如果合并使用利福平,则需要增加DTG的剂量(50mg,2次/d);RAL合并使用利福平者,可考虑增加RAL剂量(800mg,2次/d)或维持原剂量(400mg,2次/d)。利福布汀对肝酶的诱导作用较弱,使用DTG或RAL治疗的HIV合并结核感染患者可以考虑使用利福布汀替代利福平,无须调整剂量。如果患者使用利福布汀抗结核治疗,也可选择含PIs的HAART方案。
(5)静脉药瘾者:
静脉药瘾者开始抗病毒治疗时机与普通患者相同,但毒品成瘾性会影响患者的服药依从性,故在开始治疗前应向患者充分说明依从性对治疗成败的重要性,尽量采用简单的治疗方案。监督药物服用可有效提高依从性。另外,应注意抗病毒药物与美沙酮之间的相互作用。
(6)合并HBV感染者:
制订抗HIV治疗方案时应当兼顾HIV、HBV两种病毒的抗病毒治疗,更换方案时需要保留对HBV有活性的药物。当患者需要抗HBV治疗时,无论其CD4+T细胞计数高低,建议尽早开始HAART。为避免HBV相关的免疫重建炎症综合征的发生和避免单用核苷类所致耐药问题,HIV/HBV合并感染患者的HAART方案核苷类药物选择推荐TDF或TAF+3TC(FTC)。治疗过程中需要每3~6个月监测HBV DNA。如因为肾功能不全而不能使用TDF,HAART方案需加用恩替卡韦。尤其是基线HBV DNA大于20 000IU/ml时,不能使用单个对HBV有活性的核苷类药物方案以避免产生耐药性。
(7)合并HCV感染者:
HAART药物宜选择肝脏毒性小的药物,尤其当HCV RNA阳性,应避免使用含NVP的治疗方案。有条件者可考虑首选含INSTIs的抗病毒方案。合并HCV感染均要进行抗HCV治疗。尽量避免同时抗HCV和抗HIV,如确需同时治疗则需要考虑两种治疗方案药物间毒副作用的累加及药物代谢的相互影响。CD4+T细胞数<200/μl,推荐先抗HIV治疗,待免疫功能得到一定程度恢复后再适时开始抗HCV治疗。如果因为各种原因暂时不能抗HCV,即使CD4+T细胞数>500/μl也需要HAART。抗HCV治疗方案和疗程与普通HCV感染相同。直接抗病毒药物(DAAs)在HIV/HCV合并感染的抗HCV治疗方面取得良好效果,DAAs用药方案及疗效基本同单纯HCV感染者,但应注意与抗HIV药物的相互作用。EFV和LPV/r因与一些DAAs存在药物相互作用,应用DAAs前需详细评估药物相互作用对DAAs治疗的影响。
6.抗病毒治疗中的监测
应定期随访CD4+T细胞计数及病毒载量,这两项指标反映HIV/AIDS患者免疫功能重建和病毒抑制情况,与患者的预后直接相关。条件允许时未治疗无症状HIV感染者每年检测1次病毒载量。HAART初始治疗或调整治疗方案前、初治或调整治疗方案初期每4~8周检测1次,以便尽早发现病毒学失败。病毒载量低于检测下限后,每3~4个月检测1次,对于依从性好、病毒持续抑制达2~3年以上、临床和免疫学状态平稳的患者可每6个月检测1次,但如出现HIV相关临床症状或使用激素或抗肿瘤化疗药物则建议每3个月检测1次病毒载量。对于CD4+T细胞计数>350/μl的无症状HIV感染者,每6个月应检测1次;对于已接受HAART的患者在治疗的第一年内应每3个月检测1次,治疗一年以上且病情稳定患者可改为每6个月检测1次。对于抗病毒治疗后患者体内病毒被充分抑制且CD4+T细胞计数长期处于稳定水平的患者无须频繁进行 CD4+T细胞计数检测:CD4+T细胞计数在300~500/μl的患者建议每12个月检测1次;>500/μl的患者可选择性进行CD4+T细胞计数检测。但对于以下患者则需再次进行定期的CD4+T细胞计数检测:发生病毒学突破患者、出现艾滋病相关临床症状的患者、接受可能降低CD4+T细胞计数治疗的患者。
(1)评估疗效:
即病毒学、免疫学和临床效果评估。病毒学改变是最重要的指标。①病毒学指标:大多数患者抗病毒治疗后血浆病毒载量4周内应下降1个log以上,在治疗后的3~6个月应达到检测不到的水平。②免疫学指标:在HAART后1年,CD4+T细胞数与治疗前相比增加了30%或增长100/μl,提示治疗有效。③临床症状:反映抗病毒治疗效果中最敏感的指标是体重增加,儿童则可观察身高、营养及发育情况。但在开始治疗的最初的3个月出现机会性感染者应与IRIS相鉴别。
(2)检测病毒耐药性:
病毒耐药是抗病毒治疗失败的主要原因之一,对抗病毒疗效不佳或失败者可行耐药检测。
(3)观察药物副作用:
抗病毒药物的副作用直接影响患者依从性,进而影响治疗成败。使用AZT后出现严重贫血、高乳酸血症等可更换TDF(儿童感染者则换为ABC);出现乳酸酸中毒则停用所有NRTI,换用EFV+LPV/r,酸中毒纠正后半年可以使用含TDF的方案。NVP或EFV在出现严重皮疹或肝损害后可更换为LPV/r。EFV出现持续而严重的中枢神经系统毒性,如果患者无结核或肝炎,可以更换为NVP;如果合并肝炎者可以更换为LPV/r,合并结核者要合理评估决定。
(4)检测药物浓度:
特殊人群用药在条件允许情况下可进行血药浓度监测,如儿童、妊娠期妇女及肾衰竭患者等。
(二)机会性感染的处理
1.肺孢子菌肺炎
预防性治疗:CD4+T细胞计数<200/μl者均应服药。药物首选SMZ-TMP,一级预防为1片/d(1片剂量为0.48g),二级预防为2片/d。若患者对该药不能耐受或者过敏,替代药品有氨苯砜。服用至CD4+T细胞增至>200/μl并持续≥6个月时,可停止预防用药。一旦CD4+T细胞计数又降低到<200/μl时,应重新开始预防用药。
2.结核病
艾滋病患者结核病的治疗原则与非艾滋病患者相同,抗结核药物使用时应注意与抗病毒药物之间的相互作用及配伍禁忌。
治疗药物:异烟肼、利福平、利福布汀、乙胺丁醇、吡嗪酰胺,根据情况也可选用对氨基水杨酸钠、丁胺卡那、喹诺酮类抗菌药物及链霉素等。如果结核分枝杆菌对一线抗结核药物敏感,则使用异烟肼+利福平(或利福布汀)+乙胺丁醇+吡嗪酰胺进行2个月的强化期治疗,然后使用异烟肼+利福平(或利福布汀)进行4个月的巩固期治疗。对抗结核治疗反应延迟(即在抗结核治疗2个月后仍有结核病相关临床表现或者结核分枝杆菌培养仍为阳性)或胸片上出现空洞、骨和关节结核的患者,抗结核治疗疗程应延长至9个月。中枢神经系统结核患者,疗程应延长为9~12个月。鉴于HIV合并结核分枝杆菌感染者每年由潜伏转变为活动性结核者数量众多,故若有HIV感染者合并结核潜伏感染(外周血γ干扰素释放试验结果为阳性且排除活动性结核),可用以下方案进行干预:异烟肼300mg,每日1次口服,共9个月。联合使用维生素B6可减少周围神经炎的发生(25mg/d,口服)。替代方案:利福平600mg,1次/d,口服,连用4个月;或口服利福布汀,连用4个月。在进行预防性化疗之前应注意排除活动性结核病的可能。
3.非结核分枝杆菌感染
需要注意具体检出病原之分型及药敏结果。对于鸟分枝杆菌(MAC)感染的治疗的首选方案为:克拉霉素500mg/次,2次/d(或阿奇毒素500mg/d)+乙胺丁醇15mg/(kg•d)(分次服),重症患者可联合应用利福布汀(300~600mg/d)或阿米卡星(每次10mg/kg,肌内注射,1次/d)或喹诺酮类抗菌药物,疗程至少12个月。替代治疗方案:利福布汀(300~600mg/d)+阿米卡星(每次10mg/kg,肌内注射,1次/d)+环丙沙星(750mg/次,2次/d),疗程9~12个月。播散性MAC感染者在完成治疗(12个月以上)后,需要进行长期维持治疗(治疗方案与初始治疗方案一致)直至患者CD4+T细胞数增加到>100/μl并持续≥6个月时为止。其他分枝杆菌感染的治疗可根据具体鉴定的菌种及药敏结果采取相应的治疗措施。
预防性治疗:CD4+T细胞计数﹤50/μl的艾滋病患者需要给予预防性治疗,方案是克拉霉素500mg/次,2次/d;或阿奇霉素1 200mg,1次/周。如果患者不能耐受克拉霉素和阿奇霉素,可以选择利福布汀进行预防治疗,常规剂量为300mg,1次/d。如患者CD4+T细胞数增加到>100/μl并持续≥3个月时,可停止预防用药。一旦患者CD4+T细胞数<50/μl,就应再次给予预防性治疗。
4.CMV视网膜脉络膜炎
更昔洛韦10~15mg/(kg•d),分2次静脉滴注;2~3周后改为5mg/(kg•d),每日1次静脉滴注,或20mg/(kg•d)(分3次口服)。或膦甲酸钠180mg/(kg•d),分2~3次用(静脉应用需水化),2~3周后改为90mg/(kg•d)静脉滴注,1次/d。病情危重或单一药物治疗无效时可两者联用。CMV视网膜炎可球后注射更昔洛韦。
不主张进行CMV感染的一级预防。对于CD4+T细胞计数<200/μl的患者,可定期检查眼底。一旦出现CMV病,应积极治疗,在疾病控制之后需序贯用药以预防复发。在经HAART治疗后CD4+T细胞计数>100/μl且持续3~6个月以上时可以考虑停止二级预防。
5.弓形虫脑病
病原治疗:首选乙胺嘧啶(负荷量100mg,口服,2次/d,此后50~75mg/d维持)+磺胺嘧啶(1~1.5g,口服,4次/d)。替代治疗:SMZ-TMP(3片/次,3次/d口服)联合克林霉素(600mg/次,静脉给药,每6小时给药一次)或阿奇霉素(0.5g/d)。疗程至少6周。辅以对症治疗:降颅压、抗惊厥、抗癫痫等。
既往无弓形虫脑病史但CD4+T细胞数<200/μl且弓形虫抗体IgG阳性的患者应预防用药,一般采用SMZ-TMP,2片/次,1次/d。对既往患过弓形虫脑病者要长期用乙胺嘧啶(25~50mg/d)联合磺胺嘧啶(2~4g/d)预防,直至CD4+T细胞增加到>200/μl并持续≥6个月方可暂停用药。一旦CD4+T细胞数<200/μl时,需重启预防用药。
6.真菌感染
(1)念珠菌感染:
口腔念珠菌感染,首选制霉菌素局部涂抹加碳酸氢钠漱口水漱口,疗效欠佳者可口服氟康唑,100~200mg/d,疗程为7~14天。食管念珠菌感染,氟康唑100~400mg/d,口服,不能耐受口服者静脉使用氟康唑(400mg/d)进行治疗,疗程为14~21天。肺部念珠菌感染,首选两性霉素B[0.6~0.7mg/(kg•d)]治疗,也可选用氟康唑[6mg/(kg•d)]口服或静脉滴注,疗程通常为3~6个月,影像学上肺部病灶吸收或钙化后可停药。重症患者氟康唑可增加剂量和延长疗程。非白念珠菌或耐药念珠菌感染可选用卡泊芬净、伏立康唑、伊曲康唑或两性霉素B等。
(2)新型隐球菌感染:
新型隐球菌脑膜炎的病原治疗分为诱导期、巩固期和维持期三个阶段,诱导期治疗经典方案为两性霉素B联合5-氟胞嘧啶。两性霉素B为0.5~0.7mg/kg,从小剂量每天递增,5-氟胞嘧啶每天100~150mg/kg,分4次口服。诱导治疗期4~8周。在脑脊液培养转阴后改为氟康唑(600~800mg/d)进行巩固期治疗,巩固治疗期至少6周,而后改为氟康唑(200mg/d)进行维持治疗,维持期1年以上,应持续至患者在抗病毒治疗后,CD4+T细胞数达100/μl或以上,并持续至少6个月时方可停药。诱导期替代方案:氟康唑800~1 200mg,1次/d,联合5-氟胞嘧啶每天100~150mg/kg(每天分4次服)。
肺隐球菌感染:推荐使用氟康唑,每天400mg口服或静脉滴注,疗程12个月,如抗病毒治疗后CD4+T细胞数>100/μl,则在治疗1年后停止氟康唑维持治疗。
一般不推荐一级预防。如患者反复出现念珠菌感染或感染的程度较重,可考虑预防用药,首选氟康唑200mg/次,1次/d口服。对于曾患隐球菌感染的患者需长期维持治疗以防复发,首选氟康唑200mg/次,1次/d口服,也可使用同剂量的伊曲康唑替代。当患者的CD4+T细胞数>200/μl并持续至少6个月时,可停止预防用药。一旦CD4+T细胞数<200/μl需再次给予预防性治疗。
(三)机会肿瘤的处理
淋巴瘤和卡波西肉瘤为艾滋病常见肿瘤,其治疗方法多属专科之列,应有专科医师依据相关指南进行。需注意抗病毒药物和化疗药物之间的相互作用。
(四)HAART治疗后特殊问题的处理
1.方案的调整
在初始治疗中出现病毒学失败应进行二线治疗。病毒学失败的定义:在持续进行HAART的患者中,开始治疗(启动或调整)48周后血浆HIV RNA持续>200拷贝/ml;或病毒学反弹:在达到病毒学完全抑制后又出现HIV RNA>200拷贝/ml的情况。出现治疗失败时应首先评估患者的治疗依从性、药物-药物或药物-食物相互作用。若上述问题解决而病毒学结果无明显改善,则需行耐药检测。根据耐药监测结果调整治疗方案。二线治疗方案的选择原则是使用至少2种,最好3种具有抗病毒活性的药物;任何二线治疗方案都应包括至少一个具有完全抗病毒活性的bPI加用一种未曾使用过的药物类型(即融合、整合酶或辅助受体抑制剂)。
2.免疫重建炎症综合征(IRIS)
是艾滋病患者在经抗病毒治疗后免疫功能恢复过程中出现的一组临床综合征,主要表现为发热、潜伏感染的出现或原有感染的加重或恶化。多种潜伏或活动的机会性感染在抗病毒治疗后均可发生IRIS,如结核病、PCP、新型隐球菌感染等,在合并HBV及HCV感染时IRIS可表现为病毒性肝炎的活动或加重。IRIS多出现在抗病毒治疗后3个月内,需与原发或新发的机会性感染相鉴别。除了机会性感染,其他疾病如结节病和卡波西肉瘤也可出现IRIS。出现IRIS后应继续进行抗病毒治疗。原有感染恶化的IRIS通常为自限性,不用特殊处理而自愈;因潜伏感染而出现的IRIS,需要进行针对性的病原治疗;严重者可短期应用激素等控制。激素避免用于卡波西肉瘤患者及不确定的TB-IRIS患者(即不能排除结核治疗无效的情况)。CMV感染患者慎用激素,如需要使用,应当采取短程口服治疗。IRIS发生的高危因素有:首次进行抗病毒治疗、基线病毒载量高及基线CD4+T细胞数较低者。此类患者在抗病毒治疗后应警惕IRIS的发生。有效控制机会性感染后再进行抗病毒治疗或抗病毒治疗前积极发现潜在机会性感染可降低IRIS的发生率。
由于没有可用疫苗,医疗环节的工作只是整个艾滋病防治体系中靠后的部分。只有全社会的广泛动员和共同协作努力才能做好艾滋病的防控。就传染病流行之三个环节:传染源、传播途径及易感人群而言,医疗工作人员仅能投身于扩大治疗、寓防于治及防治职业暴露和母婴传播。传染源的发现、易感人群的保护则需要全社会了解艾滋病和自觉采取相应措施以避免危险行为。一旦发生相应暴露而可能感染HIV时,需要避免进一步传播并尽早接受HIV抗体筛查。以下将从几个方面进行论述。
1.加强宣传
让全民了解艾滋病的三大传播途径,教育大众许多生活接触不会传播艾滋病,避免发生“恐艾症”。
2.加强艾滋病检测
掌握数据,以利于国家制定法律、法规。
3.加强业务培训
规范诊断与治疗,制定适合我国农村地区的治疗指导方案。
4.性传播的阻断
我国新发感染者中性传播的比例已上升至首位,而性传播除因商业性行为导致的异性传播外,男男同性间传播的病例也逐年上升,做好该途径的传播阻断极为困难,全社会各部门的协调至关重要。
5.阻断母婴传播
(1)抗反转录病毒药物干预:
所有感染HIV的孕妇不论其CD4+T细胞计数多少或临床分期如何,均应终身治疗。推荐方案:TDF/FTC(或TDF+3TC 或ABC+3TC)+LPV/r(或RAL)。替代方案:TDF/FTC(或TDF+3TC或ABC+3TC或AZT/3TC或AZT+3TC)+EFV或DTG或RPV或NVP。早先的动物研究和个案报道中发现早孕期妇女暴露于EFV引起神经管畸形的风险升高,目前认为EFV可以应用于妊娠各个阶段。NVP不良反应较多,而且只可以用于CD4+T细胞<250/μl的女性。RPV不能用于HIV病毒载量>100 000拷贝/ml和CD4+T细胞计数<200/μl的患者。艾滋病感染母亲所生婴儿应在出生后尽早(6~12小时内)开始服用抗病毒药物,常规给予AZT或NVP,直至生后4~6周,对于孕期抗病毒治疗不满4周或产时才发现感染者,所生婴儿服用抗病毒药物应延长至6~12周龄。
(2)安全助产:
对于已确定HIV感染的孕妇,主动提供预防艾滋病母婴传播咨询与评估,由孕产妇及其家人在知情同意的基础上作出终止妊娠或继续妊娠的决定。对于选择终止妊娠的,应给予安全的人工终止妊娠服务,应尽早手术,以减少并发症的发生。对于选择继续妊娠的,应给予孕期保健、产后喂养等问题咨询,并采取相应干预措施。医疗保健机构应当为HIV感染孕产妇提供安全的助产服务,尽量避免可能增加HIV母婴传播危险的会阴侧切、人工破膜、使用胎头吸引器或产钳助产、宫内胎儿头皮监测等损伤性操作,以减少在分娩过程中HIV传播的概率。
(3)产后喂养指导:
应当对HIV感染孕产妇所生儿童提倡人工喂养,避免母乳喂养,杜绝混合喂养。对于因不具备人工喂养条件而选择母乳喂养的感染产妇及其家人,指导其坚持正确的纯母乳喂养,且在整个哺乳期间必须坚持抗病毒治疗,喂养时间不超过6个月。同时,应为感染孕产妇所生婴幼儿提供常规保健、生长发育和感染状况的监测、免疫接种、艾滋病检测(包括抗体检测和早期核酸检测)等,并预防营养不良。
6.血液传播的阻断
禁止静脉吸毒。血液制品管理方面,采取严打地下血站、血霸,对供血者严格进行HIV抗体检测等措施。此外,对人白蛋白、丙种球蛋白的管理也十分重要。
7.职业暴露预防
(1)暴露危险度评估:
确定具有传染性的暴露源包括血液、精液和阴道分泌物。脑脊液、关节液、胸腔积液、腹水、心包积液、羊水等体液也具有传染性,但其引起感染的危险程度尚不明确。粪便、鼻分泌物、唾液、痰液、汗液、泪液、尿液及呕吐物通常认为不具有传染性。暴露源危险度的分级:①低传染性,病毒载量水平低、无症状或高CD4水平;②高传染性,病毒载量水平高、艾滋病期、原发HIV感染、低CD4水平;③暴露源情况不明,暴露源所处病程阶段不明、暴露源是否为HIV感染及污染的器械或物品所带的病毒载量不明。
发生职业暴露的途径包括:暴露源损伤皮肤(刺伤或割伤等)和暴露源沾染不完整皮肤或黏膜。如暴露源为HIV感染者血液,那么经皮肤损伤暴露感染HIV的危险性为0.3%,经黏膜暴露为0.09%,经不完整皮肤暴露的危险度尚不明确,一般认为比黏膜暴露低。高危险度暴露因素包括暴露量大、污染器械直接刺破血管、组织损伤深。
(2)HIV职业暴露后处理原则:
①用肥皂液和流动的清水清洗污染局部;②眼部黏膜等污染时,应采用大量生理盐水反复冲洗黏膜;③存在伤口时,应轻压伤口处,尽可能挤出损伤处的血液,再用肥皂液和流动清水冲洗伤口;④用75%的酒精或0.5%碘伏对伤口局部进行消毒、包扎处理。
(3)预防治疗的适应证:
当HIV感染状态不明或暴露源不明时,不论暴露级别高低,通常不进行预防用药。如暴露源来源于HIV高危者或感染者则采取预防用药。
(4)HIV暴露后预防性抗反转录病毒治疗:
推荐方案为TDF/FTC+LPV/r或RAL或DTG。如果INSTIs不可及,可以使用PIs如LPV/r和DRV/c。对合并肾脏功能下降者应选择AZT+3TC。在发生HIV暴露后应尽可能在最短的时间内(尽可能在2小时内)进行预防性用药,最好不超过24小时,但即使超过24小时,若不超过72小时,也建议实施预防性用药。疗程为连续服用28天。
(5)HIV暴露后监测:
发生HIV暴露后立即、4周、8周、12周和6个月后检测HIV抗体。应用预防用药后,定期监测血常规、肝肾功能(服药2周、4周)。一般不推荐进行HIV P24抗原和HIV RNA测定。
8.疫苗
目前尚无成功预防性疫苗问世。













