肠道病毒(enterovirus,EV)包括脊髓灰质炎病毒、柯萨奇病毒(Coxsackievirus,Cox)、埃可病毒(ECHO virus,ECHO)及陆续发现的新型肠道病毒。肠道病毒感染呈世界性流行,可累及全身多个系统,不同年龄人群均可受染,儿童尤为多见。临床表现复杂多样,虽大多属轻症,但也偶可危及生命。本节主要介绍肠道病毒感染所致的无菌性脑膜炎、脑炎、类脊髓灰质炎、心肌炎、疱疹性咽峡炎、流行性急性结膜炎、流行性胸痛、手足口病、呼吸道感染、婴儿腹泻、出疹性疾病等。
EV属于微小RNA病毒科(Picornavirdae)的肠道病毒属,具有不少共同的理化生物学特点。病毒呈圆球状颗粒,直径30nm,体积很小,在电镜下形态与其他微小RNA病毒相似,病毒核酸内核为单股正链RNA,相对分子量为(2.3~2.8)×106,其基因组由约7 500个核苷酸组成,长约7.5kb。有4种衣壳蛋白VP1、VP2、VP3和VP4,呈20面体,立体对称。病毒颗粒裸露,无囊膜。EV抗乙醚、乙醇等消毒剂,耐酸,对氧化剂如游离氯、高锰酸钾等都甚敏感,在pH 3~10很稳定,低温-70~-20℃仍保持活力,长期存活,在自来水中存活2~168天,在土壤中存活25~125天。病毒不耐高温,56℃ 30分钟灭活,煮沸立即死亡。在干燥环境及紫外线照射下极不稳定,紫外线0.5~1小时即死亡,也可被3%~5%甲醛、酚和放射线灭活。
目前除脊髓灰质炎病毒以外的EV被分为EV A~D 4个组别,共有104种血清型(表1)。除少数型别外,肠道病毒各型之间一般无交叉免疫。
表1 人类肠道病毒分型
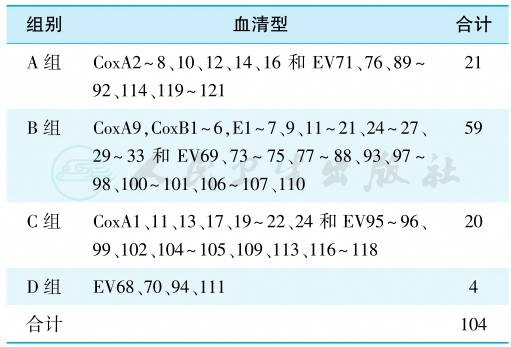
根据病毒衣壳蛋白VP1序列的差异来区分,EV71又有A、B、C三个基因型,含11个亚型,其中B型含B1~B5五个亚型,而C型也含C1~C5亚型。
柯萨奇病毒以CoxA和B表示,埃可病毒以ECHO(E)显示,新型肠道病毒则以EV表示,该型从EV68开始命名,表1中显示的EV,仅限于和人类感染相关者。
患者及带病毒者为传染源。EV主要从粪便排出,可持续几周到1~2年,也可从咽部排出,但时间短,持续1~2周,患者血液、脑脊液、胸腔积液、皮疹疱液、唾液、尿及骨髓中都可分离出病毒。本病主要经粪-口传播,也可经呼吸道或由污染的手、食品、衣服、用具等传播。
EV传播极广,隐性感染和显性感染之比为100∶1。EV所致疾病终年可见,但以夏、秋季为多。各年龄组均可受染,但以婴幼儿和儿童为主,1岁以下婴儿感染率比儿童和成人高7倍;但也有主要侵犯成人的流行报道。每年流行的病毒型别常有变动,是本病流行的特点。
由EV所致的手足口病(HFMD)于1957年由新西兰首先报道,CoxA16和EV71所致者多见。亚太地区在20世纪70年代多次发生HFMD的暴发与流行。新加坡曾发生2次HFMD暴发,主要致病原均为CoxA 16。日本发生过2次EV71相关HFMD流行。20世纪90年代后期,亚太地区HFMD的暴发或流行次数明显增多,如马来西亚发生EV71流行(2 628例,其中39例有中枢神经系统病变,死亡30多例)。澳大利亚和新加坡共报告3 790例病例,死亡3例。我国台湾发生EV71感染大暴发,共报告近13万例HFMD和疱疹性咽峡炎,其中405例为有中枢神经系统感染的重症病例,78例死亡。2000年和2001年台湾地区再次暴发。
近年来婴幼儿手足口病在中国大陆各地流行,病情危重者出现脑干脑炎、肺水肿、肺出血而死亡。引起我国手足口病血清型高达30多种,以EV71、CoxA16、CoxA6和CoxA10多见,危重型病例多由EV71感染所致,以C4基因型为主。自2008年5月2日起我国已将手足口病纳入丙类传染病进行传染病报告和管理。2008—2017年,我国手足口病平均年发病率约为147/10万,共报告约1 817万例,其中重症病例约15万例,死亡3 500多人,发病和死亡数均居丙类传染病的第一位。
病毒从咽部或肠道侵入,于局部黏膜及淋巴组织中繁殖,并从局部排出,此时即可出现局部症状。继而病毒又侵入局部淋巴结,并由此进入血液循环导致病毒血症。病毒经血液循环侵入全身网状内皮组织、深层淋巴结、肝、脾、骨髓等处,大量繁殖后再次进入血液循环后,病毒可随血流进入中枢神经系统、皮肤黏膜、心脏、呼吸器官,肝、胰、肌肉等处而引起病变。
因各病毒所对应的宿主细胞受体不同,故不同EV株对组织的嗜性各异,所导致的临床疾病呈现多样性。中枢神经系统病变和脊髓灰质炎相似,但一般较轻,以脑膜炎症为多见。脑炎患者有灶性单核细胞浸润及退行性变。CoxB组病毒感染在新生儿常引起广泛病变,涉及脑、肝、心等,病变以灶性坏死为主,伴淋巴细胞及中性粒细胞浸润。心肌炎患者常有间质淤血及炎症细胞聚集、心肌纤维灶性坏死、心包炎性浸润等。肌肉可见细胞浸润和肌纤维坏死。
EV71有高度嗜神经性,EV71的靶器官是脑干。尸检样本中发现病毒主要侵犯脑干、下丘脑、丘脑底、齿状核和脊髓灰质。肺水肿/肺出血是儿童感染EV71后的死因,肺水肿的机制是EV71破坏延髓的内侧、腹部和尾部,导致交感神经过度激活,自主神经功能紊乱,最终导致肺水肿。此外,由于细胞因子的异常激活,引起严重炎症反应,导致肺血管的通透性明显增加,诱发急性呼吸窘迫综合征。
人体感染EV后,产生3种特异性免疫抗体,即唾液及肠道局部产生的分泌型IgA、血清特异性IgM抗体和血清特异性IgG中和抗体。IgM抗体于感染后1~3日即可出现,能维持数周,其阳性表示新近感染;而IgG中和抗体增高则表示既往感染。IgG能通过胎盘传至胎儿,使之获得被动免疫,IgM则不能通过胎盘。
(一)血常规
白细胞计数大多正常,分类以淋巴细胞为主。在某些EV感染时白细胞计数可升高。
(二)病毒分离
一般采集咽拭子及粪便进行病毒分离和鉴定,尚可从患者的脑脊液、胸腔积液、心包积液、血液中或活检、尸检的组织中分离到病毒。标本可接种于WHO推荐的敏感细胞进行组织培养,观察细胞病变。同时用几种组织培养细胞进行分离以提高阳性率。阳性标本再以特异性免疫血清做中和试验进行型别鉴定。疑有CoxA组或B组病毒感染者,应将标本经皮下、腹腔或脑内途径接种乳鼠,以提高病毒分离率。
(三)血清免疫学检查
采集病初及恢复期双份血清,测定病毒型特异性抗体水平,一般用中和试验、补体结合试验、酶联免疫吸附试验等方法,其中以中和试验最为可靠,中和试验阳性消失最慢,型特异性也较强,恢复期抗体水平比早期有≥4倍上升,则诊断意义极大。因EV型多,血清学中和试验工作量大,仅在某地出现已知型别EV流行时,用此法进行诊断比较理想。
(四)分子生物学方法
采用分子生物学技术进行病毒基因扩增和氨基酸或核苷酸测序鉴定分子生物学型别,可应用cDNA探针、RNA探针或寡核苷酸探针,尤以后两者为优。从患者血液、脑脊液中可测出EV RNA,阳性率高,能在24小时内得到结果。
对EV感染迄今尚无特效治疗,主要为一般治疗和对症治疗。急性期应卧床休息。有呕吐、腹泻、食欲缺乏者要注意水、电解质平衡,对发生惊厥及严重肌痛者,可适当给予镇静剂和止痛剂。出现急性心肌炎伴心力衰竭时,积极抢救,及早采用抗心力衰竭抗休克治疗。在疾病早期和轻症时一般不主张应用肾上腺皮质激素,病情严重时可适当应用,可考虑早期应用免疫球蛋白。
EV71感染重症HFMD病例从第2期发展到第3期多在1天以内,偶尔在2天或以上。从第3期发展到第4期有时仅为数小时。因此,应当根据临床各期不同病理生理过程,采取相应救治措施。第1期:无需住院治疗,以对症治疗为主。第2期:使用甘露醇、利尿药等脱水降低颅内高压;适当控制液体入量;对持续高热、有脊髓受累表现或病情进展较快的病例可酌情应用丙种球蛋白。密切观察体温、呼吸、心率、血压及四肢皮肤温度变化等可能发展为危重型的高危因素,尤其是3岁以内、病程5天以内的病例。第3期:应收入ICU治疗。在第2期治疗基础上,阻断交感神经兴奋性,及时应用血管活性药物,同时给予氧疗和呼吸支持。酌情应用丙种球蛋白、糖皮质激素,不建议预防性应用抗菌药物。第4期:在第3期治疗基础上,及早应用呼吸机,进行正压通气或高频通气。肺水肿和肺出血病例,应适当增加呼气末正压;不宜频繁吸痰。第5期:给予支持疗法,促进各脏器功能恢复;肢体功能障碍者给予康复治疗;个别病例需长期机械通气治疗以维持生命。
重视环境卫生和个人卫生。孕妇切忌与患者接触,婴儿尽量哺母乳,有报告母乳中含抗EV抗体。由于EV型别甚多,制备特异行疫苗有一定困难,中国自主研发的EV71灭活疫苗于2015年底获得批准。接种对象是6~36月龄的健康婴幼儿,接种2剂,间隔28天。上市前的1~3期临床试验结果表明疫苗接种是安全的,预防EV71手足口病和EV71相关疾病的有效率分别是90%和80.4%。













