英文名称 :viral infectious diseases
病毒性疾病主要可分为急性感染性病毒疾病与持续性感染性病毒疾病,一方面由于病毒的繁殖是复制形式,即病毒体进入易感细胞后可以复制出数百甚至数千个子代病毒体,完全不同于细菌或其他病原微生物的二分裂方式,因此一大类病毒性疾病多表现为急性感染,并可迅速发病与传播,如流行性感冒、手足口病等。另一方面由于病毒的基因组可整合入宿主细胞的染色体,或在宿主细胞染色体外的胞质内以附加体长期存在,所以另一大类病毒性疾病表现为持续性感染,如艾滋病、乙型肝炎、单纯疱疹等。此外,由于病毒必须在活细胞中增殖而与细胞的诸多蛋白及基因相互作用,因此还与肿瘤、自身免疫疾病等相关,如人乳头状瘤蛋白E6、E7可激活细胞的癌基因或致抑癌基因失活,与肿瘤的发生、发展密切相关。因此病毒性疾病不仅致病机制复杂,而且疾病的结局也呈多样性。
(一)病毒的形态与结构
迄今为止病毒中最大的是痘类病毒,约为230nm×260nm,最小的是微小DNA病毒。小的RNA病毒如脊髓灰质炎病毒,直径约为20nm。病毒只有一种核酸作为其基因组(DNA或RNA)。这一特性是病毒不同于其他生物基因组的最重要特点。在基因组核酸等外,包有蛋白质衣壳,也称为核衣壳。蛋白质衣壳不仅起着保护核酸的作用,还具有抗原性,并在某些病毒(如鼻病毒、肠道病毒)中有识别易感细胞表面受体的作用。根据核衣壳的形态,病毒可分为立体对称、螺旋对称或复合对称。在核衣壳外,有些病毒还另有一层包膜(如流感病毒、疱疹病毒、人类免疫缺陷病毒等)。包膜来源于病毒感染的细胞,但包膜上的糖蛋白则由病毒基因编码。糖蛋白可形成突起,常是病毒吸附于细胞表面受体的配体,如流感病毒的血凝素。病毒的大小、形态和核衣壳的对称类型仅可作为病毒归属哪一科的参考,但不能以此区分病毒的属或种。
(二)病毒的复制
病毒的复制是病毒生命活动的中心,也是病毒致病的基础。在病毒感染者中常以血清中病毒的拷贝数反映病毒复制的程度。病毒的繁殖过程一般经过吸附、脱衣壳、复制、装配与释放等几个阶段。首先病毒通过吸附于易感细胞表面的受体穿入细胞或与细胞融合,或直接入侵细胞。通过脱衣壳,病毒的基因组才能释放入细胞内而发挥作用。脱衣壳后的病毒核酸一般指令感染的细胞停止合成细胞的核酸和蛋白,转而合成病毒的核酸和蛋白。
病毒的核酸种类众多,复制的形式也各不相同。基本可分为RNA病毒(包括正单链、负单链、分节段与双链RNA病毒),RNA与DNA反转录病毒(包括嗜肝DNA病毒、RNA反转录病毒)及DNA病毒(包括双链及单链)三大类。其中分节段RNA病毒可能是由单链RNA病毒保留分阶段地缺失突变后,又与其他病毒融合而形成。
大多数DNA病毒的核酸进入宿主细胞的核内,以类似细胞的DNA以半保留复制形式进行核酸复制。因此DNA病毒有较多机会与宿主细胞作用。核酸通过装配,在蛋白衣壳内形成核衣壳,但无包膜的病毒可裂解细胞而直接自细胞释放。有包膜的病毒则需加上包膜后释放(如单纯疱疹病毒等)。
大多数RNA病毒的基因组并不进入细胞核,仅在胞质内复制。正链和负链RNA基因组的区别是基因组RNA是否同时具有mRNA的功能。因RNA病毒核酸的复制需要依赖RNA的RNA多聚酶,而细胞没有这种酶,因此需要病毒本身提供。当RNA病毒核酸可起到mRNA的作用时则称为正链RNA病毒,而负链RNA病毒的核酸不具有mRNA的功能,不能合成病毒的蛋白,因此负链RNA病毒必需在其核衣壳内带有依赖RNA的RNA多聚酶方可进行复制。因RNA病毒的核酸复制不像DNA病毒需经过校正过程,所以RNA病毒比DNA病毒的核酸突变概率为高。此外,由于RNA病毒的复制仅限于胞质内,病毒的基因也不会与细胞染色体DNA整合。
另有一类介于DNA病毒与RNA病毒之间的病毒即反转录病毒科及嗜肝DNA病毒科,其共同特点是病毒在复制过程中与中心法则不同,均有反转录阶段。中心法则是自DNA转录为RNA,反转录阶段则是自RNA反转录为DNA。反转录病毒科的HIV、人类嗜T细胞病毒(HTLV)-1等的基因组虽为RNA,但在复制过程中,RNA基因组先经反转录酶拷贝成RNADNA,再经RNA酶H降解除去病毒RNA,最终获得的全长双链病毒DNA可整合入宿主细胞的染色体中。嗜肝DNA病毒的基因组虽为双链DNA,但也需经过反转录阶段。在病毒DNA复制过程中,即以RNA为模板,经反转录而复制出子代病毒基因组的负链DNA链,并据此再复制出正链DNA。由于这类病毒具有共同特殊的复制特性,因而在抗病毒药物的研发及应用方面也有共性。目前多数抗乙型肝炎病毒复制的药物即源于抗艾滋病毒的药物。
病毒基因组复制完成并经蛋白壳体装配后,可通过裂解宿主细胞释放(如肠道病毒),也可通过自宿主细胞出芽由包膜覆盖后缓慢释放(如疱疹病毒)。在病毒释放前,包膜结构中病毒的部分蛋白或多糖可出现在细胞膜表面并可被宿主的免疫系统所识别。释放出的病毒体可再次感染新的细胞。一般通过裂解释放的病毒对于抗体的中和作用较敏感。有的病毒通过细胞之间的融合而在细胞间传播(如呼吸道合胞病毒),也有少数病毒通过整合入细胞的染色体,随细胞的分裂而传至下一代细胞(如反转录病毒)。病毒作用于细胞后通过复杂的机制还可潜伏于细胞内,在一定条件下可被激活而大量复制(如疱疹病毒科)。有些DNA病毒感染细胞后还可促使细胞转化,甚至发生癌变(如人乳头状瘤病毒)。
综上所述,病毒感染的过程是具有分子水平、细胞水平、整体水平交错作用的复杂过程,其特点为,不同种类病毒的基因组可改变细胞的代谢甚至改变细胞的遗传特性。整体情况下,机体的免疫系统又会根据病毒和细胞相互作用的不同过程与结果分别发挥免疫保护或免疫损伤作用。
(三)病毒的分类
过去传统的病毒分类是根据病毒感染或传播的途径或所致疾病的种类而确定。其缺点为,许多病毒可经多途径感染,所致疾病也多样化。此外,病毒的生物学特性可随机体的不同情况(年龄、免疫状态、营养状态、器官健康状态等)而出现不同症状和导致不同预后。因此目前均以病毒的核酸型为主,结合基因组特性、病毒的大小、衣壳对称性进行分类(表1)。
表1 感染人类的主要病毒科(及一个种、朊粒)的特性
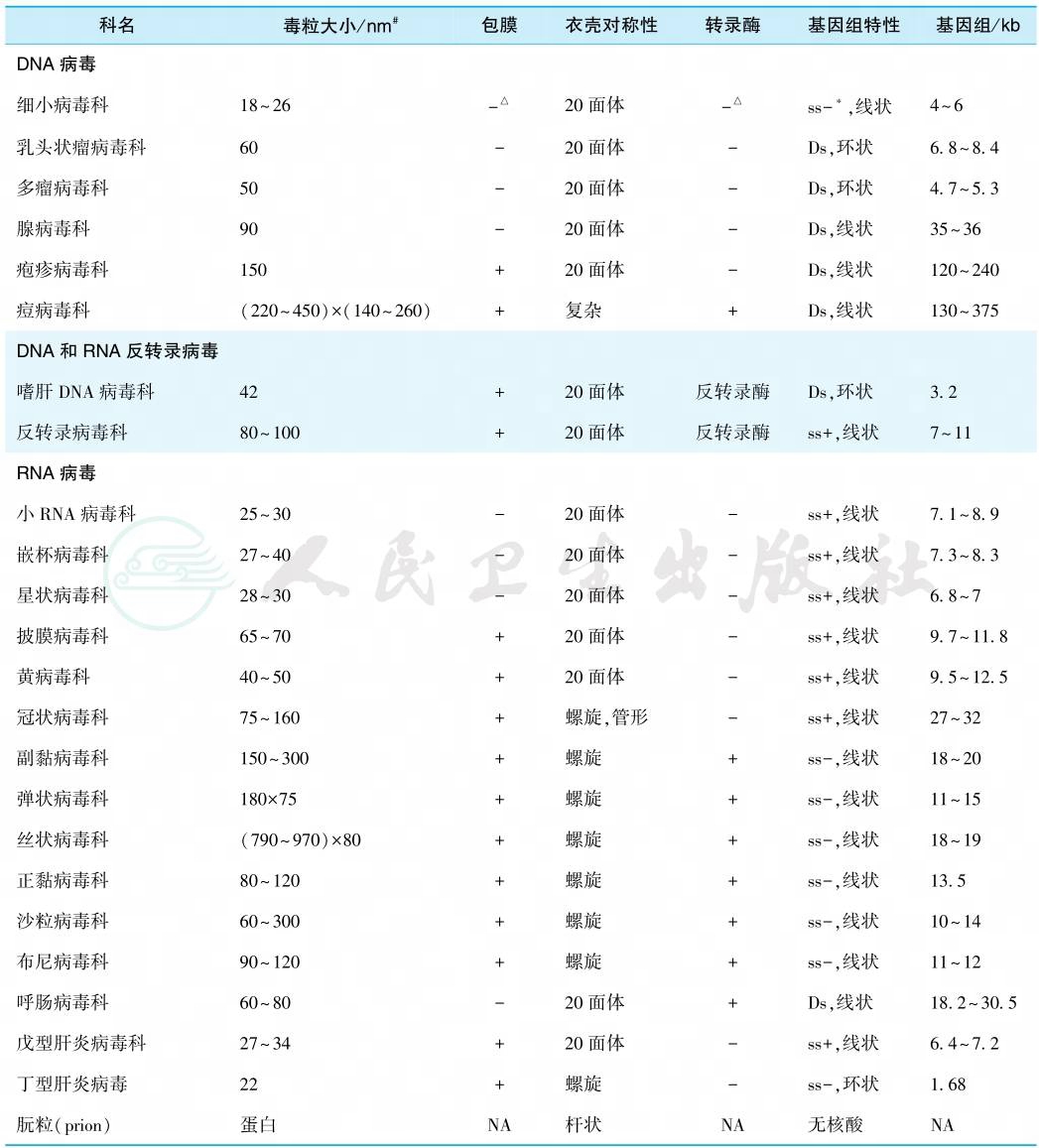
注:△+、-代表有、无;∗-为负链,+为正链;#以直径计算,少数不规则型者以多个数值表示;Ds.双链;ss.单链;NA.不适用。
从医学实际情况来看,病毒感染个体或群体均与细胞培养中的情况不同。在细胞培养中,一个病毒体常可致感染与病毒复制;然而在自然界中,病毒在传播时会遇到不利环境和机体天然(非特异)免疫系统的抵抗作用,因此病毒能引起感染必需是一定数量的病毒,经过一定的传染途径,逃逸机体的天然免疫机制,并需接触到病毒的易感细胞才可构成感染。病毒的感染主要由病毒的嗜性所左右。嗜肠道的病毒在消化道中繁殖,而嗜神经的病毒则在神经系统的细胞中繁殖。有些病毒是泛嗜性的,如脊髓灰质炎病毒、疱疹病毒等,可以感染多种系统。病毒的嗜性与细胞表面是否有病毒的受体相关,但也与细胞内是否具有病毒表达其基因所需要的诸多条件有关。只有细胞同时具备这两种因素,病毒才能完成感染。在同一环境下,每一个体是否感染病毒也不一致。幼儿及未接触过某一病毒的个体因缺乏特异性抗体往往是病毒入侵的对象。各种病毒感染机体后所引起的隐性感染与显性感染的比例也不同。如脊髓灰质炎病毒致瘫痪与隐性感染的比例约为1∶100,而麻疹的显性感染率约为100%。病毒可致急性感染、慢性感染、持续性感染及无症状病毒携带者。病毒的致病作用主要与以下几个方面相关。
1.病毒复制直接破坏宿主细胞
病毒在细胞内复制,最终可裂解宿主细胞造成损伤。
2.病毒抗免疫机制
病毒与宿主细胞在进化过程中相互依存相互作用,因此病毒具有一系列抗宿主免疫的机制,成为其致病的主要环节。例如,乙型肝炎病毒可以作用于干扰素系统,使其不被天然免疫系统识别。病毒感染细胞后可激发程序性细胞死亡,这些细胞不会再被新的病毒感染,可视为一种天然的免疫机制。有些病毒的蛋白可抑制细胞凋亡,如腺病毒的E1B蛋白。有些病毒能利用细胞凋亡的机制损害宿主。有些病毒可以编码同宿主相似的蛋白,使宿主免疫系统将其判断为自身抗原而不产生免疫反应,因而得以建立持续性感染。
3.病毒蛋白的致病作用
有些病毒蛋白本身即有毒性作用,如已发现轮状病毒的NSP4蛋白能在小鼠中引起腹泻,其作用类似细菌的毒素。病毒酶的序列也影响病毒的复制与致病性,如禽流感病毒PB2蛋白的序列可决定毒株是否在哺乳动物(猪)中复制,与对哺乳动物的致病性高度相关。
4.病毒的变异
病毒变异也是病毒致病的重要功能,其中病毒抗原的变异尤为重要。当病毒表面的重要蛋白发生抗原变异,则可逃逸抗体对原有抗原的识别,出现病毒免疫逃逸株而引起新的感染。例如流感病毒如发生不同毒株间基因片段的置换,会出现新的毒株,其表面的血凝素及神经氨酸酶的抗原性与原有流行毒株显著不同,可引起人群中的流感大流行。病毒抗原性的变异在病毒的血清学诊断和疫苗上也会带来问题。
5.病毒转化细胞的作用
目前已知7种感染人类的病毒与肿瘤发生有密切关系,即EB病毒、乙型肝炎病毒、丙型肝炎病毒、人乳头状瘤病毒、卡波西肉瘤相关疱疹病毒、梅克尔细胞多瘤病毒和人类嗜T细胞病毒(HTLV)。这些病毒有转化细胞的作用,细胞不被病毒裂解反而可无限制地在体外传代及长期生存,机制在于抑制宿主细胞内以p53和pRB蛋白为核心的肿瘤抑制信号通路,并调节多种作用于细胞生长、增殖及生存的通路,从而转化受感染的细胞,使之易于病毒的复制、组装及逃避自噬,也促进了肿瘤形成。
6.病毒引起的免疫病理作用
病毒诱生的细胞免疫和体液免疫可通过杀伤靶细胞,抗体介导对细胞的损伤及组成免疫复合物等启动免疫病理作用而损伤组织或器官。另外,病毒感染可引起宿主的细胞因子功能紊乱或失调,导致疾病加重,可称为“细胞因子暴风雨”(cytokine storm)式变化。
7.病毒分子模拟的作用
病毒感染可能会通过“分子模拟”的作用导致自身免疫系统紊乱。当病毒感染激活了针对特定病毒抗原的免疫细胞,若相似的抗原同样也存在于宿主细胞,被激活的免疫细胞也会对这个宿主细胞反应。临床上也观察到,HIV病毒感染与一些自身免疫疾病呈明显相关性,如多发性硬化。
(一)天然免疫
在抗病毒感染中除与对其他种类微生物感染相同的天然免疫机制外,自然杀伤(natural killer,NK)细胞、自然杀伤T细胞(NKT细胞)、干扰素和细胞凋亡起重要作用。但天然免疫无针对病毒的特异性,且作用较适应性(特异性)免疫为弱。
动物实验显示当去除NK细胞后,多种病毒感染均可出现严重疾病。NK细胞杀伤细胞的机制是促使靶细胞凋亡。病毒感染机体后可通过多种途径活化NK细胞发挥抗感染作用,但同时病毒本身也发展出多种策略诱导NK细胞功能低下来逃逸NK细胞介导的清除。
NKT细胞是一类与自然杀伤细胞具有共同表面标记的T细胞,可识别由CD1d提呈的糖脂类抗原。近来一些研究发现NKT细胞在抗病毒中发挥作用。HBV转基因小鼠模型证实,表达HBV的肝细胞可产生内质网相关的内源性抗原脂质(包括溶血脂质),后者可活化NKT细胞。活化的iNKT细胞通过分泌IFN-α/β/γ和活化NK细胞来抑制HBV增殖。
干扰素是一种在生物中普遍存在的天然免疫系统。干扰素没有直接的杀病毒作用,必须通过宿主细胞而发挥作用。干扰素的作用是通过与细胞表面的干扰素受体结合后,激活了JAK(一种细胞质内的蛋白酪氨酸激酶)使细胞质内的ISGF(干扰素激活因子)亚单位磷酸化,聚合后进入核内,作用于多种干扰素效应因子(包括蛋白激酶、2-5A系统等)的基因促使它们表达而起抗病毒的作用。干扰素在抗病毒感染中是机体最早出现的防御反应因子,在防止病毒在体内扩散及在病毒感染已经成立的阶段中也起一定的作用。临床实践中,在急性病毒感染抗体尚未产生前,机体已经开始恢复,即为干扰素的作用。
病毒感染细胞后,如病毒无对抗诱导细胞凋亡的机制,多数情况下细胞发生凋亡。因细胞凋亡可破坏病毒复制的场所,从而可抑制病毒复制。
(二)适应性免疫(特异性免疫)
树突状细胞通过对病毒抗原的摄取、加工、提呈给T细胞,活化初始性T细胞,在多数病毒感染中起识别与破坏病毒感染细胞的功能。T细胞在抗病毒感染中起重要作用。在病毒感染中,除Th1、Th2细胞外,调节性T(Treg)细胞、Th17细胞亚群(与炎症肿瘤及自身免疫相关),以及新发现的滤泡辅助性T细胞都已成为临床研究T细胞应答的对象。
病毒进入人体后,先由抗原提呈细胞摄取入内吞体,MHCⅡ类分子与病毒抗原形成结合体,可被机体T细胞表面的CD4和T细胞受体所识别。另外还有一系列其他组分在抗原提呈细胞与T细胞受体间参与相互作用,如 B7、CD28、LFA-1、ICAM-1/2、LFA-3等,通过信号传递产生IL-2和 IL-2受体,启动T辅助性细胞的作用。这些应答均属T细胞依赖性免疫应答(图1)。通过内吞体加工及提呈抗原的过程称为外源性抗原提呈途径。这一过程发生在病毒感染过程中,当病毒复制后释放出子代病毒时,或当已产生病毒基因编码的病毒蛋白被抗原提呈细胞摄取后,激活免疫应答。
另一种抗原提呈途径是通过内源性抗原提呈途径进行。是通过蛋白酶体(proteasome)介导的。在病毒感染的细胞内,新合成的病毒蛋白先由蛋白酶体水解成短肽后与MHCⅠ类分子结合,再加上β微球蛋白分子组成三重分子的复合体后转移到感染细胞的表面。CD8+T细胞是识别这一复合体而发挥杀伤作用的重要细胞,在感染、肿瘤中发挥特异性杀伤靶细胞的作用。通过内源性抗原提呈的途径激活CD8+T细胞的优点是机体在胞内感染病毒的早期,甚至在病毒合成新的子代病毒前即可被识别而很快被清除。因MHCⅠ类抗原存在于几乎所有有核细胞的表面,病毒感染的细胞很难逃脱被CD8+T细胞杀灭的后果。值得一提的是,由于一些病毒可对抗上述抗原提呈过程,从而发现细胞还有非常规的抗原提呈形式,被称为抗原交叉提呈机制。
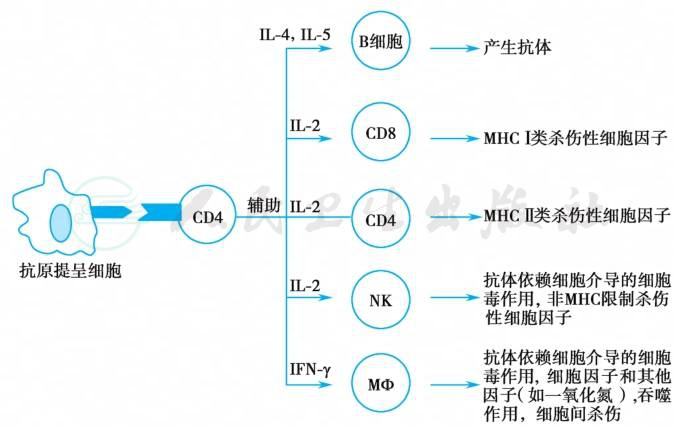
图1 CD4辅助性T细胞对其他免疫应答的辅助作用
针对病毒的特异性抗体,最重要的是IgG和IgA抗体。抗体一般在感染后5~7日出现,是病毒再次感染的主要防御机制。在体内,抗体与补体的活化起协同作用,并通过Fc受体与巨噬细胞和淋巴细胞合作发挥作用。抗体的中和作用十分复杂,虽然一般认为中和抗体起阻断病毒配体与细胞受体的作用,但实际上这样的作用并不常见,因需极大量的抗体才能阻断病毒表面为数众多的配体。IgA抗体在中和中起阻断病毒入侵黏膜细胞的重要作用。此外IgA还可通过poly-Ig的受体由体腔进入黏膜细胞内中和病毒。除抗体的滴度,抗体的亲和力也有重要作用,如已发现当Toll样受体激活受阻,抗体亲和力低下,可使呼吸道合胞病毒感染病程加重。在病毒感染中还有免疫病理的致病作用,其中包括抗体增强反应。黄病毒科的登革热病毒,在亚中和量抗体存在情况下可促进病毒在巨噬细胞内的增殖,称为抗体依赖性的病毒感染性增强(antibody dependent enhancement of virus infection,ADE)。这一增强反应可引起单个核细胞大量释放抗凝血因子,出现休克或出血性疾病。这一过程与血流中病毒组成的抗原-抗体复合物清除缓慢相关。
近年来,由于分子生物学技术的迅猛发展,人们对多种病毒基因的结构、功能及病毒细胞内复制周期有了深入的了解,由此大大推动了抗病毒药物的研发。根据抗病毒药物的作用机制,目前可分为三类:一是在细胞水平上直接抑制病毒复制,包括核苷(酸)类似物及其他抑制病毒复制周期所需的酶或蛋白质的药物;二是免疫调节剂,调整机体对病毒感染的免疫应答;三是直接作用于病毒颗粒破坏病毒结构。
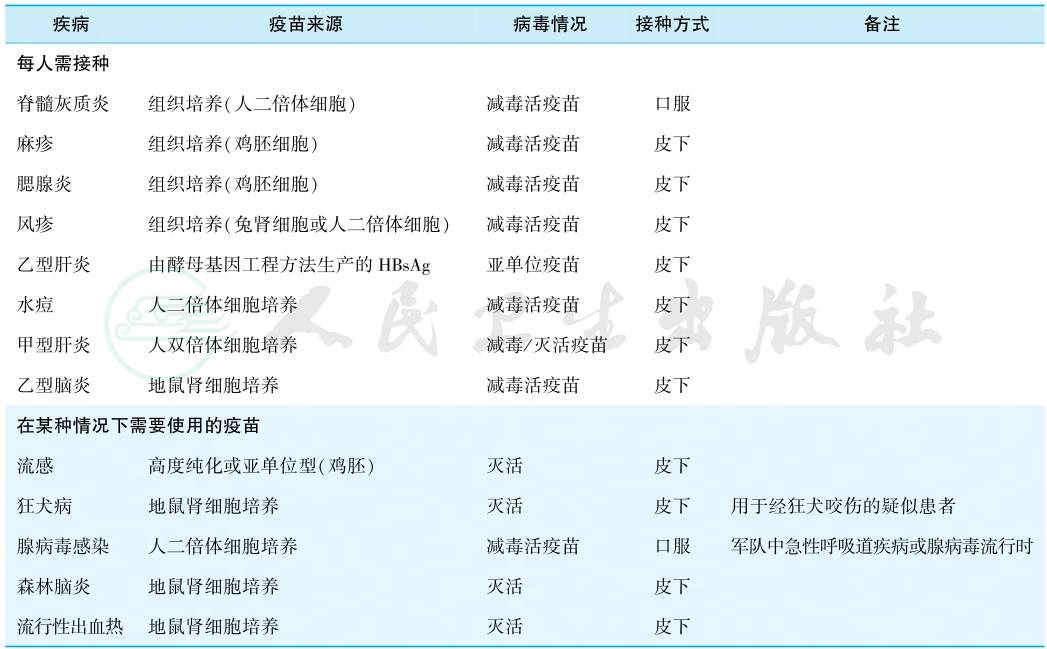
疫苗是预防病毒性疾病的重要措施,早在18世纪即应用痘苗来成功预防天花。20世纪50年代出现脊髓灰质炎疫苗,60年代有麻疹、腮腺炎和风疹疫苗,目前我国用于预防病毒性疾病的主要疫苗见表7。
表7 我国预防病毒性疾病的主要疫苗