发热(fever)是指中心躯体温度高于体温正常的日波动范围。正常成人的平均口腔温度约为(36.8±0.4)℃,女性较男性略高(36.9℃/36.7℃)。在行经妇女,晨温在排卵时可上升0.6℃,并持续到月经开始。直肠体温比口腔体温高0.4℃,比耳部(鼓膜)温度高0.8℃。通常认为口温高于37.3℃,肛温高于37.6℃,或一日体温变动超过1.2℃时即称为发热。在大多数情况下,发热是人体对致病因子的一种病理生理反应。
(一)体温的调节
正常健康人的体温比较恒定,一般保持在37℃上下的狭窄范围内(36.2~37.2℃),不因地理区域或外界环境温度的改变而有所变异。个体间的体温虽可有一定的差异,但就每一个人体而言,其体温的生理节奏性变化基本相同。
正常健康人所以有比较恒定的体温,是由于体温调节中枢通过神经、体液因素调节产热与散热两个过程,使其保持动态平衡的结果。产热的主要来源是身体的代谢活动,安静时产热的主要场所是肝脏和骨骼肌,在运动或疾病伴有发热时,骨骼肌是产热的重要场所。机体的散热主要以辐射、传导、对流、蒸发等方式进行,据估计约90%的热量通过上述方式散失,人体主要的散热部位为皮肤。
机体具有两种控制体温的系统,一是所谓行为调节,一是自身调节(即反馈调节系统)。前者是有意识的活动;后者是通过神经体液的作用而实现,其调节机构包括温度感受器和位于下丘脑的体温调节中枢。
目前生理学上多采用调定点(set point)的学说来解释下丘脑的体温调节中枢对体温调节的功能活动。该学说认为下丘脑的体温调节中枢存在着与恒温箱温度调节器相类似的调定点,此调定点的高低决定体温的水平。体温中枢调定点上移,中心温度低于调定点时,调定点的冲动发放,调温指令抵达产热和散热器官,一方面通过运动神经引起骨骼肌的张力增加或寒战,使产热增多;另一方面经交感神经系统引起皮肤血管收缩,使散热减少,最终导致发热。
(二)致热原与发热的机制
据现有的资料表明,除由甲状腺功能亢进(包括甲状腺危象)、剧烈运动、惊厥或癫痫官组织皆能产生一定影响,对神经组织损害尤为明显。体温超过42.5℃时,即可由于蛋白质的变性和酶功能失常导致脑细胞不可逆的损害。人体在发热时可有下列功能变化:持续状态等情况导致的产热过多,或因广泛皮肤病变、充血性心力衰竭等所致的散热障碍造成的发热以及功能性低热外,其余原因所致的发热皆可能与致热原作用于体温调节中枢有关。
致热原(pyrogen)是一类能引起恒温动物体温异常升高的物质的总称,微量物质即可引起发热。目前已知的致热原可概括为两类:
1.外源性致热原(exogenous pyrogen)
如病毒、衣原体、支原体、立克次体、螺旋体、细菌及其毒素、真菌、原虫、抗原抗体复合物、致热类固醇(如原胆烷醇酮,又名尿睾酮),炎症的某些内源性因子、尿酸结晶、博来霉素等,这一类致热原的分子结构复杂,不能透过血脑脊液屏障,故不能直接进入下丘脑作用于体温中枢,而是通过宿主的细胞产生所谓内源性致热原再作用于体温调节中枢,引起发热。然而,极少数外源性致热原例外,例如内毒素既能直接作用于下丘脑,又能促使各种宿主细胞合成内源性致热原。
2.内源性致热原(endogenous pyrogen)
是从宿主细胞内衍生的致热物质,体外细胞培养显示其主要来自大单核细胞和吞噬细胞。主要包括白细胞介素、肿瘤坏死因子、干扰素(interferons,IFN)等。新近研究显示致热原性细胞因子(pyrogenic cytokines)在体内、体外能互相诱导。如在家兔白介素-1(IL-1)可再诱导IL-1,在体外自人大单核细胞、人内皮细胞和人平滑肌细胞IL-1可诱导出IL-1。在体内外TNF均可诱导IL-1,IL-1在体外可诱导IFN-β,但IFN-β和IFN-α在体外不能诱导IL-1。微生物及其产物或其他疾病过程产物能激活各种细胞产生内源性致热原,新形成的内源性致热原可自同一细胞或其他类型细胞产生更多的内源性致热原。两种情况皆可产生具有负反馈作用的前列腺素。退热剂的应用虽能降温,但可减弱类前列腺素(prostanoid)对内源性致热原合成的抑制作用。
体温调节中枢引起发热的机制尚未完全清楚。最近的研究认为细菌细胞壁中肽聚糖、内毒素和外毒素或其他外源性致热原可结合至吞噬细胞(中性粒细胞、巨噬细胞)和内皮细胞表面的Toll样受体(Toll-like receptors,TLRs),促使内源性致热原的细胞因子如IL-1、IL-6或肿瘤坏死因子-α(TNF-α)产生并被释放入循环,并结合到下丘脑终板血管器(OVLT)的细胞因子受体上。此外,部分外源性致热原也可直接结合到下丘脑终板血管器(OVLT)的TLRs上。上述2条途径均可触发OVLT,从而激活环氧化酶-2 (cyclooxygenase-2,COX-2)系统,产生前列腺素E2 (PGE2),并导致脑部环磷酸腺苷(cAMP)的释放。后者又可刺激体温调节中枢的神经元,上调体温调定点。下丘脑还触发外周传出神经从而使外周血管收缩并保持核心体温直至下丘脑的PGE2下降。由于外周血管收缩导致的寒冷感觉,也导致行为的改变而保存机体的热量(图11-5-1)。
(三)发热时人体功能的变化
体温改变与常温相差3~5℃时,对人体大多数功能的影响不显著,但高热对各器
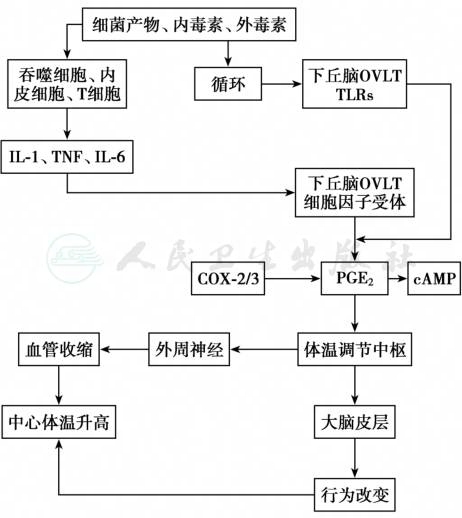
图11-5-1 发热的机制
1.神经系统
发热时中枢神经系统的兴奋性往往增高,病者可有烦躁不安、头昏、头痛、失眠等症状。体温上升到40~41℃时可出现幻觉、谵妄,甚至发生昏迷和抽搐,幼儿中枢神经系统发育尚未成熟、兴奋易扩散更易发生此等情况。
2.心血管系统
由于发热时交感肾上腺系统功能增高和血温升高对窦房结的刺激,发热者的心血管系统功能每有增强,表现为心跳加快、心肌收缩力加强、心排血量增加、血流加快等,心血管紧张性亦增高,血压可略见升高。一般体温每升高1℃,心率约增加20次,儿童心率的增加较成人为多。当某些感染或缺血、缺氧、中毒等因素影响心脏,使心肌受损,甚至出现心肌炎时,则体温虽上升不多,但心率却可显著地增快。某些感染如伤寒、病毒性肺炎,以及严重中毒、脑干损伤及心脏有传导阻滞等,体温虽上升很高,心率却相对徐缓或心率不增加甚至减慢。伴有颅内压增加的发热病者如脑膜炎、脑脓肿等,也可出现心率相对缓慢。
3.呼吸系统
高热病者的呼吸变化比较明显,在寒战时呼吸加快,每分钟容量增加,潮气量减少。由于快而浅的呼吸,动脉血氧压略有降低,呼吸性碱中毒较为多见。发热时呼吸的加快也有利于热的散发。
4.消化系统
发热时消化液生成和分泌减少,胃肠蠕动减弱。由于唾液分泌减少,故舌和口腔黏膜干燥,有利于细菌和其他病原体的侵袭和生长,而引起舌炎、齿龈炎等。各种消化酶、胃酸、胆汁等分泌减少,导致食物(尤其是蛋白质和脂肪)的消化和吸收受影响,因而有利于发酵和腐败过程的进行,使肠内积气引起鼓肠。发酵和腐败产物的吸收可引起人体中毒、食欲减退等。胃蠕动减弱和因交感神经兴奋性增高而致的幽门括约肌收缩,使胃排空时间延长,潴留于胃内已发酵的食物刺激胃壁,易引起恶心和呕吐。肠蠕动减弱和水分再吸收减少,可引起便秘。
5.泌尿系统
体温上升和高热持续时,体内的水分和钠盐潴留,同时肾小管的再吸收功能增强,因而尿量减少、比重增高,尿中氯化物含量降低。退热时尿量增加,比重降低,其中氯化物排出亦增多。感染性发热时由于高热和病原体毒素的作用,使肾实质细胞发生变性,尿中出现蛋白质和管型。
6.代谢变化
发热时分解代谢大为增强,耗氧量增加。体温每上升1℃,基础代谢约增加13%。由于交感肾上腺系统的兴奋和垂体肾上腺皮质分泌的增多,肝糖原分解加强,血糖升高,甚至出现糖尿。糖酵解也增强,血内乳酸含量增高。蛋白质和脂肪分解也显著增加,引起氮质、酮体等代谢产物的积聚和体重减轻。
7.防御功能
发热时单核吞噬细胞系统功能增强,白细胞增多,吞噬作用加强,抗体形成加速,细胞免疫功能提高,以上情况均有利于人体抵抗感染。许多发热性疾病伴有肝急性期蛋白质合成增加,这些蛋白质有助于对细菌及其毒素的控制发热,也不利于病原体生存。
对发热待查患者按前述诊断方法与步骤明确诊断后,可针对病因做出相应的处理和治疗。但是在病因未明时,合理的处理十分重要,其中尤应注意下列问题:
(一)糖皮质激素的运用
糖皮质激素因其具抗炎、抗毒、抗休克以及免疫抑制的作用,因而对包括感染、结缔组织-血管性疾病、肿瘤在内的大多数病因引起的FUO都具有良好的退热作用。由于疗效显著,基层医院中在发热患者中滥用激素的现象日益严重。激素的滥用不但改变了原有的热型和临床表现,使诊断发生困难,长期应用还将加重原有的感染性疾病或诱发二重感染等并发症,延误必要的治疗。因此,一般情况下我们不主张在病因未明的发热患者中使用激素。少数情况下,患者高度怀疑为药物热、Still病等变态反应性疾病且病情紧急时,方可在有经验的医师的指导下谨慎使用激素类药物。
(二)抗菌药物的使用
几乎所有发热待查的患者收住入院前均已不同程度的接受了抗菌药物的治疗。其中,大量的患者最后证实并不需要这类治疗。滥用抗生素治疗的直接后果是造成经济上的巨大浪费;其次抗生素的使用将使细菌培养等病原学检查的阳性率大为下降,造成诊断困难;长期使用多种抗生素导致药物热、二重感染等情况并不鲜见,干扰了对原发病的正确诊断和处理。但是,对急性高热病者,疑为感染性发热且病情严重时,可在必要的实验室检查和各种培养标本采取后,根据初步临床诊断予以经验性的抗菌治疗。
(三)退热剂的应用
关于退热剂的应用意见尚未统一。有认为退热剂会改变热型,影响诊断与预后的判断以及影响对治疗的效果的估价,某些药尚可影响患者的防御功能,如阿司匹林可抑制干扰素,延长病毒的脱壳;水杨酸可降低实验动物的存活率。但对于高热中暑、手术后高热、高热谵妄、婴幼儿高热等应采取紧急降温措施。退热剂降温应审慎,体温骤然下降伴大量出汗时,可导致虚脱或休克。老年人和体弱者尤应注意。
物理降温也可作为紧急降温措施,降温效果显著的酒精、温水擦浴尤为常用,冰袋或冷水袋置于前额、腋窝、腹股沟部冷敷亦可尝试,但后者降温效果略逊;有条件时,同时降低室温(使室温维持在27℃左右),降温效果则更为理想。
(四)关于诊断性治疗
当病因一时难以查明时,在不影响进一步检查的情况下,可按可能性较大的病因进行诊断性治疗,期待获得疗效而做出临床诊断。必须指出,诊断性治疗应选用特异性强、疗效确切及安全性大的治疗药物,剂量应充足并完成整个疗程,无特殊原因不得随便更换试验药物。这样的诊断治疗有效后方可作为临床的依据。如对于疑为疟疾的患者,多次血片或骨髓涂片中始终未能查见疟原虫,可试用氯喹,治疗成功后可做出疟疾的临床诊断。其他如结核病、阿米巴性肝脓肿等疾病也是常见的可以采用诊断性治疗的病种,但需要指出的是对疑似结核患者进行诊断性治疗时观察时间应足够长,一般以3~4周以上为宜。
对部分症状轻微,经过详细检查仍不能明确病因的发热待查患者,也可在专科门诊进行长期随访而不作特殊处理,确有不少患者可获自愈。
1.Dong MJ,Zhao K,Liu ZF,et al.A meta-analysis of the value of fluorodeoxyglucose-PET/PET-CT in the evaluation of fever of unknown origin.Eur J Radiol,2010,80(3):834-844.
2.Beutler BA.TLRs and innate immunity.Blood,2009,113 (7):1399-1407.
3.Lee Goldman,Andrew I.Schafer.Goldman’s Cecil Medicine.24th ed.Philadelphia:W.B.Saunders CO.,2011.
4.Kawai T,Akira S.Signaling to NF-kappa B by Toll-like receptor.Treads Mol Med,2007,13(11):460-469.
5.Bleeker-Rovers CP,Vos FJ,de Kleijn EM,et al.A prospective multicenter study on fever of unknown origin:the yield of a structured diagnostic protocol.Medicine(Baltimore),2007,86(1):26-38.
6.Sivakumar R,Pavulari S,Ellis S.Fever of unknown origin:case outcome.BMJ,2006,333(7570):691-694.
7.Schattner A.The patient part story remains a powerful tool in the diagnosis of fever of unknown origin.Eur J Intern Med,2005,16(1):63.













