休克是由多种不同致病因素导致有效循环血容量急剧减少,组织细胞灌注严重不足,促使各重要生命器官和细胞功能代谢障碍及结构损害为主的综合征。人类对休克的认识和研究经历了四个主要发展阶段:①19世纪症状描述阶段:面色苍白或发绀、四肢湿冷、脉搏细数、脉压变小、尿量减少、神态淡漠和血压降低。虽然只是临床征象的描绘,至今对休克的诊断仍有重要意义。②20世纪40年代急性循环衰竭认识阶段:休克的机制是因为血管运动中枢麻痹和动脉扩张引起的低血压,治疗上主要以肾上腺素提升血压为主。③20世纪60年代微循环障碍学说:休克的机制是交感-肾上腺髓质系统强烈兴奋所导致的微循环障碍,休克的关键问题在于组织血液灌流而不是血压,治疗上强调补充血容量,应用血管活性药及血管扩张药改善微循环灌流。④20世纪80年代细胞分子水平研究阶段:从细胞、亚细胞和分子水平对休克发病机制进行了研究,认识到休克的主要特征就是全身或局部组织低灌注,导致组织细胞缺氧,而不依赖动脉压的改变,确立了以纠正全身或局部组织低灌注、纠正组织细胞缺氧为目的的复苏治疗方向。休克的临床表现可以是隐匿性或是有明显的症状和体征。
(一)传统分类
Weil等于1975年按照病理生理改变,将休克分为低血容量性、心源性、分布性和梗阻性四类。
1.低血容量性休克(hypovolemic shock)
因快速大量失血、失液等因素导致有效循环容量急剧下降引起的休克称为低血容量性休克。
2.心源性休克(cardiogenic shock)
由于心泵功能障碍,心排血量急剧减少,有效循环血量显著下降所引起的休克。常见于大面积心肌梗死、心肌炎、心肌病、严重的心律失常、瓣膜性心脏病及其他严重心脏病的晚期。
3.分布性休克(distributive shock)
因血管舒张功能障碍引起血流分配紊乱,导致相对的有效循环容量不足导致的休克。包括感染性休克、神经源性休克和过敏性休克。
4.梗阻性休克(obstructive shock)
由于回心血和/或心排出通路梗阻导致心排血量减少引起的休克。包括缩窄性心包炎、心脏压塞和肺栓塞等疾病。
(二)其他类型休克
1.解离性休克(dissociative shock)
目前国外学者在原有四种类型的基础上提出的第五种类型的休克——解离性休克。解离性休克是因组织细胞的生物氧化过程发生障碍,不能有效地利用氧导致的细胞性缺氧。包括一氧化碳中毒、氰化物中毒、高铁血红蛋白血症等。
2.混合性休克(mixed shock)
即多种休克可同时或相继发生于同一患者,如低血容量性休克合并分布性休克、心源性休克合并低血容量性休克等。
(一)氧代谢障碍
休克的本质就是组织细胞缺氧。而缺氧与氧供减少、组织器官低灌注、细胞氧利用障碍密切相关。
1.氧供(oxygen delivery,DO2)就是指单位时间内循环系统向全身组织输送氧的总量。公式如下:
DO2=CaO2×CO(L/min)×10
CaO2=1.34×Hb×SaO2%+0.003×PaO2
(CO为心排血量,CaO2为动脉血氧含量,Hb为血红蛋白量,PaO2为动脉氧分压,SaO2%为动脉血氧饱和度)
以上公式简化后:DO2=1.34×Hb×SaO2%×CO(L/min)×10
因此,DO2取决于机体呼吸系统(PaO2,SaO2%)、血液系统(Hb)、循环系统(CO)。如Hb、SaO2及CO均正常,DO2仍下降,实际上是机体氧耗(oxygen consumption,VO2)增加,DO2相对不足。因此,提高DO2要着重解决呼吸(SaO2%)、血液(Hb)、循环(CO)三个系统问题。
2.组织器官灌注压是用平均动脉压(mean systemic arterial blood pressure,MAP)来表示。机体要维持一定的灌注压,组织器官才能得到血流和氧的输送。灌注压为动脉压与静脉压之差。动脉压常有波动,因此用MAP作为平均灌注压的指标。组织器官有效的灌注依赖于足够的血容量、正常的血管容积(正常的血管收缩和舒张功能)、正常的心脏泵(CO)功能。因此,提高组织器官的灌注必须通过补充有效循环容量、调节血管收缩和舒张功能、维持正常的心脏泵功能三个环节来解决。
心脏泵功能由每搏量(stroke volume,SV)和心率(HR)决定。每搏量由心室的充盈(前负荷)、心室排空的阻力(后负荷)及左或右心脏的收缩力决定。后负荷主要指全身血管阻力(systemic vascular resistance,SVR),SVR由前毛细血管括约肌的血管张力程度决定。
MAP=舒张压+(收缩压-舒张压)/3
CO=SV×HR
SVR=(MAP-CVP)×80/CO或(MAP-CVP)×80=SVR×CO
R=8ηl/πr4
(R为血管阻力,r为血管直径,η为黏滞度)
与灌注相关的血流动力学参数变化遵循以上这些相关的公式,受神经-体液和局部因素调节,维持机体稳定性。循环系统在正常情况下有自动调节能力,当动脉压增加时,血管直径减小以保持血流在稳定的水平。这种调节机制有重要的临床价值,尤其是在患者心排血量下降时,全身血管阻力代偿性增加以维持近乎正常的平均动脉压。尽管血压几乎正常,但患者仍因组织低灌注处于“隐性休克”状态。机体的这种代偿机制可较大范围地维持心脏和脑等最重要脏器的血供,并以损伤其他脏器为代价——肠道、肝脏及外周皮肤的血流减少、灌注下降。
3.氧供(DO2)与氧耗(oxygen consumption,VO2)氧耗是指单位时间内组织细胞实际消耗的氧量。可通过系统氧供(DO2)乘以氧摄取分数(O2extraction ratio,O2ER)计算得到(VO2=DO2×O2ER)。氧需求(oxygen demand)是机体为维持有氧代谢对氧的实际需求量。正常情况下,DO2维持在较高水平,使组织的氧耗量不因氧的输送而改变。当DO2降至机体临界点(c DO2),O2ER代偿性地增加,以维持系统氧耗能够满足系统氧需求。当O2ER的代偿性反应不足以满足系统氧需求,机体将从有氧代谢转换成为低效能的无氧代谢。随即无氧糖酵解产生乳酸,发生细胞内酸中毒。在DO2的临界点水平以下,氧耗量随氧供的降低而呈线性下降,这种关系称为生理性氧供依赖。在因低心排血量、低血氧饱和度或低血红蛋白血症引起的缺氧为特征的休克中,该过程被认为是细胞损害的重要机制。
在脓毒症、创伤和急性呼吸窘迫综合征(acute respiratory distress syndrom,ARDS)及心搏骤停后延迟复苏的患者中,DO2正常甚至增高,但因为氧利用受损,氧摄取分数(O2ER)始终处于非常低而固定的状态(O2ER=VO2/DO2),氧耗随氧供的降低仍呈线性关系,这种关系被称为病理性的氧供依赖。这种病理性的组织缺氧是因为血流分布障碍或在微循环或亚细胞水平的底物氧利用障碍。这种病理性的供应缺陷亦伴随着非常高的混合静脉氧饱和度或者血乳酸水平的增高。这个过程被认为是多种类型休克的重要机制。
(二)机体代偿反应与失代偿反应
1.代偿反应
在早期,动脉血压和系统氧供的微小改变可以通过交感神经系统的强烈兴奋和缩血管物质的释放,维持住生命体征。包括:①释放糖皮质激素、醛固酮和肾上腺素;②激活肾素-血管紧张素-醛固酮系统;③抗利尿激素(ADH),在血容量减少及疼痛刺激下分泌增加,对内脏小血管有收缩作用;④收缩动脉和静脉容量血管,特别是脾血管床,增强静脉回流;⑤儿茶酚胺(catecholamine,CA)大量释放入血,α受体分布密度高的皮肤、腹腔内脏、骨骼肌血管床、肾脏血管床强烈收缩,外周阻力增加,而冠状动脉和脑动脉α受体分布少,心脑血流量维持正常和增高;⑥酸中毒、发热和增多的红细胞2,3-二磷酸甘油增强组织氧解离和摄取。通过以上这些代偿机制,有助于心脑血液的供应,但减少了皮肤、腹腔内脏等器官的血液供应。
2.失代偿反应
当生理性代偿反应过度或产生病理性后果时,机体发生失代偿反应。
(1)失代偿反应:
持续缺氧和酸中毒导致血管对CA的反应性显著下降,机体血管扩张,血压进行性下降。多方面的结果导致间质和细胞水肿,造成毛细血管至细胞氧弥散受损,使得能量依赖的离子转运障碍,乳酸(lactic acid)大量产生,不能维持钾、氯和钙等的正常跨膜分布。线粒体功能障碍、异常的糖代谢和许多能量依赖的酶反应失活均导致细胞对氧的利用发生障碍。
(2)弥散性血管内凝血(disseminated intravascular coagulation,DIC):
在失代偿阶段,发生DIC的机制包括:①血液流变学的改变:血液浓缩、血细胞聚集,血黏度增高,使血液处于高凝状态;②凝血系统激活:严重缺氧、酸中毒或脂多糖(LPS)等损伤血管内皮细胞促进组织因子大量释放,同时内皮细胞损伤,暴露胶原纤维,激活因子Ⅻ,促使内、外凝血系统启动;③血栓素A2(TXA2)-前列腺素I2(PGI2)平衡失调:TXA2有促进血小板聚集和收缩小血管的作用,PGI2则有抑制血小板聚集和扩张小血管的作用,因此TXA2-PGI2失衡,促进DIC发生。
一些重要的实验室检查结果和指标的监测,可以提示休克早期组织低灌注已存在、休克的严重程度。
1.动脉血气分析
碱缺失(base deficit)可以很好地反映组织代谢情况及全身酸中毒的程度。碱缺失轻度为-5~-2mmol/L,中度为-14~-5mmol/L,重度为≤-15mmol/L。当给患者输注大量生理盐水,可能引起高氯性代谢性酸中毒。此外,可卡因中毒、酒精中毒及糖尿病酮症酸中毒都能导致代谢性酸中毒。
2.血乳酸和血乳酸清除率
血乳酸>1mmol/L为高乳酸血症,血乳酸≥4mmol/L时患者死亡率超过25%以上。乳酸清除率=[(初始血乳酸-治疗后血乳酸)/初始血乳酸]×100%,感染性休克患者6小时血乳酸清除率≥10%,其病死率明显降低。动态监测血乳酸水平和计算乳酸清除率,对判断患者预后更佳。血乳酸浓度升高,也可能是由丙酮酸脱氢酶功能降低、乳酸代谢障碍(肝功能损害)引起。乳酸/丙酮酸<10,提示乳酸堆积是由乳酸代谢障碍所致;乳酸/丙酮酸>10,提示乳酸堆积是由组织缺氧引起乏氧酵解,乳酸产生过多所致。
3.混合静脉血氧饱和度(venous oxygen saturation,SvO2)或上腔静脉血氧饱和度(superior venous oxygen saturation,ScvO2)
在DO2恒定的情况下,SvO2可以反映组织对氧的摄取量,在休克早期全身组织灌注已发生改变,而血压、CVP、心率及尿量还处于正常范围内,SvO2就已发生改变。SvO2正常值为65%~75%。根据Fick公式:SvO2=(SaO2-VO2)/1.34×CO×Hb,因此SvO2的下降早期提示:①CO下降;②Hb下降;③SaO2下降;④VO2增加。SvO2低于正常值,提示循环容量不足、心源性休克、贫血、呼吸功能不全等;SvO2低于60%,提示氧耗增加。感染性休克的病理生理特征之一是血流分布异常,有大量未经交换的无效循环,因线粒体功能障碍,组织细胞利用氧的障碍,反而导致SvO2正常或增高,SvO2>75%。ScvO2和SvO2有一定的相关性,ScvO2所测的值较SvO2高5%~15%,动态监测ScvO2,其趋势变化同样可以反映组织灌注状态。
4.胃肠黏膜pH(pHi)值
当全身各器官组织灌注不足时,胃肠道是最早、最明显出现灌注不足的。而当全身状况好转时,胃肠道又是灌注恢复最晚的器官。因此,pHi或/和Pt-CO2能直接反映组织的代谢情况,对目标治疗有指导意义。pHi正常值为7.35~7.45。pHi<7.35,提示胃肠道缺血、缺氧,PHi水平越低,胃肠道缺血越严重,病死率越高。pHi的纠正可以作为危重症患者休克治疗的终点,避免“隐性休克”逐渐发展成为多器官功能障碍综合征。
休克的诊断强调的是对休克的早期认识,目的是在休克早期就进行干预治疗,防止休克进一步发展成为多器官功能障碍(MODS),增加死亡率。因此,必须尽早恢复组织器官的灌注,增加DO2;而对感染性休克和解离性休克而言,即使恢复了组织器官的灌注,因其还存在微循环障碍和线粒体功能紊乱导致的细胞氧利用障碍,在增加氧供的同时,还需积极改善组织细胞的氧利用。因此,尽快恢复组织灌注,提高氧供,改善细胞氧利用是治疗休克的目标之一,即休克的支持性治疗,也是治疗休克的关键。而在增加了DO2,改善了细胞氧利用的同时,还需解决休克的致病因素,即休克的病因学治疗,此为治疗休克的目标之二;动态监测治疗效果,根据临床症状、组织器官灌注指标,氧代谢指标的监测,随时调整治疗方案,评估休克,此为休克治疗的目标之三,是治疗休克的方向标(图1)。
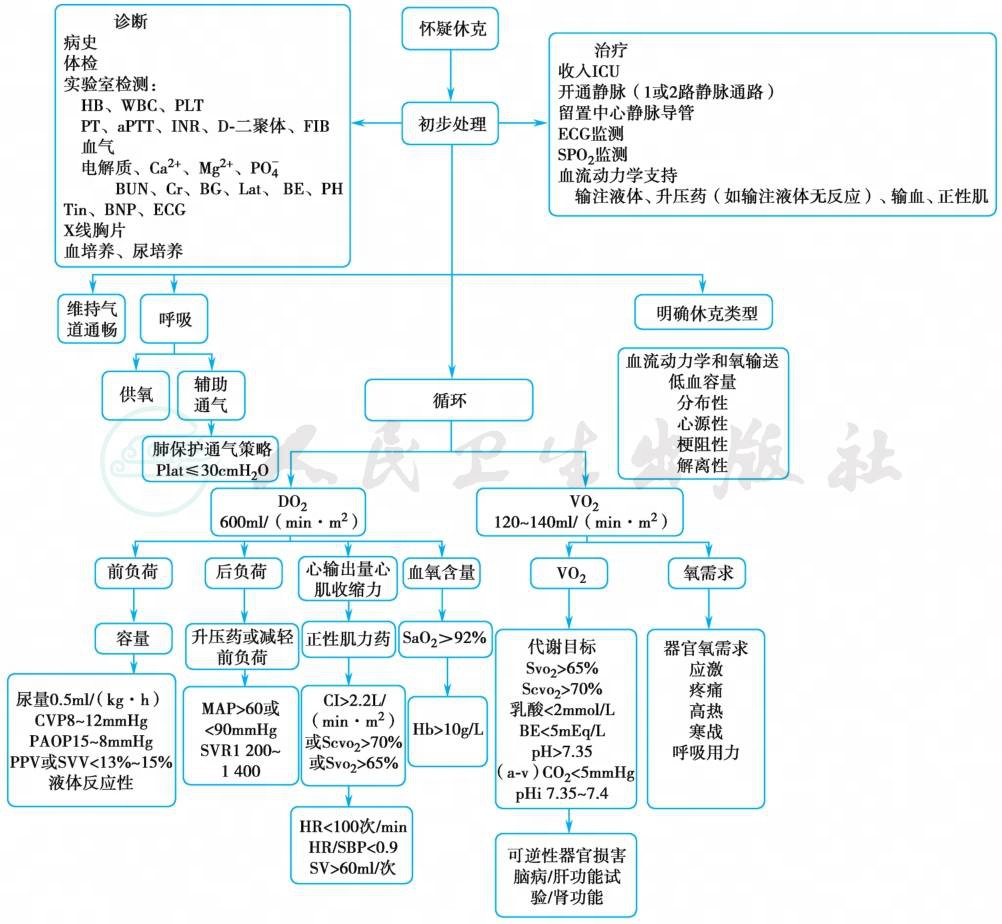
图1 休克的处理流程及目标值管理
APTT.活化部分凝血活酶时间;BNP.脑钠肽;BUN.尿素氮;CVP.中心静脉压;DO2.氧供;ECG.心电图;INR.国际标准化比值;MAP.平均动脉压;PAOP.肺动脉阻塞压;pHi.消化道黏膜pH;PPV.脉压变异率;PT.凝血酶原时间;SBP.收缩压;SVR.全身血管阻力;SVV.每搏输出量变异度;VO2.氧耗;WBC.白细胞。
(一)支持性治疗
1.恢复组织器官灌注,增加DO2
前文已经提及DO2不足与呼吸(SaO2%)、血液(Hb)、循环(CO)三个系统功能不全相关,如Hb、SaO2及CO均正常,DO2仍下降,实际上是机体VO2增加,DO2相对不足。提高DO2要抓住三个环节:改善低氧血症、纠正血液系统问题(Hb)、解决循环系统问题(CO),提高组织灌注压(以MAP作为参照指标)。
(1)改善低氧血症:
首先保持气道通畅。轻到中度的低氧血症,通过氧疗解决;重度低氧血症,特别是急性的、危及生命的,必须及时开放气道,机械通气。临床改善低氧血症的目标值:PaO2>60mmHg,SaO2>90%。因为这个目标值是保证氧供的前提。
(2)纠正血液系统问题(Hb):
危重患者主要以Hb量的丢失为主,主要措施是输注浓缩红细胞。目标值:Hb>10g/L,血细胞比容(hematocrit,Hct)为30%。因Hct达30%时,氧供达最佳状态。
(3)着力解决循环系统问题(CO),提高组织灌注压:
前文已提及提高组织灌注的关键还需要通过三个环节解决:①补充有效循环容量;②调节血管收缩和舒张功能;③维持正常的心脏泵功能。
1)补充有效循环容量:
首先要补充晶体和/或胶体,这是恢复组织灌注的先决条件。容量监测指标可通过中心静脉压(central venous pressure,CVP)和/或肺毛细血管动脉楔压(pulmonary artery wedge pressure,PAWP;又称肺动脉楔压)来了解容量的补足状况。经积极液体复苏,MAP仍≤65mmHg,或者存在威胁生命的低血压时,在积极液体复苏的同时,应早期应用血管活性药物,维持重要脏器的灌注。
2)调节血管收缩和舒张功能:
主要通过使用血管活性药物和正性肌力药物。使用血管活性药物后的效果应体现在对生命非重要器官有适当的缩血管作用,同时避免对生命重要器官的血管的收缩。临床常用的血管活性药物包括肾上腺素能类药物,如肾上腺素、去甲肾上腺素、异丙肾上腺素、多巴胺、多巴酚丁胺;血管扩张药,如硝普钠、硝酸甘油、酚妥拉明等;正性肌力药,如多巴酚丁胺、多巴胺、洋地黄类、磷酸二酯酶抑制剂(表1)。
表1 血管活性药的效应
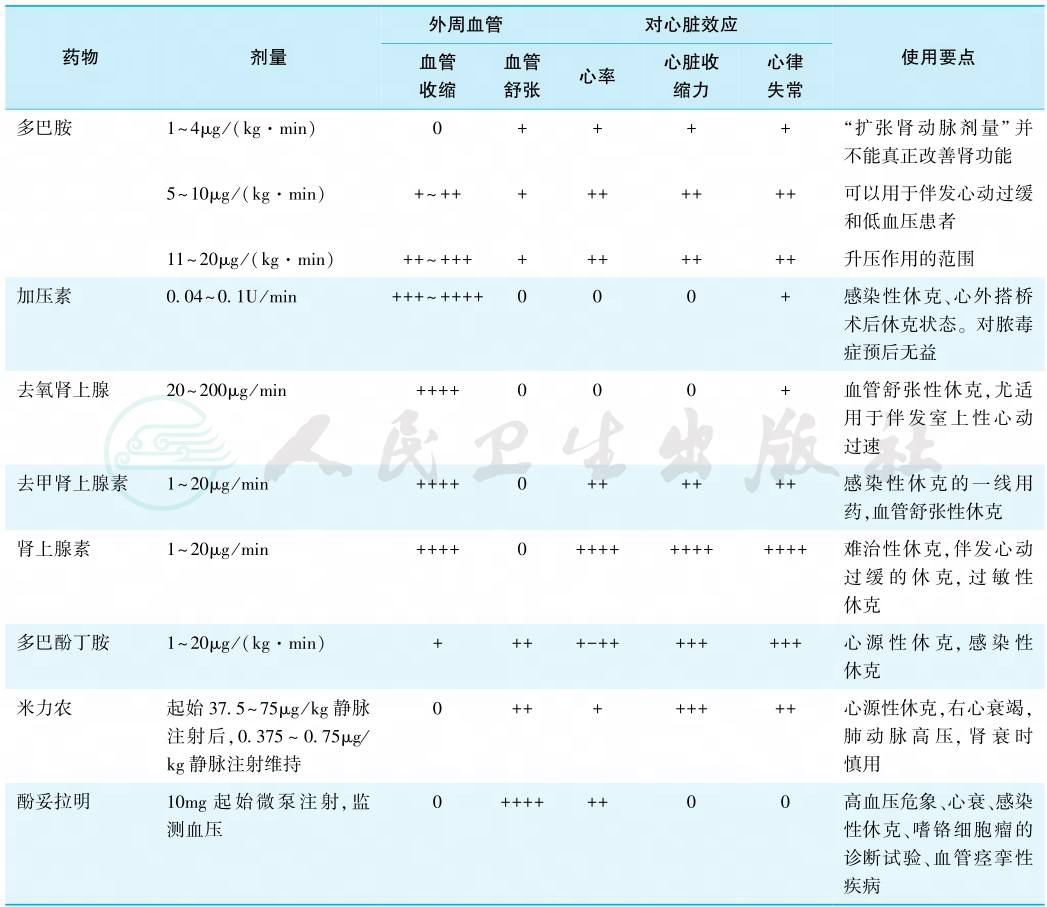
注:0表示无作用;+表示效应强度,+~++++表示效应强度逐渐增强。
3)维持正常的心脏泵功能:
主要是通过联合补液、血管收缩剂、血管扩张剂和正性肌力药三个与每搏输出量相关的因素,从而达到增加CO和氧供的目的。如容量负荷已足够,MAP仍低,则应加用针对心脏泵功能衰竭药物,如正性肌力药或血管扩张药。此外,增加心率确实能增加CO,但心率超过170次/min,舒张期心脏充盈时间便缩短,导致每搏输出量减少,CO下降,与此同时增加心肌氧耗,因此加快心率并不是改善CO的可行办法。
4)组织器官灌注压的目标值:
一般认为,MAP目标值达60mmHg已足够满足全身组织器官灌注,但危重患者的病因不同,目标值略有差异。对于明确诊断为感染性休克的患者,早期目标导向性治疗中要求:6小时内MAP≥65mmHg。最佳MAP应根据患者病情个体化制定,有高血压基础的休克患者需要较高的MAP。对伴有脑损伤的患者,因脑灌注压必须≥70mmHg以上,MAP≥70~80mmHg最为理想,才能保证脑血流正常,保证脑的氧供。对于创伤性未控制的出血性休克,最适当的灌注压的数值,目前仍有争议,其目的是适当地恢复组织器官的血流灌注,又不至于为了达到正常血压而造成机体再出血和内环境紊乱。一些文献建议MAP维持在40~50mmHg,略高于存活所需要的最低值即可。
总之,恢复组织器官灌注,提高DO2除了抓住以上三个大环节外,还需抓住三个小环节:要有有效的循环容量、稳定的血管收缩和舒张功能、适当的心排血量。满足了组织器官的灌注压,只能说明组织器官氧供达标,并不代表组织器官不缺氧。因为机体有可能还存在血流分布异常和组织氧利用障碍。
2.降低VO2,纠正氧供的相对不足
降低机体氧耗的措施:①控制体温。②镇静、镇痛。目的:用最小剂量的镇静和镇痛药解除患者疼痛、紧张及焦虑。原则:应首先实施有效的镇痛治疗。③机械通气:提供适当的和足够的呼吸支持,减少呼吸做功和呼吸肌的能量消耗。
3.改善组织细胞对氧的利用
提高细胞对氧利用的措施包括:①改善微血管功能,恢复微循环灌注:多巴胺、多巴酚丁胺、前列腺素E等。②纠正内环境紊乱,改善细胞组织的微环境:维持正常水、电解质平衡;纠正严重酸中毒;清除细胞内和组织间质中过多的水分:高渗盐水、白蛋白、利尿药等;消除炎症介质和毒性物质:血液净化、乌司他丁、依达拉奉等。③拮抗内毒素和细菌毒素:免疫球蛋白、重组人生长激素(recombinant human growth hormone,rhGH)、多黏菌素B、糖皮质激素、中医药(如人参、参麦注射液)等。④改善细胞能量代谢:1,6-二磷酸果糖、复合辅酶等。
(二)病因学治疗
休克的病因学治疗是对导致休克发生、发展病因的去除。该治疗往往需要耗费一段时间(如控制感染),有时病因一时无法确认,会使患者错失机会,病情进一步加重导致死亡。因此,在积极进行病因治疗的同时,一定要同时进行支持性治疗,使两者有机地结合在一起,提高休克患者的生存率。
(三)治疗效果的监测与评估
1.临床症状和体征的监测
休克治疗有效,患者神志好转、心率下降、尿量增多[>0.5ml/(kg•h)]、皮温及皮肤色泽好转、血压上升稳定。但临床症状和体征好转并不代表休克已纠正,机体可能还存在局部组织低灌注和缺氧。
2.容量监测的指标
CVP和PAWP是最常用的容量监测指标,可监测前负荷容量状态和指导补液。随着脉搏指示持续心输出量(PiCCO)监测技术的广泛应用,通过监测胸腔内血容量(ITBV)、血管外肺水含量(EVLW)、每搏输出量变异度(SVV)等容量指标,能更精确地反映容量状态,指导临床容量管理。CVP、MAP、BP等容量指标达标可作为休克复苏的阶段性目标,保证整个休克复苏过程以最有效的方式进行。
3.组织灌注指标
休克复苏的最终目标一定和组织灌注相关。全身灌注的监测指标包括:血乳酸、SaO2、SvO2或ScvO2、DO2、VO2、碱缺失。局部灌注的监测指标包括:胃肠道黏膜内pH(pHi)。组织灌注改善的标志是临床症状好转,尿量增加,乳酸水平降低,代谢性酸中毒得到纠正,SvO2或ScvO2>75%。研究表明,治疗休克早期,CO>4.5L/(min•m2),DO2>600ml/(min•m2),VO2>170ml/(min•m2),患者存活率提高,这三项指标是否达标,可判断患者的预后,而不能作为复苏终点的指标。碱缺失反映全身酸中毒的程度,间接反映血乳酸水平。碱缺失值越低,MODS发生率越高,死亡率越高。碱缺失和血乳酸相结合进行动态监测,可以很好地反映休克患者组织灌注的变化。目前研究表明,复苏终点的目标值是胃肠道黏膜内pH(pHi)>7.30。
4.细胞水平灌注的监测 通过观察皮肤、皮下组织和肌肉血管床,可直接了解局部细胞水平的血液灌注情况。经皮或皮下氧张力测定、近红外线光谱分析及应用光导纤维测定氧张力等新技术,可推动休克的复苏治疗达到细胞和亚细胞水平。













