英文名称 :orthostatic hypotension
体位性低血压(orthostatic hypotension,OH)是自主神经功能衰竭常见的临床表现,也是老年人中普遍存在的现象,与心脑血管事件发病率和死亡率密切相关。流行病学研究提示,随着年龄增加体位性低血压的患病率增加,年龄是体位性低血压的决定因素。在65岁以上老年人患病率为20%,75岁以上患病率为30%,在虚弱的老年人中,患病率超过50%。临床多见的神经源性体位性低血压(neurogenic orthostatic hypotension)是一种因为去甲肾上腺素能神经传递异常引起的疾病。流行病学研究表明,随着年龄和神经变性病变的增加,其发病增加,尤其在帕金森氏病(Parkinson's)和多发性系统萎缩(multiple system atrophy,MSA)多见。
近年,在美国北卡罗来纳大学公共卫生学院进行的社区动脉粥样硬化危险性研究(ARIC),纳入了11707名在基线时无脑卒中和明显心脏病的中年人,结果表明,OH是一个易于测定的指标,有助于预测中年人脑卒中发生的危险。
OH由美国神经病学学会定义为:直立时,在3分钟内收缩压下降≥20mmHg 或者舒张压下降≥10mmHg 以上。该定义没有说明在3分钟内血压下降的限度和血压下降相关的症状,因此,任何在站立基础上血压下降的疾病都可被涵盖,包括与之相关的症状:眩晕、晕厥前期、晕厥或晕倒。急性OH通常由药物、失血或者是肾上腺功能障碍引起,慢性OH主要由血压调节机制改变和自主神经功能障碍引起。诊断评价包括综合病史,自主神经系统障碍检测,在不同时间段认真测量血压(包括餐后及服药后),以及进行实验检查。目前非药物及药物干预措施的发展,使众多OH患者的生活质量有了明显的提高。无症状的患者一般不需要治疗,有症状的患者通常首先受益于非药物的干预,包括避免潜在的低血压的用药和进行身体的对抗干预。如果这些措施无明显作用,患者的症状持续,可以附加药物治疗,包括扩充血容量药物、拟交感神经药物以及辅助药物的治疗。治疗目的是改善症状,能够在走动时控制血压维持为目标血压。伴随着评估和管理的提高,能够有效的防治OH相关的晕厥、骨折、心肌梗死等突发事件的发生。
引起OH的原因可以分为急性和慢性(见图1)。急性OH常发生在相对短的时期并且常伴有症状。通常肾上腺功能不全、急性心肌缺血、药物、败血症或脱水容易导致急性发作。相反,慢性OH发生持续时间较长并且在首发时常无症状。
慢性OH可为病理或生理的原因引起。生理原因常为与年龄相关的血压调节的改变,也就是与年龄相关的收缩压增加,进一步使低血压的适应性反应降低。这些生理改变造成老年人可因体位改变、吃饭、服用新的药物或者任何急性的疾病引起体位性低血压。慢性OH病理学原因常为中枢或外周神经系统疾病所致自主神经功能受损。
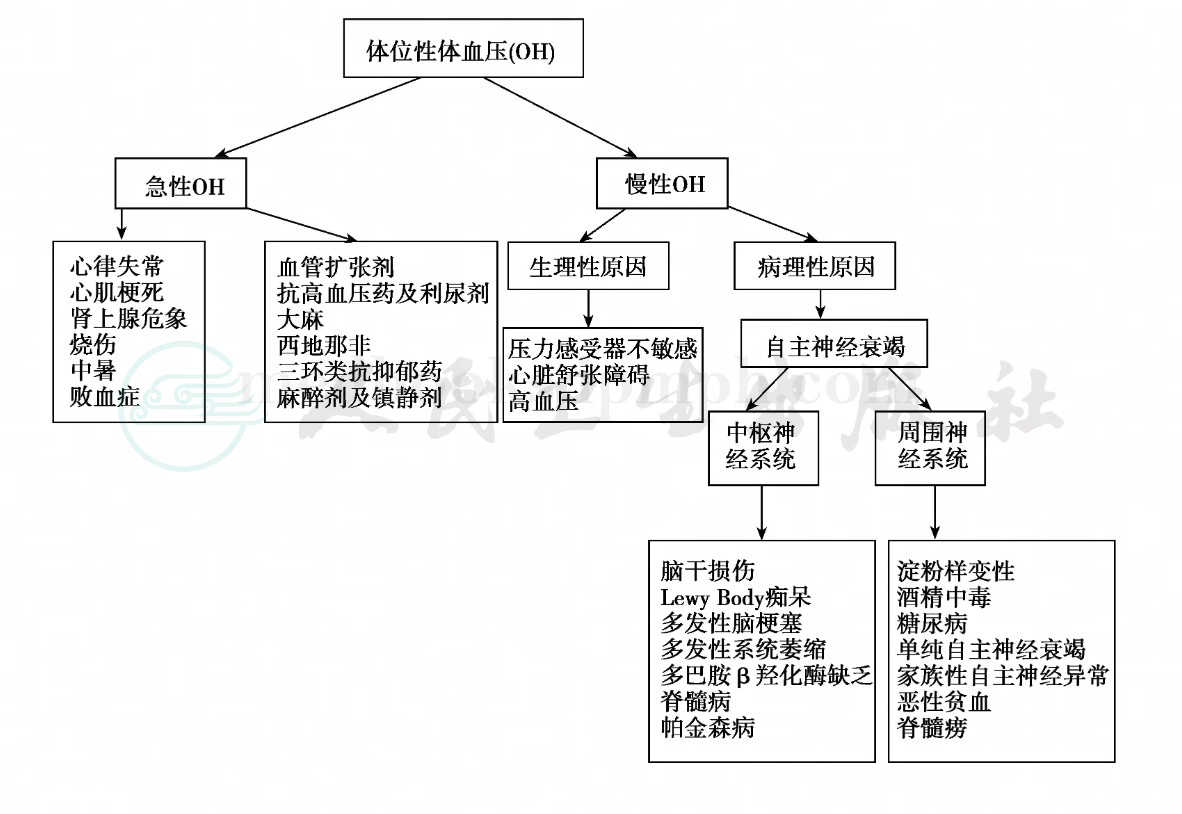
图1 体位性低血压的病因
血压变化直接与心率、每搏输出量及血管阻力相关。因此,任何引起这些参数反应的病损都会导致低血压。上述众多原因可以引起OH,其神经源性OH的病理生理机制主要交感神经节后神经元释放的去甲肾上腺素功能障碍,使血管阻力不能增加,不能代偿重力所致的血容量不足和血压下降。部分病人,在站立的短暂片刻,压力感受器反应低下,心脏输出与外周血管阻力代偿不足引起OH,而不是自主神经功能受损。
任何引起静脉回流到心脏的血流减少导致心室充盈不足和短暂的心脏输出下降均可导致血压降低。当人站立时,由于重力作用,身体上部分血液较平卧时减少500~1000ml,血液重新分布到腹腔、盆腔器官及下肢,致回心血量减少,右房压降低心输出量减少。此时,正常情况下,静脉回流减少能使颈动脉窦和主动脉弓的压力感受器激活,使交感神经活性显著增加,副交感神经活性显著降低,这个代偿反射机制常可恢复心脏输出和通过增加心率和血管阻力增加血压。此外,其他机制如局部肌肉静脉泵功能、心肺反射、小动脉张力反射、RAAS激活等亦有助于维持血压。
在正常成人,上述生理反射可在改变体位时维持收缩压基本不变,舒张压有轻微下降后回弹。老年人因压力感受器敏感性降低和交感神经功能代偿不全所致的压力反射迟钝是OH发生的病理基础。另外,随着年龄增加,肾素、血管紧张素和醛固酮、尿利钠肽减少,老龄的肾脏在容量和流量损失时期储藏盐和水能力下降,导致快速的脱水,即使在心钠素增高时,其通过肾脏排钠、排水而发挥调节血容量作用仍然有限。而且,老龄的心脏变得僵硬和顺应性下降,导致心脏充盈功能下降,这就使站立或容积收缩时引起前负荷减少从而导致每搏输出量下降。老年人肾小管对加压素的反应性也降低,故加压素的升高对血压的调节作用被抵消。由此可见,压力感受器介导的心率加快和血管收缩,肾盐和水储存以及心脏充盈在体位性血压的调节中极其重要,这些代偿能力的下降,大大增加了老年OH的风险。严重的是,OH的症状可能发生在血压降低或代偿性反应之前。(图2)
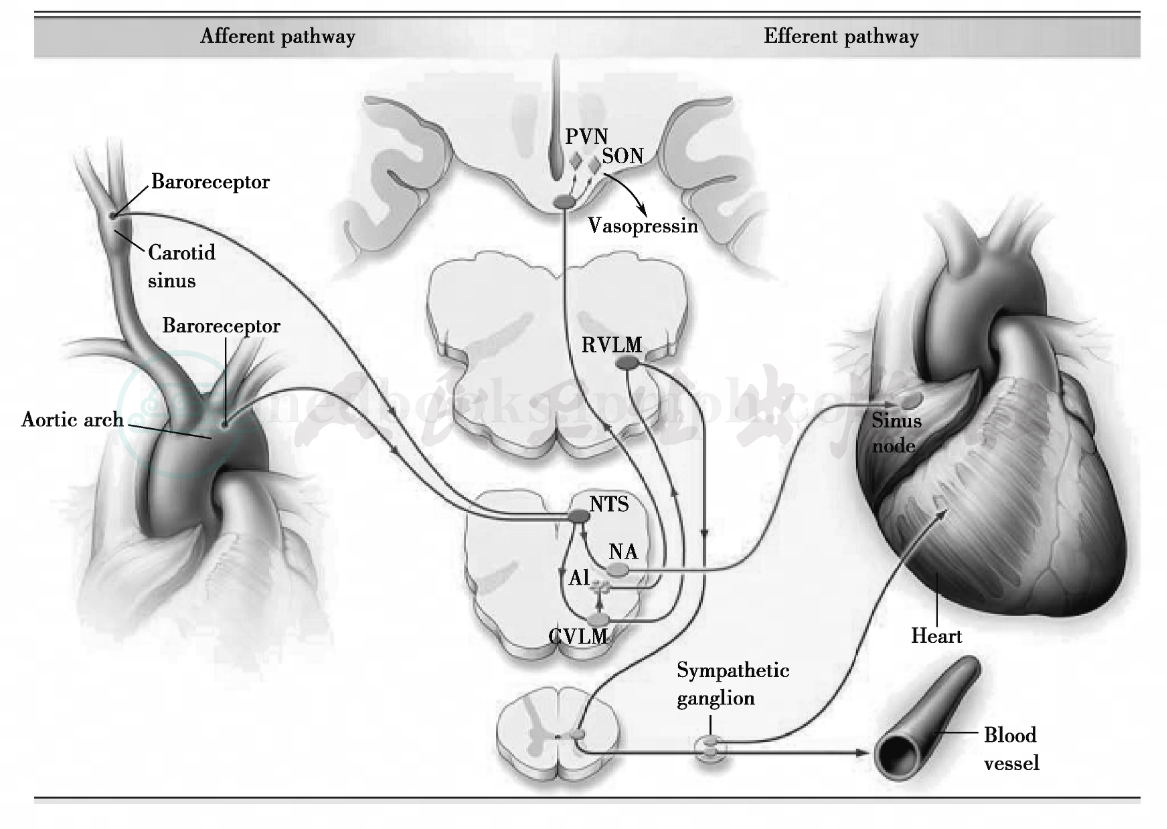
图2 压力反射
注:Carotid sinus:颈动脉窦;Aortic arch:主动脉弓;Baroreceptor:压力感受器;PVN:室旁核;SON:视上核;RVL M:延髓腹侧;CVL M:延髓腹外侧区;NTS:孤束核;NA:疑核;A1:去甲肾上腺素;Sinus node:窦房结;Vasopressin:加压素;Sympathetic ganglion:交感神经节;Blood vessel:血管;Afferent pathway:传入路径;Efferent pathway:传出路径(Roy Freeman,M﹒B.,Ch﹒B.,Neurogenic Orthostatic Hypotension,N Engl J med,2008,358,615‐624)
治疗OH应该以直接改善症状,纠正任何潜在的原因,提高患者的功能状态,减少并发症为主,而不是目标血压达标。治疗措施可以分为药物性和非药物性治疗方式。采用逐级治疗措施,包括停用引起OH的药物;非药物治疗和药物治疗。一般开始最好用非药物治疗,如果失败,再采取药物治疗。
(一)非药物干预措施
对于体位性低血压患者,患者教育是治疗的基石,研究表明进行非药物干预措施很有必要。
非药物干预措施包括逐渐改变从仰卧到站立姿势;清晨直立耐受性最低时避免直立应激;最小力量的等长练习;少食多餐减少因食物消化引起的体位性低血压。直立姿势的足背反射能促进静脉回流到心脏,加快心率,增加血压。在一天中多次的站立是简单而有效的干预措施。蹲坐或向前屈曲能导致血压增高。在长时间站立引起有症状的患者,简单坐下能使血压升高。身体的对抗练习,可以用单腿站立持续肌肉收缩30秒能增加全身静脉回流,从而增加心脏的输出量和血压,齐腰高的加压袜子和腹带也是有益的。停用任何可以引起体位性低血压的药物,这些药包括硝酸类、三环抗抑郁剂、精神安定药、α1受体阻滞剂和利尿剂。当患者服用治疗高血压的药物,可能发展体位性低血压,但如果继续应用可能会减少发生率。因此,开始治疗时可以给予低剂量和缓慢增加剂量。对急性脱水导致体位性低血压患者,首先应该进行补液治疗。对已经卧床或限制活动住院患者,应该逐渐站立缓和血流过度集中到较低的四肢。应避免减少静脉回流到心脏活动,如咳嗽、紧张、较长的站立,尤其在热天。伴有自主神经障碍和仰卧后高血压的患者,在晚上将头抬高10~20公分可减轻高血压,并且防止前夜的容量丢失,有助于早上站立时血压的恢复。患者每天摄入至少10g(185mmol)的盐,同时水量达到摄水2~2.5L,24小时尿量为1.5~2升能减轻液体丢失。早起体重增加大约1~2kg通常意味较好地补充了细胞外液体扩充容量。对老年患者应该制定相关的锻炼计划,游泳、仰卧踏车或划船等运动可减轻症状。
(二)药物干预措施
如果应用非药物干预患者症状无缓解,可以应用大多数药。
1.扩充血容量药物
(1)氟氢可的松(9‐a‐Fluorohydrocortisone):氟氢可的松是最有效的药物,一种人工合成肾上腺盐皮质激素,主要减少盐的丢失和有效扩充血容量。该药物大多数患者能耐受,持续时间长,能增加血容量且增强血管对血儿茶酚胺的敏感性,具有潜在的增强交感神经元释放去甲肾上腺素且增加血管液体容量。首用剂量为0.1mg/d到每周增加0.1mg或0.3~0.5mg/d,直到出现踝部水肿或最大剂量1mg/d。一般的副作用表现为低钾血症,仰卧性高血压,心力衰竭和头痛。仰卧性高血压是因为氟氢可的松增加了外周血管阻力。充血性心力衰竭较少见。服药期间,患者应该检测出入量和血钾。高剂量服用时给予补钾治疗。
(2)血管加压素(vasopressin analogs):血管加压素也可增加血容量。精氨酸血管加压素(arginine‐vasopressin,AVP)有着昼夜节律性,高峰期在夜间。自主神经功能衰竭的患者部分因仰卧血压增加,也因为在下丘脑视交叉上核加压素神经元丧失,使正常的AVP昼夜节律丧失而引起夜尿增加。人工合成加压素——醋酸去氨加压素(desmopres‐sin acetate,DDAVP)作用于肾脏集合管上V2受体而阻止夜尿增加、体重丢失,减少清晨体位性低血压的发生。DDAVP通常为鼻喷雾剂(5~40μg)或(100~800μg)。主要药物副作用为水中毒和低钠血症。DDAVP低剂量5μg鼻腔喷雾可减少夜尿而避免低钠血症。
2.拟交感神经药物
拟交感神经药物是通过中枢作用于心血管自主神经衰竭的患者。因此,对于那些血容量充足而直立耐受不良的患者应该给予直接或间接的去甲肾上腺素激动剂,通过减少静脉扩张并且收缩阻力血管。α1受体激动剂包括:具有直接和间接作用的麻黄碱(ephedrine),伪麻黄碱(pseudoephedrine),直接作用的米多君(midodrine)和去氧肾上腺素(phenylephrine),间接作用的哌甲酯(methylphenidate)和硫酸右旋安非他命(dextroamphetamine sulphate)。
(1)米多君(midodrine):米多君是一种选择性作用于α受体的激动剂,具有强力拟交感胺活性,于1974年应用于临床,经20多年临床证实,该药是美国FDA唯一批准的治疗体位性低血压的药物。本品的药物原形无活性,口服给药后,在血液中经氨基乙酰水解后转化为活性代谢物脱甘氨酸米多君(deglycination)。脱甘氨酸米多君为选择性外周交感神经α1受体激动剂,直接作用于突触后,释放肾上腺素兴奋剂。研究结果表明,口服或静注本品后可使健康志愿者的卧位或立位血压适度提高,对直立性低血压患者能显著地升高血压。该药具有血管张力调节功能,对直立性血压调节异常的患者除可增加外周动、静脉阻力,还可防止下肢大量血液淤积,促进血液回流,使血容量保持稳定,从而提高患者直立位血压、改善循环容量不足而引起的症状(如晨起精神不振、乏力、头晕、眼花等)。本品不会引起中枢神经系统兴奋性增高,对心脏也无直接作用,但用药后由于反馈作用,心率可能下降。
该药对立位性低血压比常用的麻黄素更有效。该药用药方便,既可口服又能注射。研究资料还表明,本品对血糖和血液尿素浓度无影响,对糖耐量、血脂、胰岛素或尿酸也无影响,无中枢神经系统活性。对肝、肾功能、骨髓、血液凝集或纤维蛋白溶解活性也均无影响。一般开始剂量为2.5mg/次,3次/天,随后每周增加2.5mg直到最大剂量10mg/次,3次/天。最好效果,早上尽早服用,晚上不晚于下午6时。氟氢可的松和米多君结合治疗可以减少剂量。不良副作用包括竖毛反应,仰卧高血压,瘙痒和感觉异常,胃肠道不适(恶心、胃灼热感和口腔炎),罕见中枢神经系统反应(头痛、眩晕、不安、兴奋和烦躁),但米多君所致的不良反应一般较轻微且短暂,并随用药剂量减少而减轻。有冠心病、心力衰竭、尿潴留、甲状腺毒症或急性肾衰竭的患者禁用。服用减慢心率药物的老年患者应该谨慎应用米多君,如β受体阻滞剂,钙通道阻滞剂和强心甙。
(2)麻黄碱(ephedrine),伪麻黄碱(pseudoephedrine):麻黄碱和伪麻黄碱是一种混合作用的α受体的激动剂,能直接作用于α肾上腺能受体,从交感神经节后神经元释放去甲肾上腺素,其药物结构、药理作用不同于米多君。对节后神经元部分或全部损害患者最适合。麻黄碱作用于α、β1、β2受体,β2扩血管作用减弱了该药物的升压作用。伪麻黄碱是麻黄碱的立体异构体,其药理作用和药效一样。麻黄碱一般为25~50mg/d,3次/天,伪麻黄碱30~60mg/d,3次/天。试验研究表明苯丙醇胺(phenylpropanolamine)12.5mg和育亨宾5.4mg联合应用,具有较好的治疗体位性低血压的作用。苯丙醇胺是一种具有血管收缩作用的药物,少数人长时间服用较大剂量能引起血压升高等不良反应,甚至引起出血性中风等严重后果。因此,FDA建议将其从药物生产中删除。
麻黄碱的中枢神经兴奋作用远较肾上腺素为强。能兴奋大脑皮层及皮层下中枢,使精神振奋;可缩短巴比妥类催眠时间,亦能兴奋中脑、延脑呼吸中枢和血管运动中枢。麻黄碱对心脏也有兴奋作用。麻黄碱使心肌收缩力增强,心输出量增加。麻黄碱使冠脉、脑、肌肉血管扩张,血流量增加;使肾、脾等内脏和皮肤、黏膜血管收缩,血流量降低。麻黄碱常引起收缩压和舒张压上升,脉压增大。其升压作用缓慢而持久。麻黄碱对支气管平滑肌的松弛作用较肾上腺素弱而持久。对膀胱三角肌和括约肌的影响,麻黄碱能使膀胱三角肌和括约肌的张力增加。可使排尿次数减少,足够量产生尿潴留。麻黄碱还有升高血糖、收缩脾脏、增加红细胞等作用。麻黄碱对胃肠道分泌通常表现抑制。本品的升压作用较弱,但较持久,使血管收缩,但无后扩张作用。用药过量时易引起精神兴奋、失眠、不安、神经过敏、震颤等症状,有严重器质性心脏病或接受洋地黄治疗的患者,也可引起恶性的心律紊乱。
(3)哌甲酯(methylphenidate)和硫酸右旋安非他命(dextroamphetamine sul‐phate):哌甲酯和硫酸右旋安非他命是间接肾上腺能受体激动剂,从节后神经元释放去甲肾上腺素,较少用于治疗体位性低血压。
3.辅助药物治疗
对于那些进行一线治疗效果不佳的患者,补充辅助药物治疗改善患者的症状。
(1)乙酰胆碱酯酶抑制剂:溴吡斯的明(pyridostigmine)是乙酰胆碱酯酶抑制剂,通过抑制乙酰胆碱酯酶增强交感神经节的神经传递,适用于神经源性的体位性低血压,可以增加站立的血压,减轻体位性低血压。避免采用首期给药加量的方式,由最小剂量30~60mg/次,2~3次/日,维持用量1周以上,根据症状改善与否再逐渐加量,症状开始改善时,维持给药量。症状缓解时,维持药量1周,而后递减1/3,维持1~2个月,若症状没有加重,再次递减1/3,在此范围内寻求最低有效给药量。报道20%患者有类胆碱功能的副作用,自觉颈项发紧,恶心,呕吐,手指抖动,肌肉颤动,局部肌肉感觉麻木,心率明显降低。
(2)促红细胞生成素:促红细胞生成素(erythropoietin)能够增加站立血压,提高直立耐受性从而改善体位性低血压,适用于已有正常细胞贫血伴发自主神经功能障碍的患者以及糖尿病自主神经病变。尽管详细的机制还不清楚,可能因为能增加红细胞和血容量。一般应用人重组促红细胞生成素,主要给药途径为静脉注射,开始应用较低剂量25~75I U/kg,3次/周,直到红细胞比容接近正常。低剂量维持,25I U/kg,1次/周。在用药期间应补充铁剂,尤其在红细胞比容增加的过程中。严重的副作用包括高血压、休克和心肌梗死。
(3)可乐定(clonidine):可乐定是一种外周α2受体激动剂,能改善体位性低血压患者中枢神经系统引起的自主神经功能衰竭,通过促进外周静脉收缩和增加静脉回流。一般用药为0.1~0.6mg/天,在严重的中枢性自主神经功能障碍的患者,可乐定应该谨慎应用,有可能导致加重低血压的发生。药物副作用包括口干、嗜睡、便秘。
(4)咖啡因:咖啡因是一种腺苷受体阻滞剂,可以抑制腺苷引起的血管扩张。甲基黄嘌呤咖啡因(methylxanthine caffeine),每天早晨200mg相当于2杯咖啡,能减弱一些患者的症状。为避免焦虑,咖啡因不宜在早上一次给的过多。因增加胃酸分泌,消化性溃疡者不宜久用。
(5)β阻断剂(β‐Blockers):非选择性的β阻断剂,尤其是那些具有内在交感神经激活的药物,如吲哚洛尔(pindolol)和扎莫特罗(xamoterol),这些药物可能因其负性肌力和负性心率作用应用受到限制。这类药物主要因为其阻滞血管β2受体从而使α肾上腺能受体介导的血管反应占主导地位。但是,这类药物的作用有待临床进一步证明。
(6)前列腺素抑制剂:吲哚美辛和其他非甾体类的抗炎药可以阻滞前列腺素扩张血管的作用,对体位性低血压患者起到升压作用。因为吲哚美辛的胃肠道和肾脏副作用,应避免在老年患者服用。
(7)育享宾(yohimbine):育享宾是一种中枢选择性的α2受体拮抗剂,能够增加中枢交感输出。在理论上对交感神经冲动传出有效,但在临床尚未证明。药物副作用为焦虑、颤抖、心悸、腹泻和仰卧性高血压。
(8)去甲肾上腺素前体药物:3,4‐D‐Lthreo‐dihydroxyp henyl serine(DL‐DOPS)是去甲肾上腺素前体,能透过血脑屏障,提高中枢神经的交感活性,具有升压作用。更重要的是对自主神经功能损害有治疗作用,用于OH的治疗。
屈昔多巴(droxidopa),多中心临床药物研究,发现人工合成的去甲肾上腺素前体‐屈昔多巴在临床应用取得初步效果。正在美国和欧洲进行多中心临床Ⅲ药物研究。屈昔多巴并不是新药,其虽然没有在欧洲和美国应用,但是其在日本应用了25年,并且记录了显示应用的安全性。屈昔多巴通过前体氨基酸进入体内转化为去甲肾上腺素,从而补充因自主神经功能衰竭引起的去甲肾上腺素的不足,是有前景的治疗方法。













